成纤维细胞与血液系统恶性肿瘤
细胞重编程与肿瘤发生

默 等 。 有 研 究 表 明 这 些 重 编 程 机 制 中 如 DNA甲 基 化 、 miRNA等与肿瘤发生有关。 2.1.1 DNA甲基化与肿瘤发生 DNA甲基化是表观遗传学研 究 中 研 究 得 最 为 深 入 的 领 域 , 它 通 过 三 种 DNA甲 基 转 移 酶 (Dnmts, 包 括Dnmt1、Dnmt3a和Dnmt3b)的 协 调 活 动 来 建 立 实现甲基化并维持之。其中,Dnmt1唯一的功能是作为一种 维持性 DNA甲 基 转 移 酶 , 相 比 而 言 ,Dnmt3a和Dnmt3b 则 是 一种从头DNA甲基转移酶。Dnmt1 和Dnmt3b在许多肿瘤细 胞和组织中都存在着过度表达,在肿瘤的发生发展中扮演着 重要角色。研究表明,通过抑制Dnmt1 或Dnmt3b的表达可以 明显抑制肿瘤细胞的增殖和肿瘤形成[14-15]。 DNA甲基化在不 同的细胞进程中扮演着重要角色,包括基因表达、转座子沉 默和病毒序列防御。异常的DNA甲基化与许多人类肿瘤有密
骨髓间充质干细胞和成纤维细胞的蛋白质组学比较

骨髓间充质干细胞和成纤维细胞的蛋白质组学比较word格式论文骨髓间充质干细胞和成纤维细胞的蛋白质组学比较作者,赵亮,魏旭峰,孙阳,陈瑜,易定华【摘要】目的,采用蛋白质组学方法研究人骨髓间充质干细胞(hBMSCs)和成纤维细胞中的蛋白表达差异.方法,对hBMSCs和成纤维细胞的蛋白样本进行双向凝胶电泳分离,通过比较两种细胞的蛋白组学图谱,确定差异表达的蛋白点,而后对差异点进行基质辅助激光解析电离飞行时间质谱分析和蛋白数据库信息检索,最后选取其中的5种蛋白进行WesternBlot实验验证蛋白质组学的研究结果.结果,在hBMSCs和成纤维细胞中鉴定出29种差异表达蛋白,其中有17种蛋白在两种细胞中有显著差别地表达,另外12种蛋白在两种细胞中有相同丰度地表达.WesternBlot 的实验结果进一步验证了蛋白质组学分析的结果.结论,hBMSCs与成纤维细胞中蛋白的差异表达体现了两种细胞在细胞形态、结构和功能上的异同性,这对于研究hBMSCs向成纤维细胞分化以及应用 hBMSCs构建组织工程瓣膜具有重要意义.【关键词】骨髓间充质干细胞成纤维细胞蛋白质组学【Abstract】AIM:TofindoutthedifferencesandsimilaritiesontheprotEinexpressionsbetween humanbonemarrowmesenchymalstemcells(hBMSCs)andhumanfibroblasts,word格式论文whichhavedifferentcellcharacteristicsandsimilarcellmorphology.METHODS: TheprotEInextractswereobtainedfromhBMSCsandfibroblasts,andseparatedbytw o-dimensionalgelelectrophoresis(2-DE).Andthenthedifferentialproteinspotswereidentifiedbymatrix-assistedlaserdesorptionionization-timeofflight-massspectrometry(MALDI-TOF-MS).TheresultsfromsimultaneousproteomicprofilingwerefurthervalidatedbyWe sternBlotofselectedproteins.RESULTS:Twenty-ninedifferentialproteinsweresuccessfullyidentifiedinhBMSCsandfibroblasts .Amongthem,17proteinswereexpressedsignificantlydifferentlyinhBMSCsfromth atinfibroblasts,andanother12proteinsequallyexpressedinthe2typesofcells.C ONCLUSION:ThedifferentialproteinexpressionsbetweenhBMSCsandfibroblastspr ovideanewinsightintothedifferentialcellstructuresandfunctionsbetweenthe2 typesofcells,whichmightbevaluableforfurtherstudyoffibroblastsdifferentia tionfromhBMSCsandtheapplicationofhBMSCsforcreatingtissueengineeredheartv alvesinthefuture.【Keywords】bonemarrowmesenchymalstemcells,fibroblasts,proteomics0引言骨髓间充质干细胞,BMSCs,是目前理想的组织工程瓣膜间质细胞的种子细胞,相对于血管来源的种子细胞,MSCs具有获取方便、多向分化潜能, 以及独特的免疫特性,能够在同种异体微环境中组织中产生免疫耐受的优点,1-2,.该研究拟全面比较hBMSCs和成纤维细胞中蛋白表达的差异,进一步word格式论文在蛋白水平理解两种在细胞结构和功能差异.这对今后研究hBMSCs在体外向成纤维细胞的分化诱导,以及应用hBMSCs构建组织工程瓣膜是非常必要的.1材料和方法1.1材料人骨髓来源于本院骨髓穿刺室,经过骨髓细胞学检查排除了血液系统的恶性疾病.人成纤维细胞,HDF,是购自CellApplications公司,/index.htm,.细胞分离、培养的主要试剂,Percoll 淋巴细胞分离液(密度为1.073g/mL),DMEM/F12,低糖,,磷酸盐缓冲液(PBS),硫酸链霉素、青霉素,均自Gibco,USA,,胎牛血清,CD34,CD44,CD29和CD105抗体,Sigma,USA,.双向凝胶电泳的主要试剂,尿素、硫脲和甘油,均自Sigma,USA,,CHAPS(美国Merck),两性电解液、IPG预制胶条(pH3,10,130mm)和碘乙酰胺,均自Bio,Rad,USA,,Bradford蛋白质检测试剂盒(上海申能博彩生物科技有限公司).WesternBlot实验所用抗体,Sigma,USA,.1.2方法(1)细胞培养和hBMSCs的鉴定:骨髓经肝素钠生理盐水(1200U/mL)肝素化后,PBS液洗涤、离心,弃掉骨髓中的脂滴等杂质,而后采用Percall淋巴细胞分离液进行密度梯度离心,获得的单核细胞静置培养于DMEM/F12培养液,含100mL/L 的胎牛血清,2mmol/L谷氨酰胺(Bio-Whittaker)和50U/mL青霉素,50mg/mL庆大霉素.原代细胞在2,3d可见少量贴壁细胞,细胞形态多样、不均一,继续培养,细胞多呈梭形,漩涡样或放射状平行排列,形成较多的细胞集落.10,14d后细胞即达80%,90%融合,传代后细胞集落消失,细胞均匀分布,平行排列,较紧密,3,4d即可传1代.当hBMSCs扩增至第3代时,采用流式细胞术分析hBMSCs的表面分子.细胞不表达造血标志CD34,CD45,而强表达CD29,CD105,阳性率分别为99.4%和99.5%,3-4,.同时,在培养的第word格式论文3代细胞体系中加入成骨细胞和脂肪细胞诱导剂,可成功地诱导向成骨细胞和脂肪细胞分化,5,.这表明分离培养的细胞为具有多向分化能力的hBMSCs.成纤维细胞在上述细胞培养液中进行常规培养和扩增.,2,hBMSCs和成纤维细胞的双向凝胶电泳,2-DE,,将hBMSCs和成纤维细胞细胞分别悬于裂解液(8mol/L尿素,40mL/L的CHAPS,40mmol/LTris,适量PMSF)中,混匀后用液氮反复冻融,再加入适量RNA酶和DNA酶,冰浴20min.4?离心(14000g,30min),收集上清液.用Bradford法测定蛋白含量,其余蛋白样品在-80?中保存.双向凝胶电泳,2,DE,分离细胞蛋白提取物,第一向固相PH梯度等电聚焦(IEF),取适量蛋白样品与水化上样缓冲液(8mol/L尿素+40g/L的CHAPS+20mmol/LDTT+5μL/LIPG缓冲液+痕量溴酚蓝)混合,银染检测时蛋白质的上样量为100,200μg,考染检测时的上样量为800,1500μg,上样总体积350μL.按程序等电聚焦结束后,将胶条在平衡液?(6mol/L尿素+375mmol/LTris+20g/L的甘油+20g/L的SDS+20g/L的DTT)中平衡10min,清洗后再置入平衡液?(6mol/L尿素+375mmol/LTris+200g/L的甘油+20g/L的SDS+100mmol/L碘乙酰胺)中平衡10min.第二向垂直平板电泳,SDS2PAGE,,将胶条移至130mL/L的丙烯酰胺胶上分离.参照文献 ,6,的方法对凝胶进行银染并扫描成像,.3,图像分析,凝胶用AGFADuoScanT1200凝胶图像扫描仪扫描,比较分析hBMSCs和成纤维细胞全蛋白凝胶数字化图像,比对分析采用ImagingMaster2DElite5.0软件完成.确定有显著性差别的蛋白表达丰度比值标准为n,2或n,0.5.,4,质谱分析及数据库检索,对选取的蛋白点进行胶内酶切,提取多肽混合物,纯化后,取1μL溶液和等体积饱和基质溶液混合,加至不锈钢靶上,室温干燥,采用基质辅助激光解吸飞行时间质谱分析法,MALDI-TOF-MS,检测蛋白多肽.通过两种检索引擎Aldente(SCs和成纤维细word格式论文胞蛋白质组学研究的可靠性,从中选取5种差异表达的蛋白,α-smoothmuscleactin,α-SMA,,enolase1,vimentin,60SacidicribosomalproteinP0andcofilin-1,进行蛋白质印迹(WesternBlot)分析.各取两种细胞进行蛋白质组学分析的蛋白样品于100?变性5min.在具有10道双垂直电泳槽内每孔内加入60μg蛋白质,120ml/LSDS-PAGE电泳,转膜,50ml/L脱脂牛奶封闭2h,杂交一抗,4?过夜.PBST洗膜3次,每次10min.杂交二抗,室温摇床上1h,PBST洗膜3次,每次10min,DAB试剂盒显色.运用BandScanV5.0软件对免疫反应条带进行定量分析.统计学处理,资料用SPSSV10.0数据处理软件包进行统计学处理.计量资料以x?s表示,P0.05为有统计学意义.2结果2.1hBMSCs和成纤维细胞蛋白的差异表达hBMSCs和成纤维细胞全蛋白提取后,进行双向凝胶电泳分析,共进行3次实验得到银染结果,两张电泳图谱的蛋白斑点分布模式有相似性,图1,.1,17,两种细胞中不同表达丰度的蛋白;18,29,两种细胞有相同表达丰度的蛋白.图1hBMSCs(A)和人成纤维细胞(B)的双向凝胶电泳图,略,3次重复实验结果经ImagingMaster2DElite510软件分析,发现hBMSCs可以检测到782?65个点,成纤维细胞可以检测到760?57个点,这些蛋白质等电点和相对分子质量分布范围较广,但大多数集中于pH4,8,相对分子质word格式论文量15,100ku区域.对其中29个稳定表达的差异蛋白质斑点进行切割,用胰蛋白酶消化后进行MALDI-TOF-MS分析,通过UniProtKB/Swiss-PROT和NCBInonredundantproteindatabases蛋白数据库搜索,成功地鉴定出29种差异表达的蛋白,其中1,17种蛋白为两种细胞中有显著差别表达的蛋白点,18,29种蛋白为两种细胞中有相同丰度表达的蛋白点,表1,.表1hBMSCs和成纤维细胞中表达的29种蛋白,略,a,9.1,b,2.0,c,2.2,在hMBSCs中表达高出倍数,,d,10.5,在成纤维细胞中的表达高于的倍数,.2.2WesternBlot结果为验证双向电泳分析的准确性,选取其中的5种蛋白,α-平滑肌肌动蛋白,enolase1,vimentin,60SacidicribosomalprotEinP0andcofilin-1作进一步的蛋白质印迹分析,5种蛋白表达量比较与双向凝胶电泳蛋白表达丰度的比较结果一致,图2,.图2hBMSCs和人成纤维细胞中5种蛋白的WesternBlot结果,略,3讨论hBMSCs是目前理想的组织工程瓣膜的间质种子细胞,成纤维细胞较肌成纤维细胞对于维持正常心脏瓣膜的结构和功能具有更重要的意义,7-10,.但尚不清楚hBMSCs向成纤维细胞进行分化的机制, 应用 hBMSCs构建的组织工程瓣膜均需移植入动物体内后一段时间才能完成组织工程瓣膜的成纤维细胞表型和基质的最后重塑.但是,有研究表明组织工程产品在体内复杂的生物word格式论文环境中重塑会存在个体差异性,11,,可能会导致组织工程瓣膜不能被很好的重塑而导致再次衰败.因此,通过比较hBMSCs和成纤维细胞中的蛋白表达差异,从细胞的蛋白水平理解两种细胞的结构和功能上的差异,对于研究在体外诱导hBMSCs向成纤维细胞分化,以及应用hBMSCs构建TEHV是非常必要的.hBMSCs最初被定义为骨髓中在体外能够粘附生长、增殖和具有自我更新和多向分化能力的“成纤维细胞”样细胞,5,,它们在形态上和成纤维细胞非常的相似.免疫细胞化学分析显示hBMSCs具有肌成纤维细胞样的表型特点,7-8,.通过流式细胞分析技术研究,一系列的表面分子在hBMSCs中被发现,3-4,,然而,有研究发现那些细胞表面分子在成纤维细胞表面有同样的表达.此后,进一步通过基因组学的方法研究发现,在两种细胞中确实存在一些差异基因.蛋白质组,作为细胞基因组的最后表达,能够更详尽、更直接地描述细胞的结构和功能特点,12,.我们第一次采用比较蛋白质组学的方法研究了hBMSCs和人成纤维细胞的蛋白表达差异.采用2-DE分离细胞蛋白样本,银染凝胶,而后挖取蛋白点进行质谱分析仍是目前有效的蛋白质组学研究方法.在这项研究中,通过比较hBMSCs和成纤维细胞蛋白的2-DE图谱,对其中29个稳定表达的差异蛋白质斑点进行了质谱分析、鉴定,相应蛋白数据库信息检索和功能分析.在hBMSCs和成细胞中具有等量高丰度的表达.这种蛋白在两种细胞中的相同表达显示了两种细胞在形态和组织来源上相似性.为了验证蛋白组结果的可靠性,我们进行鉴定、分析的29种差异蛋白中,选出5种蛋白进行了word格式论文WesternBlot实验.两种实验得出了相同的结果,进一步证实采用蛋白质组学方法在蛋白水平研究细胞的形态、结构和功能的可靠性,13,.实验通过分析hBMSCs和成纤维细胞中的蛋白差异表达清楚看到了两种细胞性质不同的hBMSCs和成纤维细胞在形态、结构和功能上异同性.这些结果对于我们今后研究hBMSCs向成纤维细胞分化和应用hBMSCs构建TEHV 是非常有意义的.【参考文献】,1,ProckopDJ.Marrowstromalcellsasstemcellsfornonhematopoietictissues,J, .Science,1997,276:71-74.,2,LiechtyKW,MackenzieTC,ShaabanAF,etal.Humanmesenchymalstemcellsengraf tanddemonstratesite-specificdifferentiationafterinuterotransplantationinsheep,J,.NatMed,2000 ,6:1282-1286.,3,BrentonS,Nathalie,B,TeresaOS,etal.MesenchymalStemCells,J,.ArchMed Res,2003,34:565-571.,4,HaynesworthSE,BaberMA,CaplanAI.Cellsurfaceantigensonhumanmarrow-deri word格式论文vedmesenchymalcellsaredetectedbymonoclonalantibodies,J,.Bone,1992,13:69-80.,5,FriedenstEInAJ,ChailakhyanRK,LalykinaKS. The developmentoffibroblastcoloniesinmonolayerculturesofguineapigbonemarrowa ndspleencells,J,.CellTissueKinet,1970,3:393-402.,6,CandianoG,BruschiM,MusanteL,etal.Bluesilver:avery-sensitivecolloidalCoomassieG-250stainingforproteomeanalysis ,J,.Electrophoresis,2004,25:1327-1333.,7,HoerstrupSP,KadnerA,MelnitchoukS,etal.Tissueengineeringoffunctionalt rileafletheartvalvesfromhumanmarrowstromalcells,J,.Circulation,2002,106:1143-1150.,8,AlexanderK,SimonPH,GregorZ,etal.Anewsourceforcardiovasculartissueeng ineering:humanbonemarrowstromalcells,J,.EurJCardiothoracSurg,2002,21:1055-1160.word格式论文,9,ReyesM,LundT,LenvikT,etal.Purificationandexvivoexpansionofpostnatalh umanmarrowmesodermalprogenitorcells,J,.Blood,2001,98:2615-2625.,10,PittengerMF,MackayAM,BeckSC,etal.Multilineagepotentialofadultmesench ymalstemcells,J,.Science,1999,284:143-147.,11,McBreartyBA,ClarkLD,ZhangXM,etal.Geneticanalysisofamammalianwound-healingtrait,J,.ProcNatlAcadSciUSA,1998,95:11792-11797.,12,BlackstockWP,WeirMP.Proteomics:quantitativeandphysicalmappingofcellu larproteins,J,.TrendsBiotechnol,1999,17:121-127.,13,PanepucciRA,SiufiJL,SilvaWAJr,parisonofgeneexpressionofumbil icalcordveinandbonemarrow-derivedmesenchymalstemcells,J,.StemCells,2004,22:1263-1278.。
癌症的病理生理学变化与临床表现

癌症的病理生理学变化与临床表现癌症是一类以恶性肿瘤为主要特征的疾病。
它是由内源性或外源性致癌因子引发生物体恶性克隆增殖和侵袭而形成的,促进因素包括基因突变、遗传、生活方式、营养、感染等。
本文将着重阐述癌症的病理生理学变化及其临床表现,并分析治疗策略。
一、病理生理学变化癌症的病理生理学变化是指在肿瘤发生、发展和转移过程中,肿瘤组织在细胞、分子和人体整体水平上发生的生理学变化。
首先就是癌细胞的增殖异常。
癌细胞的一大特征是无限增殖,因为它们能够突破细胞增殖抑制机制,绕过程序性死亡途径(凋亡)。
其次,癌细胞的分化程度低,这意味着它们失去了正常细胞的特殊功能,并能够分泌多种增殖因子,如血管内皮生长因子、成纤维细胞生长因子等,诱导永生命反应,令其他正常细胞失控增殖形成癌组织。
最后,癌细胞的侵袭能力强,能够穿过生物组织的各种屏障,形成转移灶。
二、临床表现癌症的症状和体征因其类型、部位、分化程度、临床阶段等而异。
一般而言,早期肿瘤通常无明显症状,而后期肿瘤则有全身性的异常。
下面,我们将分别从临床表现的早、晚期去进行分析。
1.早期临床表现早期癌症通常是无症状的,容易被忽视,患者也没感觉到异常。
只有通过定期体检或其他的筛查检查才能发现早期的肿瘤存在。
但是,有些癌症在早期会出现一些症状,如:胃肠道肿瘤会出现腹泻、便秘、腹痛等问题,子宫颈癌的患者可能会出现白带异常、痛经等问题,肝癌患者则可能会出现肝区酸痛、乏力等问题。
2.晚期临床表现晚期癌症的症状和体征则比较复杂,出现了全身重度异常。
例如,消化道恶性肿瘤患者会呈现贫血、体重减轻、食欲丧失、恶心呕吐等问题。
肺癌患者则可能出现咳嗽、咳痰、气短、胸痛、血痰等问题。
而对于白血病等血液系统恶性肿瘤,患者会出现淋巴结肿大、贫血、骨痛等问题。
三、治疗策略针对癌症的治疗策略包括手术、化疗、放疗、分子靶向治疗等多种方法。
目前,肿瘤专家提倡个体化精准治疗,即依据患者的病理、分子和基因型特点来设计治疗方案。
子宫内膜癌血清PDK1、Lin28B、HMGA2变化及意义

子宫内膜癌血清PDK1、Lin28B 、HMGA2变化及意义何建清,杨立芬,陈莹,宋伟唐山市妇幼保健院妇产科,河北唐山063000摘要:目的 探讨子宫内膜癌患者血清磷酸肌醇依赖性蛋白激酶-1(PDK1)水平、内膜组织Lin -28同系物B (Lin28B )、高迁移率族蛋白2(HMGA2)变化及意义。
方法 选取子宫内膜癌患者120例(观察组)和子宫良性病变80例(对照组),采用ELISA 试剂盒检测血清PDK1水平,以免疫组织化学法检测子宫内膜癌组织及良性病变子宫内膜组织Lin28B 、HMGA2阳性表达。
比较两组血清PDK1水平及子宫内膜组织Lin28B 、HMGA2阳性表达率,并观察不同临床病理特征子宫内膜癌患者PDK1、Lin28B 、HMGA2表达特点,分析血清PDK1水平及子宫内膜组织Lin28B 、HMGA2阳性表达对子宫内膜癌的诊断价值。
结果 与对照组比较,观察组血清PDK1水平及子宫内膜组织Lin28B 、HMGA2阳性表达率升高,差异有统计学意义(P 均<0.05)。
不同病理分期、分化程度、肿瘤直径、有无肌层浸润、淋巴结转移、脉管浸润子宫内膜癌患者血清PDK1水平及内膜组织Lin28B 、HMGA2阳性表达比较差异有统计学意义(P 均<0.05)。
以血清PDK1≥47.88 U/mL 、子宫内膜组织Lin28B 、HMGA2表达阳性为诊断标准,三项联合检测诊断子宫内膜癌的特异度、阳性预测值分别为93.75%、95.24%,均高于PDK1、Lin28B 、HMGA2单项检测(P 均<0.05)。
结论 子宫内膜癌患者血清PDK1水平及子宫内膜癌组织Lin28B 、HMGA2的阳性表达率增高,且与肿瘤病理分期、组织分级、肌层浸润、淋巴结转移、脉管浸润、肿瘤直径相关,三者联合检测对子宫内膜癌的诊断价值较高。
关键词:子宫内膜肿瘤;磷酸肌醇依赖性蛋白激酶1;Lin -28同系物B ;高迁移率族蛋白2doi :10.3969/j.issn.1002-266X.2024.04.017中图分类号:R737.33 文献标志码:A 文章编号:1002-266X (2024)04-0073-04子宫内膜癌是女性生殖系统中较为常见的恶性肿瘤之一[1],目前该病诊断方式主要有超声、宫腔镜、诊断性刮宫等,但诊断效能均不理想[2-3]。
肿瘤介质的作用和治疗策略

肿瘤介质的作用和治疗策略IntroductionAs one of the leading causes of death worldwide, cancer poses a significant threat to public health. Over the years, a vast array of therapeutic strategies have been developed to combat tumors, including chemotherapy, radiotherapy, and immunotherapy. However, these treatments often have limited efficacy, resulting in relapse and recurrence. To address this issue, researchers have been exploring cancer mediating therapies, which aim to target the tumor microenvironment and promote anti-tumor immune responses. In this paper, we will discuss the role of tumor microenvironment in cancer progression and the current strategies being used to target it.Tumor MicroenvironmentThe tumor microenvironment plays an essential role in cancer progression by enabling tumor cells to evade the immune system and promoting angiogenesis, which is necessary for tumor growth and metastasis. The microenvironment comprises various cell types, including cancer-associated fibroblasts (CAFs), immune cells, endothelial cells, and extracellular matrix (ECM) components. CAFs are particularly important in promoting the survival and proliferation of tumor cells. They secrete various factors, including cytokines and growth factors, which promote the growth and survival of tumor cells. Additionally, studies have shown that CAFs can remodel the ECM, creating a physical boundary that inhibits immune cell infiltration.Targeting the Tumor MicroenvironmentTargeting the tumor microenvironment has emerged as a promising strategy for cancer treatment. The goal is to modify the microenvironment to create an anti-tumor environment, thus preventing cancer progression. One approach used to target the tumor microenvironment is to inhibit angiogenesis. Anti-angiogenic therapy refers to the blockade of specific signaling pathways or the inhibition of growth factors that promote angiogenesis. Several anti-angiogenic agents, including bevacizumab and sunitinib, have been approved for cancer treatment.Another approach used to target the tumor microenvironment is to modify the immune response. Immune checkpoint inhibitors, such as pembrolizumab and nivolumab, have been developed to modulate the immune response by targeting pathways that suppress T-cell activation. By blocking immune checkpoint receptors, these agents enhance T cell activation and promote anti-tumor immunity. Additionally, adoptive cell therapy (ACT) is another approach that uses genetically engineered T cells to recognize and kill tumor cells. ACT has shown promising results in treating hematological malignancies and solid tumors.ConclusionThe tumor microenvironment plays an essential role in cancer progression, and targeting it has emerged as a promising strategy for cancer treatment. Several approaches are being used to modify the microenvironment, including anti-angiogenic therapy, immunecheckpoint inhibitors, and adoptive cell therapy. In the future, the further study of tumor microenvironment biology and the development of additional targeted therapies will be crucial for improving cancer outcomes.Keywords: tumor microenvironment, cancer therapy, angiogenesis, immune checkpoint inhibitors, adoptive cell therapy.摘要癌症作为导致全球死亡的主要原因之一,对公共卫生构成了重大威胁。
免疫评分及肿瘤免疫系统的研究进展
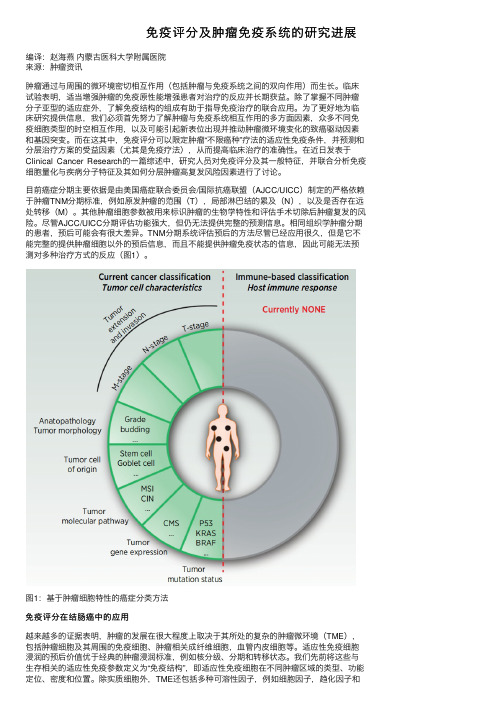
免疫评分及肿瘤免疫系统的研究进展编译:赵海燕内蒙古医科⼤学附属医院来源:肿瘤资讯肿瘤通过与周围的微环境密切相互作⽤(包括肿瘤与免疫系统之间的双向作⽤)⽽⽣长。
临床试验表明,适当增强肿瘤的免疫原性能增强患者对治疗的反应并长期获益。
除了掌握不同肿瘤分⼦亚型的适应症外,了解免疫结构的组成有助于指导免疫治疗的联合应⽤。
为了更好地为临床研究提供信息,我们必须⾸先努⼒了解肿瘤与免疫系统相互作⽤的多⽅⾯因素,众多不同免疫细胞类型的时空相互作⽤,以及可能引起新表位出现并推动肿瘤微环境变化的致癌驱动因素和基因突变。
⽽在这其中,免疫评分可以限定肿瘤“不限癌种”疗法的适应性免疫条件,并预测和分层治疗⽅案的受益因素(尤其是免疫疗法),从⽽提⾼临床治疗的准确性。
在近⽇发表于Clinical Cancer Research的⼀篇综述中,研究⼈员对免疫评分及其⼀般特征,并联合分析免疫细胞量化与疾病分⼦特征及其如何分层肿瘤⾼复发风险因素进⾏了讨论。
⽬前癌症分期主要依据是由美国癌症联合委员会/国际抗癌联盟(AJCC/UICC)制定的严格依赖于肿瘤TNM分期标准,例如原发肿瘤的范围(T),局部淋巴结的累及(N),以及是否存在远处转移(M)。
其他肿瘤细胞参数被⽤来标识肿瘤的⽣物学特性和评估⼿术切除后肿瘤复发的风险。
尽管AJCC/UICC分期评估功能强⼤,但仍⽆法提供完整的预测信息。
相同组织学肿瘤分期的患者,预后可能会有很⼤差异。
TNM分期系统评估预后的⽅法尽管已经应⽤很久,但是它不能完整的提供肿瘤细胞以外的预后信息,⽽且不能提供肿瘤免疫状态的信息,因此可能⽆法预测对多种治疗⽅式的反应(图1)。
图1:基于肿瘤细胞特性的癌症分类⽅法免疫评分在结肠癌中的应⽤越来越多的证据表明,肿瘤的发展在很⼤程度上取决于其所处的复杂的肿瘤微环境(TME),包括肿瘤细胞及其周围的免疫细胞、肿瘤相关成纤维细胞,⾎管内⽪细胞等。
适应性免疫细胞浸润的预后价值优于经典的肿瘤浸润标准,例如核分级、分期和转移状态。
血液系统
抗血小板药物中,阿司匹林抑制 COX,减少 TXA2 生成;利多格雷抑制 TXA2 合成酶,减少 TXA2 生 成并阻断 TXA2 受体;双嘧达莫抑制磷酸二酯酶,减少 cAMP 降解,增加血小板内 cAMP 的含量;噻氯匹 定干扰血小板活化,抑制血小板聚集和粘附;阿昔单抗阻断血小板 GPⅡb /Ⅲa 受体,抑制血小板聚集。右旋 糖酐可提高血浆胶体渗透压,扩充血容量,降低血液的粘滞度,减少血小板的粘附和聚集,临床主要用于 休克的抢救和预防手术后血栓形成及治疗某些血栓栓塞性疾病。
2.抗凝系统 血浆中的抗凝物质包括抗凝血酶Ⅲ(Antithrombin Ⅲ,AT-Ⅲ)和蛋白质 C(protein C,又称为抗凝蛋白 C)等。AT-Ⅲ主要由肝脏细胞合成,肺、脾、肾、心、肠、 脑和血管内皮细胞也能合成。AT-Ⅲ是丝氨酸蛋白酶的抑制剂(serine protease inhibitor), 其结构中含有精氨酸残基,能作用于以丝氨酸为活性中心的凝血因子Ⅱa、Ⅸa、Ⅹa、Ⅺa 和Ⅻa 等,与这些因子活性中心的丝氨酸残基结合,形成 1:1 的复合物,从而使上述凝血 因子失活,产生抗凝作用。
叶酸
叶酸(folic acid)属水溶性 B 族维生素,广泛存在于动、植物性食品中,少量由结肠细 菌合成的叶酸吸收极微,故人体必须从食物中获得叶酸。食物中的叶酸进人体内后,在二氢 叶酸还原酶作用下形成具有活性的四氢叶酸,作为甲基(-CH3)、甲酰基(-CHO)等一碳 基团的传递体。这些一碳基团由丝氨酸、组氨酸、甘氨酸和蛋氨酸等产生后,即以叶酸作为 载体,参与嘌呤、嘧啶等物质的合成。当叶酸缺乏时,叶酸作为载体介导的一碳基团代谢障 碍,影响了核苷酸的合成,其中最为明显的是胸腺嘧啶核苷酸的合成受阻,导致细胞核中 DNA 合成减少,细胞分裂与增殖减少。但由于对 RNA 和蛋白质合成影响较少,使细胞的 DNA/RNA 比值降低,出现细胞增大、胞浆丰富、细胞核中染色质疏松分散。红细胞系影响 最为明显,表现为巨幼红细胞性贫血;消化道上皮增殖受阻,表现为舌炎、腹泻等。
切片观察实验指导
实验一局部血液循环障碍一、〔实验目的〕通过组织切片观察,认识﹑掌握器官组织发生充血、淤血、出血、梗死等病理变化的形态学变化特征,了解其发生原因、机制﹑结局和意义。
二、〔实验材料〕充血、淤血及出血的组织切片三、〔实验内容、方法和步骤〕大体标本充血1. 肺淤血:多见于左心机能不全。
静脉回流受阻,肺体积增大,被膜紧张,色紫红,质地较坚实,切面流出多量暗红色血液。
淤血较久时,则易发生肺水肿,此时肺切面流出多量带泡沫的血样液体。
肺间质增宽,富含水分。
肺组织块投入水中如载重舟。
2. 肝淤血:常见于右心衰竭。
淤血时体积增大,边缘钝圆,色暗紫红色,切面流出多量暗紫红色血液,淤血较久时,小叶中央部充血呈暗红色,小叶边缘则肿胀或脂变呈黄褐色,形成暗红色与黄褐色相间的斑纹,类似中药槟榔的断面故称“槟榔肝”。
3肠淤血:肠壁静脉扩张增粗,充满暗红色血液,形似树枝状。
出血1. 猪肾点状出血:肾表面及切面上有多数针尖至菜籽大小的出血小点。
此标本取至猪瘟病。
2. 心内膜斑状出血:心室内膜下出现黑红色斑点,称淤斑。
3. 马肝被膜下血肿:肝被膜下与实质之间有大的凝固血块,周围结缔组织增生形成包裹。
血肿周围实质受压贫血,呈淡黄褐色。
4. 血管破裂性出血:乳牛产后子宫中动脉破裂出血,患畜死于失血过多。
此标本示血管破裂处。
5. 线状出血:肠粘膜皱壁的顶端出血,呈暗红色的线条,称线状出血。
6. 出血性子宫炎:子宫内膜弥漫性出血,呈暗紫红色。
血栓形成1. 牛肺静脉红色血栓:肺内扩张的静脉内有一血块,其中心红色,边缘淡黄,(这是因形成时间较久,边缘血红蛋白崩解之故)因发生血栓软化,血管与血栓界线不清。
2. 猪心瓣膜上白色血栓:二尖瓣向血流面有一干燥灰白赘生物附着,表面粗糙不平,呈椰菜花样外观。
瓣膜变形、缺损。
此标本取自慢性猪丹毒患猪。
4. 动脉内白色血栓:马前肠系膜动脉根部管腔扩大,管壁肥厚,内膜粗糙不平,内膜上附着干燥灰白片状血栓物质。
通过此标本理解血栓形成的条件。
血管生成与肿瘤ppt课件
-
34
胶质瘤中VEGF蛋白阳性染色主要定位于肿瘤细胞的胞 浆,内皮细胞也可呈阳性表达。43例星形细胞瘤组织中肿 瘤细胞VEGF阳性表达率为77.0%。Ⅰ、Ⅱ级组VEGF阳性表达 率和表达强度均显著低于Ⅲ、Ⅳ级组, VEGF表达强度与 MVD呈等级正相关,VEGF表达情况和MVD及肿瘤微血管形态 可能有助于判断星形细胞瘤的恶性程度。
-
25
2、VEGF的受体(VEGFR)
VEGF选择性的,具有高度亲和性的直接作用于两种Ⅲ 型酪氨酸激酶受体:VEGFR-1(flt-1)和VEGFR-2 (KDR/flk-1)来发挥作用,VEGFR-2是发挥主要功能的受 体。基因打靶技术证实VEGFR-1和VEGFR-2在血管发生中起 重要的作用。
-
7
-
8
-
9
肿瘤无血管生成的支持就不能进一步增长
肿瘤生长过程
血管前期 肿瘤生长休眠期, 直径<1~2mm
血管期
瘤体积增大,浸润、转移 有诱导血管形成的能力。
肿瘤血管形成这一过程既受机体神经内分泌因素影响, 又受肿瘤细胞和肿瘤基质细胞表达的生长因子调控。
-
10
-
11
第二节 肿瘤微血管形态和生物学特性
VEGF145,多数组织以其成熟的形式VEGF165表达为主,促 进细胞有丝分裂潜能方面VEGF165比VEGFl21更强。 5种类 型的VEGF具有相同的生物学活性,其中VEGF121和VEGF165 以可溶性方式分泌,另外三种VEGF以与细胞表达蛋白多糖 结合的形式存在 。VEGF/VPF的蛋白家族基本成员包括胎盘 生长因子和VEGFB,C,D,E。原来命名为血管通透因子 (VPF)。
一、肿瘤血管形成的特征 ⑴ 失控性:肿瘤新生血管出现迅速,生长快,并呈持续性, 10 %~20 %的肿瘤血管内皮细胞始终处于DNA合成状态,这种 持续的血管生成是由肿瘤组织血管生成生长因子持续高水平 释放造成的。
肿瘤相关巨噬细胞在肿瘤中作用的研究进展
肿瘤相关巨噬细胞在肿瘤中作用的研究进展肿瘤相关巨噬细胞(TAM)主要来源于血液中的单核细胞,在肿瘤中浸润,是构成肿瘤微环境(TME)的重要免疫细胞,参与调控肿瘤的多种复杂免疫反应,其数量与患者的预后密切相关[1],所以靶向作用TAM很有可能成为治疗肿瘤的新策略。
1 TAM的来源与募集TAM有两个主要来源,大部分TAM来源于外周血单核细胞(MDMS),这些细胞作为未成熟的单核细胞前体从骨髓中释放出来,在血液中循环,并迁移到不同的组织中分化[2];还有很少一部分TAM来源于卵黄囊,并在特定组织定植的巨噬细胞(TRM),不同来源的TAM在功能和作用上的差别尚未明确[3]。
肿瘤细胞和基质细胞可以分泌多种细胞因子和趋化因子,这些因子可将巨噬细胞募集到肿瘤细胞周围。
巨噬细胞具有高度异质性,当其被招募迁移至肿瘤间充质中后,可以通过改变自身的表型,来适应它们所处的微环境。
现已明确起募集作用的主要因子有CC・趋化因子配体-2(CC1-2)、CC1-3、CC14CC1-5、CC1・7、Ce1-8、CC1-9、CC13、CC1-14、CC1-18、巨噬细胞集落刺激因子(M-CSF)、粒细胞-巨噬细胞集落刺激因子(GM-CSF)、白细胞介素4(∣1-4)、I1/O、I1-13、脂多糖、干扰素Y(IFN-γ)、转录生长因子B(TGF-β)、血管内皮生长因子(VEGF)、肿瘤坏死因子。
(TNF-α)、血小板源生长因子(PDGF)等。
Hamnton[4]的研究说明,起募集作用的M-CSF,又称集落刺激因子1(CSF-1),是将巨噬细胞募集并极化成TAM的主要因子。
李颜君等[5]认为,M-CSF 与其受体(M-CSFR)结合,继而启动RAS、MAPK.PI3K、SATA、JAK等信号通路,发挥募集巨噬细胞的作用。
已有研究证实,在多种肿瘤模型中使用针对M-CSF的阻断剂单克隆抗体(MAb)阻断M-CSF/M-CSFR向TAM的信号传递时,TAM 数量显著减少[6]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
成纤维细胞与血液系统恶性肿瘤摘要肿瘤微环境在肿瘤的发生、发展中起重要作用。
参与这个微环境成分的细胞中,相较于造血系统肿瘤与实体肿瘤癌,癌症相关成纤维(CAFS)却很少受到关注。
在这篇综述中,我们主要探讨CAFs参与血液系统恶性肿瘤进展和潜在的靶向癌相关纤维细胞的新的治疗角度。
关键词:肿瘤相关成纤维细胞,间充质干细胞,血液系统恶性肿瘤,肿瘤微环境一主要血液系统恶性肿瘤急性白血病急性白血病是血液系统恶性肿瘤,起源于早期造血祖细胞和髓细胞(急性髓细胞样白血病AML)和淋巴机型淋巴性细胞白血病ALL的血统。
急性白血病,可以根据细胞遗传学、形态学、免疫表型的标准和骨髓的初步发展来进一步细分。
急性白血病易侵入循环系统并且发生扩散。
慢性淋巴细胞白血病(Chronic Lymphocytic Leukemia)CLL是CD19[1]单克隆扩展、CD5+B细胞携带突变和未突变的免疫球蛋白的可变区基因(IGV)。
突变的病例相比未突变的病例预后较好,也包括表达的CD38和ZAP-70的标记。
CLL,经常表现为无症状的血淋巴细胞,在淋巴结和骨髓微环境的发展。
滤泡性淋巴瘤(Follicular Lymphoma)滤泡性淋巴瘤是一种B细胞性恶性肿瘤,发展次级淋巴滤泡和含有不同比例的中心母细胞和中心细胞。
肿瘤细胞侵犯骨髓,在外周血中循环。
FL是一种惰性淋巴瘤由淋巴滤泡组成的抗凋亡蛋白Bcl-2表达的肿瘤细胞的逐步渗透[2]。
侵入淋巴结可能会较长时间的残余在他们的生理体系结构中。
霍奇金淋巴瘤(Hodgkin Lymphoma)HL是一种特殊的,来源于B细胞性的恶性肿瘤,[3] 且不表达B 细胞标记物。
其特点就是缺乏肿瘤细胞称为多核分叶状巨细胞。
霍奇金淋巴瘤在淋巴结微环境中,分在两种临床病理实体,即经典霍奇金淋巴瘤(95%例)和结节性淋巴细胞为主型(5%例)[4]。
HL淋巴结是含各种活性细胞,如嗜酸性粒细胞、中性粒细胞、浆细胞和T细胞。
多发性骨髓瘤(Multiple Myeloma)多发性骨髓瘤是一种单克隆浆细胞恶性肿瘤。
它生长在骨髓中,并且会转移到骨。
并且有显著的破坏性来影响宿主器官——骨髓。
[5]二间充质干细胞和癌相关成纤维细胞之间的差异和相似之处癌相关成纤维细胞(CAFs),在大多数实体肿瘤中较明确的定义。
但在起源于间充质干细胞造血系统恶性肿瘤的微环境中,如骨髓和淋巴结,则有较少的定义。
在这些疾病中,这些基质细胞通常被称为间质的基质干细胞,即,类似于间充质干细胞,定义为间充质干细胞(MSCs)。
然而,白血病相关的骨髓间充质干细胞和经典的实体瘤癌相关成纤维细胞之间进行比较表明,这些类型的细胞有许多共同的表型和功能特征。
因此,基于实际原因,CAF和MSC的术语可以互换使用,后者主要强调骨髓间充质干细胞是体外培养后产生的。
成纤维细胞的主要功能是胶原的合成和沉积,建立了结缔组织支架[5, 6]。
CAFs研究获得一种新的功能性极化转化为生产和释放蛋白酶--消化细胞外基质(如基质金属蛋白酶),释放促血管生成因子来促进微血管形成和转移的分子,并且促进肿瘤细胞迁徙[6]。
骨髓间充质干细胞与成纤维细胞相比具有类似的活动,但是,不同的是,骨髓间充质干细胞(MSCs)选择性地改变免疫细胞功能,主要通过抑制T细胞或树突状细胞的活性。
或者通过抑制自然杀伤细胞的杀伤能力。
尽管如此,已经解决的中胚层来源的成纤维细胞的免疫调节活性的经典的一些研究已经表明,后者表现为骨髓间充质干细胞[[7, 8]。
此外,MSCs可以分化以及成骨细胞,脂肪细胞和软骨细胞的谱系,[9]。
最后,在缺乏造血细胞和内皮细胞标志物时[10],骨髓间充质干细胞表达干细胞标志物(CD73、CD105、CD44、CD90、或CD 29)。
三成纤维细胞与血液系统恶性肿瘤在本文的引言部分提到,大多数发表的研究白血病和淋巴瘤微环境基质细胞的作用已经在测试前使用骨髓间充质干细胞体外扩增了几代了。
另一方面,由于骨髓间充质干细胞是成纤维细胞的前体,可以知道,骨的成纤维细胞具有类似的功能特性。
对于血液系统恶性肿瘤患者的骨髓成纤维细胞的一些研究支持了这个结论。
frassanito从多发性骨髓瘤(MM)患者体内分离了原代骨髓成纤维细胞,这些细胞具有多种CAFS的细胞特征并且促进肿瘤的生长[11]。
毛细胞白血病(HCL)是一种慢性B细胞恶性肿瘤,特点是渐进的纤维化过程。
主要是由于细嗜银网状纤维的积累。
在晚期患者中,可能与胶原纤维[12]并存。
糖蛋白结合蛋白,毛细胞白血病细胞聚集,促进HCL患者骨髓纤维化的过程,提高毛细胞白血病细胞源的FGF-2 [13]。
这些研究结果表明,毛细胞白血病的骨髓纤维化是由于胶原积累(网状)和非胶原(蛋白)的细胞外基质构成。
成纤维细胞与胶原纤维网织红细胞胰岛素和胶原蛋白是密切相关的,但成纤维细胞的数量没有显着增加。
[14]。
总的来说,这些结果表明,骨髓成纤维细胞是由骨髓微环境合成网状纤维和胶原来激活的。
而不是增殖和扩散。
急性白血病中的骨髓间充质干细胞(BM-MSCs)骨髓间充质干细胞已经可以从患有B细胞急性淋巴细胞白血病(B-ALL)和急性粒细胞白血病(AML)的病人体内分离,并且进行体外扩增。
骨髓间充质干细胞已经被证明能够抑制急性白血病细胞体外增殖。
主要通过抑制恶性细胞的细胞周期的G1期。
相反,在给予免疫缺陷小鼠注射急性白血病细胞与骨髓间充质干细胞的结合,后者的细胞加速肿瘤的生长,可能是通过形成癌症干细胞。
[15]Avanzini等人。
最近发现骨髓间充质干细胞五MPN患者出23的测试显示,遗传与转化中检测到的异常无关髓细胞。
此外,病患骨髓间充质干细胞与健康捐赠者的骨髓间充质干细胞相比会有几个功能缺陷。
作者假设在白血病生成时异常基质细胞所扮演的角色。
[16]最后,患者骨髓间充质干细胞急性淋巴或髓系白血病促进生存和肿瘤细胞生长以及耐药。
另外功能异常和基因研究已经划定的骨髓间充质干细胞和白血病细胞之间复杂的发展的关系,从不同的研究,还没有划定一个综合的异质性模型结果。
慢性淋巴细胞白血病中(CLL)的骨髓间充质干细胞从bm-scs CLL患者中进行的研究产生的结果与急性白血病患者获得完全一致,即基质细胞促进生存、迁移和白血病细胞耐药[17, 18]。
然而,慢性淋巴细胞白血病中研究已经识别了异常的或者肿瘤细胞的“具体”恶性细胞和基质细胞之间的相互作用机制。
原发性慢性淋巴细胞性白血病的细胞被证明具有一个有限的运输能力为谷胱甘肽合成的XC转运蛋白的低表达胱氨酸。
骨髓间充质干细胞,相反,是非常有效的在进口胱氨酸转化为半胱氨酸,释放在肿瘤微环境和被CLL细胞促进谷胱甘肽的合成。
高浓度后者分子有效性促进白血病细胞的生存和保护他们免受化疗药物的毒性。
基质驱动的保护机制在基质细胞的存在下对致敏的白血病细胞的细胞毒性药物的抑制作用。
针对这一生化途径可能是一种很有前途的治疗途径。
[19]。
骨髓间充质干细胞和淋巴瘤在经典霍奇金淋巴瘤(cHL)和滤泡性淋巴瘤(FL),两种恶性肿瘤疾病中间充质干细胞来源于生发中心的B细胞。
骨髓间充质干细胞或纤维母细胞存在于这两种肿瘤微环境中。
cHL是由单核霍奇金细胞和多核霍奇金和里-斯氏细胞(HRS)组成的,起嵌入在一个丰富的微环境中,并且其中包含其他非肿瘤细胞类型的细胞,包括T细胞和B细胞、浆细胞、嗜酸性粒细胞、肥大细胞、组织细胞/巨噬细胞。
成纤维细胞样细胞和相互交叉的网状细胞在结节硬化型胶原带大量出现,它们与里-斯氏细胞也是相关的。
[20]CAFS和多发性骨髓瘤frassanito等人研究[20]发现在多发性骨髓瘤患者的骨髓样本中癌症相关成纤维表达FSP1,αSMA和FAP。
最高比例癌症相关成纤维就是在骨髓瘤患者样本中发现的。
同时免疫组化研究发现较多的CAFs 与骨髓瘤细胞共存。
CAF它表达的细胞标记限制内皮细胞,使得它衍生出多种细胞,例如造血干细胞和间充质干细胞。
此外,frassanito 等人[20]证明骨髓瘤通过分泌TGF-β激活并聚集成纤维细胞。
反过来,CAFs可以变换骨髓基质,主要通过产生胶原和纤维连接蛋白,和通过分泌生长因子(TGF-β,HGF,IGF1)、细胞因子(IL-1、IL-6)和趋化因子(SDF-1α)。
TGF-β和来自多发性骨髓瘤细胞的条件培养基激活多发性骨髓瘤中的成纤维,使患者的多发性骨髓瘤内皮细胞和造血干细胞转化为CAF样细胞。
frassanito等人[20]利用体内异种移植的MM 5t33小鼠模型,证明了在动物体内注射活化的多发性骨髓瘤成纤维和多发性骨髓瘤细胞可以加速肿瘤生长。
而这个速度明显大于只在小鼠体内注射多发性骨髓瘤细胞。
最后,frassanito等人[20]发现SDF1αSDF-1/CXCR4的抑制影响MM细胞的迁移、黏附和增殖表明多发性骨髓瘤CAFs通过分泌SDF1 –α募集CXCR4+细胞。
总之,骨髓间充质干细胞和癌相关纤维细胞通过不同的途径促进血液系统恶性肿瘤生长、增值和迁移。
治疗意义癌相关成纤维最近被作为治疗的靶点。
癌相关成纤维与癌细胞之间相互作用的特点是一个前馈回路中各种生长因子、细胞因子及其受体在促进肿瘤的生长和发展中起着重要的作用。
例如一方面肿瘤细胞分泌过多的因子如TGF-β1、PDGF、VEGF、FGF-2、IL-6、IFN-γ,TNF, MMPs,来参与成纤维细胞激活,而另一方面CAFS产生同样的分子反过来会影响肿瘤的侵袭。
在这样的情况下,可以通过使用拮抗剂或特异性抗体作用于目的的生长因子及其受体,在某些情况下,可同时作用于肿瘤细胞和CAFS。
[21-23]而最近发现靶向的癌症相关成纤维着重转向于特殊的整合蛋白,已被发现是由肿瘤细胞和成纤维细胞表达的,并且这参与了肿瘤的恶化。
[24]特别是,最近的一项研究表明,整合素αVβ6触发导致CAFs 增殖,从而增加胃癌转移[25]。
此外,人类的治疗性抗体264rad,结合αVβ6并抑制其功能。
同时已被证明通过抑制TGF-β介导的的活化癌相关成纤维细胞,并通过减少纤维连接蛋白和αSMA在间质成纤维细胞上的表达,以此来延缓肿瘤生长,[26]。
因此,抑制整合素αVβ6的表达可能为未来治疗癌症提供新的方法。
另外,姜黄素也可以可干扰的动态互动关系研究及头颈部肿瘤细胞[27]。
具体来说,姜黄素减少与肿瘤侵袭及EMT从而减少炎症介质的释放。
这些数据证实,在临床应用中的潜力,强调提高姜黄素制剂的体内输送的需要。
1. Katz BZ, Herishanu Y: Therapeutic targeting of CD19 in hematological malignancies: past,present, future and beyond. Leukemia & lymphoma 2014, 55(5):999-1006.2. Lavik AR, Zhong F, Chang MJ, Greenberg E, Choudhary Y, Smith MR, McColl KS, Pink J, Reu FJ,Matsuyama S et al: A synthetic peptide targeting the BH4 domain of Bcl-2 induces apoptosis in multiple myeloma and follicular lymphoma cells alone or in combination with agents targeting the BH3-binding pocket of Bcl-2. Oncotarget 2015, 6(29):27388-27402.3. Solimando AG, Ribatti D, Vacca A, Einsele H: Targeting B-cell non Hodgkin lymphoma: Newand old tricks. Leukemia research 2016, 42:93-104.4. Rentas Torres Y, Rodriguez-Lopez JL, Valentin M, Silva H: Difficult Diagnosis between B CellLymphoma and Classical Hodgkin's Lymphoma. Boletin de la Asociacion Medica de Puerto Rico 2015, 107(3):98-101.5. Gooding S, Edwards CM: New approaches to targeting the bone marrow microenvironmentin multiple myeloma. Current opinion in pharmacology 2016, 28:43-49.6. Cirri P, Chiarugi P: Cancer-associated-fibroblasts and tumour cells: a diabolic liaison drivingcancer progression. Cancer metastasis reviews 2012, 31(1-2):195-208.7. Haniffa MA, Collin MP, Buckley CD, Dazzi F: Mesenchymal stem cells: the fibroblasts' newclothes?Haematologica 2009, 94(2):258-263.8. Dominici M, Le Blanc K, Mueller I, Slaper-Cortenbach I, Marini F, Krause D, Deans R, Keating A,Prockop D, Horwitz E: Minimal criteria for defining multipotent mesenchymal stromal cells.The International Society for Cellular Therapy position statement. Cytotherapy 2006, 8(4):315-317.9. Jones S, Horwood N, Cope A, Dazzi F: The antiproliferative effect of mesenchymal stem cellsis a fundamental property shared by all stromal cells. Journal of immunology 2007, 179(5):2824-2831.10. Tropel P, Noel D, Platet N, Legrand P, Benabid AL, Berger F: Isolation and characterisation ofmesenchymal stem cells from adult mouse bone marrow. Experimental cell research 2004,295(2):395-406.11. Burthem J, Cawley JC: The bone marrow fibrosis of hairy-cell leukemia is caused by thesynthesis and assembly of a fibronectin matrix by the hairy cells. Blood 1994, 83(2):497-504.12. Frassanito MA, Rao L, Moschetta M, Ria R, Di Marzo L, De Luisi A, Racanelli V, Catacchio I,Berardi S, Basile A et al: Bone marrow fibroblasts parallel multiple myeloma progression in patients and mice: in vitro and in vivo studies. Leukemia 2014, 28(4):904-916.13. Vykoupil KF, Thiele J, Georgii A: Hairy cell leukemia. Bone marrow findings in 24 patients.Virchows Archiv A, Pathological anatomy and histology 1976, 370(4):273-289.14. Avanzini MA, Bernardo ME, Novara F, Mantelli M, Poletto V, Villani L, Lenta E, Ingo DM,Achille V, Bonetti E et al: Functional and genetic aberrations of in vitro-cultured marrow-derived mesenchymal stromal cells of patients with classical Philadelphia-negative myeloproliferative neoplasms. Leukemia 2014, 28(8):1742-1745.15. Ramasamy R, Lam EW, Soeiro I, Tisato V, Bonnet D, Dazzi F: Mesenchymal stem cells inhibitproliferation and apoptosis of tumor cells: impact on in vivo tumor growth. Leukemia 2007, 21(2):304-310.16. Shehata M, Schwarzmeier JD, Hilgarth M, Hubmann R, Duechler M, Gisslinger H: TGF-beta1induces bone marrow reticulin fibrosis in hairy cell leukemia. The Journal of clinical investigation 2004, 113(5):676-685.17. Zhang W, Trachootham D, Liu J, Chen G, Pelicano H, Garcia-Prieto C, Lu W, Burger JA, CroceCM, Plunkett W et al: Stromal control of cystine metabolism promotes cancer cell survival in chronic lymphocytic leukaemia. Nature cell biology 2012, 14(3):276-286.18. Panayiotidis P, Jones D, Ganeshaguru K, Foroni L, Hoffbrand AV: Human bone marrowstromal cells prevent apoptosis and support the survival of chronic lymphocytic leukaemia cells in vitro. British journal of haematology 1996, 92(1):97-103.19. Lagneaux L, Delforge A, Bron D, De Bruyn C, Stryckmans P: Chronic lymphocytic leukemic Bcells but not normal B cells are rescued from apoptosis by contact with normal bone marrow stromal cells. Blood 1998, 91(7):2387-2396.20. Balakrishnan K, Burger JA, Quiroga MP, Henneberg M, Ayres ML, Wierda WG, Gandhi V:Influence of bone marrow stromal microenvironment on forodesine-induced responses in CLL primary cells. Blood 2010, 116(7):1083-1091.21. Pietras K, Pahler J, Bergers G, Hanahan D: Functions of paracrine PDGF signaling in theproangiogenic tumor stroma revealed by pharmacological targeting. PLoS medicine 2008, 5(1):e19.22. Wen J, Matsumoto K, Taniura N, Tomioka D, Nakamura T: Hepatic gene expression of NK4, anHGF-antagonist/angiogenesis inhibitor, suppresses liver metastasis and invasive growth of colon cancer in mice. Cancer gene therapy 2004, 11(6):419-430.23. Kim KJ, Wang L, Su YC, Gillespie GY, Salhotra A, Lal B, Laterra J: Systemic anti-hepatocytegrowth factor monoclonal antibody therapy induces the regression of intracranial glioma xenografts. Clinical cancer research : an official journal of the American Association for Cancer Research 2006, 12(4):1292-1298.24. Zhuang Z, Zhou R, Xu X, Tian T, Liu Y, Liu Y, Lian P, Wang J, Xu K: Clinical significance ofintegrin alphavbeta6 expression effects on gastric carcinoma invasiveness and progression via cancer-associated fibroblasts. Medical oncology 2013, 30(3):580.25. Eberlein C, Kendrew J, McDaid K, Alfred A, Kang JS, Jacobs VN, Ross SJ, Rooney C, Smith NR,Rinkenberger J et al: A human monoclonal antibody 264RAD targeting alphavbeta6 integrin reduces tumour growth and metastasis, and modulates key biomarkers in vivo. Oncogene 2013, 32(37):4406-4416.26. Desgrosellier JS, Cheresh DA: Integrins in cancer: biological implications and therapeuticopportunities. Nature reviews Cancer 2010, 10(1):9-22.27. Dudas J, Fullar A, Romani A, Pritz C, Kovalszky I, Hans Schartinger V, Mathias Sprinzl G,Riechelmann H: Curcumin targets fibroblast-tumor cell interactions in oral squamous cell carcinoma. Experimental cell research 2013, 319(6):800-809.。
