元素周期表中的金属与非金属
元素周期表中的规律

元素周期表中的规律元素周期表中的规律⼀、元素周期表1、周期表结构横⾏——周期:共七个周期,三短三长⼀不完全。
各周期分别有2,8,8,18,18,32,26种元素。
前三个周期为短周期,第四⾄第六这三个周期为长周期,第七周期还没有排满,为不完全周期。
纵⾏——族:七主七副⼀零⼀VIII,共16族,18列。
要记住零族元素的原⼦序数以便迅速由原⼦序数确定元素名称。
周期:⼀⼆三四五六七元素种类:28818183226零族:2He10Ne 18Ar 36Kr54Xe86Rn⼆、元素周期表中元素及其化合物的递变性规律1.原⼦结构与元素周期表的关系电⼦层数= 周期数主族元素最外层电⼦数= 主族序数= 最⾼正化合价由上述关系,就可以由原⼦结构找出元素在周期表中的位置,也可以由位置确定原⼦结构。
2、规律性由此可见,⾦属性最强的元素在周期表的左下⾓即Cs(Fr具有放射性,不考虑),⾮⾦属性最强的元素在右上⾓即F。
对⾓线附近的元素不是典型的⾦属元素或典型的⾮⾦属元素。
3、元素周期表中之最原⼦半径最⼩的原⼦:H原⼦质量最轻的元素:H元素;⾮⾦属性最强的元素:F⾦属性最强的元素:Cs(不考虑Fr)最⾼价氧化物对应⽔化物酸性最强的酸:HClO4最⾼价氧化物对应⽔化物碱性最强的碱:CsOH形成化合物最多的元素:C元素所含元素种类最多的族:ⅢB地壳中含量最⾼的元素:O元素,其次是Si元素地壳中含量最⾼的⾦属元素:Al元素,其次是Fe元素含H质量分数最⾼的⽓态氢化物:CH4与⽔反应最剧烈的⾦属元素:Cs元素与⽔反应最剧烈的⾮⾦属元素:F元素常温下为液态的⾮⾦属单质是Br2,⾦属单质是Hg……4、特殊性在掌握原⼦结构、元素性质的⼀般规律时,还要注意特殊性:⑴原⼦最外层电⼦排布是1—8个电⼦,但第⼀周期是1—2个电⼦⑵同⼀周期原⼦半径由⼤→⼩,但稀有⽓体突然增⼤(严格讲,稀有⽓体中不是原⼦半径⽽是范德华半径)⑶同⼀周期元素主要化合价由+1价到+7价,但F没有+7价,O没有+6价。
元素周期表中的化学元素及其特性

元素周期表中的化学元素及其特性元素周期表是化学中非常重要的一部分,它展示了元素的种类和特性,如原子序数、电子结构、化学性质等等。
本文将分别介绍周期表中的四个区域:主族元素、过渡元素、稀土元素和放射性元素,并探讨它们的特性和应用。
一、主族元素主族元素是周期表中从第一族到第八族的元素,它们的外层电子结构都是ns或np。
主族元素具有相似的化学性质,例如它们具有相同的氧化状态和离子化能级,因此可以进行分类和归纳。
主族元素可以分为金属元素和非金属元素。
1.金属元素主族元素中的金属元素具有良好的导电性和热传导性,而且通常具有光泽、易弯曲、延展性高等特点。
最常见的主族金属有铝、锡、铅、钠、钾等。
其中,铝是一种轻质、柔软、耐腐蚀的金属,在建筑、汽车和电子行业中应用广泛。
另外,锡常用于焊接、镀金和制造合金,而铅则用于制造电池、弹头、防辐射材料等。
2.非金属元素主族非金属元素通常是颜色鲜艳的气体或脆弱的晶体,这些元素通常都有毒性。
最常见的主族非金属有氢、碳、氮、氧、氟等。
其中,碳是一种无色、透明或黑色固体,有着良好的化学稳定性和高温耐性。
碳的应用范围非常广泛,可用于制造钢铁、石墨、金刚石等。
氧则是许多生命体系必需的元素,它广泛用于呼吸、燃烧和氧化反应等。
二、过渡元素过渡元素是位于周期表中间的元素,其特点是具有不同的氧化态,同时也具有良好的导电、热传导性和化学活性。
常见的过渡元素有铁、铜、锰、铬、钴等,这些元素在工业和生物学领域都有广泛的应用。
其中,铁和钢在建筑、汽车、航空等行业中广泛应用,铜的应用范围也非常广泛,可用于制造电线、管道、加工成各种装饰物品等。
另外,锰可以用于制造合金和干电池,铬被广泛用于不锈钢、铬合金和化学工业中。
三、稀土元素稀土元素是周期表中一组特殊的元素,它们在大多数情况下比其他元素更难处理和分离。
稀土元素具有众多的离子化态和储存能力,在工业、军事和医药领域有广泛的应用。
稀土元素可以分为2个系列,包括轻稀土元素和重稀土元素。
金属活动性顺序表

金属活动性顺序表百科名片金属活动性元素周期表里金属性越是左下方越强,越是右上方越弱。
惰性气体(惰性气体为旧称,现称为稀有气体)不算。
各种金属的金属性从左到右递减,对应金属的简单的,一般正价的离子氧化性从左到右递增(特殊:Hg2+<Fe3+<Ag+). 还有Cu(+1);Mn有+2;+4;+7价金属活动性顺序表Sb、Fr、Li、Rb、K、Cs 、Ra、NH4、Ba 、Sr、Na 、Ca、Li、Ac、La、Ce、Pr 、Nd 、P m锑、钫、锂、铷、钾、铯、镭、铵、钡、锶、钠、钙、锂、锕、镧、铈、镨、钕、钷、Sm 、Eu、Gd 、Tb 、Y 、Mg 、Dy、Am 、Ho、Er 、Tm 、Yb、Lu 、(H)、Sc、Pu 、Th 、Np 、Be 钐、铕、钆、铽、钇、镁、镅、镝、钬、铒、铥、镱、镥、(氢)、钪、钚、钍、镎、铍、Uv、Hf 、Al 、Ti 、Zr 、V 、Mn、Nb、Zn、Cr 、Ga 、Fe 、Cd 、In 、Tl 、Co铀、铪、铝、钛、锆、钒、锰、铌、锌、铬、镓、铁、镉、铟、铊、钴、Ni、Mo、Sn 、Pb 、(D2)、(H2)、Cu、Tc、Po、Hg 、Ag、Rh 、Pd 、Pt 、Au 、Sb 镍、钼、锡、铅、(氘分子)、(氢分子)、铜、锝、钋、汞、银、铑、钯、铂、金、锑金属活动性描述金属大概是这样:由强到弱铯最强然后是稀土、钡、铷、再然后是钾〉钙〉钠〉镁〉铝〉铍〉锰〉锌〉铁〉钴〉镍〉锡〉铅〉(氢)〉铜〉汞〉银〉铂〉金。
(我不太清楚过渡金属的活动性,实在太专业了。
)符号式为(从钾至金):K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au(初中生应该掌握的··)。
金属活动性顺序的主要判断依据为该金属在中性溶液中的半反应的标准电极电势大小,(通俗地说,标准电极电势基准为298K下含1mol/L浓度的H2O溶液,1标准压力的氢气的电极电势,大小规定为0),标准电极电势越小,该金属活动性越强,(非金属相反)标准电极电势>0(即活动性低于氢)时,金属不与非氧化性酸反应,标准电极电势<0时,可与非氧化性酸反映。
元素周期表(全面版)
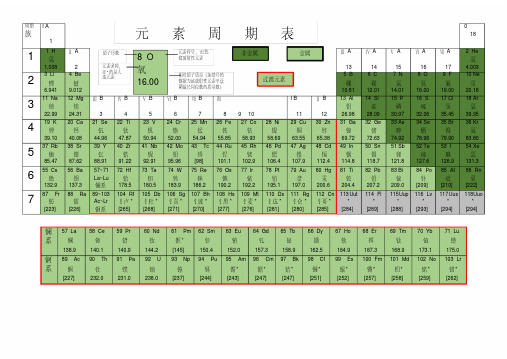
周期族I A1 0181 1 H 氢1.008 Ⅱ A2Ⅲ A13Ⅳ A14Ⅴ A15Ⅵ A16Ⅶ A172 He氦4.0032 3 Li 锂6.941 4 Be铍9.0125 B硼10.816 C碳12.017 N氮14.018 O氧16.009 F氟19.0010 Ne氖20.183 11 Na 钠22.99 12 Mg镁24.31Ⅲ B3Ⅳ B4Ⅴ B5Ⅵ B6Ⅶ B7Ⅷ8 9 10I B11Ⅱ B1213 Al铝26.9814 Si硅28.0915 P磷30.9716 S硫32.0617 Cl氯35.4518 Ar氩39.954 19 K钾39.10 20 Ca钙40.0821 Se钪44.9622 Ti钛47.8723 V钒50.9424 Cr铬52.0025 Mn锰54.9426 Fe铁55.8527 Co钴58.9328 Ni镍58.6929 Cu铜63.5530 Zn锌65.3831 Ga镓69.7232 Ge锗72.6333 As砷74.9234 Se硒78.9635 Br溴79.9036 Kr氪83.805 37 Rb 铷85.47 38 Sr锶87.6239 Y钇88.9140 Zr锆91.2241 Nb铌92.9142 Mo钼95.9643 Tc锝[98]44 Ru钌101.145 Rh铑102.946 Pd钯106.447 Ag银107.948 Cd镉112.449 In铟114.850 Sn锡118.751 Sb锑121.852 Te碲127.653 I碘126.954 Xe氙131.36 55 Cs 铯132.9 56 Ba钡137.357~71La~Lu镧系72 Hf铪178.573 Ta钽180.574 W钨183.975 Re铼186.276 Os锇190.277 Ir铱192.278 Pt铂195.179 Au金197.080 Hg汞200.681 Ti铊204.482 Pb铅207.283 Bi铋209.084 Po钋[209]85 At砹[210]86 Rn氡[222]7 87 Fr钫[223] 88 Ra镭[226]89~103Ac~Lr锕系104 Rf钅卢*[265]105 Db钅杜*[268]106 Sg钅喜*[271]107 Bh钅波*[270]108 Hs钅黑*[277]109 Mt钅麦*[276]110 Ds钅达*[281]111 Rg钅仑*[280]112 Cn钅哥*[285]113Uut*[284]114 Fl*[289]115Uup*[288]116 Lv*[293]117Uus*[294]118Uuo*[294]镧系57 La镧138.958 Ce铈140.159 Pr镨140.960 Nd钕144.261 Pm钷*[145]62 Sm钐150.463 Eu铕152.064 Gd钆157.365 Tb铋158.966 Dy镝162.567 Ho钬164.968 Er铒167.369 Tm铥168.970 Yb镱173.171 Lu镥175.0锕系89 Ac锕[227]90 Th钍232.091 Pa镤231.092 U铀238.093 Np镎[237]94 Pu钚[244]95 Am镅*[243]96 Cm锯*[247]97 Bk锫*[247]98 Cf锎*[251]99 Es锿*[252]100 Fm镄*[257]101 Md钔*[258]102 No锘*[259]103 Lr铹*[262]金属非金属过渡元素8 O氧16.00原子序数元素符号,红色指放射性元素元素名称,注*的是人造元素相对原子质量(加括号的数据为该放射性元素半衰期最长同位数的质量数)元素周期表元素周期表有关知识一、部分酸、碱和盐的溶解性表(室温)说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“-”表示那种物质不存在或遇水就分解了。
金属非金属活动顺序

常见非金属性(氧化性)的顺序:F2(>O2)>Cl2>Br2>I2>S,用它可知活泼性强的可制弱的,又可知道对应的离子的还原性的强弱,不过是相反的,结论是:S2->I->Br->Cl->F-.非金属性的对象是元素,氧化性的对象是单质.都指得电子的能力,在中学阶段基本上认为是一致的,金属性,还原性同理.金属活动顺序表H之后的认为是不活泼的.非金属性(氧化性)的顺序中认为I2,S是不活泼的非金属活动性顺序 :从左至右排列如下:F2>Cl2>O2> B r2 >I2 >S >N2> P>C >Si >H2从左至右氧化性减弱,还原性增强.举例:Cl2+2KI===I2↓+2KClS+O2======SO2↑I2+H2S===2H I+S↓2F2+2H2O===4HF+O2↑通常氧化性强——弱F2 O2 CL2 Br2 Fe3+ I2 S其中氧气和氯气差不多,排前排后都可中学化学中这里没什么考点,该注意的是:三价铁离子在Br2后面I2 前面非金属活动性顺序:从左至右排列如下:F2>Cl2>O2>Br2 >I2 >S >N2>P >C >Si >H2从左至右氧化性减弱,还原性增强. 金属活动性顺序:从左至右排列如下K >Ca>Na>Mg>Al>Zn>Fe>Sn>Pb>(H )>Cu>Hg>Ag>Pt>Au金属活动性顺序表Li、Cs、Rb、K、Ra 、Ba 、Sr、Ca、Na 、Ac、La、Ce、Pr 、Nd 、Pm 锂、铯、铷、钾、镭、钡、锶、钙、钠、锕、镧、铈、镨、钕、钷、Sm 、Eu、Gd 、Tb 、Y 、Mg 、Dy、 Am 、Ho、Er 、Tm、Yb、Lu 、(H)、Sc、Pu 、Th、Np 、Be钐、铕、钆、铽、钇、镁、镅、镝、钬、铒、铥、镱、镥、(氢)、钪、钚、钍、镎、铍、Uv、Hf 、Al 、Ti 、Zr 、V 、Mn、N b、Zn、C r 、Ga 、F e 、Cd 、I n、Tl 、Co铀、铪、铝、钛、锆、钒、锰、铌、锌、铬、镓、铁、镉、铟、铊、钴、Ni、Mo、Sn 、Pb 、(D2)、(H2)、Cu、Tc、Po、Hg 、Ag、Rh 、Pd 、Pt 、Au镍、钼、锡、铅、(氘分子)、(氢分子)、铜、锝、钋、汞、银、铑、钯、铂、金总之元素周期表里金属性越是左下方越强,越是右上方越弱。
元素金属性非金属性的比较PPT课件

2.(2011·福建,7)依据元素周期表及元素周期律, 下列推断正确的是( )
A.H3BO3 的酸性比 H2CO3 的强 B.Mg(OH)2 的碱性比 Be(OH)2 的强 C.HCl、HBr、HI 的热稳定性依次增强 D.若 M+和 R2-的核外电子层结构相同,则原子 序数:R>M
第8页/共84页
第18页/共84页
解析:该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟 悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌 握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化 学问题的能力。推出的元素为:X N;Y O;Z Al;W S;Q Cl,A 项正确;同周期原子半径从左到右依次减小,同主族从上到下依次增大,B
第39页/共84页
考点 2 元素周期表的结构及元素周期律
规律
内容
相同电子 层结构
稀有气体元素的原子与同周期非金属元 素形成的阴离子以及下一周期金属元素 形成的阳离子具有相同的电子层结构
第40页/共84页
规律
由原子 序数确 定元素 位置的 规律
内容
(1)若某元素原子序数比相应稀有气体元素多1或2,则该 元素处于该稀有气体元素所在周期的下一周期的ⅠA族 或ⅡA族;若比相应稀有气体元素少1~5,则该元素处 于稀有气体元素所在周期的ⅦA~ⅢA族 (2)预测新元素位置时,可利用原子序数较为接近的稀有 气体元素,依据上述方法进行推测
第12页/共84页
周期表中位于金属和非金属分界线附近的元素通常既 显一定的金属性,又显一定的非金属性,而过渡元素 是指副族和第Ⅷ族元素,D 错误。
答案:C
第13页/共84页
4.(2011·天津,2)以下有关原子结构及元素周期 律的叙述正确的是( )
元素金属性非金属性比较
元素金属性非金属性比较、简单微粒的半径比较及等电子体一、元素金属性非金属性强弱比较比较元素金属性强弱的依据:1、根据周期律进行比较;2、依据相同条件下金属单质与水或酸反应的剧烈程度进行比较。
与水或酸反应越容易、越剧烈,其金属性越强。
3、依据金属元素对应的最高价氧化物的水化物的碱性强弱进行比较。
碱性越强,其元素的金属性越强。
4、依据金属单质与盐溶液之间的置换反应进行比较。
较活泼金属置换出较不活泼金属。
注意:ⅠA族和ⅡA族的金属在与盐溶液反应时,通常是先与水反应生成对应的强碱和氢气,然后生成的强碱再与盐发生复分解反应。
5、依据金属阳离子的放电(得电子,氧化性)顺序进行比较。
优先放电的阳离子,其元素的金属性弱。
比较元素非金属性强弱的依据:1、根据周期律进行比较;2、依据非金属单质与H2反应的难易程度、剧烈程度和生成气态氢化物的稳定性进行比较。
与氢气反应越容易、越剧烈,气态氢化物越稳定,其非金属性越强。
3、依据最高价氧化物的水化物的酸性强弱进行比较。
酸性越强,其元素的非金属性越强。
4、依据非金属单质与盐溶液中简单阴离子或非金属氢化物之间的置换反应进行比较。
非金属性较强的置换出非金属性较弱的。
5、根据非金属元素对应的简单阴离子的放电(失电子,还原性)顺序进行比较。
还原能力强的阴离子,其元素的非金属性弱。
例1、几种短周期元素的原子半径及主要化合价如下表:元素代号L M Q R T原子半径/nm 0.160 0.143 0.102 0.089 0.074主要化合价+2 +3 +6、-2 +2 -2下列叙述正确的是()A.T的氢化物的稳定性比Q的氢化物强 B.L、M的单质与稀盐酸反应速率:M > LC.T、Q的氢化物常态下均为无色气体 D.L、Q形成的简单离子核外电子数相等例2、下表是元素周期表的一部分,有关说法正确的是A.e的氢化物比d的氢化物稳定B.a、b、e三种元素的原子半径:e>b>aC.六种元素中,c元素单质的化学性质最活泼D.c、e、f的最高价氧化物对应的水化物的酸性依次增强二、简单微粒半径大小的比较方法1.根据元素周期律比较(包括同周期原子的半径比较规律、同主族原子及离子的半径比较规律);2.若几种微粒的核外电子排布相同(即电子数相同),则核电荷数越多,半径越小;写出2e-电子组、10电子组、18电子组简单微粒并比较半径大小:3.质子数相同时(即同一元素的原子与离子),电子数越多,半径越大;4.不满足上述三种情况时,依据“微粒的电子层数越多,半径越大”进行比较。
金属性最强的元素是什么怎么判断金属性强弱
金属性最强的元素是什么怎么判断金属性强弱金属性最强的元素是Cs,非金属性最强的元素是F。
在元素周期表中,越向左、向下,元素金属性越强,越向右、向上,元素的非金属越强。
最活泼的金属元素是钫,但是钫是放射性元素,不能稳定存在,非放射性元素中,金属性最强的是铯,非金属性最强的元素是氟。
铯色白质软,熔点低,28.44 ℃时即会熔化。
它是在室温或者接近室温的条件下为液体的五种金属元素之一。
铯的物理性质和化学性质与同为碱金属的铷和钾相似。
该金属极度活泼,并且能够自燃。
它是具有稳定同位素的元素中电负性最低的,其稳定同位素为铯-133。
铯通常是从铯榴石中提取出来的,而其放射性同位素,尤其是铯-137,是更重元素的衰变产物,可从核反应堆产生的废料中提取。
1.在一定条件下金属与水反应的难易程度和剧烈程度。
一般情况下,与水反应越容易、越剧烈,其金属性越强。
2.常温下与同浓度酸反应的难易程度和剧烈程度。
一般情况下,与酸反应越容易越剧烈,其金属性越强。
3.依据最高价氧化物的水化物碱性的强弱。
碱性越强,其元素金属性越强。
4.一句金属单质与盐溶液之间的置换反应。
一般是活泼金属置换不活泼金属但是IA族与IIA族的金属反应在于盐溶液反应时,通常是先与水反应生成对应的强碱和氢气,然后生成的强碱再可能与盐发生复分解反应。
5.依据金属活动性顺序表(极少数除外)6.依据元素周期表。
同周期中,从左向右,随着电荷数的增加,金属性逐渐减弱,同主族中,由上而下,随着电荷数的增加,金属性逐渐增强。
7.依据电池中的电极名称。
做负极材料的金属性高玉做正极材料的金属性。
8.依据电解池中阳离子的放电(得电子)顺序,优先放电的阳离子,其元素的金属性弱。
感谢您的阅读,祝您生活愉快。
元素周期表非金属性强弱顺序
元素周期表非金属性强弱顺序1、同一周期,从左到右:原子的还原性逐渐减弱,氧化性逐渐增强;其对应的离子的氧化性逐渐增强,还原性逐渐减弱。
2、同一主族,从上到下:原子的还原性逐渐增强,氧化性逐渐减弱;其对应的离子的氧化性逐渐减弱,还原性逐渐增强。
非金属性强弱顺序判断:1、元素在周期表中的相对位置①同周期元素,自左向右,元素的非金属性依次增强,如F>O>N>C>B;Cl>S>P>Si等。
②同主族元素自上而下,非金属性依次减弱,如F>Cl>Br>I;O>S >Se;N>P>As等。
2、非金属单质与氢气化合的越容易,非金属性越强。
如F2、Cl2、Br2、I2与H2化合由易到难,所以非金属性F>Cl>Br >I。
3、气态氢化物的越稳定,非金属性越强。
如稳定性:HF>H2O>HCl>NH3>HBr>HI>H2S>PH3,所以非金属性:F>O>Cl>N>Br>I>S>P。
4、最高价氧化物对应的水化物的酸性越强,非金属性越强。
如酸性:HClO4>H2SO4>H3PO4>H2CO3>H4SiO4,则非金属性:Cl>S>P>C>Si。
5、非金属性强的元素的单质能置换出非金属性弱的元素的单质。
如2F2+2H2O=4HF+O2↑;O2+4HCl=2H2O+2Cl2(地康法制Cl2);Cl2+2NaBr=2NaCl+Br2;3Cl2+2NH3=N2+6HCl;Cl2+H2S=S+2HCl。
6、非金属单质对应阴离子的还原性越强,该非金属元素的非金属性越弱。
常见阴离子的还原性由强到弱的顺序是S2->I->Br->Cl->F-,则非金属性S<I<Br<Cl<F。
7、与变价金属反应时,金属所呈价态越高,非金属性越强。
如Cu+Cl2→CuCl2;2Cu+S→Cu2S,说明非金属性Cl>S。
8、几种非金属同处于一种物质中,可用其化合价判断非金属性的强弱。
如HClO、HClO3中,氯元素显正价、氧元素显负价,说明氧的非金属性强于氯。
9、能量:非金属元素原子得电子放热,放热越多离子越稳定,非金属越强。
第四章 第二节 第2课时 元素周期表和元素周期律的应用 【新人教版 高中化学必修一】
第2课时元素周期表和元素周期律的应用[核心素养发展目标] 1.了解元素周期表中元素的分区,理解元素的化合价与元素在周期表的位置关系。
2.了解元素与元素周期律的应用,理解元素原子结构、在周期表中的位置和元素性质三者之间的关系,建立“位、构、性”关系应用的思维模型。
一、金属元素与非金属元素在周期表中的分布及性质规律1.元素周期表与元素周期律的关系(1)元素周期表是元素周期律的具体表现形式,反映了元素之间的内在联系。
(2)元素周期表中元素的金属性和非金属性变化的规律。
同周期元素由左向右金属性减弱,非金属性增强;同主族元素由上向下金属性增强,非金属性减弱。
2.元素周期表的金属区和非金属区(1)金属性强的在周期表的左下方,最强的是Cs(放射性元素除外),非金属性强的在周期表的右上方(稀有气体除外),最强的是F。
(2)分界线附近的元素,既能表现出一定的金属性,又能表现出一定的非金属性,故元素的金属性和非金属性之间没有严格的界线。
3.元素化合价与元素在周期表中位置的关系(1)同主族元素的最高正价和最低负价相同(O、F除外)。
(2)主族元素最高正化合价=主族序数=最外层电子数。
(3)非金属元素的最高正价和最低负价的绝对值之和等于8(H最低价为-1,O、F除外)。
(1)金属元素只表现金属性,非金属元素只表现非金属性()(2)氟元素非金属性最强,所以其最高价氧化物对应水化物的酸性最强()(3)原子最外层电子数大于3且小于8的元素一定是非金属元素()(4)最外层电子数是2的元素,最高正价一定是+2价()(5)第二周期元素的最高正价等于它所处的主族序数()答案(1)×(2)×(3)×(4)×(5)×1.短周期主族元素中最高价氧化物对应的水化物酸性最强的是HClO4,碱性最强的是NaOH。
气态氢化物稳定性最强的是HF。
2.X元素能形成H2X和XO2两种化合物,则该元素的原子序数可能是()A.13 B.14 C.15 D.16答案 D解析根据H2X可知,X为-2价,X元素在第ⅥA族,上述四种元素属于第ⅥA族的是16号元素硫。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
矿产资源开发利用方案编写内容要求及审查大纲
矿产资源开发利用方案编写内容要求及《矿产资源开发利用方案》审查大纲一、概述
㈠矿区位置、隶属关系和企业性质。
如为改扩建矿山, 应说明矿山现状、
特点及存在的主要问题。
㈡编制依据
(1简述项目前期工作进展情况及与有关方面对项目的意向性协议情况。
(2 列出开发利用方案编制所依据的主要基础性资料的名称。
如经储量管理部门认定的矿区地质勘探报告、选矿试验报告、加工利用试验报告、工程地质初评资料、矿区水文资料和供水资料等。
对改、扩建矿山应有生产实际资料, 如矿山总平面现状图、矿床开拓系统图、采场现状图和主要采选设备清单等。
二、矿产品需求现状和预测
㈠该矿产在国内需求情况和市场供应情况
1、矿产品现状及加工利用趋向。
2、国内近、远期的需求量及主要销向预测。
㈡产品价格分析
1、国内矿产品价格现状。
2、矿产品价格稳定性及变化趋势。
三、矿产资源概况
㈠矿区总体概况
1、矿区总体规划情况。
2、矿区矿产资源概况。
3、该设计与矿区总体开发的关系。
㈡该设计项目的资源概况
1、矿床地质及构造特征。
2、矿床开采技术条件及水文地质条件。
