生物化学王镜岩第三版生化第四章氨基酸课件
王镜岩《生物化学》第三版考研笔记(提要版本071页)

王镜岩《生物化学》第三版考研笔记(提要版本071页)内容提要:1、氨基酸与蛋白质氨基酸分类:常见蛋白质氨基酸,不常见蛋白质氨基酸,非蛋白氨基酸;氨基酸的酸碱化学,氨基酸两性解离,氨基酸的等电点;氨基酸的旋光性和紫外吸收。
蛋白质的共价结构:蛋白质的化学组成和分类,蛋白质功能,蛋白质的形状和大小,蛋白质构象和组织层次。
肽:肽键结构,肽的物理化学性质,活性多肽。
蛋白质一级结构测定:Sanger试剂,DNS及Edman降解,二硫桥位置确定。
蛋白质的三维结构:XRD原理;稳定蛋白质三维结构的作用力,肽平面和两面角;蛋白质的二级结构:α-螺旋,β-折叠片,β-转角;超二级结构和结构域;球状蛋白的三级结构;亚基缔合和四级结构。
蛋白质结构与功能的关系:肌红蛋白和血红蛋白的结构与功能,镰刀状细胞贫血病;免疫球蛋白。
蛋白质的分离、纯化和表征:蛋白质分子量测定,沉降分析及沉降系数,沉降系数单位,凝胶过滤及SDS-PAGE法测分子量;蛋白质的沉淀;电泳:区带电泳、薄膜电泳、等电聚焦电泳、毛细管电泳。
2、酶和辅酶酶催化作用特点:反应温合、高效、专一、可调节控制;酶活性调节控制:调剂酶浓度、激素调节、反馈抑制调节、抑制剂激活剂调节、别构调控、酶原激活,可逆共价修饰;酶的化学本质及其组成,辅酶和辅基,单体酶,寡聚酶和多酶复合体。
酶的命名和分类:习惯命名法;国际系统命名法及酶的编号,六大类酶的特征。
酶的专一性:“锁与钥匙”学说;诱导楔合假说;过渡态理论,过渡态类似物与医药和农药的设计,催化抗体。
酶的活力测定:酶活力单位,比活力。
酶工程:化学修饰酶,固定化酶,人工模拟酶。
酶促反应动力学:底物浓度与酶反应速度,酶促反应动力学方程式及推导,米氏常数的意义和求法。
酶的抑制作用:不可逆抑制和可逆抑制及动力学判断,一些重要的抑制剂,有机磷农药和磺胺药作用机制。
温度、PH、激活剂对酶反应影响。
酶的作用机制:酶活性部位及研究方法;影响酶催化效率的有关因素:临近和定向效应、底物形变和诱导契合、酸碱催化、共价催化、金属离子催化、多元催化和协同效应、微环境影响;溶菌酶作用机制和胰凝乳蛋白酶。
生物化学王镜岩第三版第31章--氨基酸的生物合成PPT课件
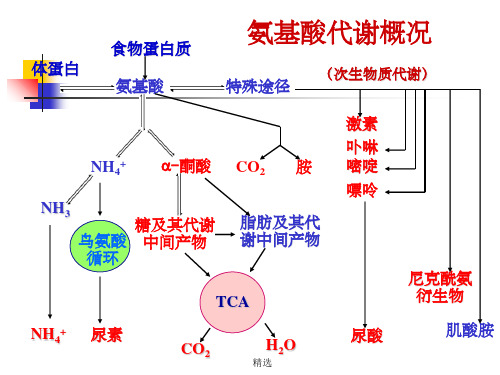
氨
NAD(P)H+H+ NAD(P)+
谷氨酸脱氢酶
α-酮戊二酸
精选
COO│ H3N— C—H │ CH2 │ CH2 │ COO-
谷氨酸
谷氨酸脱氢酶途径
COOH
CH2 CH2 + NH3
L-谷氨酸脱氢酶
C=O COOH
NAD(P)H+H+ NAD(P)+
α-酮戊二酸
(TCA循环产生的)
COOH
CH2
谷氨酸族
精选
柠檬酸循环
氨基酸的分族
α-酮戊二酸 谷氨酸
草酰乙酸 天冬氨酸
谷氨酰胺 脯氨酸 精氨酸
(谷氨酸族)
天冬酰胺 甲硫氨酸 赖氨酸 苏氨酸
(天冬氨酸族)
精选
糖酵解
甘油酸-3-磷酸
丝氨酸
半胱氨酸
甘氨酸
(丝氨酸族)
丙酮酸
丙氨酸 缬氨酸 亮氨酸
(丙酮酸族)
精选
糖酵解
戊糖磷酸途径
磷酸烯醇式丙酮酸 赤藓糖-4-磷酸
CH2
+ H2O
CH NH2
COOH
谷氨酸
这是异养真核生物(如真菌)的氨同化的主要 途径,要求[NH3]高。
精选
3、谷氨酸酰胺化为谷氨酰胺
由谷氨酸与氨再生成谷氨酰胺,合成谷氨酰胺要消耗ATP. 也能把氨转变为有机物。
COO│ H3N— C—H │ CH2 │ CH2 │ COO-
谷氨酸
COO-
│
+ NH4+
ATP ADP+Pi 谷氨酰胺合成酶
H3N— C—H │ CH2 │
CH2
│
C=O
王镜岩-生物化学I-第2章 脂质—第3章 氨基酸

CH2 O O
性
CH2OH
鞘磷脂
磷酸胆碱(或 磷酸胆胺)
头
•(一)鞘糖脂(glycosphingolipid)
• 以神经酰胺为母体
1、酸性鞘糖脂
含有唾液酸或硫酸基
①硫酸鞘糖脂(硫苷脂) ②唾液酸鞘糖脂(神经节苷脂)
2、中性鞘糖脂
半乳糖基神经酰胺 (脑苷脂)
Galβ1 1Cer
•(二)甘油糖脂(glyceroglycolipid)
1.等电点的定义
2.等电点的计算
对于R基无解离基团的氨基酸:
pI=(pK1+pK2)/2
对于R基有解离基团的氨基酸:pI等于等电形式两侧的pK值
之和的一半,以等电形式为中心,另一个pK值为第二级解离,
可以忽略不计。 2.19
4.25
9.67
如 Glu: Glu+
Glu+-
Glu-
Glu2-
若 pH=pI=3.22,
❖蜡 (含14-36C个碳原子的饱和或不饱和脂肪 酸与含16-30C个碳原子的一元醇所形成的 酯)
复合脂质
➢单纯脂类的衍生物:除了含有脂肪 酸和醇外,还含有非脂分子的成分
❖ 磷脂(磷酸和含氮碱) ❖ 糖脂(糖) ❖ 硫脂(硫酸)
衍生脂质
由单纯脂类或复合脂类衍生而来或与 它们关系密切。
❖萜类:天然色素、香精油、天然橡胶 ❖固醇类:固醇(甾醇、性激素、肾上腺皮
常 温 下
呈液态:油(oil) 呈固态:脂(fat)
油脂
中性脂/真脂
三酰甘油(triacylglycerol, TG)
1分子甘油和3分子脂肪酸形成的酯
脂肪酸
饱和∽ : 16C软脂酸、 18C硬脂 酸
生物化学王镜岩第三版ppt课件

NAD
胞液中:甘油-α-磷酸脱氢酶
甘油-α-磷酸
线
二羟丙酮磷酸
甘油-α-磷酸
粒
线粒体内:甘油-α-磷酸脱氢酶
体
内
FADH2
FAD
膜
NADH FMD CoQ b c1 c aa3 O2
38
2.肝、肾、心等组织的苹果酸穿梭作用
NADH
天冬 转氨酶
氨酸
草酰乙酸
NAD
胞液中:苹果酸脱氢酶
苹果酸
天冬 转氨酶
36
四、胞液中的NADH 的再氧化 139页
细胞溶胶中的NADH逆浓度梯度转运到线粒体内 膜进入电子传递进行氧化。
肌肉、神经组织中的甘油-α-磷酸穿梭作用 (1.5ATP)
肝、肾、心等组织的苹果酸穿梭作用 (2.5ATP)
37
139页
1.肌肉、神经组织中的甘油-α-磷酸穿梭作用
NADH 二羟丙酮 磷酸
第九章 生物氧化 第114页
第一节 第二节 第三节
生物氧化的方式和特点 生物氧化的历程 生物氧化与能量代谢
1
氧化-还原电势
117页
氧化还原对 ee-
Oxidized 氧化型
Reduced 还原型
某一化合物的氧化型和还原型,称为一对氧化 还原对。如Zn/Zn2+,Cu2+/Cu。
2
生物体中标准氧化还原电势 117页表
pH 7
H+
外
内
脂不溶
脂溶
34
2.氧化磷酸化抑制剂
氧化磷酸化抑制剂抑制氧的利用又抑制 ATP的形成,但不直接抑制电子传递链上 的载体的作用。
机制:干扰ATP生成过程(ATP合酶), 干扰由电子传递的高能状态形成ATP的过 程,结果也使电子传递不能进行。
王镜岩生物化学课件004酶

1995年,Jack W. Szostak研究室首先报道了具有DNA连接酶活性DNA片段,称 为脱氧核酶(Deoxyribozyme);
• 酶学研究的主要方向:一方面在酶的分子水平上揭示酶 与生命活动的关系;另一方面酶的应用研究。
六、酶的活力测定与分离纯化
1、酶活力与酶促反应速度
酶活力
在一定条件下,酶催化某一反应的反应速度(一般测初速度)。
酶促反应速度
单位时间、单位体积中底物的减少量或产物的增加量。
研究酶促反应速度,以酶促反应的初速度为准(底物消耗≤5%)。
2、酶的活力单位(U)
国际单位——IU单位(1961)
在最适反应条件下,每分钟催化1umol底物转化为产物所需的 酶量,称一个国际单位(IU)。
1、习惯命名
依据底物来命名 蛋白酶、淀粉酶
依据催化反应的性质命名
水解酶、转氨酶 结合上述两个原则命名 琥珀酸脱氢酶 加上酶的来源命名 胃蛋白酶、牛胰凝乳蛋白酶
2、国际系统命名
基本原则 明确标明酶的底物及催化反应的性质。 (底物为水时可略去不写)
习惯名称 谷丙转氨酶
系统名称 丙氨酸:α-酮戊二酸氨基转移酶
酶的催化活性与辅酶、辅基、金属 离子有关。
二、酶的化学本质及其组成 1、 酶的化学本质
绝大多数酶是蛋白质
少数酶是RNA(核酶)
★ ribozyme核酶(具有催化功能的RNA)
2、 酶的化学组成
单纯酶类(simple enzyme)
仅由蛋白质组成。 例如:脲酶、溶菌酶、淀粉酶、脂肪酶、核糖核酸酶等。
酶的发现及研究历史
王镜岩-生物化学思维导图课件
徐徐風兒
徐
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
徐徐風兒
《生物化学绪论》ppt课件
3、动态的或生理生物化学发展时期(1903~1950,动态生物化学阶段)大约从二十世纪初到二十世纪五十年代。此阶段对各种化学物质的代谢途径有了一定的了解。物质代谢途径及动态平衡、能量转化,光合作用、生物氧化、糖的分解和合成代谢、蛋白质合成、核酸的遗传功能、酶、维生素、激素、抗生素等的代谢。 1905年 哈登和杨发现酶和辅酶; 1926年美国Sumner从刀豆中得到脲酶的结晶,证明酶的化学本质是蛋白质,1946年获诺贝尔奖。 1955年 Sanger完成牛胰岛素氨基酸组成分析; 1932年,英国科学家Krebs 发现尿素合成的鸟氨酸循环; 1937年,Krebs提出三羧酸循环的基本代谢途径,1953年获诺贝尔生理学奖; 1940年,德国科学家Embden和Meyerhof提出了糖酵解代谢途径等。
1990. 10. 1 人类基因组计划 Human Genomic Project 2000完成
Dulbecco
作物基因组计划 家畜基因组计划 微生物基因组计划
1985年, “人类基因组测序和作图”计划(简称HGP)提出。
20世纪末和21世纪初:后基因组时代,产生了功能基因组学、蛋白质组学、结构基因组学等。 1997年2月23日克隆羊诞生 目前已能用基因工程的方法生产许多产品如乙型肝炎疫苗、酶制剂、人生长激素、各种干扰素、各种白细胞介素等等。
生 物 化 学
单击添加副标题
Biochemistry
绪论 Introduction
饲养主人5月7日给兽医打电话说:“一头牛前左腿不能着地,没有外伤,有点儿奇怪。” 牛海绵状脑病
01
几百万种生物的共同的语言
03
遗传密码相同、酶一样
02
构成生物体的氨基酸相同:20种
04
生成乳酸的过程一样
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氨基酸的旋光性与光谱性质
氨基酸的旋光性:
氨基酸的构型(指α-碳)也以甘油醛为参考物, 从蛋白质的酸水解或酶水解液中得到的都是L型,但 D型氨基酸在自然界也存在;蛋白质用碱水解或有 机合成氨基酸时,得到的都是无旋光性的DL-消旋 物
氨基酸的光谱性质:
参与蛋白质组成的20多种氨基酸在可见光区没有 光吸收,在红外区和远紫外区都有光吸收,但在近 紫外区只有芳香族氨基酸有光吸收;
Cl
HN—CH—COOH
5-二甲氨基萘磺酰氯 (DNS-Cl)
R
DNS-氨基酸
取代DNFB测定蛋白质N端氨基酸,灵敏度高
氨基酸与2,4一二硝基氟苯(DNFB)的反应
(sanger反应)
+
DNFB(dinitrofiuorobenzene)
弱碱中
氨基酸
DNP-AA(黄色)
+ HF
氨基酸与苯异硫氰酯(PITC)的反应 (Edman反应)
生物化学王镜岩第三版生化第四章 氨基酸课件
第四章
氨基酸
氨基酸
氨基酸名称与符号
氨基酸的名称与符号
alanine arginine asparagine aspartic acid cysteine glutamine glutamic acid glycine histidine isoleucine leucine lysine methionine phenylalanine proline serine threonine tryptophan tyrosine valine
氨基酸的主要化学反应
氨基酸的化学反应
α-氨基 参加的 反应
与亚硝酸反应(生成羟基氨基 酸和氮气)
与酰化试剂反应(氨基被酰基 化而被保护)
烃基化 反应
DNFB反应(生成DNP-氨基酸) PITC反应(生成PTH-氨基酸)
形成西佛碱反应(与醛类化合物)
脱氨基反应
成盐成酯
α-羧基参加的反应
成酰氯(与二氯亚砜等) 脱羧基反应
当pH大于等电点时,氨基酸带净负电荷; 当pH小于等电点时,氨基酸带净正电荷! 在一定的pH范围内,氨基酸溶液的pH离等 电点愈远,氨基酸所携带的净电荷愈大。
比较常见的错误
氨基酸溶液的净电荷为零; 物质所带净电荷为零时溶液的pH值; 氨基酸的净电荷为零时的pH值; 氨基酸分子达到中性时溶液的pH值; 当氨基酸、蛋白质以离子存在时,环 境的pH值;
氨基酸作为两性电解质
氨基酸的理化性质
两性电解质
同一个氨基酸分子上可以同时携带正电 荷和负电荷,称为两性电解质ampholyte。
氨基酸的酸碱性质
根据酸碱质子理论,HA
A- + H+
氨基酸是两性电解质,既是质子供体,又是
质子受体。当氨基酸完全质子化时,可看作 是多元酸;COOH和NH3+可以发生解离,用 Ka表示它们的解离常数;在氨基酸溶液中, pH值
叠氮反应(氨基酸酯与肼、亚硝酸)
α-氨基与α-羧基共同参加反应
与茚三酮反应(氨与还原茚三 酮发生作用生成紫色物质)
成肽反应
侧链R基参加的反应
酪氨酸酚羟基 组氨酸咪唑 精氨酸胍基
色氨酸吲哚基 半胱氨酸巯基
酰化反应
CH3 CH3 N
CH3 CH3 N
H2N—CH—COOH +
pH9.7
R
O=S=O 40℃ O=S=O
丙氨酸 精氨酸 天冬酰氨 天冬氨酸 半胱氨酸 谷氨酰胺 谷氨酸 甘氨酸 组氨酸 异亮氨酸 亮氨酸 赖氨酸 甲硫氨酸 苯丙氨酸 脯氨酸 丝氨酸 苏氨酸 色氨酸 酪氨酸 缬氨酸
Ala
A
Arg
R
Asn Asx
N
Asp Asx
D
Cys
C
Gln Glx
Q
Glu Glx
E
Gly
G
His
H
Ile
I
Leu
L
Lys
K
A
CR
C
L型 R
ห้องสมุดไป่ตู้
D型 A
苏氨酸的异构体
苏氨酸 Thr 有四种异构体
氨基酸的理化性质
氨基酸的一般理化性质
氨基酸的理化性质
一般物理性质
无色晶体,熔点较高(200~ 300℃) ,水中溶解度各不同,取决 于侧链。
在紫外有特征吸收的仅三个芳香族的 氨基酸Trp、Tyr、Phe, 利用这一特 点,可以通过测定280nm处的紫外吸 收值的方法对蛋白溶液进行定量。
+
PITC(phenylisothiocyanate) 弱硷中 (400 C)
(硝基甲烷 400 C) H+
苯乙内酰硫脲衍生物(PTH-AA) (phenylisothiohydantion-AA)
氨基酸与水合茚三酮共热,发生氧化脱氨反应,生 成NH3与酮酸。水合茚三酮变为还原型茚三酮。 加热过程中酮酸裂解,放出CO2,自身变为少一个 碳的醛。水合茚三酮变为还原型茚三酮。 NH3与水合茚三酮及还原型茚三酮脱水缩合,生成
现在为了正确表示左旋和右旋,采用 (+)和(-)的符号,(+)代表 右旋,(-)代表左旋。从右旋的D 型甘油醛出发,可以合成出左旋的D 型乳酸。从这点我们也可以看出物质 的旋光性与手性原子上的构型没有确 定的关系。
左旋D型乳酸
右旋D型甘油醛
L和D型氨基酸
L型氨基酸 与 D型氨基酸
L- amino acid
D- amino acid
L和D型氨基酸的判断
•“ D/L”判断法
(看CAR的走
向)
将H原子靠近自己,观察CAR的走向,逆时针
(左转)为L型,顺时针(右转)为D型。 D:dextro 右 C:carboxyl group ;
拉丁语中 L: levo 左 A:amino group ;
R:residue ;
计算公式如下:
pH=pKa+lg(质子受体/质子供体)
Ka1 +
A+
A0
Ka2 +
A0
A-
[A0] [H+] Ka1=
[A+]
[A-] [H+] Ka2=
[A0]
pH=pKa+lg(质子受体/质子供体)
当 [A0] = [A+] , pH=pKa1
当 [A0]=[A-] , pH=pKa2
氨基酸的酸碱滴定
氨基酸的酸碱滴定曲线
00..11HHCCll
pK值的变化
解离基团的pK值会发生较大的变化
等电点 (isoelectric point, pI)
氨基酸、多肽等两(兼)性电解质 [ampholyte]在溶液中所携带的净电荷 [net electric charge]为零时的溶液 的pH值。因此也叫isoelectric pH.
Met
M
Phe
F
Pro
P
Ser
S
Thr
T
Trp
W
Tyr
Y
Val
V
不 用 的 字 母
JUZBOX
要求: 能倒背
L和D的来源
L型和D型的由来
甘油醛的旋光性
左旋甘油 醛的构型
右旋甘油 醛的构型
按原子序数法确定了L型和D型氨基酸,但现在L和D已经不代 表氨基酸的旋光性,只代表氨基酸的绝对构型。 为什么?
