01第一章 基本概念1-2状态和状态参数PPT课件
合集下载
1-2 状态与状态参数

1 mmHg = 133.3224 Pa 1 mmH2O = 9.80665 Pa
8
状态和状态参数
比体积v:
单位质量物质所占有的体积,密度的倒数。 反映工质疏密程度。 单位:m3/kg
vV 1
m
9
状态和状态参数
温度T:
传统:表示物体的冷热程度。 平动
微观:衡量分子平均动能的量度。 热力学:
比体积:v V m
3
m V T p ρ
0.5m 0.5m 0.5V 0.5V
TT pp ρρ
广延量 强度量
状态Hale Waihona Puke 状态参数 状态参数的特征:
1(x1,y1) a
数值仅取决于给定状态,与到达状态的路径无关。 状态确定,状态参数就确定,反之亦然。
b 2(x2,y2)
点函数
其微元变量为 全微分
国际单位制 (SI): 1 Pa (帕) = 1 N/m2
单位名称 巴
标准大气压 工程大气压 (千克力每平方厘米) 毫米汞柱(0℃) 毫米水柱(4℃)
单位符号
bar atm
at(kgf/cm2)
mmHg mmH2O
换算关系
1 bar = 105 Pa 1 atm = 101325 Pa
1 at = 1 kgf/cm2 = 98066.5 Pa
2
状态和状态参数
状态参数的分类:
强度量(Intensive properties):
• 数值与物质的量无关
• 如:T、p
广延量(Extensive properties):
• 数值正比于物质的量 • 如:V
比参数(Specific properties):
8
状态和状态参数
比体积v:
单位质量物质所占有的体积,密度的倒数。 反映工质疏密程度。 单位:m3/kg
vV 1
m
9
状态和状态参数
温度T:
传统:表示物体的冷热程度。 平动
微观:衡量分子平均动能的量度。 热力学:
比体积:v V m
3
m V T p ρ
0.5m 0.5m 0.5V 0.5V
TT pp ρρ
广延量 强度量
状态Hale Waihona Puke 状态参数 状态参数的特征:
1(x1,y1) a
数值仅取决于给定状态,与到达状态的路径无关。 状态确定,状态参数就确定,反之亦然。
b 2(x2,y2)
点函数
其微元变量为 全微分
国际单位制 (SI): 1 Pa (帕) = 1 N/m2
单位名称 巴
标准大气压 工程大气压 (千克力每平方厘米) 毫米汞柱(0℃) 毫米水柱(4℃)
单位符号
bar atm
at(kgf/cm2)
mmHg mmH2O
换算关系
1 bar = 105 Pa 1 atm = 101325 Pa
1 at = 1 kgf/cm2 = 98066.5 Pa
2
状态和状态参数
状态参数的分类:
强度量(Intensive properties):
• 数值与物质的量无关
• 如:T、p
广延量(Extensive properties):
• 数值正比于物质的量 • 如:V
比参数(Specific properties):
状态和状态参数

1 at = 1 kgf/cm2 = 98066.5 Pa
1 mmHg = 133.3224 Pa 1 mmH2O = 9.80665 Pa
• 压力单位的换算关系: 1 atm = 760 mmHg = 1.03323 at = 1.01325 bar = 0.01325 MPa 1 at = 735.559 mmHg = 0.967841 atm = 0.980665 bar = 0.0980665 MPa
• 国际单位制:J 或 J / kg • 工程单位制:kcal 或 cal / kg 1 kcal = 4186.8 J =4.1868 kJ
5、焓 Enthalpy
• 焓是一个组合的状态参数: • 单位质量物质的焓称为比焓(有时简称为焓):
国际单位制:J 或 J / kg 工程单位制:kcal,比焓的单位是 kcal/kg
6、熵 Entropy
• 熵是一个导出的状态参数 • 对简单可压缩均匀系,可由其它状
参数导出:
• 单位质量的物质的熵称为比熵 Specific Entropy (有时简称为熵):
• 国际单位制:J / K 或 J / (kg. K ) • 工程单位制:kcal 或 kcal / (kg. K )
The P-V diagram of a compression process.
• 状态参数分类
–强度量(Intensive Property), 与物质总量无关
温度、压力、比体积等
–广延量(Extensive Property), 与物质总量成正比
体积,质量,热力学能,熵等
结束
• 热力学能 组成热力系的大量微观粒子本身具有的能量
( 不包括热力系宏观运动的能量和外场作用的 能量 ) • 热力学能包括:
1 mmHg = 133.3224 Pa 1 mmH2O = 9.80665 Pa
• 压力单位的换算关系: 1 atm = 760 mmHg = 1.03323 at = 1.01325 bar = 0.01325 MPa 1 at = 735.559 mmHg = 0.967841 atm = 0.980665 bar = 0.0980665 MPa
• 国际单位制:J 或 J / kg • 工程单位制:kcal 或 cal / kg 1 kcal = 4186.8 J =4.1868 kJ
5、焓 Enthalpy
• 焓是一个组合的状态参数: • 单位质量物质的焓称为比焓(有时简称为焓):
国际单位制:J 或 J / kg 工程单位制:kcal,比焓的单位是 kcal/kg
6、熵 Entropy
• 熵是一个导出的状态参数 • 对简单可压缩均匀系,可由其它状
参数导出:
• 单位质量的物质的熵称为比熵 Specific Entropy (有时简称为熵):
• 国际单位制:J / K 或 J / (kg. K ) • 工程单位制:kcal 或 kcal / (kg. K )
The P-V diagram of a compression process.
• 状态参数分类
–强度量(Intensive Property), 与物质总量无关
温度、压力、比体积等
–广延量(Extensive Property), 与物质总量成正比
体积,质量,热力学能,熵等
结束
• 热力学能 组成热力系的大量微观粒子本身具有的能量
( 不包括热力系宏观运动的能量和外场作用的 能量 ) • 热力学能包括:
工程热力学(基本概念)
国际实用温标的固定点
平衡状态
平衡氢三相点 平衡氢沸点 氖沸点 氧三相点 氧冷凝点
国际实用温标指定
值
T,K
t,℃
13.81 -259.34
20.28 -252.87
20.102 -246.048
54.361 -218.789
90.183 -182.962
平衡状态
水三相点 水沸点
锌凝固点 银凝固点 金凝固点
一、热力过程
定义:热力系从一个状态向另一个状态变化时所经 历的全部状态的总和。
二、准平衡(准静态)过程
准平衡过程的实现
工程热力学 Thermodynamics
二、准平衡(准静态)过程
定义:由一系列平衡态组成的热力过程 实现条件:破坏平衡态存在的不平衡势差(温差、
力差、化学势差)应为无限小。 即Δp→0 ΔT→0 (Δμ→0)
工程热力学 Thermodynamics
三、可逆过程
力学例子:
定义: 当系统完成某一热力过程后,如果有可能使系统再
沿相同的路径逆行而恢复到原来状态,并使相互中所涉 及到的外界亦恢复到原来状态,而不留下任何变化,则 这一过程称为可逆过程。
实现条件:准平衡过程加无耗散效应的热力过程 才是可逆过程。
工程热力学 Thermodynamics
用来实现能量相互转换的媒介物质称为工质。
理想气体
工 质
实际气体
蒸气
工程热力学 Thermodynamics
二、平衡状态
(一)热力状态:热力系在某一瞬间所呈现的宏观
物理状况。(简称状态)
(二)平衡状态 1、定义:一个热力系统,如果在不受外界影响的条件下,
系统的状态能够始终保持不变,则系统的这种状态称为平衡 状态。
工程热力学基本概念

= 收获/代价
炉
热效率: t
w net q1
顺 时 针
汽轮机
发电机 凝 汽 器
逆向循环 又称制冷循环或热泵循环
高温热源
或 制 Q1
逆 时
热冷 泵机
W
针
Q2
低温热源
制冷循环的经济性用制冷系数衡量:
2
1
1,a,2
1,b,2
b
2
状态参数的变化只与初终态相关,
1 dxx2 x1 与路径无关。
状态参数都有以上特性。
状态参数的循环 dx 0 积分等于零。
反之,有以上特性之一, 即为状态参数。
1-3 平衡状态、状态方程式、坐标图
一、平衡状态
热力系在没有外界作用的情况下〔重力场除 外〕,宏观性质不随时间变化的状态。
热力过程:工质由一个状态变化到另一状态所经历 的全部状态的总和。
实际过程由一系列非 平衡状态组成
例:
非平衡状态
无法简单描述
平衡状态
宏观静止
能量不能转换
“平衡〞意味着宏观静止, 引入 理想模型:
“过程〞意味着变化,意味着
准平衡过程
平衡被破坏。二者如何统一?
一、准平衡过程 热力系从一个平衡态连续经历一系列
系统与外界 通过边界进 展相互作用
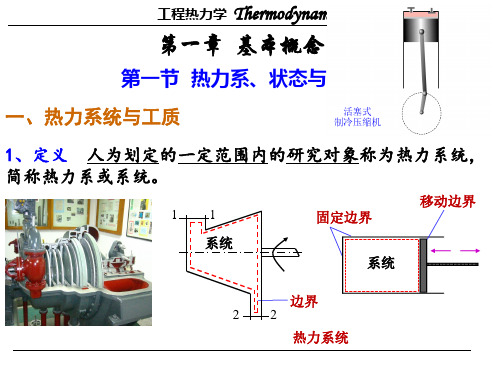
热力系的选取主要决定于研究任务 。
选取热力系时注意:
❖热力系可以很大,但不能大到无限。
❖热力系可以很小,但不能小到只包含少量分子, 以致不能遵守统计平均规律。
❖ 边界可以是实际存在的, 也可以是假想的。
❖ 边界可以是固定的, 也可以是变动的。
系统与外界通过边界进展相互作用。
平衡的中间态过渡到另一个平衡态
01第一章 基本概念1-2状态和状态参数

国际单位制:J / K 或 J / (kg.k) 工程单位制:kcal 或 kcal / (kg.k)
状态参数
• 状态参数是热力系状态的单值函数
• 状态参数的值仅取决于给定的状态,而与达到 这一状态的途径无关 • 状态参数的这一特性在数学上的表现是:它是点 函数,它的微分是全微分,全微分的循环积分 等于零
状态的单值函数。 物理上—与过程无关; 数学上—其微量是全微分。
dx 0
1b 2
dx dx
1a 2
状态参数分类
广延量(extensive property) 强度量(intensive property )
V 又:广延量的比性质具有强度量特性,如比体积 v m 工程热力学约定用小写字母表示单位质量参数。
1-2 状态和状态参数
热力学状态(state of thermodynamic system) —热力系在指定瞬间所呈现的全部宏观性质的总称 (系统宏观物理状况的综合) 状态参数(state properties) —从各个不同方面描写这种宏观状态的物理量
六个常用状态参数:
压力、比体积、温度、 热力学能、焓、熵
e u ek ep
外部储存能
宏观动能与内动能的区别
5、焓
• 焓是一个组合的状态参数:
H U pV
• 单位质量物质的焓称为比焓(有时简称为焓):
H h u pv m
H mh
• 国际单位制:J 或 J / kg • 工程单位制:kcal,比焓的单位是kcal/kg。 • 在工程单位制中pV乘积的单位是功kgf.m。
功和热量单位kcal之间的换算关系
1 1kgf m kcal 426 .936
基本概念及定义热力学参考幻灯片

6
3. 温度 Temperature , T ( t )
温度是标志系统冷、热程度的参数。 温度的建立以及测量是以热力学第零定律为基础的。
热力学第零定律(热平衡定律)The Zeroth Law of Thermodynamics : 两个系统分别与第三个系统处于热平衡,则这两个系统彼此也
必然处于热平衡。 处于同一热平衡态的所有系统,不论是否相互接触,必定有某一宏
Vm,千摩尔容积, m3/kmol
11
1-5 准静态过程和可逆过程
1. 热力过程 系统从一个状态出发,经历一系列中间状态而变 化到另一个状态所经历的全部过程称为热力过程。
初态 pA GpbA 条件改变:G↓为G’,使 pA G'pbA
终态 p'AG'pbA
第一章 基本概念及定义
12
2. 准静态过程 quasi-static state process
第一章 基本概念及定义
9
状态公理: 确定系统平衡状态所需的独立状态参数的数目,等于系统
和外界间进行能量传递方式的数目。n+1
系统状态变化,取决于系统和外界间的能量传递。 对于常见的气态物质组成的系统,没有化学反应时,即简单 可压缩系统,它和外界间传递的能量只有热量和系统容积变化 功,因此只要有两个独立的状态参数即可确定系统的状态。 状态参数坐标图:
• 按系统与外界是否有热量交换 绝热系统(insulated system) 非绝热系统 (特例:透热系统)
• 按系统与外界交换的准静态功的模式分类 简单系统 复杂系统
孤立系统(isolated system )
4
1-2 热力学系统的状态及基本状态参数
热力学状态(状态) : 热力系统在某一瞬间所呈现的宏观物理状况。
3. 温度 Temperature , T ( t )
温度是标志系统冷、热程度的参数。 温度的建立以及测量是以热力学第零定律为基础的。
热力学第零定律(热平衡定律)The Zeroth Law of Thermodynamics : 两个系统分别与第三个系统处于热平衡,则这两个系统彼此也
必然处于热平衡。 处于同一热平衡态的所有系统,不论是否相互接触,必定有某一宏
Vm,千摩尔容积, m3/kmol
11
1-5 准静态过程和可逆过程
1. 热力过程 系统从一个状态出发,经历一系列中间状态而变 化到另一个状态所经历的全部过程称为热力过程。
初态 pA GpbA 条件改变:G↓为G’,使 pA G'pbA
终态 p'AG'pbA
第一章 基本概念及定义
12
2. 准静态过程 quasi-static state process
第一章 基本概念及定义
9
状态公理: 确定系统平衡状态所需的独立状态参数的数目,等于系统
和外界间进行能量传递方式的数目。n+1
系统状态变化,取决于系统和外界间的能量传递。 对于常见的气态物质组成的系统,没有化学反应时,即简单 可压缩系统,它和外界间传递的能量只有热量和系统容积变化 功,因此只要有两个独立的状态参数即可确定系统的状态。 状态参数坐标图:
• 按系统与外界是否有热量交换 绝热系统(insulated system) 非绝热系统 (特例:透热系统)
• 按系统与外界交换的准静态功的模式分类 简单系统 复杂系统
孤立系统(isolated system )
4
1-2 热力学系统的状态及基本状态参数
热力学状态(状态) : 热力系统在某一瞬间所呈现的宏观物理状况。
第一章 Basic concepts
三. 温度 T
反映分子聚集疏密程 用容积法测量 度。 描述系统是否处于热平衡状态的物理量
宏观意义:冷热程度 微观意义:大量微观粒子热运动剧烈程度
测量依据 热力学第零定律 1931年福勒(英 国) 与第三个系统处于热平衡的两个 系统,彼此也处于热平衡
T1 T3 T2
1bar 105 Pa
1at 1kgf / cm
(extensive property)与系统数量有关:①加和性;②大写字母 (intensive property)与系统数量无关:①小写字母 (specific property)单位质量工质具有的量:①小写字母 (external property)描述系统作为整体的宏观运动状态参数:速 度、位移等。
压力能转化为动 能,动能转化为 热能
• • •• • •• • • •• • • ••• •• • •
自由膨胀
混合
Q T2
T1>T2
结 ①过程的发生向不平衡势差减小的方向进行,直至势差为 零。 论 ②过程中,存在功耗散为 如不特指,均为可逆过程
热。
不同势差的本质?是否能用统一量描述?
第
1 章 基本概念
P10~41
温标 温度的度量标尺: ①规定温标基准点;②分度 绝对K
373.15
摄氏℃ 100 水沸点
华氏F
朗肯R
212
发烧 100
671.67 559.67 491.67 459.67 0
37.8 273.16 273.15
0.01 水三相点 0 冰熔点 -17.8
32
5 o (t / F 32 ) 9 T / oR t / oF 459 .67 9 T / oR T / K 5 t / oC
热工基础与应用 (第4版)课件:热能转换的基本概念和基本定律
§2-2 热力学能和总储存能 一、内部储存能——热力学能:工质微观粒子所具有的能量。
分子运动所具有的内动能
热力学能
分子间由于相互作用力所具有的内位能 维持一定分子结构的化学能和原子核内部的核能
热力学能U 是状态参数; 比热力学能 u=U/m
热工基础与应用
二、外部储存能
Ek
1 mc2 2
或
ek
1 c2 2
可逆过程的热量
热工基础与应用
§1-3 热力循环
1、定义:
工质从某一初态出发经历一系列热 力状态变化后 又回到原来初态的热力 过程.即封闭的热力过程,简称循环。
2、分类 : 按性质 按目的
可逆循环:全部由可逆过程构成。 不可逆循环:只要存在不可逆过程。
正循环(即动力循环):对外输出动力。 逆循环(即制冷循环或热泵循环):制冷或制热。
q du pdv
或
2
q u pdv
1
热工基础与应用
§2-5 稳定流动系统的能量方程
一、稳定流动系统
1、定义:稳定流动系统是指热力系统内各点状态参数不随时间变
化的流动系统。
2、实现条件:
(1)进出系统的工质流量相等且不随时间而变;
(2)系统进出口工质的状态不随时间而变;
(3)系统与外界交换的功和热量等所有能量不随时间而变。
热工基础与应用
四、状态参数坐标图和状态方程式
1、独立的状态参数 :简单可压缩系统 2 。
2、状态参数坐标图
p
T
p1
1( p1, v1 )
T1
1 (T1 , s1 )
O
v1 v
O
3、状态方程式
状态参数坐标图
s1 s
工程热力学(第五版)第一章课件
1.2.5 基本状态参数
U形管式压力计示意图
pb
U形管式压力计示意图
pb
p pb
p pb
p
pg
p pb pg
p
pv
p pb pv
真空度
当工质是处于负压工作状态时,工质的真实压力p低于环境压力pb,
其测量得到的相对压力称为真空度 p v 。
第1章 基本概念
1.2 热力系统的状态和状态参数
1.2.5 基本状态参数
例1-2某刚性容器被分隔为两部分,在容器壁上分别装有三个压力表,表B的 读数为80kPa,表C的读数为100kPa,试问压力表A的读数是多少? 设当地大气压为770mmHg。 已知: pgB 80kPa, pgC 100kPa, pb 770mmHg。 求 : pgA ? 解 由图示依据真实压力、参考压力和 相对压力之间的关系,可写出如下3 个关系式,从中整理出所求量。
物质 (水蒸气)
热力系统
物质 (凝结水)
蒸汽放热给冷却1.2 热力系统的分类
第1章 基本概念
1.1 热力系统 1.1.2 热力系统的分类
开口热力系(水泵示意图)
开口热力系统(水泵示意图)
锅炉给水 来自冷凝器的水
电动机
水 泵
水泵的简化热力学分析模型
水泵的简化热力学分析模型
边 界的特性 可以是真实的,也可以是假想的;可以是固定的,也可以是
运动的。
第1章 基本概念
1.1 热力系统
1.1.1 热力系统的定义
热力系统、界面、外界
热力系、界面、 外界例Ⅳ
界面
系
统
界面是真实的、固定不动的
第1章 基本概念
1.1 热力系统
工程热力学与传热学:1-2 平衡状态及状态参数
(2)热力学第零定律(the zeroth law of Thermodynamics) 如果两个物体同时与第三个物体处于热平衡,
则它们彼此也处于热平衡。 (3)温标 (temperature scale)
温度的数值表示法。
➢ 热力学温标 (thermodynamic scale of temperature)
1—2 平衡状态及状态参数
1-2-1 工质的热力学状态
பைடு நூலகம்
1. 工质的热力学状态(thermodynamic state)
工质在热力变化过程中的某一瞬间所呈现的宏观
物理状况。
2. 状态参数(state parameter)
系统的 热力学状
描述工质所处状态的宏观物理量。 态
说明
➢状态参数是热力系统状态的单值函数
10m H2O
HH g
p
Hg
1.013 105 pa 13.6 103 9.81
760m
m
Hg
(3)绝对压力,表压力和真空度 ➢ 绝对压力(absolute pressure) 是以绝对真空为基准计量得到的压力,
是工质的真实压力。
➢ 表压力(gage pressure)
是以大气压为基准测量得到的压力 用 Pe 表示
热力学温标基准点:
取水的三相点(triple point)(纯水固、液、气三相
平衡共存的状态点)为基准点,
定义其温度为273.16 K。
1K= 水的三相点?
➢ 热力学摄氏温标(Celsius)
定义: t = T – 273.15 ℃
✓ 摄氏温度0 ℃ = 热力学温度273.15K ✓ 水的三相点温度 t = 0.01 ℃
2. 压力 (pressure)
则它们彼此也处于热平衡。 (3)温标 (temperature scale)
温度的数值表示法。
➢ 热力学温标 (thermodynamic scale of temperature)
1—2 平衡状态及状态参数
1-2-1 工质的热力学状态
பைடு நூலகம்
1. 工质的热力学状态(thermodynamic state)
工质在热力变化过程中的某一瞬间所呈现的宏观
物理状况。
2. 状态参数(state parameter)
系统的 热力学状
描述工质所处状态的宏观物理量。 态
说明
➢状态参数是热力系统状态的单值函数
10m H2O
HH g
p
Hg
1.013 105 pa 13.6 103 9.81
760m
m
Hg
(3)绝对压力,表压力和真空度 ➢ 绝对压力(absolute pressure) 是以绝对真空为基准计量得到的压力,
是工质的真实压力。
➢ 表压力(gage pressure)
是以大气压为基准测量得到的压力 用 Pe 表示
热力学温标基准点:
取水的三相点(triple point)(纯水固、液、气三相
平衡共存的状态点)为基准点,
定义其温度为273.16 K。
1K= 水的三相点?
➢ 热力学摄氏温标(Celsius)
定义: t = T – 273.15 ℃
✓ 摄氏温度0 ℃ = 热力学温度273.15K ✓ 水的三相点温度 t = 0.01 ℃
2. 压力 (pressure)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
p,v,T,U,H,S
五、压力(pressure)
定义:单位面积上承受的垂直作用力
p F
当地大气压pb (local atmospheric pressure)
A
绝对压力 p (absolute pressure)
表压力 pg ( pe )(gauge pressure; manometer pressure) 真空度 pv (vacuum; vacuum pressure)
1mmHg 133.32Pa
1mmH2O9.80665Pa
2、比体积和密度
比体积(specific volume)
v V m
单位质量工质的体积 m 3 / k g
密度(density)
m V
单位体积工质的质量 k g / m 3
两者关系:
v 1
3、温度和温标(temperature and temperature scale)
在工程单位制中焓和比焓的定义式应写为
HUApV huApv
▪ 国际单位制:J 或 J / kg ▪ 工程单位制:kcal,比焓的单位是 kcal/kg。 ▪ 由于在工程单位制中pV乘积的单位是功kgf.m。
6、熵
• 熵是一个导出的状态参数对简单可压缩均匀系, 它可以由其它状参数按下列关系式导出:
SdUTpdV S0
toCT K2 7 3 .1 5
华氏温标和朗肯温标 {T} °R={t} ℉ +459.67 华氏温标和摄氏温标 {t} ℃=5/9[{t} ℉-32]
4、热力学能(内能)(internal energy)
• 热力学能是指组成热力系的大量微观粒子本身具有的能量(不包括 热力系宏观运动的能量和外场作用的能量)。
1-2 状态和状态参数
热力学状态(state of thermodynamic system) —热力系在指定瞬间所呈现的全部宏观性质的总称 (系统宏观物理状况的综合)
状态参数(state properties) —从各个不同方面描写这种宏观状态的物理量
六个常用状态参数:
压力、比体积、温度、 热力学能、焓、熵
Hale Waihona Puke HUpV• 单位质量物质的焓称为比焓(有时简称为焓):
h H u pv Hmh m
• 国际单位制:J 或 J / kg • 工程单位制:kcal,比焓的单位是kcal/kg。 • 在工程单位制中pV乘积的单位是功kgf.m。
功和热量单位kcal之间的换算关系
1kgm f 1 kcal 42.9636
pg p pb
pv pb p
pg(pv)
g z
常用压力单位:
压力计、真空表、U形管压力计、斜管式微压计
1Pa 1mN2 1MPa 1106Pa 1bar 1105Pa
1kPa 1103Pa
例题1 例题2
1atm101325Pa 760mmHg 1a t1kgf/2c9m80 .5P6a6
dSdUpdV T
• 单位质量的物质的熵称为比熵(有时简称为熵)
sm SduTpdvs0
dsdSdupdv mT
国际单位制:J / K 或 J / (kg.k) 工程单位制:kcal 或 kcal / (kg.k)
状态参数
• 状态参数是热力系状态的单值函数
• 状态参数的值仅取决于给定的状态,而与达到 这一状态的途径无关
• 状态参数的这一特性在数学上的表现是:它是点 函数,它的微分是全微分,全微分的循环积分 等于零
状态的单值函数。 物理上—与过程无关; 数学上—其微量是全微分。
Ñ dx0 dx dx
1b2
1a2
状态参数分类
广延量(extensive property) 强度量(intensive property )
1 kcal = 4186.8 J= 4.1868 kJ
总(储存)能 (total stored energy of system)
热力学能,内部储存能
E U E k E p e u e k e p
总能 宏观动能 宏观位能 外部储存能
宏观动能与内动能的区别
5、焓
• 焓是一个组合的状态参数:
温度:表示物体的冷热程度可用分子平均移动能的大小来表示,即
温度的定义:
mc 2 3 T
22
测温的基础—热力学第零定律(zeroth law of thermodynamics)
热力学温标和国际摄氏温标
(thermodynamics scale; Kelvin scale; absolute temperature scale and internal Celsius temperature scale)
又:广延量的比性质具有强度量特性,如比体积
v
V
m
工程热力学约定用小写字母表示单位质量参数。
系统两个状态相同的充要条件: 所有状态参数一一对应相等
简单可压缩系两状态相同的充要条件: 两个独立的状态参数对应相等
例1-1 某热电厂测得新蒸汽的表压力为100at,凝汽器的真空度(pv/pb )为94 %,送风机表压为145mmHg,当时气压计读数为755mmHg。试将它们换算成 Pa和MPa为单位的绝对压力。
• 热力学能包括:分子动能、分子位能、 分子化学能、原子能等(在 工程热力学中通常只考虑前两种)
• 对于气体,分子动能包括分子的移动能、转动能和分子内部的振动能。 • 单位质量物质的热力学能称为比热力学能(有时简称为热力学能)
u U Umu
m
• 国际单位制:J 或 J / kg • 工程单位制:kcal 或 cal / kg
例1-2 从工程单位制水蒸气热力性质表中查得水蒸气在450℃、30 at时的 比体积、比焓和比熵为
在国际单位制中,上述参数各为若干?
感谢亲观看此幻灯片,此课件部分内容来源于网络, 如有侵权请及时联系我们删除,谢谢配合!
五、压力(pressure)
定义:单位面积上承受的垂直作用力
p F
当地大气压pb (local atmospheric pressure)
A
绝对压力 p (absolute pressure)
表压力 pg ( pe )(gauge pressure; manometer pressure) 真空度 pv (vacuum; vacuum pressure)
1mmHg 133.32Pa
1mmH2O9.80665Pa
2、比体积和密度
比体积(specific volume)
v V m
单位质量工质的体积 m 3 / k g
密度(density)
m V
单位体积工质的质量 k g / m 3
两者关系:
v 1
3、温度和温标(temperature and temperature scale)
在工程单位制中焓和比焓的定义式应写为
HUApV huApv
▪ 国际单位制:J 或 J / kg ▪ 工程单位制:kcal,比焓的单位是 kcal/kg。 ▪ 由于在工程单位制中pV乘积的单位是功kgf.m。
6、熵
• 熵是一个导出的状态参数对简单可压缩均匀系, 它可以由其它状参数按下列关系式导出:
SdUTpdV S0
toCT K2 7 3 .1 5
华氏温标和朗肯温标 {T} °R={t} ℉ +459.67 华氏温标和摄氏温标 {t} ℃=5/9[{t} ℉-32]
4、热力学能(内能)(internal energy)
• 热力学能是指组成热力系的大量微观粒子本身具有的能量(不包括 热力系宏观运动的能量和外场作用的能量)。
1-2 状态和状态参数
热力学状态(state of thermodynamic system) —热力系在指定瞬间所呈现的全部宏观性质的总称 (系统宏观物理状况的综合)
状态参数(state properties) —从各个不同方面描写这种宏观状态的物理量
六个常用状态参数:
压力、比体积、温度、 热力学能、焓、熵
Hale Waihona Puke HUpV• 单位质量物质的焓称为比焓(有时简称为焓):
h H u pv Hmh m
• 国际单位制:J 或 J / kg • 工程单位制:kcal,比焓的单位是kcal/kg。 • 在工程单位制中pV乘积的单位是功kgf.m。
功和热量单位kcal之间的换算关系
1kgm f 1 kcal 42.9636
pg p pb
pv pb p
pg(pv)
g z
常用压力单位:
压力计、真空表、U形管压力计、斜管式微压计
1Pa 1mN2 1MPa 1106Pa 1bar 1105Pa
1kPa 1103Pa
例题1 例题2
1atm101325Pa 760mmHg 1a t1kgf/2c9m80 .5P6a6
dSdUpdV T
• 单位质量的物质的熵称为比熵(有时简称为熵)
sm SduTpdvs0
dsdSdupdv mT
国际单位制:J / K 或 J / (kg.k) 工程单位制:kcal 或 kcal / (kg.k)
状态参数
• 状态参数是热力系状态的单值函数
• 状态参数的值仅取决于给定的状态,而与达到 这一状态的途径无关
• 状态参数的这一特性在数学上的表现是:它是点 函数,它的微分是全微分,全微分的循环积分 等于零
状态的单值函数。 物理上—与过程无关; 数学上—其微量是全微分。
Ñ dx0 dx dx
1b2
1a2
状态参数分类
广延量(extensive property) 强度量(intensive property )
1 kcal = 4186.8 J= 4.1868 kJ
总(储存)能 (total stored energy of system)
热力学能,内部储存能
E U E k E p e u e k e p
总能 宏观动能 宏观位能 外部储存能
宏观动能与内动能的区别
5、焓
• 焓是一个组合的状态参数:
温度:表示物体的冷热程度可用分子平均移动能的大小来表示,即
温度的定义:
mc 2 3 T
22
测温的基础—热力学第零定律(zeroth law of thermodynamics)
热力学温标和国际摄氏温标
(thermodynamics scale; Kelvin scale; absolute temperature scale and internal Celsius temperature scale)
又:广延量的比性质具有强度量特性,如比体积
v
V
m
工程热力学约定用小写字母表示单位质量参数。
系统两个状态相同的充要条件: 所有状态参数一一对应相等
简单可压缩系两状态相同的充要条件: 两个独立的状态参数对应相等
例1-1 某热电厂测得新蒸汽的表压力为100at,凝汽器的真空度(pv/pb )为94 %,送风机表压为145mmHg,当时气压计读数为755mmHg。试将它们换算成 Pa和MPa为单位的绝对压力。
• 热力学能包括:分子动能、分子位能、 分子化学能、原子能等(在 工程热力学中通常只考虑前两种)
• 对于气体,分子动能包括分子的移动能、转动能和分子内部的振动能。 • 单位质量物质的热力学能称为比热力学能(有时简称为热力学能)
u U Umu
m
• 国际单位制:J 或 J / kg • 工程单位制:kcal 或 cal / kg
例1-2 从工程单位制水蒸气热力性质表中查得水蒸气在450℃、30 at时的 比体积、比焓和比熵为
在国际单位制中,上述参数各为若干?
感谢亲观看此幻灯片,此课件部分内容来源于网络, 如有侵权请及时联系我们删除,谢谢配合!
