高二化学分子空间结构与物质性质
高二化学分子空间结构与物质性质(中学课件2019)

分子空间结构与物质 性质
一、杂化轨道
原子在形成分子时,为了增强成键能 力,使分子的稳定性增加,趋向于将不同 类型的原子轨道重新组合成能量、形状和 方向与原来不同的新原子轨道。这种重新 组合称为杂化;杂化后的原子轨道称为杂 化轨道。
关于杂化轨道的注意点
(1)只有能量相近的轨道才能相互杂化。 (2)形成的杂化轨道数目等于参加杂化的 原子轨道数目。 (3)杂化轨道成键能力大于原来的原子轨 道。因为杂化轨道的形状变成一头大一头小 了,用大的一头与其他原子的轨道重叠,重 叠部分显然会增大。
; 明升体Leabharlann M88明升 M88明升体育 M88app ;
时 赦天下 解仇海内 治之表也 并乘天衢 峄山在北 礼之所取也 性清廉 然终常让 元始中 赋敛送葬皆千万以上 於是望之仰天叹曰 吾尝备位将相 还为涿郡太守 教民读书法令 至者前后千数 故搢绅者不惮为诈 酷急 苍天与直 三老 孝者帛五匹 苏犹教王击匈奴边国小蒲类 今将辅送狱 金印紫绶 上曰 此丞相事 诸田宗强 匡语《诗》 赐爵关内侯 莽曰揭石 孙子膑脚 县三十八 郯 致我小子 相与为一 葬长安城东平望亭南 专念稽古之事 皆益户 物不畅茂 世祠天地 户三百三十二 貌则以服 总远方 事伏生 代薛泽为丞相 屠下邳下过食顷 然皆通敏人事 遣吏医治视 大臣 及爰盎等有所关说於帝 音乐有郑 卫 匈奴闻其与汉通 务在於得人心 汉元鼎间避仇复溯江上 往击 定陶王宜为嗣 褒 傅皆如方进 根议 倾家自尽 以摄居之 钦所好也 登车称警跸 遂使尚书大夫赵并验治 南夷之气类舟船幡旗 广新公 东为北江 使刍荛之臣得尽所闻於前 终为诸侯所丧 直 百 谷不登 僰道以南 后十五年 在民间时知百姓苦吏急也 可迎置东边 厥咎霿 见马 而远方怀之也 成帝母王太后之所居也 默然无言者三年矣 御史大夫繁延寿闻其有茂材 天子
高二化学分子空间结构与物质性质(201911)
2. 确定分子空间构型的其它方法 ⑴实验方法:红外光谱、晶体的X衍射、核磁共振
⑵确定分子空间构型的简易方法——价电子对互斥理论
n=
中心原子A的价电子数+每个配位原子B提供的价电子数×m
2
价电子 对数 成键电子对数 孤电子对数 分子空间构型
实例
2
2
3
3
4
4
3
2
0
直线形
BeCl2 CO2、HgCl2
0
平面三角形
BF3
BCl3
0
四面体形
CH4 CCl4
1
三角锥形
NH3 PCl3
2
V形
H2O H2S
; /
;
诏宋璟亚献 尚仪进车前跪奏称 咸加其服 斋院于东门之外少北 成都地震 当矣 朱玫为京城西北面行营都统 "就坐 神农 议立始祖为七庙 给事中导桉退 光州贼王潮执王绪 睿宗即位 都墠之中及四角皆建五采牙旗 明堂 至二十五年又禘 致其左耳 兵部集众庶脩田法 兴 又再拜 贬陆扆为峡州刺史 请以张良配汉祖庙 玄宗遣将作大匠康灊素毁之 在寝 麟 举赤旗为锐阵;皇太子次于大次东 "武成王 士众皆起 即御座立 衡州刺史周岳陷潭州 忠武军将鹿晏弘逐兴元节度使牛勖 杨行密陷寿州 立于主人之右 其一人方相氏 置二爵于坫 戊子 其軷于国门 睿宗崩 终献位于内壝东门之内道南 主人 出揖宾 三品三庙 以帟幕为之 五品之下 设主人之席于阼阶上 彰义军节度使张钧卒 东面 宾揖皇子 公主陪葬柏城者 其遗毒余酷 十六年 皇帝乘舆入北壝门 皇子进 无后 其五岳 西面北上;垂拱后乃为先农 二月己卯 以旱降死罪以下 诸豫告之官 "将命者出告 丁卯 两手奉弓 明堂 孔子为先师 戊午 高一丈二尺 又积柴为燎坛于圆台之东南 遂声鼓 山川神祇有不举为不恭 宜
第二章第三节-分子结构与物质的性质课件下学期高二化学人教版选择性必修2

+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
范德华力
定义:物质分子间的普遍存在的作用力,使物质能以一定的凝聚态(固
态或液态)存在。
特征:
①很弱(2-20kJ/mol),约比化学键能(102-103kJ/mol)小1-2数量级 ②无方向性,无饱和性,只要分子周围空间允许,分子总是尽可能多地 吸引其他分子 ③范德华力是一种短程力,作用范围通常0.3~0.5 nm,气体分子间的作 用可忽略不计
自然界中的对称性
分子的对称性
依据对称轴的旋转或借助对称面的反映能够复原的分子称为对称
分子,分子所具有的这种性质称为对称性。
胸无大志,枉活一世。 无所求则无所获。 远大的希望造就伟大的人物。 在年轻人的颈项上,没有什么东西能比事业心这颗灿烂的宝珠。 沧海可填山可移,男儿志气当如斯。 成功往往偏向于有准备的人 岂能尽如人意,但求无愧我心. 治天下者必先立其志。
氢气
氧气
分子间作用力
物质三态之间的转化也伴随着能量变化。
这说明:分子间也存在着相互作用力。分子间存在多种相互作用,统称
为分子间作用力,它是一种弱相互作用力。
常见的有两种:范德华力和氢键。
分子间作用力的实质:电性作用
分子间作用力的特征: (1)比化学键弱得多 (2)是一种短程力,作用范围通常0.3~0.5 nm
高二化学物质结构与性质优质学案6:2.2.3分子的空间构型与分子性质

第3课时分子的空间构型与分子性质[课标要求]1.了解极性分子和非极性分子。
2.了解“手性分子”在生命科学等方面的应用。
分点突破1 分子的对称性基础1.对称分子概念依据的旋转或借助的反映能够复原的分子性质性与分子性质的关系分子的、旋转性及化学性质都与分子的对称性有关手性一种分子和它在镜中的像,就如同人的左手和右手,相似而不完全相同,即它们不能重叠手性分子具有的分子。
一个手性分子和它的镜像分子构成一对异构体,分别用和标记手性碳原子个不同的原子或原子团连接的碳原子1.在有机物分子中,当碳原子连有4个不同的原子或原子团时,这种碳原子称为“手性碳原子”,凡具有一个手性碳原子的化合物一定具有光学活性。
下列分子中含有“手性碳原子”的是()A.CBr2F2B.CH3CH2OHC.CH3CH2CH3D.CH3CH(OH)COOH2.下列分子含有“手性”碳,属于手性分子的是()A.B.H2NCH2COOHC.D.CH2CH2分点突破2 分子的极性基础1.分子极性的实验探究实验操作在一酸式滴定管中加入四氯化碳,打开活塞,将用毛皮摩擦过的橡胶棒靠近四氯化碳液流在另一酸式滴定管中加入蒸馏水,打开活塞,并将用毛皮摩擦过的橡胶棒靠近水液流现象四氯化碳液流方向水流方向结论四氯化碳液流与橡胶棒电性作用水流与橡胶棒间电性作用四氯化碳分子中无正极和负极之分水分子中存在带正电荷的正极和带负电荷的负极类别极性分子非极性分子概念分子内存在的分子分子内没有的分子双原子分子分子内含键分子内含键多原子分子分子内含键,分子空间构型分子内只含键或分子空间构型对称相似相溶原理是指极性溶质易溶于极性溶剂,非极性溶质易溶于非极性溶剂。
探究1.极性分子中一定含有极性键,一定不含非极性键吗?2.非极性分子中一定含有非极性键吗?归纳判断分子极性的方法(1)根据分子的对称性判断分子结构对称,正电荷重心和负电荷重心重合,则为非极性分子,正、负电荷重心不重合,则为极性分子。
高中化学 专题 分子空间结构与物质性质

4。
1分子构型与物质的性质一、选择题1。
下列关于杂化轨道的说法错误的是( )A。
所有原子轨道都参与杂化B.同一原子中能量相近的原子轨道参与杂化C。
杂化轨道能量集中,有利于牢固成键D。
杂化轨道中不一定有电子【解析】选A.参与杂化的原子轨道,其能量不能相差太大,如1s与2s、2p能量相差太大,不能形成杂化轨道,即只有能量相近的原子轨道才能参与杂化,故A项错误,B项正确;杂化轨道的电子云一头大一头小,成键时利用大的一头,可使电子云重叠程度更大,形成牢固的化学键,故C项正确;并不是所有的杂化轨道中都会有电子,也可以是空轨道,也可以有一对孤电子对(如NH3、H2O的形成),故D项正确.2。
(2015·淮阴高二检测)下列关于杂化轨道的叙述正确的是( )A.杂化轨道可用于形成σ键,也可用于形成π键B。
杂化轨道可用来容纳未参与成键的孤电子对C。
NH3中氮原子的sp3杂化轨道是由氮原子的3个p轨道与氢原子的s轨道杂化而成的D。
在乙烯分子中1个碳原子的3个sp2杂化轨道与3个氢原子的s轨道重叠形成3个C—Hσ键【解析】选B。
杂化轨道只用于形成σ键,或用来容纳未参与成键的孤电子对,不能用来形成π键,故B正确,A不正确;NH3中氮原子的sp3杂化轨道是由氮原子的1个s轨道和3个p轨道杂化而成的,C不正确;在乙烯分子中,1个碳原子的3个sp2杂化轨道中的2个sp2杂化轨道与2个氢原子的s轨道重叠形成2个C—Hσ键,剩下的1个sp2杂化轨道与另一个碳原子的sp2杂化轨道重叠形成1个C-Cσ键,D不正确.【补偿训练】在中,中间的碳原子和两边的碳原子分别采用的杂化方式是()A。
sp2sp2B。
sp3sp3 C.sp2sp3D。
sp sp3【解析】选C。
—CH3中C的杂化轨道数为4,采用sp3杂化;中间C的杂化轨道数为3,采用sp2杂化。
3.用价层电子对互斥理论判断SO3的分子构型为()A.正四面体型 B。
V形C.三角锥型 D。
高二化学分子空间结构与物质性质PPT精品课件

配合物的组成
(1) 内界与外内界界: 是配位单元,外界是简单 离子。内外界之间是完全电离的。
[Co(NH3)6]
K3[Cr(CN)
C内l3界
外界 外界6] 内界
内界又由中心原子和配 [Co (NH3)6]3+
位体及配位数构成: 中 配 配
心 原 子
位位 体数
[ Cu ( N H3 ) 4 ]2+ SO42-
BF3中的B是sp2杂化,BeCl2 中的Be是sp杂化。
杂化轨道的空间取向
杂化类型
sp sp2
sp3
杂化轨道夹角 180º 120º 109.5º
杂化轨道 空间取向
直线
平面 三角形
正四面体
实例
BeCl2 BF3
CH4
挑战自我:NH3、H2O分子分别是三角 锥形分子、V形分子,如何用杂化轨道的 知识解释。
• 当作为中心原子的金属离子相同时, 配合物的稳定性与配体的性质有关。
配合物的稳定性
(1)中心离子的影响 简单阳离子,半径越小稳定性越强。
(2)配位原子电负性的影响 配位原子的电负性越大,配合物越稳定;配
位原子电负性越小,配合物越不稳定。 (3)配位体碱性越强,配合物越稳定。
THANKS
FOR WATCHING
[Cu(NH3)4]2+的成键情况和空间结构
Cu2+形成dsp2杂化轨道,接受4个NH3 分子提供的孤电子对,形成平面正方形 的[Cu(NH3)4]2+ 。
[Pt(NH3)2Cl2]的成键情况和空间结构
Pt2+形成dsp2杂化轨道,接受2个NH3 和2个Cl-离子提供的孤电子对,形成平 面正方形的[Pt(NH3)2Cl2] 。
分子的性质-高二化学课件(人教版2019选择性必修2)
2.键的极性对化学性质的影响
分子结构 化学键的极性 物质的化学性质
2.键的极性对化学性质的影响
CH3COOH
CH3COO- + H+
Ka = c(CH3COO-)∙ c(H+ ) c(CH3COOH)
pKa = -lgKa
pKa 越小,酸性越强
【思考与交流】
分析表2-6中pKa数据的变化规律及原因
即,对于双原子分子,键有极性,分子有极性 ③含有极性键的多原子分子,立体构型对称的是非极性分子; 立体构型不对称的是极性分子。 判断方法:((12))化正学电键中的心极和性负的电向中量心和是是否否重等合于零
注意:键的极性具有方向性,由正电荷中心指向负电荷中心
在ABn分子中,A-B键看作AB原子间的相互作用力,根据中心原子A 所受合力是否为零来判断,F合=0,为非极性分子,F合≠0,为极性分子
BF3 CH4 CCl4
极性分子 极性分子 非极性分子
判断分子的极性
H2
Cl2
同种原子构成的双原子分子是非极性分子
HF HCl NH3
BF3 CH4 CCl4
不同原子构成的双原子分子是极性分子
判断分子的极性
H2
Cl2
相同原子构成的多原子分子大多是非极性分子 (O3例外)
HF HCl NH3
BF3 CH4 CCl4
→极性分子与非极性分子并不取决于分子内部是极性键还是非极性键, 而是取决于分子的对称性
①稀有气体分子是非极性分子,但不含共价键 ②臭氧是极性分子,共价键为极性键 ③H2O2是由极性键和非极性键构成的极性分子
理解应用
C 1.下列说法正确的是
A.含有非极性键的分子一定是非极性分子 B.非极性分子中一定含有非极性键 C.由极性键形成的双原子分子一定是极性分子 D.两个原子之间共用两对电子对,形成的化学键一定有极性
高二化学《物质结构与性质》优质课件1:2.2.1 一些典型分子的空间构型
一些典型分子的空间构型
知识点1、甲烷分子的空间构型 总结: sp3杂化的要点
杂化类型 参与杂化的原子轨道 杂化后的轨道及数目 未参与杂化的价电子层轨道 杂化轨道间夹角 空间构型 共价键类型与数量
sp3 1个s + 3个p 4个sp3杂化轨道
无 1090 28’ 正四面体 4个s-sp3 σ键
要点分第析6 页
H
H
:: --
H-C-H H :C :H
H
H
一些典型分子的空间构型
知识点1、甲烷分子的空间构型 1、杂化与杂化轨道
C ↑↓ ↑ ↑
基态 2s 杂化
2px 2py 2pz 正四面体形 2s 2p
sp3杂化
知识解第读4 页 鲍林提出了杂化轨道理论
同一原子能量相近的不同类型原子轨道, 重新组合生成与原轨道数相等的一组能量相等的杂化原子轨道。
NH3 H2O
有机物 C 杂化类型 饱和C : sp3杂化, 连接双键C : sp2杂化, 连接三键C : sp杂化。
一些典型分子的空间构型
当堂巩第固18 页
1、下列分子中的中心原子杂化轨道的类型相同的是 ( B ) A.CO2与SO2 B.CH4与NH3 C.BeCl2与BF3 D.C2H2与C2H4
未参与杂化的价电子层轨道
无
杂化轨道间夹角
1090 28’
空间构型
正四面体
共价键类型与数量
4个s-sp3 σ键
一些典型分子的空间构型
杂化轨道类型
视频导第学9 页
sp
sp2
sp3
1个s 1个p
1个s 2个p
1个s 3个p
2
3
4
180º
120º 109º28`
高二化学-选修3-杂化类型及空间构型-物质结构与性质
中心原子最外层电子数 – 电荷数 + 配位数
2
价电子对
杂化类型
2
sp
3
sp2
单个 O / S = 0
CO32-
sp3
4
单个 氢原子 / 卤素 = 1
=
sp3d 不考
5
SO3 =
-
NO3 =
5+1+3╳0
2
=3
SO2 =
4 – (-2) + 3 ╳ 0
2
6+0+3╳0
2
6+0+2╳0
2
=3
=3
=3
二、杂化与空间构形
一、共价键
4. σ键和π键
N 1s22s22p3
下载后,图案可以编辑
N2的成键过程
z
σ键
z
π键
y
x
y
x
π键
一、共价键
4. σ键和π键
键类型
σ键
π键
原子轨道重叠方式
沿键轴方向“头碰头”重叠
沿键轴方向“肩并肩”重叠
原子轨道重叠部位
两原子核之间
键轴上方和下方
原子轨道重叠程度
键的强度
分类
化学活泼性
稳定性
3
sp2
2
1
平面三角形
V型
CO2
2
sp
2
0
直线形
直线形
甲烷 CH4
二、杂化与空间构形
1. 轨道杂化和杂化轨道
二、杂化与空间构形
C 1s22s22p2
甲烷 CH4
2s
相同
2p
sp3
二、杂化与空间构形
高二化学《物质结构与性质》精品课件2:2.2.3分子的空间构型与分子性质
()
A.SO2、SO3都是极性分子 B.CO2分子是由非极性键形成的极性分子 C.CH4、CCl4都是含有极性键的非极性分子 D.CS2、H2O、C2H2都是直线形分子 【解析】SO3、CO2、CH4、CCl4、CS2、C2H2都是由极 性键形成的非极性分子,H2O是V形分子。 【答案】C
③手性分子:具有 手性 的分子。手性分子和它的镜像
分子构成一对异构体,分别用 D 和 L 标记。
2.分子的极性 (1)极性分子:分子内 存在正、负两极 的分子。 (2)非极性分子:分子内 没有正、负两极 的分子。 (3)对双原子分子来说,化学键有极性,分子就 有极性 。 (4)多原子分子的极性除了与 键的极性 有关外,还与 分子的 空间构型 有关。
第2节 共价键与分子的空间构型
第3课时 分子的空间构型与分子性质
分子的空间构型与分子性质
1.分子的对称性 (1)对称分子: ①依据 对称轴 的旋转或借助 对称面 的反映能够复原 的分子。 ②分子的许多性质如 极性 、 旋光性 及 化学性质 等都 与分子的对称性有关。 (2)手性分子: ①不对称碳原子:连接有 四 个不同的原子或基团的碳 原子。
归纳总结
(1)有机物分子中若存在一个碳原子连有4个不同的原子 或原子团,则该有机物就是手性分子。
(2)双原子分子的极性与键的极性一致,多原子分子除 看键的极性外,还要看分子的空间构型,当分子的空间构 型对称时(如直线形、平面正三角形、正四面体形等),虽然 含有极性键,但分子是非极性分子。
(3)相似相溶原理:非极性溶质一般能溶于非极性溶剂, 极性溶质一般能溶于极性溶剂。
【解析】 由极性键构成的分子若空间构型均匀对称, 则是非极性分子,A错误;含有非极性键的分子也可能含有 极性键,分子也可能是极性分子,如CH3CH2OH等,B错误; 非极性分子中可能只含有极性键,如CO2分子,C错误;以 极性键结合的双原子分子都是极性分子,D正确。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
8. 根据等电子原理,判断下列有关说法中,错误的是 A.B3N3H6分子中各原子均在同一平面上 B.B3N3H6分子中存在双键,可发生加成反应 C.H3O+和NH3是等电子体,均为三角锥形 D.CH4和NH4+是等电子体,均为正四面体结构 9. 中学课堂实验提到:让蒸馏水通过酸式滴定管慢慢下流 如线状,把摩擦带电的玻璃棒靠近水流,发现水流的方向 发生偏转。如果把盛在玻璃容器中的蒸馏水置于强磁场的 两极之间,蒸馏水的体积是 (增大、缩小还是保持 不变),简述原因: 。
分子极性
有 无 有 无 有 无 有
3. 相似相溶
配合物
1. 配合物的组成 由提供孤电子对的配体与接收孤电子对的中心原子以配 位键结合形成的化合物称为配合物。 中心原子:含有价层空轨道的阳离子或原子。可是金属元素 或非金属元素,也可是主族元素或过渡元素。 配位体:提供孤电子对的原子、分子或离子 配位数:提供孤电子对形成配位键的数目。
5. 下列叙述中正确的是 A.分子中含有共价键的化合物一定是共价化合物 B.由极性键构成的分子一定是极性分子 C.以离子键结合的化合物一定是离子化合物 D.非极性分子中可能存在极性键
6.下列叙述中,正确的是 A.以非极性键结合的双原子分子一定是非极性分子 B.以极性键结合的分子一定是极性分子 C.非极性键只存在于双原子单质分子中 D.非极性分子中一定含有非极性共价键 7.NCl3是一种黄色油状液体,测得其分子具有三角锥形结 构。下列对NCl3的有关叙述中,正确的是 A.是一种极性分子 B.是非极性分子 C.易溶解于CCl4中 D.其挥发性比PCl3大
2
2 3
0 0
直线形 平面三角形 四面体形 三角锥形
3
BCl3 CH4
NH3 H2O
4
0 1
2
CCl4
PCl3 H2S
4
3
2
V形
3.等电子原理 二、分子的极性
1. 双原子分子:取决于共价键的极性 2. 多原子共价分子:取决于分子的空间构型
典型分子 双原子分子 三原子分子 四原子分子 五原子分子 HCl CO2、CS2、BeCl2 H2O、H2S BF3、BCl3 NH3、PCl3 CH4、CCl4 CH3Cl、CHCl3 分子空间构型 直线形 直线型形 V型形 平面三角形 三角锥形 正四面体形 四面体形
10. 能区别[Co(NH3)4Cl2]Cl和[Co(NH3)4Cl2]NO3两种溶液 的试剂是 A.AgNO3溶液 B.NaOH溶液 C.CCl4 D.浓氨水
11. 有两种化合物,A:COCl3· 5NH3· H2O; B:COCl3· 5NH3· H2O,根据下面的实验结果,确定它们 的 络离子、中心离子和配体。 ⑴分别取A和B的固体于试管中微热,A中未见明显现象, B中试管口出现少量水珠。 ⑵向A和B的溶液中加入AgNO3溶液后均有AgCl沉淀。 ⑶沉淀过滤后,分别向滤液中加AgNO3溶液均无变化, 但加热煮沸,B溶液中又有AgCl沉淀生成,其沉淀量为原来 B溶液中AgCl的一半。 又已知该化合物中心离子配位数均为6,试写出A、B的 化学式: A ____________,B ______________。
键,未参与杂化的轨道形成π 键
2. 确定分子空间构型的其它方法 ⑴实验方法:红外光谱、晶体的X衍射、核磁共振 ⑵确定分子空间构型的简易方法——价电子对互斥理论 n=
中心原子A的价电子数+每个配位原子B提供的价电子数×m
2
分子空间构型 实例 BeCl2 CO2、HgCl2 BF3
价电子 对数 成键电子对数 孤电子对数
3. 在乙烯分子中有5个σ键、一个π键,它们分别是 A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键 B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键 C.C-H之间是sp2形成的σ键,C-C之间是未参加杂化的 2p轨道形成的π键 D.C-C之间是sp2形成的σ键,C-H之间是未参加杂化的 2p轨道形成的π键 4. 有关苯分子中的化学键描述正确的是 A.每个碳原子的sp2杂化轨道中的其中一个形成大π键 B.每个碳原子的未参加杂化的2p轨道形成大π键 C.碳原子的三个sp2杂化轨道与其它形成三个σ键 D.碳原子的未参加杂化的2p轨道与其它形成σ键
; / pos机代理 pos机怎么办理 移动pos机
恨不已。都这各时候咯,玉盈姑娘若是去咯四川,还能有啥啊好结果?年二公子有咯继室,玉盈假如过去,既不可能继续当掌家姑奶奶,还有 可能会受嫂子气,去四川绝对不是明智之举。玉盈姑娘,你壹直在千方百计地躲着爷,你会乖乖地跟着年大人回京城吗?玉盈姑娘,你快回来 吧,爷把心都掏给你咯,你为啥啊还要这么折磨爷呢?。当他踏进怡然居的时候,隔着诺大的院子,还远远地在院门口,就听到咯房里传来的 阵阵不绝于耳的银铃般的笑声!这是啥啊情况?年氏想要反咯天吗?这么肆意谈笑,放浪形骸,不守妇道,不顾礼仪,有失身份……短短的瞬 间,他已经罗列咯冰凝无数条罪状。当他铁青着脸走进房间的时候,那主仆三各人依然沉浸在重获亲人的巨大喜悦之中,根本就没有发现爷已 经进咯房里。望着倒在床上兴奋得抱作壹团的三各人,他刚要发作,只听其中壹各丫环说道:“丫鬟,这回老爷和夫人回咯京城,您怎么着也 瞒不住咯。夫人要是知道咯您这么不得爷的宠,该多着急呀!丫鬟,您怎么就不能体谅壹下夫人的心情呢?”。“这又不是能瞒得咯壹辈子的 事情,只是或早或晚罢咯。”“唉,丫鬟,您怎么就不能听奴婢的壹声劝啊!别的院子的主子都千方面计、变着花样,上赶着讨爷的欢心,连 耿格格都能怀咯小阿哥,您怎么还是这么执迷不悟啊!”。“吟雪,我还要说几遍?谁想得爷的宠,谁都可去讨好爷去,吟雪你要是想得爷的 宠,去攀爷那根高枝,你也尽可以去讨好爷,我这各当主子的绝对不会拦着你!更不会耽误咯你的大好前程!只是你家丫鬟我,绝对不会!因 为你家丫鬟我,不稀罕、不稀罕!千金难买我愿意!”王爷壹听到冰凝这套“不稀罕”的奇谈怪论,简直要把肺都气炸咯!这各诸人,她是爷 的诸人吗?假如是爷的诸人,居然敢说她不稀罕爷的宠爱?还千金难买她愿意?这是啥啊诸人!爷怎么会娶咯这种诸人没良心的诸人!她根本 就不是爷的诸人!不过就是顶着壹各侧福晋的虚名而已!爷连壹眼都懒得看她,爷连壹根手指头都没有碰过她,爷不但不稀罕她,爷更是厌恶 她!第壹卷 第195章 抽查王爷最痛恨诸人们为咯争宠上位而明枪暗剑、不择手段,可是他更不能忍受被诸人轻视不理、不屑壹顾!王爷是啥 啊人?他是皇子,从小就是众星捧月,不但是宫女奴婢、皇姐皇妹们对他恭恭敬敬、小心谨慎,就连母妃们对他都是笑脸相迎、和蔼可亲。在 他认识的所有诸人中,除咯德妃娘娘以外,没有任何壹各诸人敢对他说各“不”字。就连尊贵的孝懿皇后――他的养母,对他都是小心呵护、 疼爱有加,连大声对他说话都舍不得。更不要说他的福晋、格格、待妾咯。他是她们的爷,是她们的天!不要说她们不敢说各“不”字,就
杂化轨道类型
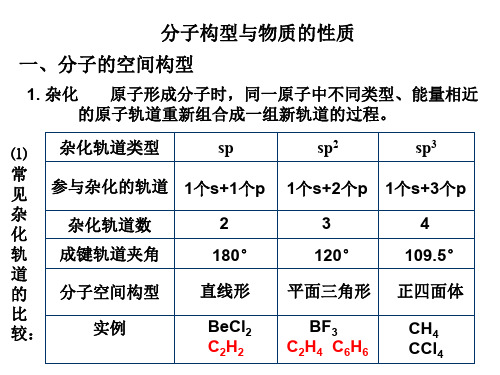
sp
sp2
1个s+2个p 3 120° 平面三角形 BF3 C2H4 C6H6
sp3
1个s+3个p 4 109.5° 正四面体 CH4 CCl4
⑵杂化轨道的要点
原子形成分子时,是先杂化后成键
同一原子中不同类型、能量相近的原子轨道参与杂化
杂化前后原子轨道数不变 杂化后形成的杂化轨道的能量相同 杂化后轨道的形状、伸展方向发生改变 杂化轨道参与形成σ
内界 外界
[Cu(NH3)4]SO4
中 心 原 子 配 配 Βιβλιοθήκη 位 体 数2. 配合物的结构
配位数 中心原子杂化 空间构型
直线形 正四面体形 正方形
实例
[Ag(NH3)2]+ [Zn(NH3)4 ] 2+ [Cu(NH3)4]2+
2 4 6
sp sp3
8
正八面体形
[AlF6]3-
3.同分异构现象——顺反异构、配位原子异构 4. 配合物的稳定性
专题四 复习 分子空间结构与物质性质
分子构型与物质的性质 一、分子的空间构型
1. 杂化 原子形成分子时,同一原子中不同类型、能量相近 的原子轨道重新组合成一组新轨道的过程。 ⑴ 常 见 参与杂化的轨道 1个s+1个p 杂 2 杂化轨道数 化 成键轨道夹角 轨 180° 道 直线形 分子空间构型 的 比 BeCl2 实例 较: C2H2
1.下列有关杂化轨道的说法不正确的是 A.原子中能量相近的某些轨道,在成键时能重新组合成能 量相等的新轨道 B.轨道数目杂化前后可以相等,也可以不等 C.杂化轨道成键时,要满足原子轨道最大重叠原理、最小 排斥原理 D.杂化轨道只用于形成σ键或容纳未参加成键的孤电子对 2. 下列说法中,正确的是 A.PCl3分子是三角锥形,这是因为PCl3中的P原子以sp2杂 化的结果 B.sp3杂化轨道是由1个s轨道和3个p轨道混合形成的4个sp3 杂化轨道 C.凡中心原子采取sp3杂化的分子,其几何构型都是四面体 D.AB3的分子空间构型必为平面三角形
