燃烧学复习重点

第三章 着火和灭火理论
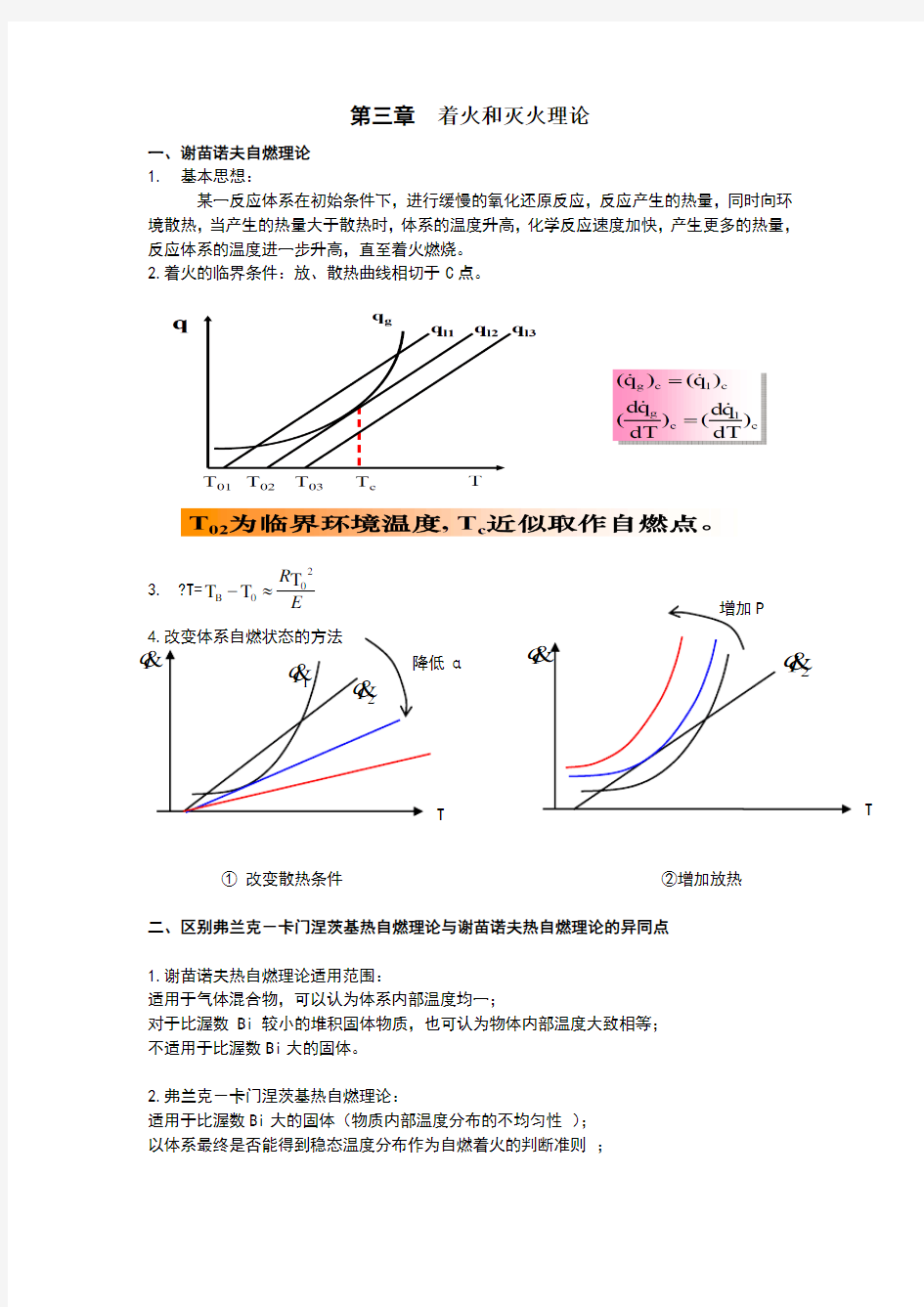
一、谢苗诺夫自燃理论 1. 基本思想:
某一反应体系在初始条件下,进行缓慢的氧化还原反应,反应产生的热量,同时向环境散热,当产生的热量大于散热时,体系的温度升高,化学反应速度加快,产生更多的热量,反应体系的温度进一步升高,直至着火燃烧。 2.着火的临界条件:放、散热曲线相切于C 点。
3.?T=E
R 2
0B T T T ≈-
① 改变散热条件 ②增加放热
二、区别弗兰克-卡门涅茨基热自燃理论与谢苗诺夫热自燃理论的异同点
1.谢苗诺夫热自燃理论适用范围:
适用于气体混合物,可以认为体系内部温度均一;
对于比渥数 Bi 较小的堆积固体物质,也可认为物体内部温度大致相等; 不适用于比渥数Bi 大的固体。
2.弗兰克-卡门涅茨基热自燃理论:
适用于比渥数Bi 大的固体(物质内部温度分布的不均匀性 ); 以体系最终是否能得到稳态温度分布作为自燃着火的判断准则 ;
T
q α
T
自燃临界准则参数 δcr 取决于体系的几何形状。 三、链锁自然理论 1.
反应速率与时间的关系 2.运用链锁自燃理论解释着火半岛现象 在第一、二极限之间的爆炸区内有一点P
(1)保持系统温度不变而降低压力,P 点则向下垂直移动
自由基器壁消毁速度加快,当压力下降到某一数值后,f < g, φ < 0 ----------------------第一极限
(2)保持系统温度不变而升高压力,P 点则向上垂直移动
自由基气相消毁速度加快,当压力身高到某一数值后,f < g, φ < 0 ----------------------第二极限
(3)压力再增高,又会发生新的链锁反应
导致自由基增长速度增大,于是又能发生爆炸。
3.基于f (链传递过程中链分支引起的自由基增长速率)和g (链终止过程中自由基的消毁速率 )分析链锁自燃着火条件
w 0w 123M HO M O H +→++?22??+→+OH O H H HO 222
a.在低温时, f 较小(受温度影响较大),相比而言,g 显得较大,故:
这表明,在
的情况下,自由基数目不能积累,反应速率不会自动加速,反应速率随着时间的增加只能趋势某一微小的定值,因此,f b.随着系统温度升高,f 增大,g 不变,在 时 因此,随着时间的增加,反应速率呈指数级加速,系统会发生着火 C.在 时, 反应速率随时间增加呈线性加速,系统处于临界状态 四、强迫着火 1.最小点火能:能在给定的可燃混气中引起着火的最小火花能 2.电极熄火距离 定义:不能引燃混合气的电极间的最大距离成为电极熄火距离。 五.灭火措施(注意两者差别) 1.基于热理论的灭火措施 (1)降低系统氧或者可燃气浓度; (2)降低系统环境温度; (3)改善系统的散热条件,使系统的热量更容易散发出去。 2.灭火措施总结 1. 降低系统着火温度。 2. 断绝可燃物。 3. 稀释空气中的氧浓度。 4. 抑制着火区内的链锁反应。 第四章 :可燃气体的燃烧 1.解释缓燃与爆震(预混气两种火焰传播形式)火焰传播机理 缓燃(正常火焰传播)火焰传播机理:依靠导热和分子扩散使未燃混合气温度升高,并进入反应区而引起化学反应,导致火焰传播 爆震(爆轰)火焰传播机理:传播不是通过传热、传质发生的,它是依靠激波的压缩作用使未燃混合气的温度不断升高而引起化学反应的,从而使燃烧波不断向未燃混合气中推进。 2.缓燃与爆震的特点 在爆震区经过燃烧后气体压力增加、燃烧后气体密度增加、燃烧以超音速传播(M ∞>1) 在缓燃区经过燃烧后气体压力减小或接近不变、气体密度减小、燃烧以亚音速进行(M ∞<1) 3.火焰前沿的定义 火焰前沿(前锋、波前):一层一层的混合气依次着火,薄薄的化学反应区开始由点燃的地方向未燃混合气传播,它使已燃区与未燃区之间形成了明显的分界线,称这层薄薄的化学反应发光区为火焰前沿(锋面)。 4.火焰位移速度及火焰法向传播速度 火焰位移速度是火焰前沿在未燃混合气中相对于静止坐标系的前进速度,其前沿的法向指向未燃气体。 火焰法向传播速度是指火焰相对于无穷远处的未燃混合气在其法线方向上的速度。 f g ?=-<0f g ?=- 5.可燃混气爆炸压力的计算 爆炸前:n1、T1、P1、V1, 爆炸后:n2、T2、P2、V2(=V1) 则有:P1V1=n1RT1,P2V1=n2RT2 两式相除得: 以乙醚为例: C4H10O +6 (O2+ = 4CO2 + 5H2O + 6× n1 = n2 = 爆炸时的升压速度 P —瞬时压力,Pa ;Sl —火焰传播速度,cm/s ;Kd —系数;K —系数,Cp/Cv=;t —时间,s 例:某容器中装有甲烷和空气预混气,体积为9L ,甲烷的体积浓度为%,爆炸前初温T1=298K ,初始压力P1=×105 Pa ,爆炸时温度为T2=2300K ,最大爆炸压力P2=×105 Pa ,甲烷火焰传播速度为Sl= cm/s ,热容比K=,求甲烷爆炸时平均升压速度。 解:甲烷燃烧反应式为: CH4+2O2+ CO2+2H2O+ n1=n2= (kmol) 由 得: 9MPa 9.0)25273(6.29)2500273(6.311.0112212=+?+??==T n T n P P 11 331P V t S P K P l d +=K T n T n T n T n K d ????? ??-????? ??=13411222 1122π(Pa/s) 12t P P v -=86.23454.112985.1023005.102985.1023005.1014.3341342 11222 1122=???? ??-?????? ??????=???? ? ??-????? ??=K T n T n T n T n K d π11 331P V t S P K P l d +=) (086.07.341001325.186.23459000)1001325.1100756.8(11)1(3355 53 3s S P K V P P t l d ≈?????-?= ??-= 平均升压速度为 第四章 爆炸极限的影响因素 (1)初始温度 爆炸性混合物的初始温度越高,则爆炸极限范围越大,即爆炸下限降低而爆炸上限增高 (2)初始压力 一般压力增大,爆炸极限扩大 ;压力降低,则爆炸极限范围缩小 待压力降至某值时,其下限与上限重合,将此时的最低压力称为爆炸的临界压力。若压力降至临界压力以下,系统便成为不爆炸 (3)惰性介质即杂质 若混合物中含惰性气体的百分数增加,爆炸极限的范围缩小,惰性气体的浓度提高到某一数值,可使混合物不爆炸 (4)容器 容器管子直径越小、爆炸极限范围越小。 (5)点火能源 火花的能量、热表面的面积、火源与混合物的接触时间等,对爆炸极限均有影响 7.莱—夏特尔公式的证明与应用 莱—夏特尔公式的证明如下: 指导思想:将可燃混合气体中的各种可燃气与空气组成一组,其组成符合爆炸下限时的比例,可燃混气与空气组成的总的混合气体为各组之和。 4.设各种可燃气体积为:V1,V2,V3,……,Vi 。则总的可燃气体积为V =V1+V2+V3+……+Vi 2)设各组可燃气—空气在爆炸下限时的体积为: V ’1,V ’2,V ’3,……,V ’I 则总的可燃混气—空气体积为 V ′= V ’1+V ’2+V ’3,……,V ’I 3)设各种可燃气爆炸下限为:x1下,x2下,x3下,…xi 下。则 4) (4)设总的可燃混气的爆炸下限为x 下。则有 ) /(12.8286.01001325.1100756.855s Pa v =?-?=100V'V ?i i i x = 下100V'V 3 3 3?= 下x 100V'V 1 1 1?=下x 100V 'V 2 2 2?= 下x 100x V V'i i i ?下 = 100x V V'111?下 =100x V V'22 2?下 = 100x V V'33 3?下 = % 100 /100/100/100/100 332211?+?+?+?+?=下下下下 i i x V V x V V x V V x V V 100%' V x V ?下= (5)设 证毕 例 题 1.可燃气体含C2H6 40%,C4H10 60%,取1m3该燃气与19m3空气混合。该混合气体遇明火是否有爆炸危险(C2H6和C4H10在空气中的爆炸上限分别为%、%,下限为%、%) 五、含有惰性气体的可燃混气爆炸极限的计算方法 如果可燃混气中含有惰性气体,如N2、CO2等,计算其爆炸极限时,仍然利用莱—夏特尔公式,但需将每种惰性气体与一种可燃气编为一组,将该组气体看成一种可燃气体成分。 比如:H2+N2, CO+CO2, CH4 该组在混合气体中的体积百分含量为该组中惰性气体和可燃气体体积百分含量之和。 而该组气体的爆炸极限可先列出该组惰性气体与可燃气的组合比值,再从图中查出该组气体的爆炸极限,然后代入莱—夏特尔公式进行计算。 %x P x P x P x P 100i i 332211下 下下下下 =+?+++x 100V V ?i i P =100V V 11 ?=P 100V V 2 2?=P 100V V 33?=P %0.2%1.6 60340100=+ =下x %9.7%8.56012.540100=+=上x 混合气中可燃气浓度:1/(1+19)=5% % < 5% < % 故,该混合气体遇火爆炸。 解: 乙烷:P1=40% 丁烷:P2=60% 图4-25 氢、一氧化碳、甲烷与氮、二氧化碳混合气体在空气中的爆炸极限 例4-1 求煤气的爆炸极限。煤气组成为:H2一%;CO 一%;CO2一%;O2一0%;CH4一%;N2一%。 解: 分组:CO2+H2;N2+CO ;CH4 CO2+H2: %+%=%; N2+CO :%+%=%; CH4:%。 从图4-25查得: H2+CO2组的爆炸极限为:%~70%; CO +N2组的爆炸极限为:40%~73%。 CH4的爆炸极限为:5%~15% 8. F-S-I 体系爆炸浓度极限图 以可燃气—氧气—氮气体系为例 5 .04.122.6H CO 22=% % =96 .13.274.53CO N 2=% % =% =下19%0 .57 .0407.800.66.18100 ++=x % =上53.70%15 7 .030.77.80706.18100 ++= x 例题:已知乙烯在氧气中的爆炸浓度极限为3~80%,氮气惰化时的爆炸临界点为(氧气10%,氮气87%,乙烯3%)。 (1)请绘出乙烯—氧气—氮气体系的爆炸浓度极限图。 (2)用图解法计算乙烯在空气中的爆炸浓度极限。 (3)在1m3的混合气(乙烯20%,其余为空气)中,至少掺入多少m3的氮气后遇明火不会爆炸。 (4)激波的形成过程;爆轰的发生过程、形成条件 A.激波的形成过程 同理,后面的压缩波的波速都将比前面的压缩波的传播速度快,不难想象,经过一段时间后,这些压缩波将会叠加在一起,波的能量也将迅速增大,即形成所谓的“激波” 。激波前后气体的参数(压力、温度、密度等)发生了显着的变化。 B.爆轰的发生过程 C.爆轰的形成条件 1.初始正常火焰传播能形成压缩扰动 2.管子要足够长或自由空间的预混气体积要足够大 3.可燃气浓度要处于爆轰极限范围内 4.管子直径大于爆轰临界直径 10.预防可燃气爆炸的方法 ①严格控制火源;②防止预混可燃气的产生; ③用惰性气体预防气体爆炸;④切断爆炸传播的途径。 11.湍流火焰区别于层流火焰的明显特征 火焰长度短,厚度较厚,发光区模糊,有明显噪音等 12.火焰高度随流速的变化 流速比较低时,处于层流状态,火焰高度随流速增加成正比提高,在流速比较高时,处于湍流状态,火焰高度几乎与流速无关。 例题:为什么1mol可燃气完全燃烧所需氧气摩尔数越大,扩散火焰高度越高答:1mol可燃气完全燃烧所需氧气摩尔数越大,则对氧气的需求就更加强烈,通过增加火焰高度以获得更充足的氧气供应。 第五章总结 1.根据液体燃料蒸发与汽化的特点,可将其燃烧形式分为 液面燃烧,灯芯燃烧,蒸发燃烧,雾化燃烧 2.蒸发热:在一定的温度和压力下,单位质量的液体完全蒸发所吸收的热量。液体蒸发过程中,高能量的分子离开液面进入空间,使剩余液体的内能越来越低,液体的温度会越来越低,欲使液体的温度保持不变,液体须从外界吸收能量。也即:要使液体处于恒温恒压下蒸发,液体须从外界吸收的能量。 液体蒸发吸热的原因:主要为了增加液体分子的动能以克服分子间引力而逃逸出液面,因此,分子间力大的液体,其蒸发热也越高;此外,蒸发热还用于气化时蒸气体积膨胀对外所做的功。 3.闪燃:这种在可燃液体上方,蒸气与空气的混合气体遇火源发生的一闪即灭的燃烧现象即称之为闪燃。 液体的闪点:在规定的实验条件下,液体表面能够产生闪燃的最低温度称为闪点。 4.同系物闪点的变化规律: (1)同系物闪点随分子量增加而升高; (2)同系物闪点随沸点的升高而升高; (3)同系物闪点随比重的增大而升高; (4)同系物闪点随蒸气压的降低而升高; (5)同系物中正构体比异构体闪点高。 5.自燃着火与自然点 自燃着火:没有火源作用,而靠外界加热而引起的着火现象 同系物的自燃点有以下规律: (1)同系物自燃点随分子量增加而减少。 (2)同系物中正构体比异构体自燃点低。 (3)饱和烃比相应的不饱和烃的自燃点高。 6.闪点计算(联系后面的温度极限) (1)根据波道查的烃类闪点公式计算 对于烃类可燃液体,其闪点服从波道查公式: 其中:t f 为闪点,t b 为沸点。 (2)根据道尔顿公式计算 根据爆炸极限的经验公式,当液面上方的总压为 P 时,可燃液体的闪点所对应的可燃液体的蒸气压 P f 为: 其中:N 为燃烧 1摩尔 可燃液体所需的氧原子数。 (3)根据可燃液体碳原子数计算 式中:n c 为可燃液体分子中的碳原子数 (4)利用可燃液体的爆炸下限计算 闪点(温度)时液体的蒸气浓度就是该液体蒸气的爆炸下限 L 液体的饱和蒸气浓度和蒸气压的关系为: 0.69473.7 f b t t =-1 4.76(1) f P P N = +-2(277.3)10410f c t n += 若已知爆炸下限L ,即可求出P f ,根据克劳修斯一克拉佩龙方程,求出该液体的闪点: (5)根据布里诺夫公式计算 P f —闪点温度下可燃液体的饱和蒸气压,Pa P —可燃液体蒸气与空气混合气体的总压,101325Pa D 0 —可燃液体蒸气在空气中于标准状态下的扩散系数,查表 β—燃烧1摩尔可燃液体所需的氧原子数 7.会利用爆炸温度极限判断可燃液体的爆炸温度危险性 爆炸温度极限 : 液面上方液体蒸气浓度达到爆炸浓度极限,混合气体遇火源就会发生爆炸。 (1)凡爆炸温度下限(t 下)小于最高室温的可燃液体,其蒸气与空气混合物遇火源均能发生爆炸; (2)凡爆炸温度下限(t 下)大于最高室温的可燃液体,其蒸气与空气混合物遇火源均不能发生爆炸; (3)凡爆炸温度上限(t 上)小于最低室温的可燃液体,其咆和蒸气与空气的混合物遇火源不发生爆炸,其非饱和蒸气与空气的混合物遇火源有可能发生爆炸。 爆炸温度极限的计算 爆炸温度下限为液体的闪点,其计算与闪点计算相同 爆炸温度上限的计算,可根据已知的爆炸浓度上限值计算相应的饱和蒸气压,然后用克劳修斯一克拉佩龙方程等方法计算出饱和蒸气压所对应的温度,即为爆炸温度上限。 5.油池火d(容器直径)与v(燃烧速度)的关系 当d 很小的时候,有v 与d 近似成反比的关系;当d 很大时,有vl 与d 近似无 100% 100 f f P LP L P P = ?= ' 303.2lg C RT L P V +-=0f AP P D β = 关系。 9.引燃着火及着火点;引燃的着火条件;灯芯点火的原理 可燃液体的着火方式:引燃(点燃)和自燃 引燃(点燃):可燃液体的蒸汽与空气的混气在一定的温度条件下,与火源接触发生连续燃烧现象 燃点:发生引燃着火的最低温度。 灯芯点火的原理: 由于毛细现象,灯芯将可燃液体吸附到灯芯中,由于灯芯比热小,灯芯上液体的热对流运动被限制,因此容易用小火焰加热,使得灯芯上的可燃液体被加热到燃点以上温度而被点燃,同时灯芯周围的液体被加热,表面张力平衡被破坏,从而使得液体产生回流,即在液体表面上产生一个净的作用力,驱使热流体离开受热区,而液面以下临近的冷流体则流向加热区。 10.影响液体燃烧速度的因素;液体自燃的原因;有机化合物自然点变化的规律 影响液体燃烧速度的因素:1.液体的初温影响2.容器直径大小的影响3.容器中液体高度的影响4.液体中的含水量的影响 5.有机同系物液体密度的影响6.风的影响 11.液体的稳定燃烧;影响液体燃烧速度的因素 可燃液体一旦着火并完成液面上的传播过程之后,就进入稳定燃烧的状态。因素:1.液体的初温影响;2.容器直径大小的影响;3.容器中液体高度的影响 12.点源法计算火焰辐射 13.沸溢及形成条件;喷溅及其发生条件和危害 在热波向液体深层运动时,由于热波温度远高于水的沸点,因而热波会使油品中的乳化水气化,形成油包气的气泡,即油的一部分形成了含有大量蒸气气泡的泡沫,使液体体积膨胀,向外溢出,使液面猛烈沸腾起来,就象“跑锅”一样。这种现象叫沸溢。 沸溢形成必须具备三个条件:(1)原油具有形成热波的特性,即沸程宽,比重相差较大; (2)原油中含有乳化水,水遇热波变成蒸气; (3)原油粘度较大,使水蒸气不容易从下向上穿过油层。如果原油粘度较低,水蒸气很容易通过油层,就不容易形成沸溢。 喷溅现象(扬沸) 原油中的水以水垫形式存在 随着燃烧的进行,热波的温度逐渐升高,热波向下传递的距离也加大 当热波达到水垫时,水垫的水大量蒸发,蒸气体积迅速膨胀,以至把水垫上面的液体层抛向空中,向罐外喷射。这种现象叫喷溅。 喷溅发生的征兆 出现油面蠕动、涌涨现象;火焰增大、发亮、变白;出现油沫2~4次; 烟色由浓变淡,发生剧烈的“嘶!嘶!”声等。 金属油罐会发生罐壁颤抖,伴有强烈的噪声(液面剧烈沸腾和金属罐壁变形所引起的);烟雾减少,火焰更加发亮,火舌尺寸更大,火舌形似火箭。 喷溅的危害 当油罐火灾发生喷溅时,能把燃油抛出70~120m 。不仅使火灾猛烈发展,而且严重危及扑救人员的生命安全,因此,应及时组织撤退,以减少人员伤亡。 宽沸程液体热波形成机理 火灾形成后火焰加热液面;液面液体蒸发,低沸点液体先蒸发,高沸点组份形成高温重质微团;高温重质微团下沉,对流换热,将热量向下传递,形成热波。 14. 第六章 可燃固体的燃烧 1固体燃烧的形式 (1)蒸发燃烧 (2)表面燃烧(3)分解燃烧(4)熏烟燃烧(阴燃) (5)动力燃烧(爆炸) 2评定固体火灾危险性的参数 (1)熔点、闪点和燃点 熔点越低的可燃固体,闪点和燃点也越低,火灾危险性越大; (2)氧指数 氧指数是指刚好维持物质燃烧时的混合气体中最低氧含量的体积百分数。氧指数越小的高聚物,燃烧时对氧的需求量越(或者说燃烧时受氧气浓度的影响越小),因而火灾危险性越大。 氧指数小于22的属易燃材料;氧指数在22-27之间的属难燃材料;而氧指数大于27的属 直径平方定律 122t K d d s -= 高难燃材料。 3、固体着火燃烧理论 固体引燃条件和引燃时间 (1) 如果S<0,固体不能被引燃或只能发生闪燃; 如果S>0,固体表面接受的热量除了能维持持续燃烧,还有多余部分。这部分热量可以使可燃气的释放速率进一步提高,为固体持续燃烧创造更好的条件; S=0固体能否被引燃的临界条件。 ※(2)薄片状固体引燃时间计算(计算题,考的可能性很大) 假设一薄物体的厚度、密度、热容和它与周围环境间的对流换热系数分别为τ、ρ、c 、和h ; 薄物体的燃点和环境温度(或物体初温)分别为 T i 和T 0。 a 物体两边同时受温度为T ∞的热气流加热 b 果物体单面受热,另一面绝热,引燃时间为 c 果物体单面受热,另一面不绝热 d 体一面受热通量为的辐射加热,另一面绝热时 e 果一面受辐射热,另一面不绝热,则有 4高聚物燃烧的普遍性特点 (1)发热量较高、燃烧速度较快(2)发烟量较大,影响能见度(3)燃烧(或分解)产物的危害性大 5木材燃烧大体分为有焰燃烧和无焰燃烧两个阶段。 木材有焰燃烧: 木材热分解出的可燃气燃烧,它的特点是燃烧速度快;燃烧量大,约占整个木材重量的70%火焰温度高,燃烧时间短,火灾发展速度猛烈,是火灾发展中的有决定性意义的时期。(为什么说有焰燃烧是火灾发展中的有决定性意义的时期) 6阴燃:固体物质无可见光的缓慢燃烧,通常产生烟和伴有温度升高 阴燃的结构分为三个区域 区域1热解区 区域2:碳化区 区域3:残余区/碳区 (书P248) 7阴燃向有焰燃烧的转变 (—)阴燃从材料堆垛内部传播到外部时转变为有焰燃烧 (二)加热温度提高,阴燃转变为有焰燃烧 ()0≥-+?-??=l E cr V C Q Q G L H S &&????? ??--?=∞∞i i T T T T h c t 0ln 2τρ??? ? ??--?=∞∞i i T T T T h c t 0ln τρ??? ? ??-+-?=∞∞i i T T T T T h c t 2ln 00τρ()?? ????--?=0''''ln T T h Q Q h c t i r r i &&αατρ()??????--?=0' '''2ln 2T T h Q Q h c t i r r i &&αατρ (三)密闭空间内材料的阴燃转变为有焰燃烧(甚至轰燃)8粉尘爆炸的条件 a 粉尘本身必须是可燃的 b 粉尘以一定的浓度悬浮于空气中 c 存在足够的引起粉尘爆炸的火源 9粉尘爆炸的特点(与气体爆炸相比) a点火能大 b感应期长,可达数十秒 c爆炸压力和升压速度小于气体爆炸 d “二次爆炸”(为什么有二次爆炸且危害大) (1)初次爆炸的冲击波有扬尘作用 (2)离爆炸点越远,破坏越严重 e烟气中CO浓度高,毒性大 10.粉尘爆炸的危害 6.粉尘爆炸具有连续性,即会产生二次爆炸 7.粉尘爆炸具有跳跃性,表现在离起爆点越远,破坏越严重 8.粉尘爆炸容易引起不完全燃烧
