溶液表面吸附的测量
固体在溶液中的吸附

综合化学实验安徽师范大学2007年度校级精品课程1固体在溶液中的吸附一目的要求1.掌握测量固体在溶液中吸附作用的方法和技能。
2.推算活性碳的吸附量及比表面积。
二实验原理吸附能力的大小常用吸附量Г表示(有时也用q)。
吸附量Г指每克吸附剂吸附溶质的物质的量。
弗罗因德利希(Freundlich)从吸附量和平衡浓度的关系曲线得出经验方程:1jnkcmΓ= = g (1)式中,n 表示吸附溶质的物质的量(mol);m 表示吸附剂的质量(g);c 表示吸附平衡时溶液的浓度(mol/L);k,j 表示经验常数,由温度、溶剂、吸附质与吸附剂的性质决定。
将式(1)取对数得:1lg lg c lg kjΓ= + (2)以lgΓ对lgc作图可得一直线,由直线的斜率和截距可求得j 和k。
实验表明在一定浓度范围内,活性炭对有机酸的吸附符合朗格缪尔(Langmuir)吸附方程:KC Γ1KC ∞Γ=+(3)式中,Г表示吸附量,通常指单位质量吸附剂上吸附溶质的摩尔数;Г∞表示饱和吸附量;C表示吸附平衡时溶液的浓度;K为常数。
将(3)式整理可得如下形式:C1 1CΓK Γ∞∞=+Γ(4)作C/Г-C图,得一直线,由此直线的斜率和截距可求Г∞和常数K。
如果用醋酸作吸附质测定活性炭的比表面时,按照Langmuir 单分子层吸附模型,假定吸附质分子在吸附剂表面上是直立的,利用活性炭在醋酸溶液中吸附作用可测定活性炭的比表面积(S0)。
可按下式计算:S0=Г∞×6.023×1023×2.43×10-19(4)式中,S0 为比表面(m2·kg-1);Г∞为饱和吸附量(mol·kg-1);6.023×1023为阿佛加德罗常数;2.43×10-19为每个醋酸分子所占据的面积(m2)。
式(3)中的吸附量Г可按下式计算()VmC C Γ−= 0 (5)式中,C0 为起始浓度;C 为平衡浓度;V 为溶液的总体积(dm3);m 为加入溶液中吸附剂质量(g)。
溶液吸附法测定固体比表面积

2 -1 2 -1
次甲基蓝原始溶液 2g·dm ;次甲基蓝标准溶液 0.1g·dm ;颗粒活性炭。 三、实验步骤 1.活化样品 将活性炭置于瓷坩埚中放入 500℃马福炉中活化 1h(或在真空箱中 300℃活化 1h), 然后 置于干燥器中备用。 2.溶液吸附 取 50mL 带塞锥形瓶 5 只,分别准确称取活化过的活性炭约 0.1g,按照下表给出的比例 配制不同浓度的次甲基蓝溶液 50mL,塞上包有锡纸的软木塞,然后放在振荡器上振荡 3h。 编号 V(次甲基蓝溶液)/mL V(蒸馏水)/mL 3.配制次甲基蓝标准溶液 用台称分别称取 2g、4g、6g、8g、11g 浓度为 0.3126×10 mol·dm 的标准次甲蓝溶液 于 100mL 容量瓶中,用蒸馏水稀释至刻度,待用。 4.原始溶液的稀释 为了准确测定原始溶液的浓度,在台称上称取浓度为 0.2%的原始溶液 2.5g 放入 500mL 容量瓶中,稀释至刻度。 5.平衡液处理 样品振荡 3h 后,取平衡溶液 5mL 放入离心管中,用离心机旋转 10min,得到澄清的上 层溶液。分别取 5g 澄清液放入 500mL 容量瓶中,并用蒸馏水稀释到刻度。 6.选择工作波长 用某一待用标准溶液,以蒸馏水为空白液,在 600nm~700nm 范围 内测量吸光度,以最 大吸收时的波长作为工作波长。 7.测量吸光度。 在工作波长下, 依次分别测定五个标准溶液的吸光度, 以及稀释以后的原始溶液及平衡 溶液的吸光度。 四、注意事项 1.标准溶液的浓度要准确配制,原始溶液及吸附平衡后溶液的浓度都应选择适当的范围, -3 -3 本实验原始溶液的浓度为 2g·dm 左右,平衡溶液的浓度不小于 1g·dm 。 2.活性炭颗粒要均匀,且五份称重应尽量接近。 3.振荡时间要充足,以达到吸附饱和,一般不应小于 3h。 五、数据处理 1.把数据填入下表 稀释后原始溶液的吸光度:1.332 标准溶液 A 平衡溶液 A 标准溶液称 取量 浓 度 /(mol/L) 2g 0.289 1 2.121 2.作 A—C 工作曲线。 2g 0.0626 4g 0.125 6g 0.188 8g 0.25 11g 0.344 4g 0.662 2 0.466 6g 1.257 3 0.137 8g 1.672 4 0.118 11g 1.999 5 0.044
溶液的表面吸附
s s A s A
G = n µ + n µ + Aγ
s s A s A s B s B
s A s A s B s B s B s B
dG = n dµ + µ dn + n dµ + µ dn + γdA + Adγ
表面热力学基本关系式: 表面热力学基本关系式
dG = − S dT + V dp + µ dn + µ dn
代入吉布斯等温吸附式 b′γ 0 a2 Γ2 = ⋅ ' RT K + a2 Ka2 Γ2 = Γ∞ ⋅ 1 + Ka2
两亲分子在气液界面上的定向排列
根据实验, 根据实验,脂肪酸在水中的浓度达到一定数值 后,它在表面层中的超额为一定值,与本体浓度无 它在表面层中的超额为一定值, 关,并且和它的碳氢链的长度也无关。 并且和它的碳氢链的长度也无关。 这时, 这时,表面吸附已达到 饱和,脂肪酸分子合理的 饱和, 排列是羧基向水, 排列是羧基向水,碳氢链向 空气。 空气。
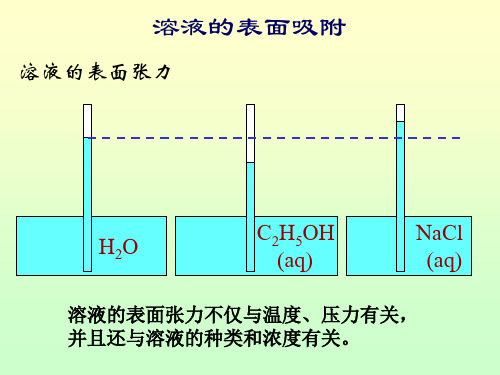
溶液的表面吸附
溶液的表面张力
H 2O
C2H5OH (aq)
NaCl (aq)
溶液的表面张力不仅与温度、压力有关, 溶液的表面张力不仅与温度、压力有关, 并且还与溶液的种类和浓度有关。 并且还与溶液的种类和浓度有关。
溶质对表面张力的影响
1.
d γ / dc > 0
非表面活性物质 无机盐、不挥发酸碱
γ
n dµ + n dµ + Adγ = 0
s A s A s B s B
溶液相, 由吉布斯-杜亥姆方程 溶液相 由吉布斯 杜亥姆方程 Gibbs-Duhem equation
中科大物理化学实验十二:溶液中的吸附作用和表面张力的测定

图2
5
6、连接橡皮管。
如毛细管的半径为 r,气泡由毛细管口逸出时受到向下的总作用力为r2P 最大,而
P 最大=P 系统-P 大气压
hg
式中,h-数字式微压差测量仪上的读数 g-重力加速度
-压力计内液体的密度
气泡在毛细管上受到表面张力引起的作用力为 2r。气泡自毛细管口逸出时,上述两种力
看作相等,即:
r 2 P最大 r 2hg
(5)
r hg
2
(6)
若用同一只毛细管和压力计,在同一温度下,对两种溶液而言,则得:
1 h1 2 h2
1
2 h2
h1
K' h1
(7)
式中 K' 为毛细管常数。 用已知表面张力2 的液体为标准,从(7)式可求出其他液体的表面张力1。
线的斜率 B ( ( c )T )代入 Gibbs 吸附公式,可以求出不同浓度时气
-液界面上的吸附量。
在一定温度下,吸附量与溶液浓度之间的关系由 Langmuir 等
温方程式表示:
K C
1 K C
(2)
图 1 正丁醇水溶液的表面
张力与浓度的关系图
为饱和吸附量,K 为经验常数,与溶质的表面活性大小有关。
将(3)式化成直线方程,则
CC 1
(3)
物理化学 溶液吸附法测定固体物质的比表面
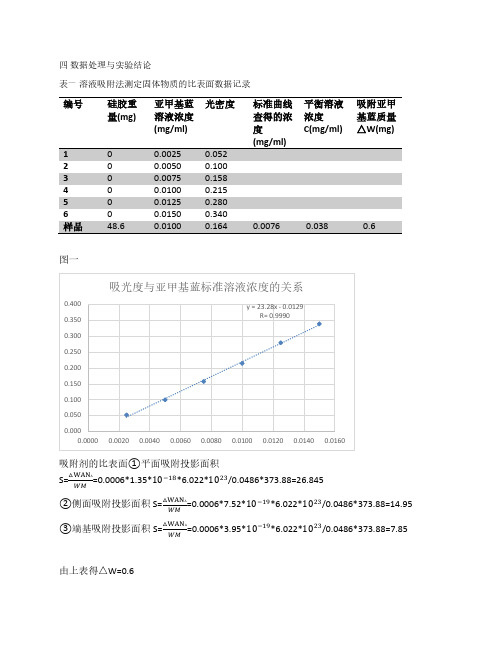
四 数据处理与实验结论表一 溶液吸附法测定固体物质的比表面数据记录编号硅胶重量(mg)亚甲基蓝溶液浓度(mg/ml) 光密度标准曲线查得的浓度平衡溶液浓度C(mg/ml) 吸附亚甲基蓝质量△W(mg) 2 0 0.0050 0.100 3 0 0.0075 0.158 4 0 0.0100 0.215 5 00.0125 0.280 图一吸附剂的比表面①平面吸附投影面积S=△WAN AWM=0.0006*1.35*10−18*6.022*1023/0.0486*373.88=26.845②侧面吸附投影面积 S=△WAN AWM =0.0006*7.52*10−19*6.022*1023/0.0486*373.88=14.95 ③端基吸附投影面积S=△WAN AWM=0.0006*3.95*10−19*6.022*1023/0.0486*373.88=7.85由上表得△W=0.6五.实验讨论实验中测定吸光度与标准溶液的浓度的关系时得到吸光度与浓度的标准工作曲线y = 23.28x - 0.0129 R= 0.9990≈1 所以曲线拟合性较好。
六.思考题1公式(9-1)的应用要求的条件?测量比表面较大的试样所得的结果较为满意2产生实验结果的偏差荡后吸取清液时为什么不能吸取上硅胶?实验要测量的是硅胶吸附后的甲基蓝溶液的浓度,吸上硅胶可能会导致硅胶中的甲基蓝重新析出,影响光密度和实验结果。
3比表面的测定与温度,吸附质的浓度,吸附平衡的时间有什么关系?温度高时吸附量低,反而吸附量高,吸附质的浓度至少要能满足吸附剂达到饱和吸附时所需的浓度但溶液不能太浓,否则会出现多层吸附震荡要达到饱和吸附时所需时间,吸附剂颗粒大小不要相差太大。
4亚甲基蓝吸附投影面积A对测定比表面有什么影响?如何测定?S=△WAN A亚甲基蓝吸附吸附于吸附剂上有三种取向,平面吸附投影侧面吸附投影端基吸附WM投影。
不同投影方式有不同的面积,从而影响比表面。
溶液表面吸附量的测定24页文档

谢谢
11、越是没有本领的就越加自命不凡。——邓拓 12、越是无能的人,越喜欢挑剔别人的错儿。——爱尔兰 13、知人者智,自知者明。胜人者有力,自胜者强。——老子 14、意志坚强的人能把世界放在手中像泥块一样任意揉捏。——歌德 15、最具挑战性的挑战莫过于提升自我。——迈克尔·F·斯特利
溶液表面吸附量的测定
1、合法而稳定的权力在使用得当时很 少遇到 抵抗。 ——塞 ·约翰 逊 2、权力会使人渐渐失去温是令人反感 ;权力 不易确 定之处 始终存 在着危 险。— —塞·约翰逊 4、权力会奴化一切。——塔西佗
5、虽然权力是一头固执的熊,可是金 子可以 拉着它 的鼻子 走。— —莎士 比
正丁醇表面吸附量查表
正丁醇表面吸附量一、背景介绍正丁醇(n-Butanol)是一种重要的有机溶剂,广泛应用于化学、医药、印刷等多个领域。
正丁醇的表面吸附量是研究其物理性质和应用性能的关键参数之一。
本文将探讨正丁醇表面吸附量的相关知识和其影响因素。
二、正丁醇表面吸附量测定方法2.1 静态吸附法静态吸附法是最常用的正丁醇表面吸附量测定方法之一。
其具体步骤如下: 1. 准备一定浓度的正丁醇溶液。
2. 将待测材料(如固体表面、液体界面)与正丁醇溶液接触。
3. 经过一段时间后,将材料与溶液分离,测定被固定在材料上的正丁醇质量。
4. 通过质量差计算正丁醇的表面吸附量。
2.2 动态吸附法动态吸附法是另一种常用的正丁醇表面吸附量测定方法,其原理是通过流体的冲刷,使溶液中的正丁醇与待测材料发生接触和吸附,然后测定出流体中正丁醇的浓度变化,从而计算表面吸附量。
三、影响正丁醇表面吸附量的因素3.1 温度温度是影响正丁醇表面吸附量的重要因素之一。
一般来说,随着温度升高,正丁醇的表面吸附量会减少。
这是因为随着温度的升高,分子热运动加剧,溶质分子与材料表面的相互作用减弱,导致吸附量下降。
溶液的pH值也对正丁醇的表面吸附量有一定影响。
一般来说,在中性或弱酸性条件下,正丁醇的表面吸附量较高。
这是因为在这种条件下,溶液中的正丁醇分子能与材料表面产生较强的相互作用,从而增加吸附量。
3.3 材料特性材料的表面特性也是影响正丁醇表面吸附量的重要因素。
例如,材料的表面活性、表面粗糙度、化学性质等都会影响正丁醇与材料表面的相互作用力,进而影响吸附量的大小。
不同的材料表面对正丁醇的吸附性能有所差异。
3.4 正丁醇浓度正丁醇浓度也是影响其表面吸附量的重要因素之一。
一般来说,随着溶液中正丁醇浓度的增加,其表面吸附量也会增加。
这是因为溶液中正丁醇分子的浓度越高,与材料表面相互作用的机会就越多,导致吸附量增加。
四、正丁醇表面吸附量的应用4.1 传感器正丁醇表面吸附量的变化可用于传感器的设计和制备。
表面活性剂水溶液动态表面张力的测定及吸附动力学
表面活性剂水溶液动态表面张力的测定及吸附动力学一、实验目的1. 熟悉滴体积法测定溶液动态表面张力的方法2. 掌握从动态表面张力数据研究吸附动力学规律的一般方法二、实验原理处于吸附平衡状态的表面活性剂溶液,其本体相与表面层具有不同的组成。
现突然使表面迅速扩展,一部分本体溶液被迫进入表面层。
若表面面积增大的速率足够快,则在表面刚扩展时,表面层与体相有相同或相近的组成,但这不是平衡态。
随后会进行表面活性剂分子从本体相向表面层的扩散,经若干时间后到达新的吸附平衡状态,该过程称为松弛作用(relaxation). 对于发生正吸附的表面活性剂水溶液,松弛过程中溶液的表面张力随时间而降低,其系列数值称为动态表面张力(Dyn amic surface ten sio n) ,换言之,表面活性剂溶液的动态表面张力是指处在非平衡状态的表面在向平衡态趋近时其表面张力随时间而发生的变化。
这种表面张力随时间的变化由以下两个因素控制。
第一,在表面层与亚表面区( 表面下紧挨表面的一薄层本体相溶液)之间表面活性剂分子的交换;第二,在亚表面区与本体相之间通过扩散所进行的表面活性剂分子交换。
如果表面活性剂分子在表面层与亚表面区之间的交换比扩散要快得多(交换能瞬时完成) ,则在动态表面张力向其平衡值趋近的整个期间,表面层与亚表面区之间实际上是处在平衡状态。
在且仅在这种情况下,可以在表面层与亚表面区之间应用吉布斯(Gibbs) 吸附等温式将吸附量与表面张力通过一定的状态方程相联系。
此时吸附属扩散控制机理。
反之,若表面活性剂分子在表面层与亚表面区之间的交换比扩散要慢,则可以假设亚表面区与体相的组成相同。
在这种情况下,表面层在整个表面陈化过程中都不与亚表面区处于平衡态,吉布斯公式不能用。
此时吸附过程受表面层与亚表面区间分子的交换速度所控制,属迁移控制机理。
介于这两种极端情况之间的所有中间状态,由于表面层与亚表面区之间不是处于平衡状态,吉布斯公式也不能用,其吸附过程受各种动力学因素所制约。
实验十八溶液吸附法测定固体的比表面积一、目的1用次甲基蓝水溶液
一、目的1.用次甲基蓝水溶液吸附法测定颗粒活性炭的比表面积2.了解Langmuir 单分子层吸附理论3.了解溶液法测定比表面的基本原理二、原理根据光吸收定律,当入射光为一定波长的单色光时,其溶液的吸光度与溶液中有色物质的浓度及溶液层的厚度成正比式中A 为吸光度,I 0为入射光强度,I 为透射光的强度,a 为吸光系数,l 为光径长度或液层厚度,c 为溶液的浓度。
实验表明,次甲基蓝溶液在可见区有两个吸收峰:445nm 和665nm ,但在445nm 处活性炭吸附对吸收峰有很大的干扰,故本实验选用的工作波长为665nm 。
水溶性染料的吸附已应用于测定固体比表面,在所有的染料中次甲基蓝具有最大的吸附倾向,研究表明,在一定浓度范围内,大多数固体对次甲基蓝的吸附是单分子层吸附,符合Langmuir 吸附理论。
设固体表面的吸附位总数为N ,覆盖度为θ,溶液中吸附质的浓度为c ,则有:吸附质分子(在溶液) 吸附质分子(在固体表面)吸附速率解吸速率当达到动态平衡时所以式中称为吸附平衡常数,a 逾大,固体对吸附质的吸附能力逾强。
若以Γ表示浓度c 时的平衡吸附量,以Γ∞表示全部吸附位被占据的单分子层吸附量,即饱和吸附量,则代入(18-1)式有变为直线形式可得吸附 k 1 解吸 k -1 A I I a l c ==lg 0 r k N c r k N a d =-=-111()θθ实验十八 溶液吸附法测定固体的比表面积Γ Γ ∞ Γ ∞ Γ Γ Γ ∞ Γ ∞作c /Γ~c 图,从其斜率可求得Γ∞,再结合截距便得到k 吸 ,Γ∞指每克吸附剂饱和吸附吸附质的物质的量,若每个吸附质分子在吸附剂上所占据的面积为σA ,则吸附剂的比表面(s )可以按下式计算式中L 为Avogadro 常数。
次甲基蓝是一个具有矩形结构的分子:阳离子的大小为17.0×7.6×3.25×10-30m 3,次甲基蓝的吸附有三种取向:平面吸附投影面积为135×10-20m 2,侧面吸附投影面积为75×10-20m 2,端基吸附投影面积为39 ×10-20m 2,对于非石墨型的活性炭,次甲基蓝是以端基吸附取向,吸附在活性炭表面,因此σA =39×10-20m 2。
固体比表面积的测定——溶液吸附法
固体比表面积的测定——溶液吸附法一、目的要求1. 学会用次甲基蓝水溶液吸附法测定活性炭的比表面积。
2. 了解郎缪尔单分子层吸附理论及溶液法测定比表面积的基本原理。
二、基本原理溶液的吸附可用于测定固体比表面积。
次甲基蓝是易于被固体吸附的水溶性染料,研究表明,在一定浓度范围内,大多数固体对次甲基蓝的吸附是单分子层吸附,符合郎缪尔吸附理论。
郎缪尔吸附理论的基本假设是:固体表面是均匀的,吸附是单分子层吸附,吸附剂一旦被吸附质覆盖就不能被再吸附;在吸附平衡时候,吸附和脱附建立动态平衡;吸附平衡前,吸附速率与空白表面成正比,解吸速率与覆盖度成正比。
设固体表面的吸附位总数为N ,覆盖度为θ,溶液中吸附质的浓度为c ,根据上述假定,有吸附速率: r 吸 = k 1N (1-θ)c (k 1为吸附速率常数) 脱附速率: r 脱 = k -1N θ (k -1为脱附速率常数)当达到吸附平衡时: r 吸 = r 脱 即 k 1N (1-θ)c = k -1N θ由此可得: c K cK 吸吸+=1θ (2-25-1)式中K 吸=k 1/k -1称为吸附平衡常数,其值决定于吸附剂和吸附质的性质及温度,K 吸值越大,固体对吸附质吸附能力越强。
若以Γ表示浓度c 时的平衡吸附量,以Γ∞表示全部吸附位被占据时单分子层吸附量,即饱和吸附量,则: θ =Γ /Γ∞带入式(2-25-1)得 cK cK 吸吸+=∞1ΓΓ (2-25-2)整理式(2-25-2)得到如下形式c K c∞∞+=ΓΓΓ11吸 (2-25-3)作c /Γ~c 图,从直线斜率可求得Γ∞,再结合截距便可得到K 吸。
Γ∞指每克吸附剂对吸附质的饱和吸附量(用物质的量表示),若每个吸附质分子在吸附剂上所占据的面积为σA ,则吸附剂的比表面积可以按照下式计算S =Γ∞L σA (2-25-4)式中S 为吸附剂比表面积,L 为阿伏加德罗常数。
次甲基蓝的结构为:阳离子大小为17.0 ×7.6× 3.25 ×10-30 m3次甲基蓝的吸附有三种取向:平面吸附投影面积为135×10–20m 2,侧面吸附投影面积为75×10–20m 2,端基吸附投影面积为39×10–20m 2。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溶液表面吸附的测量
溶液表面吸附的测量
实验日期:20 年月日
姓名:学号:班级:
一、实验目的
(1)掌握最大气泡压力法测定溶液表面张力的原理和方法。
(2)根据吉布斯(Gibbs )吸附方程式,计算溶质(乙醇)在单位溶液表面的
吸附量Γ,并作Γ-c 图。
二、实验原理
在定温下,纯物质液体的表面层与本体(内部)组成相同,根据能量最低原理,为降低体系的表面吉布斯自由能,将尽可能地收缩液体表面。
对溶液则不同,加入溶质后,溶剂表面张力发生变化,根据能量最低原理,若加入的溶质能降低溶剂表面张力时,则溶质在表面层的浓度比在溶液本体的浓度大,反之,若溶质使溶剂表面张力升高,溶质在表面层的浓度小于在溶液本体中的浓度。
溶质在溶液表面层与在溶液本体中浓度不同的现象称为溶液的表面吸附,即溶液借助于表面吸附来降低表面吉布斯自由能。
溶液表面吸附溶质的量Γ与表面张力σ、浓度c 有关,其关系符合Gibbs 吸附方程
式中:Γ吸附量;c 溶液浓度;T 温度;R 气体常数;σ表面张力或表面吉布斯自由能。
表示在一定温度下,表面张力随浓度的变化率。
如果溶液表面张力随浓度增加而减
小,即0,此时溶液中溶质在表面层中的浓度大于在溶液本体中的浓度,
称为正吸附。
如果>0,则Γ
在一定温度下,测定不同浓度溶液的表面张力σ,以σ对c 作图,求不同浓度时的值。
由Gibbs 吸附方程求各浓度下的吸附量Γ。
将待测液体装入表面张力仪中,使玻璃毛细管下端与液面相切,若液体能润湿管壁,则液体沿毛细管上升形成凹液面,其液面所受压力
为大气压力P 0和附加压力ΔP 。
根据拉
普拉斯(Laplace )方程:
式中:r 为弯曲液面曲率半径;σ为液体与气体表面(界面)张力。
因是凹液面,弯曲液面的曲率半径r
图C22.1 实验装置示意图
图C22.2 毛细管口示意图
当打开漏斗的活塞,让水缓慢滴入下面密封的加压瓶中时,毛细管内液面上受到比毛
细管外液面上更大的压力,毛细管内液面开始下降。
当此压力差在毛细管上面产生的作用
稍大于毛细管口液体的表面张力所能产生的最大作用时,气泡就从毛细管口逸出,如图
C22.2所示。
气泡逸出前能承受的最大压力差为ΔP max ,可以用微压差测量仪测出。
根
据拉普拉斯方程,毛细管内凹液面的曲率半径等于毛细管的半径r 时,能承受的压力差最大。
则有
测定毛细管的半径r 和ΔP max 即可求得液体表面张力σ。
直接测定毛细管半径r
容易带入较大的误差,可用同一支毛细管,在相同条件下分别测出已知表面张力为σ1的
参考液体的ΔP max,1和待测液体的ΔP max ,由上式得
,可求出其它液体的表面张力σ。
三、实验步骤
1) 配制溶液:使用0.01g 或更高精度的电子天平称取无水乙醇,加入到容量瓶中,
加水至刻度。
配制浓度0.5~6.0 mol·dm 的乙醇水溶液,浓度分布如表所示。
2) 按图1所示检查安装仪器。
将恒温水通入表面张力仪内,调节恒温槽至设定温度,设定温度应比室温高约5℃,且能查到该温度下纯水的表面张力值。
3) 在洗净的表面张力仪中加入适量去离子水,通恒温水10min 以上。
通过表面张力
仪下部的活塞调节液面高低,使得放入毛细管,旋紧橡皮塞时,玻璃毛细管下端刚好与液
面相切。
4) 将毛细管与乳胶管断开,将毛细管内外处理干净(用吹气法),将毛细管放入表
面张力仪,缓慢旋紧橡皮塞,使毛细管下端刚好与液面相切。
使微压差测量仪通大气,按
一下“置零”按钮,然后轻轻将毛细管与乳胶管连接上。
5) 缓缓打开漏斗的活塞,使水慢慢滴下,毛细管上面压力逐步增大,当毛细管下端
气泡稳定形成(约5~10s
出一个气泡)后,从微压差测量仪上读取压力差最大值。
读三次,计算时取平均值。
6) 用上述方法,将表面张力仪中的去离子水换为不同浓度待测的乙醇水溶液,测得各溶液的
值。
注意:每次更换溶液时,用待测溶液涮洗表面张力仪3次。
将毛
-3
细管与乳胶管断开,将毛细管内外残留的上次液体去除干净。
每次更换溶液后,在表面张力仪中应恒温10min 以上,为了节省时间,可先将盛待测溶液的磨口塞锥形瓶放入恒温槽内恒温,恒温后的溶液放入表面张力仪后再恒温3min 。
7) 实验完毕,洗净玻璃容器。
四、数据处理
恒温槽温度:28℃
如表所示,记录去离子水、各浓度的乙醇-水溶液的浓度、面张力,计算不同浓度乙醇水溶液的表面张力。
用Origin 作
、恒温温度,查出水的表曲线。
80
s u r f a c e t e n s i o n (m N /m )
60
40
concentration (mol/dm3)
对拟合曲线求导,得到切线斜率吸附量Г的值,作Г-c 曲线。
由,可以得到不同浓度溶液的
0.006
Γ(m o l /m 2)
0.003
0.000
c(mol/L)
曲线在各浓度点的吸附量Г:
五、思考题
(1)实验前为什么一定要确保表面张力仪和玻璃毛细管的洁净?
答:如果毛细管洗涤不干净,可能使实际测量溶液浓度偏差,对表面张力值产生影响,且气泡生成速率可能不稳定,影响压力的变化速率,压差计读数不稳定,影响测量。
(2)为什么不直接测量毛细管的半径,而用标定的办法?
答:毛细管半径太小,且测量起来不方便;直接测定毛细管半径r 容易带来较大误差,可用同一支毛细管,在相同条件下分别测出已知表面张力为σ1的参考液体的ΔP max,1
和待测液体的ΔP max ,因为
由上式可求出其它液体的表面张力σ。
可以减小误差。
