高中化学原子结构知识点总结
高中化学原子结构

煌敦市安放阳光实验学校包集中学高中化学必修二原子结构一、知识点精讲(知识再现)1.原子的构成:2.原子中有关量的关系:质子数=核电荷数=核外电子数=原子序数离子电荷数=质子数—核外电子数质量数(A)=质子数(Z)+中子数(N)质子数(Z)=离子的核外电子数+离子的电荷数(阳离子为正,阴离子为负)3.同位素:4.相对原子质量=元素的一个原子的质量/1个12C原子的质量×1/125.几种特殊粒子的结构特点:⑴离子的电子层排布:主族元素阳离子跟上一周期稀有气体的电子层排布相同;阴离子跟同一周期稀有气体的电子排布相同,如O2-、F-与Ne相同⑵电子粒子(注意主要元素在周期表中的相对位置)①10电子粒子:CH4、N3-、NH2-、NH3、NH4+、O2-、OH-、H2O、H3O+、F -、HF、Ne、Na+、Mg2+、Al3+②18电子粒子:SiH4、P3-、PH3、S2-、HS-、H2S、Cl-、HCl、Ar、K+、Ca2+、(F2、H2O2、C2H6、CH3OH)③核外电子总数及质子总数均相同的阳离子有:Na+、NH4+、H3O+;阴离子有:F-、OH-、NH2-、HS-、Cl-。
6.氢原子光谱:广义上讲光即,可见光的真空波长在之间。
可见光的视觉颜色不同,根本原因是。
氢气在高压分解为原子后得到的光谱特点是,这种光谱是,原子光谱即为;而阳光形成光谱为,这种光谱特点是。
原子光谱的形成有什么特点?答:7.原子结构模型:玻尔的原子模型有哪些基本观点?答:氢光谱为什么是线状光谱?谱线的波长或频率与能级间能量差有什么关系?原子在正常或稳状态时,电子尽可能处于能量最低的轨道,这种状态称为;电子受激发处于能量高于的状态称为。
8.原子轨道与四个量子数:原子中单个电子的空间运动状态可以用来描述,而每个原子轨道由三个只能取整数的量子数共同描述。
⑴主量子数n:决轨道。
取值为;1,2,3,4…n越大。
n值与电子层相对,n=1表示、离核的第一电子层。
高中化学知识点总结( 物质与结构)

《物质结构基础》第一部分原子的结构和性质第一节原子的结构1、能层(1)原子核外的电子是分层排布的。
根据电子的能级差异,可将核外电子分成不同的能层。
(2)每一能层最多能容纳的电子数不同:最多容纳的电子数为2n2个。
(3)离核越近的能层具有的能量越低。
(4)能层的表示方法:能层一二三四五六七……符号K L M N O P Q ……最多电子数 2 8 18 32 50 ……离核远近由近————————————→远能量高低由低————————————→高2、能级在多电子的原子中,同一能层的电子,能量也可以不同。
不同能量的电子分成不同的能级。
【提示】①每个能层所包含的能级数等于该能层的序数n,且能级总是从s能级开始,如:第一能层只有1个能级1s,第二能层有2个能级2s和2p,第三能层有3个能级3s、3p、3d,第四能层有4个能级4s、4p、4d和4f,依此类推。
②不同能层上的符号相同的能级中最多所能容纳的电子数相同,即每个能级中最多所能容纳的电子数只与能级有关,而与能层无关。
如s能级上最多容纳2个电子,无论是1s还是2s;p能级上最多容纳6个电子,无论是2p还是3p、4p能级。
③在每一个能层(n)中,能级符号的排列顺序依次是ns、np、nd、nf……④按s、p、d、f……顺序排列的各能级最多可容纳的电子数分别是1、3、5、7……的两倍,即分别是2、6、10、14……3、基态原子与激发态原子(1)基态原子为能量最低的原子。
基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子。
(2)基态原子与激发态原子相互转化与能量转化关系:4、构造原理与基态原子的核外排布随着原子核电荷数的递增,绝大多数元素的原子核外电子的排布将遵循如图的排布顺序,我们将这个顺序成为构造原理。
(1)它表示随着原子叙述的递增,基态原子的核外电子按照箭头的方向在各能级上依此排布:1s,2s,2p,3s,3p,4s,3d,4p,5s,4d,5p,6s……这是从实验得到的一般规律,适用于大多数基态原子的核外电子排布。
高中化学物质结构与性质专题知识点总结

高中化学选修 3 知识点总结一、原子结构1、能层和能级(1)能层和能级的划分! 在同一个原子中,离核越近能层能量越低。
"同一个能层的电子,能量也可能不同,还可以把它们分成能级s 、p 、 d 、f ,能量由低到高依次为 s 、p 、d 、f 。
# 任一能层,能级数等于能层序数。
$ s 、p 、d 、f ⋯⋯可容纳的电子数依次是 1、3、5、7⋯⋯的两倍。
% 能层不同能级相同,所容纳的最多电子数相同。
2、构造原理(1)构造原理是电子排入轨道的顺序,构造原理揭示了原子核外电子的能级分布。
(2)构造原理是书写基态原子电子排布式的依据,也是绘制基态原子轨道表示式的主 要依据之一。
(3)不同能层的能级有交错现象,如 E (3d )>E (4s )、E (4d )> E ( 5s )、 E ( 5d )>E ( 6s )、 E ( 6d )> E ( 7s )、 E ( 4f )> E ( 5p )、 E ( 4f )> E ( 6s )等。
原子轨道的能 量关系是: ns <( n-2)f < (n-1 )d < np(4)能级组序数对应着元素周期表的周期序数,能级组原子轨道所容纳电子数目对应 着每个周期的元素数目。
根据构造原理,在多电子原子的电子排布中:各能层最多容纳的电子数为2n 2 ;最外层不超过 8 个电子;次外层不超过 18 个电子;倒数第三层不超过 32 个电子。
( 5)基态和激发态 ①基态:最低能量状态。
处于 最低能量状态 的原子称为 基态原子 。
" 激发态:较高能量状态(相对基态而言)。
基态原子的电子吸收能量后,电子跃迁至 较高能级时的状态。
处于激发态的原子称为激发态原子 。
# 原子光谱:不同元素的原子发生电子跃迁时会吸收(基态→激发态) 和放出(激发态 →&'()*(+*,-./0123456()7892:;<-=>?5&@&A5@?()2B ='C5较低激发态或基态)不同的能量(主要是光能),产生不同的光谱——原子光谱(吸收光谱和发射光谱)。
高中化学《原子结构》微课精讲知识点教案课件习

元素在周期表中的位置由其原子序 数决定,原子序数等于核电荷数, 也等于质子数和中子数之和。
周期表中元素性质递变趋势总结
01
原子半径
同一周期中,从左到右,随着原子序数的递增,原子半径逐渐减小;同
一族中,从上到下,随着原子序数的递增,原子半径逐渐增大。
02
金属性与非金属性
同一周期中,从左到右,元素的金属性逐渐减弱,非金属性逐渐增强;
仔细审题
认真阅读题目,理解题意,明确题目所考查的知 识点。
排除法
根据所学知识,逐一排除错误选项,提高答题准 确率。
比较法
通过对选项进行比较,找出最符合题意的答案。
计算题解题思路梳理
01
02
03
04
明确计算目标
仔细阅读题目,明确需要计算 的目标,如原子序数、电子数
、质量数等。
列出已知条件
将题目中给出的已知条件列出 ,为计算做好准备。
选择计算方法
根据计算目标和已知条件,选 择合适的计算方法,如公式法
、守恒法等。
细心计算
按照所选方法进行计算,注意 计算过程中的细节和单位换算
。
实验题答题规范训练
理解实验原理
了解实验所涉及的化学原理和 方法,为实验设计和操作提供 依据。
分析实验数据
对实验数据进行认真分析和处 理,得出合理的结论。
明确实验目的
应用
解释分子的几何构型和化学键的性质,预测分子的反应活 性。
04
元素周期表与元素性质递变规律
元素周期表结特点分析
周期
元素周期表中的每一横行称为一 个周期,同一周期中的元素从左 到右,原子序数依次增加,电子
层数相同。
族
高中化学必修2知识点归纳总结

高中化学必修2知识点归纳总结高中化学必修2知识点归纳总结第一篇:《高中化学必修2知识点归纳总结》高中化学必修2知识点归纳总结第一章物质结构元素周期律一、原子结构质子(Z个)原子核注意:中子(N个)质量数(A)=质子数(Z)+中子数(N)1. 原子序数=核电荷数=质子数=原子的核外电子数核外电子(Z个)★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n2;③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层:一(能量最低)二三四五六七对应表示符号: K L M N O P Q 3.元素、核素、同位素元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(对于原子来说) 二、元素周期表 1.编排原则:①按原子序数递增的顺序从左到右排列②将电子层数相同的各元素从左到右排成一横行。
(周期序数=原子的电子层数)........③把最外层电子数相同的元素按电子层数递增的顺序从上到下排成一纵行。
..........主族序数=原子最外层电子数 2.结构特点:核外电子层数元素种类第一周期 1 2种元素短周期第二周期 2 8种元素周期第三周期 3 8种元素元 7第四周期 4 18种元素素 7第五周期 5 18种元素周长周期第六周期 6 32种元素期第七周期 7 未填满(已有26种元素)表主族:ⅠA~ⅦA共7个主族族副族:ⅢB~ⅦB、ⅠB~ⅡB,共7个副族(18个纵行)第Ⅷ族:三个纵行,位于ⅦB和ⅠB之间(16个族)零族:稀有气体三、元素周期律1.元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律。
原子结构——高中化学竞赛

1-1-3 原子的质量
• 特征 原子的质量很小,不等于构成它的质子和中子 质量的简单加和,存在质量亏损 例:1摩尔氘原子的质量比1摩尔质子和1摩尔中子 的质量和小0.00431225g。该差值等于核子结合成 原子核释放的能量---结合能 不同数量的核子结合成原子释放的能量与核子 的数量不成比例。
比结合能是某原子核的结合能除以其核子数,比 结合能越大,原子核越稳定
跃迁规则 原子内电子可由某一定态跃迁 到另一定态,在此过程中放出或吸收辐射能。
其频率γ由下式决定:
γ= E2-E1/h (E2>E1)
举例:
Balmer线系
Lyman系 Balmer系 Paschen系 Brackett系
应用:
1. 解释原子稳定存在的问题 2.计算电子绕核运动的半径r、在轨道上
M .Plack量子论(1909 )
根据A.Einstein光子学说(1908 年)
D.Rutherford有核原子模型
1913年,玻尔总结了当时的最近物理学发现,建立 了氢原子核外电子模型,解释了氢原子光谱,后 人称玻尔理论,要点如下:
行星模型 玻尔假定,氢原子核外电子是处 在一定的线形轨道上绕核运行的
)
: 波数(波长的倒数 = 1/ ,cm-1).
n : 大于2的正整数,n=3、4、5、6时分
别对应Hα、Hβ、Hγ、Hδ四条谱线的波长.
RH : Rydberg常数, RH= R / c RH = 1.09677107 m-1vΒιβλιοθήκη 11 RH ( 22
1 )
n2
: 谱线波长的倒数, 波数(cm-1) n: 大于2的正整数 RH:里德堡常数:1.09677576107 m-1
运动行为。
(完整版)人教版高中化学选修3知识点总结:第一章原子结构与性质
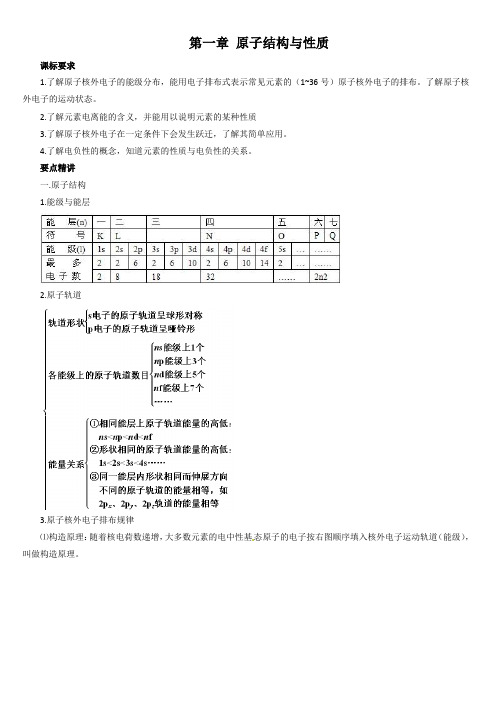
第一章原子结构与性质课标要求1.了解原子核外电子的能级分布,能用电子排布式表示常见元素的(1~36号)原子核外电子的排布。
了解原子核外电子的运动状态。
2.了解元素电离能的含义,并能用以说明元素的某种性质3.了解原子核外电子在一定条件下会发生跃迁,了解其简单应用。
4.了解电负性的概念,知道元素的性质与电负性的关系。
要点精讲一.原子结构1.能级与能层2.原子轨道3.原子核外电子排布规律⑴构造原理:随着核电荷数递增,大多数元素的电中性基态原子的电子按右图顺序填入核外电子运动轨道(能级),叫做构造原理。
能级交错:由构造原理可知,电子先进入4s 轨道,后进入3d 轨道,这种现象叫能级交错。
说明:构造原理并不是说4s 能级比3d 能级能量低(实际上4s 能级比3d 能级能量高),而是指这样顺序填充电子可以使整个原子的能量最低。
也就是说,整个原子的能量不能机械地看做是各电子所处轨道的能量之和。
(2)能量最低原理 现代物质结构理论证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。
构造原理和能量最低原理是从整体角度考虑原子的能量高低,而不局限于某个能级。
(3)泡利(不相容)原理:基态多电子原子中,不可能同时存在4个量子数完全相同的电子。
换言之,一个轨道里最多只能容纳两个电子,且电旋方向相反(用“↑↓”表示),这个原理称为泡利(Pauli )原理。
(4)洪特规则:当电子排布在同一能级的不同轨道(能量相同)时,总是优先单独占据一个轨道,而且自旋方向相同,这个规则叫洪特(Hund )规则。
比如,p3的轨道式为或,而不是洪特规则特例:当p 、d 、f 轨道填充的电子数为全空、半充满或全充满时,原子处于较稳定的状态。
即p0、d0、f0、p3、d5、f7、p6、d10、f14时,是较稳定状态。
前36号元素中,全空状态的有4Be 2s22p0、12Mg 3s23p0、20Ca 4s23d0;半充满状态的有:7N 2s22p3、15P 3s23p3、24Cr 3d54s1、25Mn 3d54s2、33As 4s24p3;全充满状态的有10Ne 2s22p6、18Ar 3s23p6、29Cu 3d104s1、30Zn 3d104s2、36Kr 4s24p6。
高中化学必修3知识点

高中化学必修3知识点篇一:高中化学选修3知识点总结高中化学选修3知识点总结二、复习要点1、原子结构2、元素周期表和元素周期律3、共价键4、分子的空间构型5、分子的性质6、晶体的结构和性质(一)原子结构 1、能层和能级(1)能层和能级的划分①在同一个原子中,离核越近能层能量越低。
②同一个能层的电子,能量也可能不同,还可以把它们分成能级s、p、d、f,能量由低到高依次为s、p、d、f。
③任一能层,能级数等于能层序数。
④s、p、d、f??可容纳的电子数依次是1、3、5、7??的两倍。
⑤能层不同能级相同,所容纳的最多电子数相同。
(2)能层、能级、原子轨道之间的关系每能层所容纳的最多电子数是:2n(n:能层的序数)。
2、构造原理2(1)构造原理是电子排入轨道的顺序,构造原理揭示了原子核外电子的能级分布。
(2)构造原理是书写基态原子电子排布式的依据,也是绘制基态原子轨道表示式的主要依据之一。
(3)不同能层的能级有交错现象,如E(3d)>E(4s)、E (4d)>E(5s)、E(5d)>E(6s)、E(6d)>E(7s)、E (4f)>E(5p)、E(4f)>E(6s)等。
原子轨道的能量关系是:ns<(n-2)f <(n-1)d <np(4)能级组序数对应着元素周期表的周期序数,能级组原子轨道所容纳电子数目对应着每个周期的元素数目。
根据构造原理,在多电子原子的电子排布中:各能层最多容纳的电子数为2n2 ;最外层不超过8个电子;次外层不超过18个电子;倒数第三层不超过32个电子。
(5)基态和激发态①基态:最低能量状态。
处于最低能量状态的原子称为基态原子。
②激发态:较高能量状态(相对基态而言)。
基态原子的电子吸收能量后,电子跃迁至较高能级时的状态。
处于激发态的原子称为激发态原子。
③原子光谱:不同元素的原子发生电子跃迁时会吸收(基态→激发态)和放出(激发态→较低激发态或基态)不同的能量(主要是光能),产生不同的光谱——原子光谱(吸收光谱和发射光谱)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学原子结构知识点总结
化学原子结构是化学学科中的基础概念之一,它是研究物质的组成、性质和变化的基础。
本文将对高中化学原子结构的知识点进行总结,包括原子模型、电子结构、元素周期律等内容。
一、原子模型
原子模型是原子结构的基础,它描述了原子的基本构成和性质。
经过多年的探索和实验,科学家们提出了多种原子模型,其中最有代表性的是卢瑟福原子模型和波尔原子模型。
卢瑟福原子模型认为,原子由一个带正电的小球(原子核)和围绕核运动的带负电荷的电子组成。
这个模型解释了原子的尺寸和电荷分布,但无法解释光谱现象。
波尔原子模型基于卢瑟福原子模型,进一步提出了电子在原子中的能级结构。
波尔认为,电子只能在特定的能级上运动,每个能级对应一定的能量。
这个模型成功地解释了氢原子光谱现象。
二、电子结构
电子结构是原子结构的核心内容,它描述了电子在原子中的排布、能量和运动状态。
电子结构的主要特点是电子云、能级和轨道。
电子云是电子在原子中的空间分布,它代表了电子存在的概率密度。
电子云的形状可以用概率分布图或三维图像表示,其中概率分布图描述了电子云在不同方向上的密度分布。
能级是电子在原子中的能量状态,它代表了电子的稳定状态。
能级分为基态和激发态,基态是电子的最低能量状态,激发态是电子的高能量状态。
能级越高,电子的能量越大。
轨道是电子在原子中的运动状态,它代表了电子的运动轨迹。
轨道分为s、p、d、f四种类型,每种类型有不同的形状和能量。
s轨道是球形的,p轨道是双叶形的,d轨道是复杂的多叶形,f轨道更加复杂。
三、元素周期律
元素周期律是化学中最基本的规律之一,它描述了元素的周期性变化规律。
元素周期律基于元素的原子结构和化学性质,将元素按照一定的顺序排列,形成周期表。
周期表中元素的排列方式是按照原子序数从小到大排列的。
周期表分为横行和竖列两个方向,横行称为周期,竖列称为族。
周期表中的元素按照周期和族的位置,具有一定的物理和化学性质。
周期表中,周期数代表了元素的能级数,元素的化学性质随着周期数的增加而变化。
族数代表了元素的电子结构,元素的化学性质随着族数的增加而变化。
四、总结
高中化学原子结构知识点的掌握对于学生理解化学知识体系、提高化学素养非常重要。
本文总结了原子模型、电子结构、元素周期律等核心知识点,希望能够对学生的化学学习有所帮助。
