酸碱盐溶解性表
部分酸碱盐的溶解性表

OH H+ NH4+ K+ Na+ Ba2+ Ca2+ Mg2+ Al3+ Mn2+ Zn2+ Fe2+ Fe3+ Cu2+ Ag+ 酸 1、三大强酸:HCl、HNO3、H2SO4 2、四大强碱:KOH、NaOH、Ba(OH)2、Ca(OH)2 3、可溶性碱:KOH、NaOH、Ba(OH)2、Ca(OH)2、NH3·H2O 4、不可溶性碱的颜色:Cu(OH)2蓝色、Fe(OH)3红褐色、其余不溶性碱为白色 5、盐类物质记忆口诀:钾钠氨盐都可溶;碳酸氢盐都可溶;硝酸盐遇水无影踪;氯化物不溶氯化银;硫酸盐不溶硫酸钡,微溶硫酸钙、硫 酸银;碳酸盐、磷酸盐只溶钾钠氨 溶、挥 溶 溶 溶 微 不 不 不 不 不 不 不
说明:溶表示可溶于水;不表示不溶于水;微表示微溶于水;挥表示挥发性
-
NO3
-
Cl
-
SO4
2-ห้องสมุดไป่ตู้
CO3
2-
O
2-
溶、挥 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 碱
溶、挥 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 不
溶 溶 溶 溶 不 微 溶 溶 溶 溶 溶 溶 溶 微 盐
溶、挥 溶 溶 溶 不 不 微 溶 溶 溶 溶 不 不 不 不 不 不 不 不 不 不 不 不 氧化物
酸碱盐的溶解性表是学习化学的重要工具之一

酸碱盐的溶解性表是学习化学的重要工具之一酸碱盐溶解性表:一把可以“开启”化学大门的钥匙。
酸碱盐的溶解性表是学习化学的重要工具之一,它能够清楚表明物质在各种不同条件下的溶解性,这种特殊的属性有助于我们理解并预测化学过程及其产物。
一、什么是酸碱盐溶解性表酸碱盐溶解性表是一张总结了各种酸碱盐物质在不同条件下溶解性的表格,它是由三行表示酸、碱、盐的溶解性,并有一些特殊的符号表示物质的溶解性。
在这张表中,化学学家会根据实际测试结果,用相应的符号来标注各种物质在不同条件下的溶解性,从而使该表能够表现出一种完成的形式来总结酸碱盐的溶解性。
二、酸碱盐溶解性表的意义在学习和加深对酸碱盐溶解性方面的理解中,酸碱盐溶解性表是至关重要的。
它可以让我们准确知道不同物质在各种环境中溶解性的变化,从而帮助我们更清楚地理解化学过程及其产物。
1、帮助我们理解化学过程酸碱盐溶解性表是学习化学的一个很重要的工具,其中涵盖了各种各样的反应,例如过程中物质的分解、混合、变质等,通过其中的反应公式,我们可以更清楚地了解反应的机理。
2、帮助我们预测化学反应的产物酸碱盐溶解性表中的符号也可以用来预测化学反应的产物,因为它直接表明了酸碱盐物质在混合后溶解性的变化情况,可以帮助我们判断反应过程中物质会产生什么样的结果,从而使我们能够更好地预测化学反应的产物。
三、总结酸碱盐溶解性表是学习化学的重要工具,帮助我们更清楚地理解化学过程及其产物,也能预测化学反应的产物,从而有助于我们深入了解酸碱盐的溶解性特点。
然而,学习酸碱盐溶解性并不仅仅是停留在表格上读取信息,而是要深入了解每一个现象背后的原理,这样才能正确地解释这些现象,并获得更好的理解,灵活运用酸碱盐溶解性表格,以期更好地利用酸碱盐溶解性表中的信息,实现高效的化学学习。
酸碱盐溶解性表的分类解释
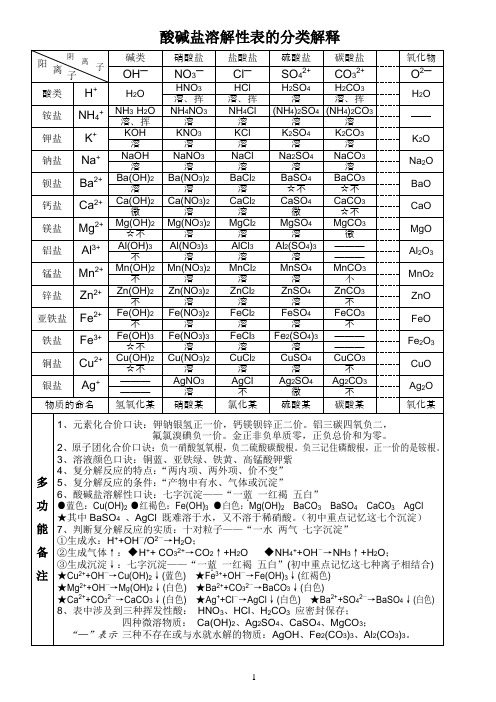
CuCO3
CuO
☆不
溶
溶
溶
不
银盐
Ag+
———
AgNO3
AgCl
Ag2SO4
Ag2CO3
Ag2O
———
溶
不
微
不
物质的命名
氢氧化某
硝酸某
氯化某
硫酸某
碳酸某
氧化某
多
功
能
备
注
1、元素化合价口诀:钾钠银氢正一价,钙镁钡锌正二价。铝三碳四氧负二,
氟氯溴碘负一价。金正非负单质零,正负总价和为零。
2、原子团化合价口诀:负一硝酸氢氧根,负二硫酸碳酸根。负三记住磷酸根,正一价的是铵根。
SO32-
S2-
SiO32-
PO43-
HCO3-
H+
溶、挥
溶、挥
溶
溶、挥
溶、挥
溶、挥
溶、挥
溶、挥
微
溶
溶、挥
NH4+
溶、挥
溶
溶
溶
溶
溶
溶
溶
溶
水解
溶
溶
Li+
溶
溶
溶
溶
溶
溶
微
溶
溶
溶
不
溶
Rb+
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
微
溶
K+
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶Байду номын сангаас
溶
溶
Cs+
溶
酸碱盐溶解性表及应用

利用物质间相互反应或离子间组合出现变色、沉淀、气体、 无现象等不同现象进行鉴别
例3.在整理实验室试剂时,发现有一瓶失去标签的无色溶液
,可能是Na2CO3溶液,也可能是Ca(OH)2溶液,下列试剂不 能一次性将其确定的是( )
A .稀盐酸 (HCl) B .氯化钙溶液 (CaCl2)
C .酚酞试液
D .碳酸钠溶液(Na2CO3)
人教版九年级化学下册附录Ⅰ
酸碱盐溶解性表及应用
怀安县左卫中学:李媛媛
一、部分酸碱和盐的溶解性表解析
阴离子 阳离子
OH-
NO3—
Cl-
SO42-
CO32-
酸
H+
溶、挥 溶、挥
溶
溶、挥
表
、 碱 、
NH4+ K+
溶、挥 溶
溶 溶
溶 溶
溶 溶
溶 溶
格
盐
Na+
溶
溶
溶
溶
溶
的 构 成
溶
Ba2+
溶
溶
溶
不
不
解
Ca2+
不
不
解
Ca2+
微
溶
溶
微
不
性
性
Mg2+
不
溶
溶
溶
微
角 度
表
Al3+
不
溶
溶
溶
-
(
Mn2+
不
溶
溶
溶
不
20℃
Zn2+
不
溶
溶
溶
不
)
Fe2+
不
溶
完整)初中化学酸碱盐溶解性表以及口诀

完整)初中化学酸碱盐溶解性表以及口诀
盐的分类可以分为盐酸盐、硝酸盐、碳酸盐、硫酸盐、钠盐、钾盐、镁盐、钙盐、亚铁盐和铁盐等多种类型。
其中,盐酸盐包括NaCl和KCl,硝酸盐包括NaNO3和KNO3,碳酸盐包括Na2CO3、MgCO3、FeCO3和CaCO3,硫酸盐包括
Na2SO4、K2SO4、MgSO4、FeSO4和CaSO4,钠盐包括NaCl、NaNO3、Na2CO3、Na2SO4和NaNO3等。
钾盐包括KCl、KNO3和K2CO3等。
酸碱盐的溶解性与阳离子和阴离子的组合有关。
在20℃下,H+、NH4+、K+、Na+、Ba2+、Ca2+、Mg2+、Al3+、
Mn2+、Zn2+、Fe2+、Fe3+和Cu2+等阳离子与NO3-、Cl-和
SO42-等阴离子结合时,大多数都能溶解。
但是,AgCl只有微溶,BaSO4只有微溶,而碳酸盐只有K+、Na+、NH4+等阳离
子才能溶解,碱类只有K+、Na+、NH4+和Ba2+、Ca(OH)2、CaSO4、Ag2SO4等阳离子才能溶解。
为了记忆这些酸碱盐的溶解性,可以使用口诀:“钾钠铵
硝酸盐全溶,盐酸盐只有AgCl不容,硫酸盐只有BaSO4不容,
碳酸盐只溶K+、Na+、NH4+,碱类只溶K+、Na+、NH4+和Ba2+、Ca(OH)2、CaSO4、Ag2SO4”。
常见的酸碱盐溶解性表

常见的酸、碱、盐溶解性表(常温)
酸碱盐溶解性表和口诀(精华版)
说明:
1、此为20℃时的情况。
“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“——”表示那种物质不存在或遇到水就分解了。
2、记住初中阶段可能常用到的不溶性物质(已重点框出),知道几个微溶性物质(有底色处)。
其余不溶物一般不常考,除此之外就都是可溶性物质了。
3、微溶性物质:在反应物可视为可溶,在生成物可视为不溶,适用于除杂、鉴别题型。
4、白色沉淀:氯化银、碳酸钙、碳酸钡、硫酸钡、氢氧化铝、氢氧化镁
红褐色沉淀:氢氧化铁(Fe(OH)3)
蓝色沉淀:氢氧化铜(Cu(OH)2)
有色离子:溶液中若有
铜离子(Cu2+):呈蓝色亚铁离子(Fe2+):呈浅绿色铁离子(Fe3+):呈黄色适用于物质推断题型。
5、特殊不溶解:氯化银、硫酸钡既不溶于水,也不溶于稀硝酸。
注:以上所有离子符号的电荷数及正负应写在右上方且本身不加括号、化学式中的数字角码
应写在右下方,这里是为了方便打字,请谅解。
部分酸碱盐溶解性背诵口诀
①钾钠铵盐硝酸盐,
完全溶解不困难。
②硫酸盐中钡不溶,
盐酸盐中只银难,
硫酸钡和氯化银,
两种沉淀记心间。
③碳酸盐溶钾钠铵,
碳酸铝铁银碱无。
④硫酸钙银盐微溶,
微溶还有碳酸镁。
⑤碱有钾钠铵钡溶,
氢氧化钙是微溶,
其他全都不能溶。
⑥常见诸酸皆可溶,
记住挥酸盐硝碳。
注:口诀仅供参考,本身并不完全准确,但是能促进记忆。
酸碱盐的溶解性表口诀高中
酸碱盐的溶解性表口诀高中酸碱盐的溶解性表口诀是学习酸碱盐的基础,在高中物理化学中有着重要的作用。
一般来说,酸碱盐的溶解性会与溶质的性质,溶解介质的性质,溶液的倍量有关。
那么,我们需要记住酸碱盐的溶解性表口诀,以便能够正确地判断某一酸碱盐是否能够溶于某一介质中,更加深入地学习酸碱盐的方面。
在高中物理化学中,酸碱盐的溶解性表口诀是学习酸碱盐的一个重要知识点,可以记住以下口诀:溶于水的有HCl、NaOH、KNO3、NaHCO3,而溶于醇的有HNO3、H2SO4、C2H5OH、NaClO。
下面我们来看看酸碱盐的溶解性表口诀的一些具体内容:一、 HCl、NaOH、KNO3、NaHCO3都能溶于水,其中HCl是一种强酸,NaOH是一种强碱,而KNO3和NaHCO3则都是碱性无机盐。
二、 HNO3、H2SO4、C2H5OH、NaClO都能溶于醇,其中HNO3是一种强酸,H2SO4是一种强碱,而C2H5OH和NaClO则都是碱性无机盐。
三、汞是一种重要的金属,也能够溶于稀硫酸,这是一种强酸,它的溶解度受温度的影响,随着温度的升高,汞的溶解度也会增加。
四、铝能够溶于硫酸铝,硫酸铝是一种弱酸,属于酸性无机盐,它的溶解度也受温度的影响,随着温度的升高,铝的溶解度也会增加。
五、碳酸钠可以溶于水,也可以溶于乙醇,碳酸钠是一种弱碱,属于碱性无机盐,它的溶解度受温度的影响,随着温度的升高,碳酸钠的溶解度也会增加。
六、氯化氢(HCl)可以溶于水,也可以溶于乙醇,它属于强酸,它的溶解度受温度的影响,随着温度的升高,氯化氢的溶解度也会增加。
七、氢氧化钙(Ca(OH)2)可以溶于水,也可以溶于乙醇,它属于强碱,它的溶解度受温度的影响,随着温度的升高,氢氧化钙的溶解度也会增加。
以上就是高中物理化学中酸碱盐的溶解性表口诀的一些具体内容,希望大家能够记住,以便在学习酸碱盐的方面更加深入地理解。
从口诀中我们可以得知,溶解在酸碱盐中是非常重要的,它的溶解性受到溶质的性质,溶解介质的性质,溶液的倍量以及温度等因素的影响。
酸碱盐溶解性表是学习化学的重要工具
酸碱盐溶解性表是学习化学的重要工具。
它可以帮助我们了解不同物质在不同pH条件下的溶解性,从而更好地理解化学反应中物质的变化。
另外,酸碱盐溶解性表还可以帮助我们确定溶液的pH 值,进而更好地控制化学实验中的反应条件。
酸碱盐溶解性表还可以帮助我们解释很多日常生活中的现象,如食物的味道、牙齿腐蚀、酸雨等。
总之,酸碱盐溶解性表是学习化学的重要工具,对于深入理解化学反应和现象有着重要的作用。
此外,酸碱盐溶解性表还可以帮助我们确定溶液是酸性还是碱性,从而决定使用何种试剂进行酸碱中和反应。
通过学习酸碱盐溶解性表,我们可以更好地掌握酸碱中和反应的基本原理和应用。
酸碱盐溶解性表对于化学工业来说也很重要,在工艺中需要控制酸碱度来保证产品质量,同时在环境保护上也有重要意义。
总之,酸碱盐溶解性表是一个非常重要的化学工具,不仅在学习上有着重要作用,在工艺和环保上也有着重要意义。
另外, 酸碱盐溶解性表还可以帮助我们了解酸碱盐的性质, 比如酸的强弱, 碱的单质和水溶液的强度等。
这些性质对于化学反应的研究和工业应用都非常重要。
酸碱盐溶解性表还可以帮助我们了解酸碱盐的反应性质, 例如酸碱反应的类型, 产生的离子, 以及酸碱反应的平衡常数等。
这些性质对于理解酸碱反应机理和掌握酸碱反应的工业应用都非常重要。
总之, 酸碱盐溶解性表是一个非常重要的工具, 它可以帮助我们了解酸碱盐的性质和反应性质, 对于学习化学, 理解化学反应和工业应用都有着重要意义。
初中化学酸碱盐溶解性表以及口诀
阳离子阴离子OH-NO3-Cl-SO42-CO32-H+H2O HNO3HCl H2SO4H2CO3硝酸(溶)盐酸(溶)硫酸(溶)碳酸(溶)NH4+NH3·H2O NH4NO3NH4Cl (NH4)2SO4(NH4)2CO3氨水(溶)硝酸铵(溶)氯化铵(溶)硫酸铵(溶)碳酸铵(溶)K+KOH KNO3KCl K2SO4K2CO3氢氧化钾(溶)硝酸钾(溶)氯化钾(溶)硫酸钾(溶)碳酸钾(溶)Na+NaOH NaNO3NaCl Na2SO4Na2CO3氢氧化钠(溶)硝酸钠(溶)氯化钠(溶)硫酸钠(溶)碳酸钠(溶)Ba2+Ba(OH)2Ba(NO3)2BaCl2BaSO4BaCO3氢氧化钡(溶)硝酸钡(溶)氯化钡(溶)硫酸钡(不)碳酸钡(不)Ca2+Ca(OH)2Ca(NO3)2CaCl2CaSO4CaCO3氢氧化钙(微)硝酸钙(溶) 氯化钙(溶)硫酸钙(微)碳酸钙(不)Mg2+Mg(OH)2Mg(NO3)2MgCl2MgSO4MgCO3氢氧化镁(不)硝酸镁(溶)氯化镁(溶)硫酸镁(溶)碳酸镁(微)Al3+Al(OH)3Al(NO3)3AlCl3Al2(SO4)3Al2(CO3)3氢氧化铝(不)硝酸铝(溶)氯化铝(溶)硫酸铝(溶)碳酸铝(-)Zn2+Zn(OH)2Zn(NO3)2ZnCl2ZnSO4ZnCO3氢氧化锌(不)硝酸锌(溶)氯化锌(溶)硫酸锌(溶)碳酸锌(不)Fe2+Fe(OH)2Fe(NO3)2FeCl2FeSO4FeCO3部分酸、碱、盐溶解性表(20℃)氢氧化亚铁(不)硝酸亚铁(溶)氯化亚铁(溶)硫酸亚铁(溶)碳酸亚铁(不)Fe3+Fe(OH)3Fe(NO3)3FeCl3Fe2(SO4)3Fe2(CO3)3氢氧化铁(不)硝酸铁(溶)氯化铁(溶)硫酸铁(溶)碳酸铁(-)Cu2+Cu(OH)2Cu(NO3)2CuCl2CuSO4CuCO3氢氧化铜(不)硝酸铜(溶)氯化铜(溶)硫酸铜(溶)碳酸铜(不)Ag+AgOH AgNO3AgCl Ag2SO4Ag2CO3氢氧化银(-)硝酸银(溶)氯化银(不)硫酸银(微)碳酸银(不)通常情况下,大多数酸都易溶于水且部分有挥发性;大多数碱都难溶于水(除钾钠铵钡可溶外);盐中有钾盐、钠盐和硝酸盐都易溶于水,氯化物中只有氯化银不溶,硫酸盐中只有硫酸钡不溶,碳酸盐和磷酸盐多数不溶于水。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3目前尚未制出纯净的碳酸铜,只合成了CuCO3·2H2O和Cu(NH3)2CO3等混合物。
溶
不
不
不
Zn2+
不
溶
溶
溶
不
不
不
Cr3+
不
溶
溶
溶
-
-
不
Fe2+
不
溶
溶
溶
不
不
不
Fe3+
不
溶
溶
溶
-
-②
不
Sn2+
不
溶
溶
溶
-
-
不
Pb2+
不
溶
微溶
不
不
不
不
Cu2+
不
溶
溶
溶
不
—③
不
Hg2+
溶(且仅存于溶液中)
溶
溶溶Biblioteka 不不不Ag+
-(分解为氧化银)
溶
不
微溶
不
不
不
1氢氧化铝中存在少量碳酸铝,用易溶铝盐和碳酸盐反应,瞬间内生成碳酸铝,但瞬间又水解成氢氧化铝.
酸碱盐溶解性(20℃)
阳离子
阴离子
OH—
NO3—
Cl—
SO42-
SO32-
CO32-
PO42-
H+
溶、挥
溶、挥
溶
溶、挥
溶、挥
溶
NH4
溶、挥
溶
溶
溶
溶
溶
溶
K+
溶
溶
溶
溶
溶
溶
溶
Na+
溶
溶
溶
溶
溶
溶
溶
Ba2+
溶
溶
溶
不
不
不
不
Ca2+
微溶
溶
溶
微溶
不
不
不
Mg2+
不
溶
溶
溶
微溶
微溶
不
Al3+
不
溶
溶
溶
-
-①
不
Mn2+
不
溶
溶
