高中酸碱盐溶解度表(全)
常见酸、碱、盐溶解度表[1]
![常见酸、碱、盐溶解度表[1]](https://img.taocdn.com/s3/m/6d7b525fd0d233d4b04e69c3.png)
微
0.063
As3+
难
——
——
——
——
溶
6
Bi3+
难
难
——
——
难
Sb3+
难
0.000175
溶
384.7(0℃)
——
——
——
——
Ag+
难
8.4×10-15
溶
182
难
难
Cr3+
——
——
Cu2+
难
0.00033
微
溶
Fe2+
难
微
Fe3+
——
——
微
Hg+
难
溶
难
Hg2+
难
溶
难、微
Mn2+
难
Zn2+
难
溶
溶
74.5
难
Sr2+
微
0.8
溶
71
微
0.013
溶
53.8
难
Ba2+
溶
3.9
溶
8.7
难
0.00024
溶
36
难
Al3+
难
0.0001
溶
69
溶
38
溶
70
——
——
Ga3+
微
溶
﹥500
溶
﹥500
In3+
微
溶
﹥500
Tl+
25.9(0℃)
溶
9.55
溶
微
重点高中酸碱盐溶解度表格模板全

阴离子
阳离子
溶,挥
溶,挥
溶
溶,挥
溶,挥
溶,挥
微
溶
溶,挥
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
不
-
不
不
不
不
微
溶
溶
微
-
不
不
不
不
不
溶
溶
溶
-
微
微
不
不
不
溶
溶
溶
-
-
-
不
不
不
溶
溶
溶
不
不
不
不
不
不
溶
溶
溶
不
不
不
不
不
不
溶
溶
溶
-
-
―
不
不
不
溶
溶
溶
不
不
不
不
不
不
溶
溶
溶
-
-
不
不
不
不
溶
溶
溶
不
-
-
-
不
不
溶
微
不
不
不
不
不
不
不
溶
-
溶
不
不
不
-Hale Waihona Puke 不不溶溶
溶
不
酸、碱、盐的溶解性表(20℃)
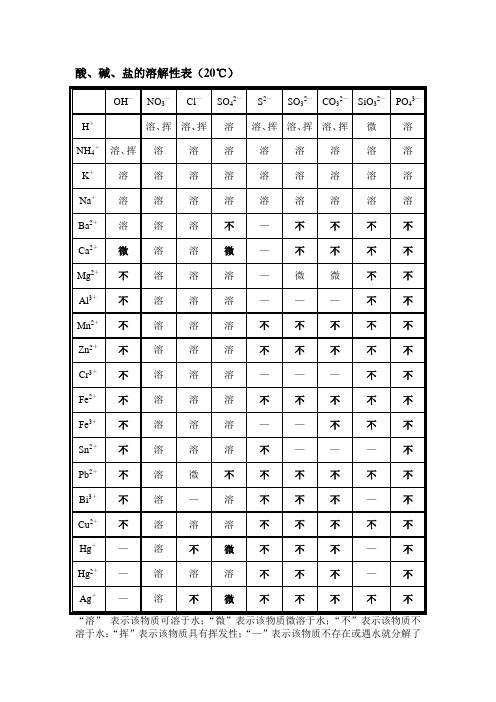
OH—
NO3—
Cl—
SO42—
S2—
SO32—
CO32—
SiO32—
PO43—
H+
溶、挥
溶、挥
溶
溶、挥
溶、挥
溶、挥
微
溶
NH4+
溶、挥
溶
溶
溶
溶
溶
溶
溶
溶
K+
溶
溶
溶
溶
溶
溶
溶
溶
溶
Na+
溶
溶
溶
溶
溶
溶
溶
溶
溶
Ba2+
溶
溶
溶
不
—
不
不
不
不
Ca2+
微
溶
溶
微
—
不
不
不
不
Mg2+
不
溶
溶
溶
—
微
微
不
不
Al3+
不
溶
溶
溶
—
—
—
不
不
Mn2+
不
溶
溶
溶
不
不
不
不
不
Zn2+
不
溶
溶
溶
不
不
不
不
不
Cr3+
不
溶
溶
溶
—
—
—
不
不
Fe2+
不
溶
溶
溶
不
不
不
不
不
Fe3+
不
溶
溶
溶
—
—
不
不
不
部分酸碱盐的溶解性表

OH H+ NH4+ K+ Na+ Ba2+ Ca2+ Mg2+ Al3+ Mn2+ Zn2+ Fe2+ Fe3+ Cu2+ Ag+ 酸 1、三大强酸:HCl、HNO3、H2SO4 2、四大强碱:KOH、NaOH、Ba(OH)2、Ca(OH)2 3、可溶性碱:KOH、NaOH、Ba(OH)2、Ca(OH)2、NH3·H2O 4、不可溶性碱的颜色:Cu(OH)2蓝色、Fe(OH)3红褐色、其余不溶性碱为白色 5、盐类物质记忆口诀:钾钠氨盐都可溶;碳酸氢盐都可溶;硝酸盐遇水无影踪;氯化物不溶氯化银;硫酸盐不溶硫酸钡,微溶硫酸钙、硫 酸银;碳酸盐、磷酸盐只溶钾钠氨 溶、挥 溶 溶 溶 微 不 不 不 不 不 不 不
说明:溶表示可溶于水;不表示不溶于水;微表示微溶于水;挥表示挥发性
-
NO3
-
Cl
-
SO4
2-ห้องสมุดไป่ตู้
CO3
2-
O
2-
溶、挥 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 碱
溶、挥 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 不
溶 溶 溶 溶 不 微 溶 溶 溶 溶 溶 溶 溶 微 盐
溶、挥 溶 溶 溶 不 不 微 溶 溶 溶 溶 不 不 不 不 不 不 不 不 不 不 不 不 氧化物
部分酸碱盐的溶解性表

\
不
\
不
不
不
溶
微
不
不
6不溶 1微溶
说明:“溶”表示该物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“\”表示该物质不存在或者遇到水就分解了。
部分酸、碱和盐的溶解性表(常温)
OH-
CO32-
HCO3-
Cl-
Br-
I-
NO3-
SO42-
SO32-
SiO32-
H+
溶、挥
溶、挥
溶、挥
溶、挥
溶、挥
溶、挥
溶
溶、挥
不
1不溶 7溶挥
NH4+
溶、挥
溶
溶
溶
溶
溶
溶
溶
溶
\
1溶挥
K+
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
全溶
Na+
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
全溶
Ba2+
溶
不
溶
溶
溶
溶
溶
不
不
不
4不溶
Ca2+
微
不
溶
溶
溶
溶
溶
微
不
பைடு நூலகம்
不
3不溶 2微溶
Mg2+
不
微
溶
溶
溶
溶
溶
溶
不
不
3不溶 1微溶
Al3+
不
\
\
溶
溶
酸碱盐的溶解性表

说明:此为2(rc时的情况。
"溶"表示那种物质可溶于水, "不"表示不溶于水,"微"表示微溶于水,"挥"表示挥发性,表示那种物质不存在或遇到水就分解了背诵口诀1 •钾钠鞍盐都可溶,氯化物不溶氯化银硫酸盐钙银微溶换不溶硝酸盐遇水影无踪钾钠锁钙碱可溶红褐铁,蓝絮铜其它沉淀白色呈注:4初中用够了.红褐铁,代表铁盐沉淀为红褐色[fe(oh)2氢氧化亚铁除外】,蓝絮铜代表,铜盐为蓝色絮状沉淀。
2•氯化银【不溶酸】,碳酸钙,碳酸换,硫酸顿【不溶酸】,氢氧化铝.氢氧化镁,为白色沉淀。
氢氧化铁〔红褐色〕氢氧化铜〔蓝色〕说明【】内为前一物质的特点2•钾钠镀盐全都溶其他全都不能溶AgCL BaSO4酸也不溶-氧气的性质:4〕单质与氧气的反响:〔化合反响〕1. 镁在空气中燃烧:2Mg + 02点燃2MgO2. 铁在氧气中燃烧:3Fe + 202点燃Fe3O43.铜在空气中受热:2Cu + 02加热2CuO4.铝在空气中燃烧:4A! + 302点燃2AI2O35.氢气中空气中燃烧:2H2 + 02点燃2H2O6•红磷在空气中燃烧〔研究空气组成的实验〕:4P + 502点燃2P2O57. 硫粉在空气中燃烧:S + 02点燃SO28. 碳在氧气中充分燃烧:C+O2点燃CO29. 碳在氧气中不充分燃烧:2C + 02点燃2CO(2)化合物与氧气的反响:10. 一氧化碳在氧气中燃烧:2CO + 02点燃2CO211. 甲烷在空气中燃烧:CH4 + 202点燃CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 302点燃2CO2 +3H2O⑶氧气的来源:13 •玻义耳研究空气的成分实验2HgO加热Hg+ 02 t14 •加热高猛酸钾:2KMnO4协热K2MnO4 + MnO2 + 02 t〔实验室制氧气原理A15 •过氧化氢在二氧化猛作催化剂条件下分解反响:H2O2MnO22H2O+ 02 t〔实验室制氧气原理2]二自然界中的水:电2H2T+ 02 t17. 生石灰溶于水:CaO + H2O == Ca(OH)218. 二氧化碳可溶于水:H2O + CO2==H2CO319.镁在空气中燃烧:2Mg + 02点燃2MgO 21.氢气复原氧化铜:H2 + CuO加热Cu + H2O 22.镁复原氧化铜:Mg + CuO加热Cu + MgO四、碳和碳的氧化物:⑴碳的化学性质23.碳在氧气中充分燃烧:C + 02点燃CO2 24 .木炭复原氧化铜:C+ 2CuO高温2Cu + CO2t 25.焦炭复原氧化铁:3C+ 2Fe203高温4Fe + 3CO2T⑵煤炉中发生的三个反响:〔几个化合反响〕26 •煤炉的底层:C + 02点燃CO2 27.煤炉的中层:CO2 + C高温2CO 28.煤炉的上部蓝色火焰的产生:2CO + 02点燃2CO2⑶二氧化碳的制法与性质:29 •大理石与稀盐酸反响〔实验室制二氧化碳〕:CaCO3 + 2HC! == CaC!2 + H2O + CO2t 30・碳酸不稳定而分解:H2CO3 == H2O + CO2t 31・二氧化碳可溶于水:H2O +CO2== H2CO332 •高温熾烧石灰石〔工业制二氧化碳〕:CaCO3高温CaO + CO2t 33 •石灰水与二氧化碳反响[鉴别二氧化碳〕:Ca(OH)2 + CO2 === CaCO3 1+ H2O⑵金属单质+盐+氢气 〔詈换反⑷一氧化碳的性质:34 . 一氧化碳复原氧化铜:CO + CuO 加热Cu + CO2 35. 一氧化碳的可燃性:2CO + 02点燃2CO2五燃料及其利用:37.甲烷在空气中燃烧:CH4 + 202点燃CO2 + 2H2O 38 •酒精在空气中燃烧:C2H5OH + 302点燃2CO2 + 3H2O 39.氢气中空气中燃烧:2H2 + 02点燃2H2O/u 金属(1)金属与氧气反响:40・镁在空气中燃烧:2Mg + 02点燃2MgO 41・铁在氧气中燃烧:3Fe + 202点燃Fe3O4 42. 铜在空气中受热:2Cu + 02加热2CuO43. 铝在空气中形成氧化膜:4A! + 302 = 2AI2O344. 锌和稀硫酸 Zn + H2SO4 = ZnSO4 + H2t 45. 铁和稀硫酸 Fe + H2SO4 = FeSO4 + H2t 46. 镁和稀硫酸 Mg + H2SO4 = MgSO4 + H2t 47. 铝和稀硫酸2AI +3H2SO4 = A!2(SO4)3 +3 H2!其它反响:Na2CO3辖幕醫Zn+ 2HC_n n znc_2+ H2T萍幕醫Fe+ 2HC一n n艮一2+H2T棘幕鬣Mg+ 2HC一n h Mgc_2+ H2T・茄君帝聆嬲2A_+ 6HC一nu2A_C一3+ 3 H2T二的翻般网+即〔两蒔〕..................鬓專+器 B 1B^8 - Fe + CCSO4n n FeSO4 +Cu盘〔匕霍+的a ...即+釧川〔总〔2〕糜+的醫喜....... 弱+为 56・ 咕e2O3+6HC一HH2Fec_3+3H257・$203 + 3H2SO4n n+ 3H2O58・ - a c o+ 2HC_Hucuc一2 + H2O59・ ^s s ss -aco+H2SO4n n CUSO4 + H.〔〕嬲+気弱;s ^s7二一(4)另一种酸61. 盐酸和氢氧化钙反响:2HCI + Ca(OH)2 == CaCI2 + 2H2O62. 氢氧化铝药物治疗胃酸过多:3HCI + AI(OH)3 == A/C/3 + 3H2O63. 硫酸和烧碱反响:H2SO4 + 2NaOH == Na2SO4 + 2H2O 64 .大理石与稀盐酸反响:CaCO3 + 2HC! == CaC!2 + H2O + CO2t 65碳酸钠与稀盐酸反响:Na2CO3 + 2HCI = = 2NaC! + H2O+ CO2t 66 •碳酸氢钠与稀盐酸反响:NaHCO3 + HC!== NaC! + H2O + CO2t67.硫酸和氯化坝溶液反响:H2SO4 + BaCI2== BaSO4 !+ 2HC!2、碱的化学性质⑴碱+非金属氧化物 .............. 盐+水68 •苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O69 •苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O盐+水74.铁和,铜溶液另一种酸70 •苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O71 •消石灰放在空气中变质:Ca(OH)2 + CO2二二CaCO3 I + H2O72.消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3 1+ H2O〔3〕碱+盐 ......... 另_种碱+另一种盐73.氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3l+ 2NaOH 3.盐的化学性质(1)盐〔溶液〕+金属单质・……另一种金属+另一种盐 75碳酸钠与稀盐酸反响:Na2CO3 + 2HCI==2NaCI + H2O + CO2t碳酸氢钠与稀盐酸反响:NaHCO3 + HC/== NaCI + H2O + CO2t⑶盐+碱 ............ 另一种碱+另一种盐76.氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3!+ 2NaOH⑷盐+盐两种新盐77•氯化钠溶液和硝酸银溶液:NaCI + AgNO3二二AgClJ +〔2〕碱 +⑵盐+NaNO3 78・硫酸钠和氯化锁:Na2SO4 + BaC/2 == BaSO4l + 2NaC!钾钠硝钱均可溶.盐酸盐不溶AgCI.硫酸盐不溶BaSO4,碳•溶解性口诀一钾钠链盐溶水快,◎硫讎除去坝铅钙。
常见的酸碱盐溶解性表

常见的酸、碱、盐溶解性表(常温)
【史上最全!】部分酸、碱、盐溶解性表的归纳.doc
Mg
Al3+ Mn2+ Zn
2+
Fe2+ Fe3+ Cu
2+ +
Ag
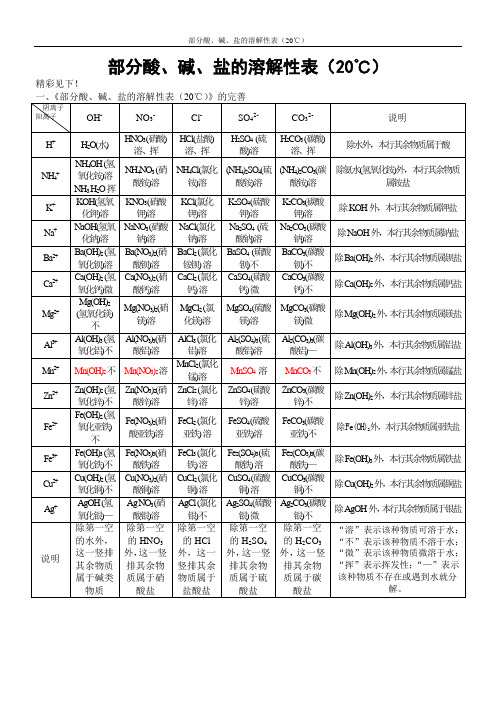
部分酸、碱、盐的溶解性表(20℃)
部分酸、碱、盐的溶解性表(20℃)
一、 《部分酸、碱、盐的溶解性表(室温) 》的完善,即阴离子和阳离子形成的化合物的化学式 阴离子 OHNO3ClSO42CO32阳离子 H+ NH4+ K+ Na+ Ba Ca
2+ 2+ 2+
H2O NH4OH= NH3 H2O KOH NaOH Ba(OH)2 Ca(OH)2 Mg(OH)2 Al(OH)3 Mn(OH)2 Zn(OH)2 Fe(OH)2 Fe(OH)3 Cu(OH)2 AgOH
HNO3 NH4NO3 KNO3 NaNO3 Ba(NO3)2 Ca(NO3)2 Mg(NO3)2 Al(NO3)3 Mn(NO3)2 Zn(NO3)2 Fe(NO3)2 Fe(NO3)3 Cu(NO3)2 Ag NO3
HCl NH4Cl KCl NaCl BaCl2 CaCl2 MgCl2 AlCl3 MnCl2 ZnCl2 FeCl2 FeCl3 CuCl2 AgCl
NO3HNO3(硝酸) 溶、挥
ClHCl(盐酸) 溶、挥
SO42H2SO4 (硫 酸)溶
CO32H2CO3 (碳酸) 溶、挥
说明 除水外,本行其余物质属于酸
H+ NH4+ K+ Na+ Ba2+ Ca2+ Mg2+ Al3+ Mn2+ Zn2+ Fe2+ Fe3+ Cu2+ Ag+
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
不
-
-
-
不
不
溶
微
不
不
不
不
不
不
不
溶
-
溶
不
不
不
-
不
不
溶
溶
溶
不
不
不
不
不
-
溶
不
微
不
不
不
-
不
-
溶
溶
溶
不
不
不
-
不
-
溶
不
微
不
不
不
不
不
酸碱和盐的溶解性表( C)
阴离子
阳离子
溶,挥
溶,挥
溶
溶,挥
溶,挥
溶,挥
微
溶
溶,挥
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
不
-
不
不
不
不
微
溶
溶
微
-
不
不Hale Waihona Puke 不不不溶
溶
溶
-
微
微
不
不
不
溶
溶
溶
-
-
-
不
不
不
溶
溶
溶
不
不
不
不
不
不
溶
溶
溶
不
不
不
不
不
不
溶
溶
溶
-
-
―
不
不
不
溶
溶
溶
不
不
不
不
不
不
溶
溶
溶
-
-
不
不
不
不
溶
溶
