高考化学二轮复习精品资料专题5 金属及其化合物 (教师版)

专题五金属及其化合物
【2013考纲解读】
钠、铝、铁、铜及其化合物是日常生活中非常重要的物质,特别是铝、铁在国民经济中占有极其重要的地位。命题的重点将是钠及其化合物(特别是Na2O2、Na2CO3、NaHCO3)的性质、铝及其化合物的两性、Fe2+与Fe3+之间的转化关系、铜的冶炼及Cu(OH)
2的性质等。估计以后高考试题将会在选择题中以离子共存、离子方程式、氧化还原反应、物质的鉴别与分离等角度考查金属元素及其化合物的性质,也会在非选择题中以金属元素的性质为载体,通过推断题、实验题,考查考生运用金属元素的有关知识分析解决问题的能力。以实验探究的形式考查元素化合物的性质将成为2013年高考命题的新亮点。
【知识网络构建】
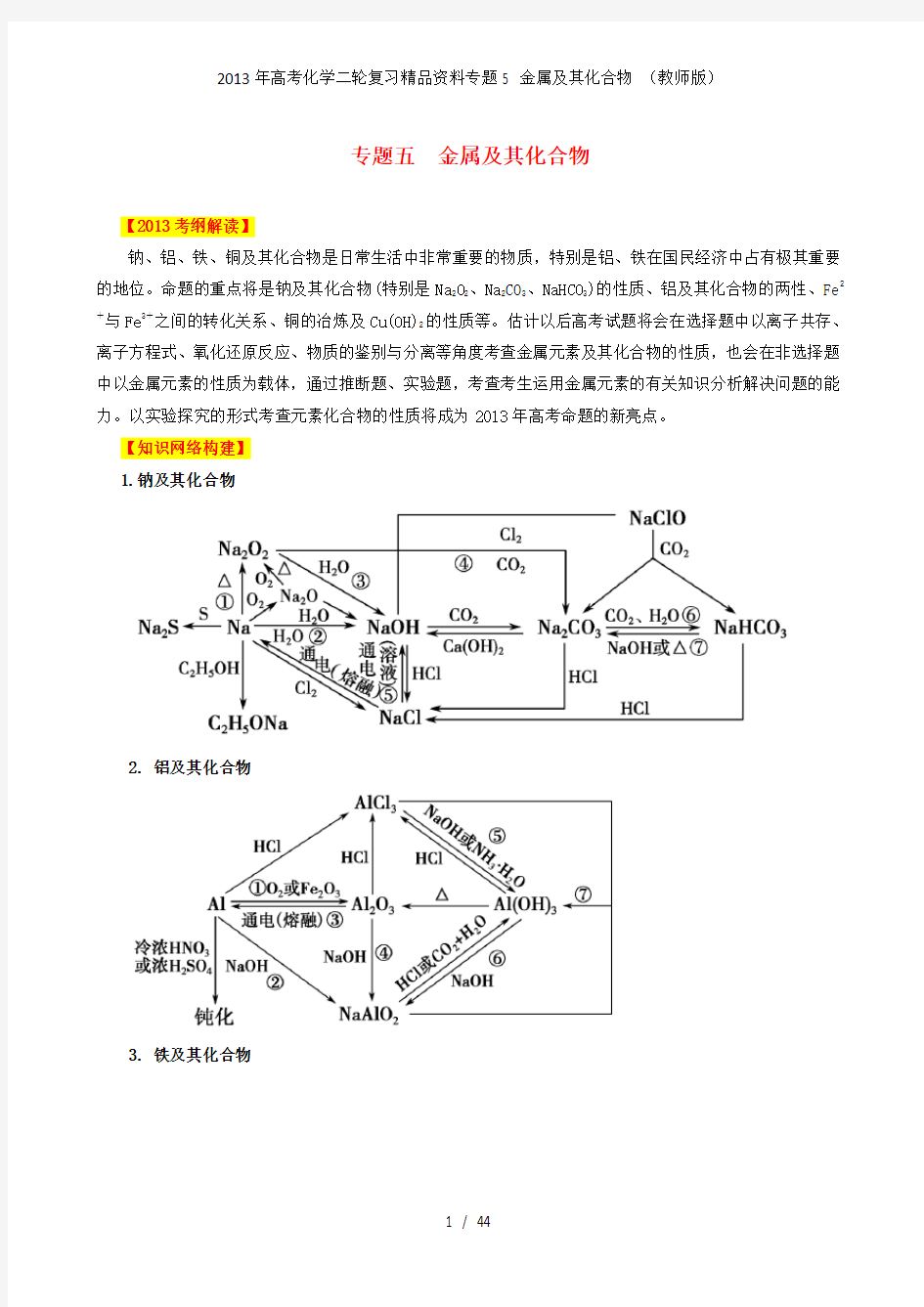
1.钠及其化合物
2. 铝及其化合物
3. 铁及其化合物
4. 铜及其化合物
【高频考点突破】
考点一 常见金属及化合物的主要性质
1.钠及其化合物
(1)等物质的量的金属钠被氧化成Na 2O 和Na 2O 2时转移的电子数相同。
(2)钠与酸反应时,先与酸反应,酸不足再与水反应。
(3)钠与盐的溶液反应:钠不能置换出溶液中的金属,钠直接与水反应,反应后的碱再与溶液中的其他物质反应。
(4)Na 2O 2与CO 2或H 2O 反应时,生成1 mol O 2,转移电子的物质的量为2 mol 。
(5)Na 2O 2跟CO 2和水蒸气组成的混合气体反应时,应先考虑Na 2O 2跟CO 2的反应。因为若先发生反应:2Na 2O 2+2H 2O===4NaOH +O 2↑,必定还发生反应:2NaOH +CO 2===Na 2CO 3+H 2O 。
(6)Na 2O 2与SO 2反应的化学方程式为:Na 2O 2+SO 2===Na 2SO 4。
(7)向Na 2CO 3溶液中逐滴滴入盐酸,反应是分步进行的。反应的离子方程式依次为:CO 2-3+H +===HCO -
3、HCO -3+H +===H 2O +CO 2↑。
2.镁、铝及其化合物
(1)镁在空气中燃烧主要发生反应:2Mg +O 2=====点燃2MgO ,此外还发生反应:3Mg +N 2=====点燃Mg 3N 2、2Mg +
CO 2=====△2MgO +C 。
(2)Mg 3N 2与水反应:Mg 3N 2+6H 2O===3Mg(OH)2+2NH 3↑。
(3)加热Mg(HCO 3)2溶液生成的是Mg(OH)2沉淀,而不是MgCO 3沉淀,因为Mg(OH)2比MgCO 3更难溶于水。
反应方程式为Mg(HCO 3)2=====△Mg(OH)2↓+2CO 2↑。
(4)铝与NaOH 溶液、非氧化性强酸反应生成H 2。常温下,浓硝酸、浓硫酸使铝发生钝化。
(5)Al 2O 3、Al(OH)3仅能溶于强酸和强碱溶液中(如在氨水和碳酸中不溶)。
(6)Al 3+、AlO -2只能分别存在于酸性、碱性溶液中。Al 3+与下列离子不能大量共存:OH -、CO 2-3、HCO -3、SO 2-3、S 2-、ClO -、AlO -2,其中OH -是因为直接反应,其余均是因为发生了剧烈的双水解反应。AlO -2与下列离子不能大量共存:H +、HCO -3、Al 3+、Fe 2+、Fe 3+,其中H +和HCO -3是因为与AlO -2直接反应(AlO -2+HCO -3+H 2O===Al(OH)3↓+CO 2-3),其余也是因为发生了剧烈的双水解反应。
(7)明矾的净水原理:明矾的化学式为KAl(SO 4)2·12H 2O ,它在水中能电离:KAl(SO 4)2===K ++Al 3++2SO 2-4。铝离子发生水解反应,生成的氢氧化铝胶体具有很强的吸附能力,吸附水中的悬浮物,使之沉降以达到净水目的:Al 3++3H 2O
Al(OH)3(胶体)+3H +
。 3.铁、铜及其化合物
(1)Fe 与Cl 2反应只能生成FeCl 3,与I 2反应生成FeI 2,与反应物的用量无关。
(2)Fe 与水蒸气在高温下反应生成H 2和Fe 3O 4,而不是Fe 2O 3。
(3)过量的Fe 与硝酸作用,或在Fe 和Fe 2O 3的混合物中加入盐酸,均生成Fe 2+。要注意产生的Fe 3+还可以氧化单质Fe 这一隐含反应:Fe +2Fe 3+===3Fe 2+。
(4)NO -3与Fe 2+在酸性条件下不能共存。
(5)Fe 2O 3、Fe(OH)3与氢碘酸反应时,涉及Fe 3+与I -的氧化还原反应,产物为Fe 2+、I 2和H 2O 。
(6)FeCl 3溶液加热浓缩时,因Fe 3+水解和HCl 的挥发,得到的固体为Fe(OH)3,灼烧后得到红棕色Fe 2O 3固体;而Fe 2(SO 4)3溶液蒸干时,因硫酸是难挥发性的酸,将得不到Fe(OH)3固体,最后得到的固体仍为Fe 2(SO 4)3。
(7)注意亚铁盐及Fe(OH)2易被空气中氧气氧化成三价铁的化合物。如某溶液中加入碱溶液后,最终得到红褐色沉淀,并不能断定该溶液中一定含有Fe 3+,也可能含有Fe 2+。
例1、用类推的方法可能会得出错误结论,因此推出的结论要经过实践的检验才能确定其正确与否。下列推论中正确的是( )
A .Na 失火不能用CO 2灭火,K 失火不能用CO 2灭火
B .工业上用电解熔融MgCl 2的方法制取金属镁,也用电解熔融AlCl 3的方法制取金属铝
C .Al 与S 直接化合可以得到Al 2S 3,Fe 与S 直接化合也可以得到Fe 2S 3
D .Fe 3O 4可以写成FeO·Fe 2O 3的形式,Pb 3O 4也可写成PbO·Pb 2O 3的形式
【答案】A
【解析】 AlCl 3为共价化合物,熔融状态不导电,故不能用电解熔融AlCl 3的方法制取金属铝;Fe 与S 直接化合只能生成FeS ;Pb 3O 4中铅的化合价分别为+2和+4,故Pb 3O 4应写成2PbO·PbO 2的形式。
【变式探究】由熔盐电解法获得的粗铝含一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝,工艺流程如下:
(1)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,相关的化学方程式为①__________________和②__________________________。
(2)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除Cl2外还含有________;固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在________。
(3)在用废碱液处理气体A的过程中,所发生反应的离子方程式为_____________________________。
(4)镀铝电解池中,金属铝为________极,熔融盐电镀液中铝元素和氯元素主要以AlCl和Al2Cl形式存在,铝电极的主要电极反应式为___________________________________。
(5)钢材镀铝后,表面形成的致密氧化铝膜能防止钢材腐蚀,其原因是_________________________。
生
【解析】 (1)结合题意,即是Fe2O3、SiO2和金属Al在高温下发生置换反应;(2)杂质中还存在H2,与Cl2结合形成HCl,高温下Cl2也能与Na和Al反应生成NaCl和AlCl3(700 ℃时升华形成气体);(3)冷凝后的气体Cl2和HCl均能与碱液反应;(4)电镀时,镀层金属作阳极,失电子形成阳离子,即Al失电子形成Al3+,Al3+再与AlCl结合形成Al2Cl;(5)防止腐蚀的原理包括隔绝金属与电解质溶液的接触、改变金属内部结构等。
【点评】以金属及其化合物的基本知识为命题线索,设置情境,或者结合某些新技术等命题来考查
考生综合运用基本知识来解决实际问题的能力是近几年高考中的一个新动向,尤其是新课标试验区的高考题,频频出现。因此在复习过程中既要注重基础知识复习,更要注重综合能力的提升。
考点二 常见金属与其化合物的转化
两种常见金属及其化合物的转化形式:
1.直线型转化关系
A ――→X
B ――→X C
(1)Na ――→O 2Na 2O ――→O 2Na 2O 2
(2)X 为强酸,如NaAlO 2――→HCl Al(OH)3――→HCl AlCl 3
(3)X 为强碱,如AlCl 3――→NaOH Al(OH)3――→NaOH NaAlO 2
2.三角型转化关系
例2、物质A 、B 、C 、D 为中学常见单质,其组成元素的原子序数依次减小,且其中只有三种是短周期元素,B 为黄绿色气体。试根据图12-3中物质的相互转化关系回答下列问题。
(1)A 的化学式为________。
(2)在FG 的转化中,A 的作用是________;在①~⑥的反应中,不属于氧化还原反应的是________。(多填或少填无分)
(3)写出A 在高温下与H 反应的化学反应方程式并标出电子转移的方向和数目:
_____________________________。
(4)写出反应⑥的化学反应方程式:___________________。
(5)已知在101 kPa 条件下,2 mol D 完全燃烧生成液态生成物放出571.6 kJ 热量;请书写表示D 燃
烧热的热化学方程式:_________________________________________。
【答案】(1)Fe (2)还原剂⑤⑥
(5)在氢气燃烧热的热化学方程式中,氢气的化学计量数必须是1 mol。
【变式探究】A~I分别表示中学化学中常见的一种物质,其中A、I为常见金属,它们之间的相互关系如图12-4所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F 六种物质中均含同一种元素。
图12-4
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中的位置是___________________。
(2)写出C物质的化学式:________。
(3)写出下列反应的化学方程式或离子方程式:
反应①的化学方程式:__________________________;
反应④的离子方程式:____________________________;
反应⑥的化学方程式: ____________________。
(4)从能量变化的角度看,反应①②③中,属于ΔH<0的反应是________。(填序号)
【答案】(1)第四周期第Ⅷ族
(2)FeCl 2
(3)8Al +3Fe 3O 4=====高温4Al 2O 3+9Fe
2Al +2OH -
+2H 2O===2AlO -2+3H 2↑
4Fe(OH)2+O 2+2H 2O===4Fe(OH)3
(4)①②
【解析】 G 为主族元素的固态氧化物,由G 可以与NaOH 反应和反应③,猜测G 是Al 2O 3,则J 是NaAlO 2,G 电解得到金属铝和氧气,由反应④可知,I 是金属铝,H 是氧气,联想反应①为铝热反应,A 在氧气燃烧得到B ,可知B 是Fe 3O 4,A 是金属铁,Fe 3O 4与盐酸反应生成Fe 2+和Fe 3+,从反应流程可以看出,C 是FeCl 2,E 是Fe(OH)2,F 是Fe(OH)3。反应⑤为Fe 3O 4+8HCl===FeCl 2+2FeCl 3+4H 2O ,反应⑥为4Fe(OH)2+O 2+2H 2O===4Fe(OH)3。
考点三 金属及其化合物的实验探究
有关金属及其化合物探究实验的特点:要求考生对文字、图形、表格数据、反应流程中的信息进行提取、分析、猜想和归类,考查学生基础知识的综合应用、基本的实验方法和基本技能的掌握程度,考查学生对科学探究方法和过程的理解,对实验的评价。
例3、铁不能与冷、热水反应,但能与水蒸气反应。资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570 ℃时,生成FeO ,高于570 ℃时,生成Fe 3O 4。老师用如图12-5所示实验装置,完成还原铁粉与水蒸气反应的演示实验。
(1)实验中使用肥皂液的作用是__________________。
(2)甲同学为探究实验后试管内的固体含有哪些物质,进行了下列实验:
图12-5
34___________________。
