辽宁省葫芦岛市第八高级中学 2020学年高二化学上学期第二次月考试题(实验班,无答案)
辽宁省葫芦岛市第八高级中学2019-2020学年高二化学上学期期中试题(含解析)
D. 植物通过光合作用将CO2转化为葡萄糖是太阳能转变成化学能的过程,D错误;
故选B.
3。下列热化学方程式中△H代表燃烧热的是( )
A. CH4(g)+3/2O2(g)=2H2O(l)+CO(g) △H1
B。 S(s)+3/2O2(g)=SO3(s) △H2
【详解】A、反应热与物质的聚集状态及物质的量有关,物质状态不同、物质的量不同,反应热不同,故A错误;
B、反应热量变化需要说明物质 聚集状态,物质状态不同,反应能量变化不同,故B错误;
C、C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.3kJ·mol—1表示1mol固态碳和1mol水蒸气反应生成1mol一氧化碳气体和1mol氢气并吸收131。3kJ热量,故C正确;
故选C.
4.已知下列热化学方程式:
(1)CH3COOH (l)+2O2(g) == 2CO2(g)+2H2O (l) ΔH1=-870。3 kJ·mol-1
(2)C(s)+ O2(g) == CO2(g) △H2=—393。5 kJ•mol-1
(3)H2(g) + O2(g) == H2O(l) △H3=-285。8kJ·mol-1
辽宁省葫芦岛市第八高级中学2019-2020学年高二化学上学期期中试题(含解析)
一、选择题(每题3分,共20题)
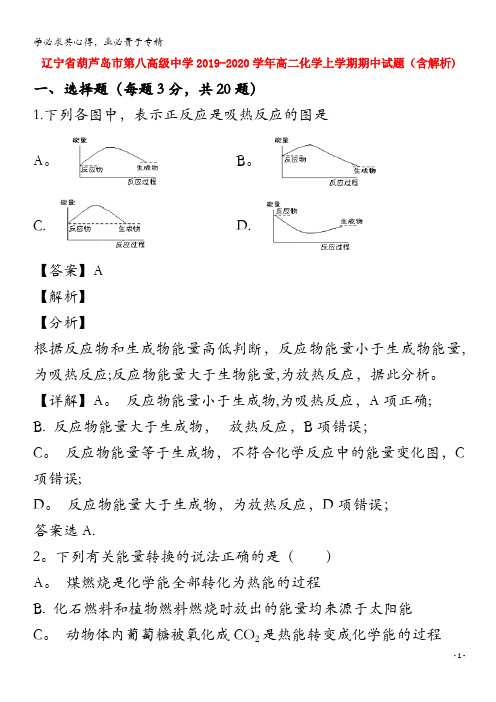
1.下列各图中,表示正反应是吸热反应的图是
A。 B。
C. D.
【答案】A
【解析】
【分析】
根据反应物和生成物能量高低判断,反应物能量小于生成物能量,为吸热反应;反应物能量大于生物能量,为放热反应,据此分析。
辽宁省葫芦岛市第八高级中学2020届高三化学上学期期中试题(实验班,含解析)

【答案】D
【解析】
【分析】
水的电离平衡H2O H++OH—,H+和OH-能抑制水的电离,能水解的盐促进水的电离。
【详解】①H+对水的电离起到抑制作用②Cl-对水的电离无影响③Al3+能结合水电离产生的OH-生成弱碱Al(OH)3,促进水的电离④K+对水的电离无影响⑤S2-能结合水电离产生的H+生成HS—,促进水的电离⑥OH-使水的电离平衡逆移⑦NO3-对水的电离无影响⑧NH4+能结合水电离产生的OH-生成弱电解质NH3·H2O,促进水的电离。故选D.
C、电解质导电,需要条件,即水溶液或熔融状态,因此纯硫酸不导电,故错误;
D、OH-离子浓度相同,溶液中导电离子的浓度以及所带电荷数相同,因此导电能力相同,故正确;
答案选D。
2.在下列实验方法中,不能证明醋酸是弱酸的是( )
A 25 ℃时,醋酸钠溶液呈碱性
B. 25 ℃时,0。1 mol/L的醋酸的pH约为3
④H2CO3是弱电解质,在水溶液中部分电离,离子浓度很小,
所以自由移动离子数目由大到小的排列顺序为②③①④,
故合理选项是C。
【点睛】本题以离子数目计算为载体考查强弱电解质及电解质电离特点,明确硫酸氢钠在熔融状态下和水溶液里电离方式区别是解题关键,注意强酸酸式盐和弱酸酸式盐电离不同点。
9。将0.1mol·L-1的下列物质的水溶液,从常温加热到90 ℃,溶液的pH不变的是
5。相同温度下,已知下面三个数据:①7.2×10﹣4、②2。6×10﹣4、③4.9×10﹣10分别是三种酸的电离平衡常数,若已知这三种酸可发生如下反应:NaCN+HNO2═HCN+NaNO2NaNO2+HF═HCN+NaF NaNO2+HF═HNO2+NaF由此可判断下列叙述中正确的是( )
辽宁省葫芦岛市第八中学高二化学上学期第一次月考试题(无答案)

辽宁省葫芦岛市第八中学2016-2017学年高二化学上学期第一次月考试题(无答案)答题时间: 90 分钟总分数: 100分所需相对原子质量:H-1 C—12 N-14 O-16 Na—23Mg—24 Al- 27 S—32 Cu-64 Zn—65一、选择题:(每题只有一个正确答案,每题3分,共60分)1、已知33A s、35Br位于同一周期,下列关系正确的是A. 原子半径:As>Cl>PB. 热稳定性:HCl>AsH3>HBrC. 还原性:As3―>S2―>Cl―D.酸性:H3AsO4>H2SO4>H3PO42、下列有关化学用语使用正确的是A. NH4Br的电子式:B. S2―的结构示意图:ClC. 乙酸的分子式:CH3COOHD. 原子核内有19个中子的氯原子:35173、短周期元素R、T、Q、W在元素周期表中的相对位置如下图所示,其中T所处的周期序数与族序数相等。
下列判断不正确的是A.最简单气态氢化物的热稳定性:R>Q B.最高价氧化物对应水化物的酸性:Q<WC.原子半径:T>Q>R D.含T的盐溶液一定能与碱反应4、下列关于化学键的叙述,正确的一项是A. 离子化合物中一定含有离子键B. 单质分子中均不存在化学键C. 全部由非金属元素形成的化合物中不可能含有离子键D.含有共价键的化合物一定是共价化合物5、下列关于原子结构、元素性质的说法正确的是A. 非金属元素组成的化合物中只含共价键B. IA族金属元素是同周期中金属性最强的元素C. 同种元素的原子均有相同性质的质子数和中子数D. VIIA族元素的阴离子性还原性越强,其最高价氧化物对应水化物的酸性越强6、某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。
下列有关叙述正确的是A.该反应为放热反应 B.催化剂能改变该反应的焓变C.催化剂能降低该反应的活化能 D.逆反应的活化能大于正反应的活化能7、①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池,①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。
辽宁省2020-2021年高二上学期第二次段考化学试卷

辽宁省2020-2021年高二上学期第二次段考化学试卷姓名:________ 班级:________ 成绩:________一、选择题 (共16题;共33分)1. (2分) (2019高一下·东阳期中) 已知C(s)+H2O(g)=CO(g)+H2(g) ΔH=akJ·mol-1 , 2C(s)+O2(g)=2CO(g) ΔH=-220kJ·mol-1 , H-H、O=O和O-H键的键能为436 kJ·mol-1、496 kJ·mol-1和462kJ·mol -1 ,则a为()A . -350B . +130C . +350D . -1302. (2分) (2016高二上·青海期中) 己知:HCN(aq)与NaOH(aq)反应的△H=﹣12.1KJ/mol;HCl(aq)与NaOH(aq)反应的△H=﹣55.6KJ/mol.则HCN在水溶液中电离的△H等于()A . ﹣67.7 KJ/molB . ﹣43.5 KJ/molC . +43.5 KJ/molD . +67.7 KJ/mol3. (2分)下列推断或表述正确的是()A . 澄清石灰水与足量小苏打溶液混合的离子方程式为:Ca2++OH-+HCO3-=CaCO3↓+H2OB . 向2.0mL浓度均为0.1 mol·L-1的KCl、KI混合液滴加1~2滴0.01 mol·L-1AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp小C . 将体积相同pH均为1的盐酸和醋酸加水稀释至pH为3,盐酸的体积变化大,证明醋酸是弱酸D . 25℃时,pH=4.7,浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液中。
c(CH3COO-)+c(OH-)>c (CH3COOH)+c(H+)4. (2分)下列各项中的两个量,其比例为2∶1的是A . 硫酸铵固体中n(NH4+)与n(SO42-)B . 相同温度下,0.02 mol/L的醋酸溶液与0.01 mol/L 醋酸溶液中的c(H+)C . 液面均在“0”刻度时,50 mL酸式滴定管和25 mL酸式滴定管内所盛溶液的体积D . 40℃时pH=7的(NH4)2SO4与NH3·H2O的混合液中,c(NH4+)与c(SO42-)5. (2分) (2019高二上·鹰潭期末) 下列说法正确的是()A . 某放热反应能自发进行,则该反应一定是熵增的反应B . 0.1 mol·L-1 CH3COONa溶液与0.05 mol·L-1盐酸等体积混合后的酸性溶液中:c(CH3COO -)>c(CH3COOH)>c(Cl-)>c(H+)C . pH相等的①(NH4)2SO4 ②NH4HSO4 ③NH4Cl三种溶液中,c(NH4+)大小:①>③>②D . 某温度时水的离子积常数KW=10-12 ,若将此温度下pH=11的NaOH溶液a L与pH=1的稀硫酸b L 混合,若所得混合液pH=2,则a∶b=9∶116. (2分) (2018高二上·佛山期末) 下列实验能达到预期目的的是()A . AB . BC . CD . D7. (3分) (2018高一上·江苏开学考) 可逆反应进行到一定程度会达到化学平衡状态,如K2Cr2O7溶液中存在平衡:Cr2O72- (橙色)+H2O 2CrO42- (黄色)+2H+。
辽宁省2020-2021年高二上学期第二次月考化学试卷(兴国班)

辽宁省2020-2021年高二上学期第二次月考化学试卷(兴国班)姓名:________ 班级:________ 成绩:________一、选择题 (共18题;共37分)1. (2分)(2017·湛江模拟) 对于常温下0.1mol•L﹣1氨水和0.1mol•L﹣1醋酸,下列说法正确的是()A . 0.1 mol•L﹣1氨水,溶液的pH>13B . 0.1 mol•L﹣1氨水加水稀释,溶液中c(H+)和c(OH﹣)都减小C . 0.1 mol•L﹣1醋酸溶液中:c(H+)=c(CH3COO﹣)D . 0.1 mol•L﹣1醋酸与0.1 mol•L﹣1NaOH溶液等体积混合所得溶液中:c(Na+)>c(CH3COO﹣)>c(OH ﹣)>c(H+)2. (2分)下列液体均处于25℃,有关叙述中,正确的是()A . 某溶液中水电离出的c(H+)=10﹣13 ,则该溶液的pH一定为13B . pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的2倍C . pH相同的氨水与盐酸等体积混合,所得溶液pH<7D . pH=7的CH3COOH与CH3COONa混合溶液中,c(Na+)=c(CH3COO﹣)3. (2分) (2018高二上·佛山期末) 化学与生产、生活、科技密切相关,下列有关说法错误的是()A . 为保护轮船的外壳,常在外壳上镶入锌块B . 明矾溶于水后产生具有吸附性的胶体粒子,可作漂白剂C . 燃料电池的能量转换效率远高于普通燃料燃烧的能量转换效率D . 锅炉水垢中的硫酸钙可用碳酸钠溶液处理,使之转化为碳酸钙,再用酸除去4. (2分) (2017高三上·白山期中) 向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是()A . a点对应的溶液中:Na+、Fe3+、SO42﹣、HCO3﹣B . b点对应的溶液中:Na+、S2﹣、SO42﹣、Cl﹣C . c点对应的溶液中:Ag+、Ca2+、NO3﹣、F﹣D . d点对应的溶液中:K+、NH4+、I﹣、CO32﹣5. (2分)某溶液中含有NH4+、SO32﹣、SiO32﹣、Br﹣、CO32﹣、Na+ ,向该溶液中通入过量的Cl2 ,下列判断正确的是()①反应前后,溶液中离子浓度基本保持不变的有四种②有胶状物质生成③有刺激性气味气体产生④溶液颜色发生变化⑤溶液中至少发生了3个氧化还原反应.A . ①②③④B . ①②③④⑤C . ①③④⑤D . ②④⑤6. (2分)能影响水的电离平衡,并使溶液中的c(H+)>c(OH﹣)的操作是()A . 向水中投入一小块金属钠B . 将水加热煮沸C . 向水中通入CO2气体D . 向水中加食盐晶体7. (3分)(2016·银川模拟) 下列有关物质的量浓度关系中,正确的是()A . 等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)=c(SO )>c(NH )>c(H+)>c (OH﹣)B . 室温下,pH=3的醋酸与pH=11的NaOH溶液等体积混合:c (Na+)>c (CH3COO﹣)>c(OH﹣)>c(H+)C . 浓度均为0.1 mol•L﹣1CH3COONa、NaHCO3、﹣ONa溶液中:若c(OH﹣)分别为c1、c2、c3 ,则c3>c2>c1D . NaHCO3溶液中:c(Na+)=c(H2CO3)+c(HCO )+2c(CO )8. (2分) (2015高一上·河源月考) 下列离子方程式正确的是()A . 稀硫酸滴在银片上:2Ag+2H+═2Ag++H2↑B . 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO ═BaSO4↓C . 硝酸银溶液与盐酸反应:Ag++Cl﹣═AgCl↓D . 澄清石灰水与碳酸钠溶液反应:Ca(OH)2+CO ═CaCO3↓+2OH﹣9. (2分) (2018高二上·黑龙江期中) 不同温度T1、T2时,硫酸钡在水中的溶解平衡曲线如图所示,已知硫酸钡的溶度积随温度升高而增大,下列说法正确的是()A . 升高温度,可以使溶液由b点变为d点B . 加入BaCl2固体,可以使溶液由a点变为c点C . c点表示在T1、T2温度下溶液中均有固体析出D . T1温度下,恒温蒸发溶剂,可以使溶液由d点变为T1曲线上a、b之间某一点10. (2分)下列各组物质相互混合反应,既有气体生成,最终又有沉淀生成的是()①铝投入NaOH溶液中②NaHCO3溶液滴入Al2(SO4)3溶液中③金属钠投入FeCl3溶液中④过量氨水滴入FeCl3溶液中⑤浓Ba(OH)2溶液滴入浓(NH4)2SO4溶液中⑥过量盐酸滴入NaAlO2溶液中A . ①②③B . ②③④C . ④⑤⑥D . ②③⑤11. (2分)常温下,实验测得下列四种物质的pH如图所示,下列说法错误的是()A . 苹果汁的c(H+)=0.3mol•L﹣1B . 生理盐水是一种中性溶液C . 石灰水的碱性比肥皂水强D . 石灰水与苹果汁能发生中和反应12. (2分) (2016高二下·新疆期中) 关于NaHCO3溶液,下列表述不正确的是()A . c(Na+)=c(HCO3﹣)+c(CO32﹣)+c(H2CO3)B . c(Na+)+c(H+)=c(HCO3﹣)+c(CO32﹣)+c(OH﹣)C . HCO3﹣的水解程度大于HCO3﹣的电离程度D . c(H+)+c(H2CO3)=c(OH﹣)+c(CO32﹣)13. (2分)常温下,向100mL 0.1 mol.L﹣1HCl的溶液p 中逐滴加入0.2mol.L﹣1MOH溶液的过程中,其pH变化如图所示(溶液体积变化忽略不计).下列说法中正确的是()A . MOH为一元强碱B . N点水的电离程度小于K点水的电离程度C . 在K点,c(M+)>c(Cl﹣)>c(OH﹣)>c(H+)D . K点对应的溶液中,有c( MOH)+c( M+)=0.2 mol.L﹣114. (2分) (2015高二下·锡山期中) 一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=﹣lgc(M),p(CO32﹣)=﹣lgc(CO32﹣).下列说法正确的是()A . MgCO3、CaCO3、MnCO3的Ksp依次增大B . a点可表示MnCO3的饱和溶液,且c(Mn2+)>c(CO32﹣)C . b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32﹣)D . c点可表示MgCO3的不饱和溶液,且c(Mg2+)>c(CO32﹣)15. (2分) (2014高二下·资阳期末) 下列各溶液中,相关微粒物质的量浓度关系错误的是()A . 0.1 mol·L-1NaHCO3溶液中:c(OH-)=c(H+)+c(H2CO3)-c(CO32-)B . 0.1 mol·L-1NH4Cl溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O)=0.1 mol·L-1C . pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-)D . 常温下,浓度为0.1 mol·L-1 NaHSO3溶液的pH<7:c(Na+)>c(HSO3-)>c(SO32-)>c(H+)16. (2分) (2017高二上·浦东期末) 用0.100mol/L标准盐酸溶液滴定20mL未知浓度的氢氧化钠溶液,下列操作会造成测定结果偏低的是()A . 装盐酸的滴定管用蒸馏水洗干净后立即装入盐酸B . 滴加盐酸时滴到锥形瓶外C . 滴定达到终点时,振荡时待测液溅出锥形瓶D . 滴定前装盐酸的滴定管有气泡,滴定后气泡消失17. (2分)(2018·泉州模拟) 无水氯化铝是常用的有机化工试剂,易水解、易升华。
辽宁省葫芦岛市高三化学上学期第二次月考试题新人教版

本试卷共分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
总分:100分时间:90分钟可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27 Si:28 P:31 S:32 Cl:35.5 Fe:56 Br:80第Ⅰ卷(选择题,共42分)一、选择题(本题共包括21小题,每小题2分,共42分,每小题只有一个选项....符合题意) 1.化学与生产、生活、社会密切相关。
下列有关说法中不正确的是( ) A.华裔科学家高琨在光纤传输信息领域中取得突破性成就,光纤的主要成分是高纯度的单质硅B.新能源汽车的推广与使用有助于减少光化学烟雾的产生C.2010年12月10日刚刚结束的联合国坎昆气候变化大会,其主要议题是节能减排的低碳经济。
低碳经济就是以低能耗、低污染、低排放为基础的经济发展模式D.超级病菌NDM1几乎对所有抗生素都具有抗药性,死亡率很高。
为防止超级病菌的感染,要加强环境、个人的卫生和消毒,其中消毒剂常选用含氯消毒剂、双氧水、酒精等适宜的物质2.下列物质的分类结果全部正确的是( )A.NO2——酸性氧化物Na2O2——碱性氧化物Al2O3——两性氧化物B.汽油——混合物胆矾——纯净物HD——单质C.纯碱——碱硫化氢——酸小苏打——酸式盐D.液氯——非电解质硫酸钡——强电解质醋酸——弱电解质3.水是最宝贵的资源之一。
下列表述正确的是( )A.H2O的电子式为B.4 ℃时,纯水的pH=7C.D162O中,质量数之和是质子数之和的两倍D.273K、101 kPa,水分子间的平均距离d:d(气态)>d(液态)>d(固态)4.下列关于有机物的说法正确的是( )A.乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去B.乙烯和苯都能使溴水褪色,褪色的原理相同C.淀粉、蛋白质完全水解的产物互为同分异构体D.石油裂解和油脂皂化都有高分子生成小分子的过程5.分子式为C4H10O并能与金属钠反应放出氢气的有机化合物有( ) A.3种 B.4种 C.5种 D.6种6.茉莉酸甲酯具有强烈而持久的茉莉花香,广泛用于人工配制的茉莉精油中,其结构简式如图所示。
辽宁省葫芦岛市第八高级中学2020-2021学年高二上学期期中考试化学试卷 含答案
B. SO2 的体积分数不再变化 D.各物质的浓度不再变化
14.下列说法正确的是( )
A.强电解质溶液的导电能力一定比弱电解质溶液强
B.中和等体积、等物质的量浓度的盐酸和醋酸溶液,两者所需氢氧化钠一样多
C.将氢氧化钠和氨水溶液各稀释一倍,两者的 OH-浓度均减少到原来的1 2
D.如果盐酸的浓度是醋酸浓度的二倍,则盐酸的 H+浓度也是醋酸的二倍。
B.CO(g)+H2O(g)=CO2(g)+H2(g)
C.2CO(g)+O2(g)=2CO2(g)
D.3O2(g)=2O3(g)
1
13.在一定温度下的容积不变的密闭容器中发生反应:2SO2(g)+O2(g)⇌ 2SO3(g)。下列不能
说明反应达到平衡状态的是( )
A.气体的压强不再变化 C.混合物的密度不再变化
C.v(N2)=0.2mol/(L•s)
C.v(NH3)=0.3mol/(L•s)
11.把石灰石浸入盐酸中,下列措施能使反应速率增大的是( )
①加大盐酸用量②增大盐酸浓度③粉碎石灰石④增大体系压强
A. ①④
B.①③
C.②③
D.③④
12.下列变化过程为熵增的是( )
A.2NH4NO3(s)=2N2(g)+4H2O(g)+O2(g)
热化学方程式。
20.写出电离方程式(每个 2 分,共 6 分)
(1)HClO (2) NH3•H2O (3)H2CO3 21.写出水解的离子方程式(每个 2 分,共 6 分)
(1)CH3COONa (2)NH4Cl (3)Na2CO3 20.(每空 2 分,共 16 分)某温度时,在一个 2L 的密闭容器中,X、Y、Z 气态三种物质的
辽宁省葫芦岛市第八高级中学2018届高三上学期第二次月考化学试题(实验班)缺答案
葫芦岛八高中2017–2018学年度上学期高三第二次月考考试试题(科目:化学命题人:马丽杰审核人:)答题时间:90分钟总分数:100分可能用到的相对原子质量:H-1 Ne—4 C-12 N—14 O—16 Na—23 P —31 Fe—56一、选择题(本题包括20小题,每小题3分,共60分,每小题只有一个选项符合题意)1。
下列选项中所涉及的两个量一定相等的是()A.电解精炼铜时阳极溶解与阴极析出的铜的质量B.6。
2gNa2O 和7.8gNa2O2中所含的离子数C。
11.2 LN2与14gCO气体所含有的原子数D.20g重水(D2O)与34gNH3所含有的电子数2.设NA表示阿伏加德罗常数的值,下列说法正确的是( )A标准状况下,2。
24 L CCl4中含Cl原子数目为0.4N AB白磷分子(P4)呈正四面体结构,12。
4 g白磷中含P—P键的数目为0。
6N AC.5。
6 g铁粉在2.24 L(标准状况)氯气中充分燃烧,失去的电子数为0. 3N AD常温常压下,10 g 46%的乙醇溶液中含氧原子总数为0.1N A3.美好的生活离不开化学,,我们应感恩化学,掌握必要的化学知识。
下列说法错误的是()A。
合理使用化肥可以提高农作物的产量B. 二氧化氯、臭氧均可用作自来水消毒剂C. 氢氧化铝和碳酸钠均可用于治疗胃酸过多D. 化妆品中的甘油可起到保湿滋润皮肤的作用4。
已知X、Y、Z、W、R是原子序数依次增大的五种短周期主族元素,其中Y、R原子最外层电子数相等;X元素最低负价绝对值与W元素最高正价相等;工业上常用电解熔融氧化物的方法冶炼W 单质;Z、W、R的最高价氧化物对应的水化物两两反应均生成盐和水。
下列说法正确的是( )A。
原子半径由大到小的顺序:Z、W、YB。
简单气态氢化物的稳定性由强到弱的顺序:X、Y、RC. W的最高价氧化物对应的水化物碱性比Z的强D。
R的最高价氧化物对应的水化物化学式一定是HRO5。
辽宁省葫芦岛市第八中学高二化学上学期第一次月考试题
辽宁省葫芦岛市第八中学2016-2017学年高二化学上学期第一次月考试题(无答案)答题时间: 90 分钟总分数: 100分所需相对原子质量:H-1 C—12 N-14 O-16 Na—23Mg—24 Al- 27 S—32 Cu-64 Zn—65一、选择题:(每题只有一个正确答案,每题3分,共60分)1、已知33A s、35Br位于同一周期,下列关系正确的是A. 原子半径:As>Cl>PB. 热稳定性:HCl>AsH3>HBrC. 还原性:As3―>S2―>Cl―D.酸性:H3AsO4>H2SO4>H3PO42、下列有关化学用语使用正确的是A. NH4Br的电子式:B. S2―的结构示意图:ClC. 乙酸的分子式:CH3COOHD. 原子核内有19个中子的氯原子:35173、短周期元素R、T、Q、W在元素周期表中的相对位置如下图所示,其中T所处的周期序数与族序数相等。
下列判断不正确的是A.最简单气态氢化物的热稳定性:R>Q B.最高价氧化物对应水化物的酸性:Q<WC.原子半径:T>Q>R D.含T的盐溶液一定能与碱反应4、下列关于化学键的叙述,正确的一项是A. 离子化合物中一定含有离子键B. 单质分子中均不存在化学键C. 全部由非金属元素形成的化合物中不可能含有离子键D.含有共价键的化合物一定是共价化合物5、下列关于原子结构、元素性质的说法正确的是A. 非金属元素组成的化合物中只含共价键B. IA族金属元素是同周期中金属性最强的元素C. 同种元素的原子均有相同性质的质子数和中子数D. VIIA族元素的阴离子性还原性越强,其最高价氧化物对应水化物的酸性越强6、某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。
下列有关叙述正确的是A.该反应为放热反应 B.催化剂能改变该反应的焓变C.催化剂能降低该反应的活化能 D.逆反应的活化能大于正反应的活化能7、①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池,①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。
2020年辽宁省葫芦岛市黑山科中学高二化学月考试题含解析
2020年辽宁省葫芦岛市黑山科中学高二化学月考试题含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. 可以用来分离蛋白质与氯化钠溶液的方法是()A.渗析B.过滤C.电泳D.分液参考答案:A2. 短周期元素中,原子基态时具有1个未成对电子的元素共有多少种:A.5 B.6 C.7 D.8参考答案:C略3. .对于可逆反应A(g)+2B (g)2C (g)(正反应吸热),下列图象中正确的是A B C D参考答案:D略4. 门捷列夫的突出贡献是()A. 提出原子学说B. 提出分子学说C. 发现元素周期律D. 发现能量守恒定律参考答案:C门捷列夫的突出贡献是发现了元素周期律,答案选C。
5. 已知汽车尾气无害化处理反应为:2NO(g) + 2CO(g) N2(g) + 2CO2(g)。
下列说法不正确的是A.反应达到平衡后,NO的反应速率为零B.使用高效催化剂可有效提高反应速率C.升高温度可使该反应的速率增大D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡参考答案:A略6. 下列有机物是的同系物的是()A.B.C.D.参考答案:B略7. 下列物质的用途不正确的是A.水玻璃可用作木材防火剂B.用大量的二氧化硫作食品漂白剂C.硅可用于制造太阳能电池D. 食醋可作食品酸味剂参考答案:B二氧化硫不能作食品漂白剂。
8. 有机物A是一种常用的内服止痛解热药。
1 mol A 水解得到1 mol B 和1 mol 醋酸。
A溶液具有酸性,不能使FeCl3溶液显色。
A的相对分子质量不超过200。
B 分子中碳元素和氢元素总的质量分数为0.652。
A、B都是由碳、氢、氧三种元素组成的芳香族化合物。
则下列推断中,正确的是()A.A、B的相对分子质量之差为60 B.1个B分子中应当有2个氧原子C.A的分子式是C7H6O3D.B能与NaOH溶液、FeCl3溶液、浓溴水等物质反应参考答案:D9. 工业上接触法制硫酸的生产中,下列措施有利于提高SO2转化率的是()①V2O5作催化剂②通入过量O2③两次氧化④SO2、O2循环使用⑤通过热交换器进行热交换⑥通入过量的SO2A.①②③B.②③④⑤C.②③④⑤⑥D.①⑤⑥参考答案:B解析:①用催化剂只能增大化学反应速率,不影响化学平衡;⑥中通入过量的SO2,必然导致SO2的转化率降低。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
葫芦岛市八高中2020 –2020 学年度上学期高二年级实验班 考试试题化学 答题时间: 90分钟 总分数: 100分 一.选择题(单选.每题3分) 1.一定温度时,测得纯水中c(OH-)=2.5×10-7 mol·L-1,则c(H+)为 ( ) A.2.5×10-7 mol·L-1 B.1.0×10-7 mol·L-1 C.1×10-142.5×10-7 mol·L-1 D.无法确定c(H+) 2.在盐酸滴定NaOH溶液的实验中,以甲基橙为指示剂,滴到终点时的颜色变化是 ( ) A.由黄色变红色 B.由黄色变橙色 C.由橙色变红色 D.由红色变橙色 3.将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g) 2HBr(g)0H<, 平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是 ( ) A. a>b B. a=b C. a<b D. 无法确定 4.用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考右图,从下表中选出 正确选项 ( ) A.①② B.①③ C.②④ D.③④ 5.常温时,将pH=3的盐酸和pH=11的氨水等体积混合后,所得的溶液pH ( ) A.等于7 B.大于7 C.小于7 D.无法确定 6.反应:A(气)+3B(气) 2C(气) △H<0达平衡后,将气体混和物的温度降低,下列叙述中正确的是 ( ) A.正反应速率加大,逆反应速率变小,平衡向正反应方向移动 B.正反应速率变小,逆反应速率加大,平衡向逆反应方向移动 C.正反应速率和逆反应速率都变小,平衡向正反应方向移动 D.正反应速率和逆反应速率都变小,平衡向逆反应方向移动 7.用物质的量均是0.1 mol的CH3COOH和CH3COONa配成1L混合溶液,已知其中c(CH3COO-)大于c(Na+),对该混合溶液的下列判断正确的是 ( ) A.c(H+)>c(OH-) B.c(CH3COO-)+c(CH3COOH)=0.1 mol·L-1 C.c(CH3COOH)>c(CH3COO-) D.c(CH3COO-)+c(OH-)=0.1 mol·L-1 8.下列依据热化学方程式得出的结论正确的是 ( ) A.已知C(石墨,s)=C(金刚石,s) ΔH > 0,则金刚石比石墨稳定 B.已知C(s)+O2(g)=CO2(g) ΔH1 ; C(s)+1/2O2(g)=CO(g) ΔH2,则ΔH2>ΔH1 C.已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol D.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ/mol,则含20 g NaOH的稀溶液与稀盐酸完全中和,中和热为28.65 kJ/mol 9.下列叙述正确的是 ( ) A.硫酸铵溶液中加入适量氨水,当溶液的pH=7时,c(SO42-)>c(NH4+) B.常温下,等物质的量浓度的 (NH4)2CO3 和Na2CO3溶液,前者的c(HCO3-)小 C.NaHCO3溶液中离子浓度有如下关系:c(CO32-)+c (OH-)=c (H+)+c(H2CO3) D.等物质的量浓度、等体积的NaX和弱酸HX溶液混合后,各粒子浓度关系是: c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+)
10.在密闭容器中发生反应:aX(g)+bY(g)cZ(g)+dW(g)当反应达到平衡后,保持温度不变,将气体压缩到原来的1/2体积,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述中不正确的是 ( ) A.平衡向逆反应方向移动 B.a + b > c + d C.Z的体积分数减小 D.X的转化率减小
11.下列各图中,表示正反应是吸热反应的是:
A B C D
12.已知反应3A(g)+B(g)C(s)+4D(g)+Q,右图中a、b表示一定条件下,D的体积分数随时间t的变化情况。若要使曲线b变为曲线a,可采取的措施是:①增大B的浓度 ②升高反应温度 ③缩小反应容器的体积(加压) ④加入催化剂 A ①② B ①③ C ②③ D ③④ 13.一定温度下,可逆反应A2(g)+B2(g)2AB(g)达到平衡状态的标志是: A.单位时间内生成 n mol A2,同时生成 n mol AB B.体系内的总压不随时间变化 C.单位时间内生成2n mol AB的同时生成n mol B2
锥形瓶中的液 滴定管中的溶液 选用指示剂 选用滴定管 ① 碱 酸 石蕊 (乙) ② 酸 碱 酚酞 (甲) ③ 碱 酸 酚酞 (甲) ④ 酸 碱 酚酞 (乙)
装订线内禁止答题
班级 姓名 考号 D.单位时间内生成 n mol A2的同时,生成n mol B2 14.下列事实不能用勒夏特列原理解释的是: A.开启啤酒瓶后,瓶中马上泛起大量泡沫 B.由H2(g)、I2(g)、HI(g)组成的平衡体系,加压后颜色加深 C.实验室中常用排饱和食盐水的方法收集氯气 D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 15.下列离子方程式中,属于水解反应的是: A.HCOOH+H2OHCOO— + H3O+ B.CO2+H2OHCO3— + H+ C.CO32— + H2OHCO3— + OH— D.HS— + H2OS2— + H3O+ 16.在下列溶液中,各组离子一定能够大量共存的是: A.使酚酞试液变红的溶液: Na+、Cl-、SO42-、Fe3+ B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- C.c(H+)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br- D.碳酸氢钠溶液:K+、SO42-、Cl-、H+ 17.25℃时,在NH4+的浓度均为1mol·L-1的(NH4)2SO4 、(NH4)2CO3 、(NH4)2Fe(SO4)2的溶液中,测得三种物质的浓度分别为a、b、c(mol·L-1),则下列判断正确的是: A. a>b>c B. c>a>b C. b>a>c D. a >c>b 18.下列叙述正确的是 A.95 ℃纯水的pH<7,说明加热可导致水呈酸性 B.pH = 3的醋酸溶液,稀释至10倍后pH<4 C.0.2 mol·L-1的盐酸,与等体积水混合后pH =3 D.pH = 3的醋酸溶液,与pH = 11的氢氧化钠溶液等体积混合后pH = 7 19.根据下列热化学方程式 (1)C(s) + O2(g) = CO2(g) △H1=–393.5 kJ/mol (2)H2(g) + 21O2(g) =H2O(l) △H2=–285.8 kJ/mol (3)CH3COOH(l) +2O2(g)=2CO2 (g) + 2H2O(l) △H3=–870.3kJ/mol 可以计算出2C(s) + 2H2(g)+ O2(g)=CH3COOH(l)的反应热为: A.△H=244.1kJ/mol B.△H=-488.3kJ/mol C.△H=-996.6kJ/mol D.△H=996.6kJ/mol 20.在室温下,100ml 0.1mol/L的醋酸溶液中,欲使其溶液的pH值减小,但又要使醋酸电离程度减少,应采取
A.加入少量CH3COONa固体 B.通入少量氯化氢气体 C.提高温度 D.加入大量水 第Ⅱ卷 (选择题 共40分) 二.填空题(本题包括4小题,共52分) 21.(12分)向恒容密闭容器中充入一定量 PCl5,在温度为T时发生反应PCl5(g) PCl3(g)+Cl2(g) ΔH=+124 kJ·mol-1。回答下列问题: (1)要提高上述反应的转化率,可采取的措施有______________。 (2)在热水中,五氯化磷完全水解,生成磷酸(H3PO4),该反应的化学方程式是_______________________________________________。若将0.01 mol PCl5投入热水中,向其中滴加NaOH溶液至酸恰好被完全中和生成正盐,继续加水得到1 L溶液,再逐滴加入AgNO3溶液,先产生的沉淀是____________[已知Ksp(Ag3PO4)=1.4×10-16,Ksp(AgCl)=1.8×10-10]。 (3) 已知白磷(P4)的燃烧热为3093.2 kJ/mol,请写出白磷燃烧的热化学方程式 _____________________________________________。
22(18分)在2L密闭容器内,800℃时反应:2NO(g)+O2(g)错误!未找到引用源。2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) 0 1 2 3 4 5 n(NO)(mol) 0.020 0.010 0.008 0.007 0.007 0.007
(1)写出该反应的平衡常数表达式:K= 。 已知:300CK>350CK,则该反应是 热反应。 (2)右图中表示NO2的变化的曲线是 。 用O2表示从0~2 s内该反应的平均速率v= 。 (3)能说明该反应已达到平衡状态的是 。
班级
姓名 a.v(NO2)=2v(O2) b.容器内压强保持不变 c.v逆(NO)=2v正(O2) d.容器内密度保持不变 (4)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。 a.及时分离除NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂 23(10分)实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度,在实验室中进行如下实验,请完成下列填空: (1) 配制100mL 0.10mol/L NaOH标准溶液。 (2) 取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。 实验编号 NaOH溶液的浓度 (mol/L) 滴定完成时,NaOH溶液滴入的体积(mL) 待测盐酸溶液的体积 (mL) 1 0.10 22.62 20.00 2 0.10 22.72 20.00 3 0.10 22.80 20.00 ①滴定达到终点的现象是 ,此时锥形瓶内溶液的pH为 。 ②根据上述数据,可计算出该盐酸的浓度约为 (保留两位有效数字) ③排去碱式滴定管中气泡的方法应采用操作 ,然后轻轻挤压玻璃球使尖嘴部分充满碱液。 甲 乙 丙 ④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。(多选扣分) A、滴定终点读数时俯视读数 B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗 C、锥形瓶水洗后未干燥 D、称量前NaOH固体中混有Na2CO3固体 E、配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3 F、碱式滴定管尖嘴部分有气泡,滴定后消失
