饱和甘汞电极和氯化银电极换算
甘汞电极的电极电势

甘汞电极的电极电势甘汞电极(Ag-AgCl电极)是一种常用的电化学电极,它由银电极和氯化银电极组成,广泛应用于生物、化工等领域的化学分析和电化学实验中。
甘汞电极适用于大多数溶液和介质环境,例如自然水体、几乎中性和弱碱性溶液,以及生物体系中。
甘汞电极的电极电势,是指它与标准氢电极之间的电位差,并且通常以表观电极电势(Eº)的形式呈现。
甘汞电极作为标准参考电极,其表观电极电势被定义为0.1976±0.0001V(25℃下)。
那么,甘汞电极的电极电势是如何产生的呢?这其实涉及到电化学原理中的两个重要概念:电极反应和电位。
电极反应指的是在电极上发生的化学反应,它可以将一种化学物质转化为另一种化学物质,并产生电荷或电流。
电位则是电极在特定条件下所具有的电势,也就是说,对于同一半反应,不同的电位值代表着不同的反应状态。
因此,甘汞电极的电位即为电极反应的电位。
在甘汞电极中,银电极起到氧化剂(Anode)的作用,氯化银电极则起到还原剂(Cathode)的作用。
电极反应可以表示为:Ag(s)→Ag+(aq)+e-(氧化)综合两个反应可以得到:在这个反应中,Ag+(aq)是氧化剂,Cl-(aq)是还原剂。
与标准氢电极相比,甘汞电极的电势更加稳定和易于操作。
当使用甘汞电极进行电化学实验时,需要将它与待测样品溶液建立联系。
此时,甘汞电极的电势就会随着样品溶液的特性而发生变化。
例如,如果待测溶液中含有不同的离子种类或浓度,那么甘汞电极的电势就会受到不同程度的影响。
通常,通过使用标准缓冲溶液或标准试剂,可以得到较为准确的甘汞电极电势值。
需要注意的是,甘汞电极在操作过程中需要注意保持干燥、清洁和无损伤,避免外部环境对其电位产生影响。
此外,甘汞电极也需要定期校正和维护,以确保其电势值的准确和稳定。
饱和甘汞电极的电极反应式

饱和甘汞电极的电极反应式饱和甘汞电极的电极反应式一、前言在化学分析中,电极是不可或缺的重要工具。
其中,饱和甘汞电极是最常用的一种电极之一。
本文将详细介绍饱和甘汞电极的电极反应式。
二、什么是饱和甘汞电极饱和甘汞电极是由金属汞(Hg)制成的,它与其溶液中的离子之间形成一个平衡态。
当这个平衡态达到稳定时,就称为饱和甘汞电极。
三、饱和甘汞电极的组成1. 金属汞(Hg)2. 溶剂:通常为氯化钾(KCl)溶液3. 铅盖:用于密封四、饱和甘汞电极的作用原理在饱和甘汞电极中,金属汞(Hg)与其溶液中的离子之间形成一个平衡态。
Hg + X- ↔ HgX (X-代表离子)在这个反应式中,金属汞(Hg)可以与任何离子结合形成相应的盐。
例如,当钾离子(K+)存在时,金属汞(Hg)可以与其结合形成氯化汞(HgCl2)。
因此,饱和甘汞电极可以用于测量离子的活度。
五、饱和甘汞电极的电极反应式在饱和甘汞电极中,金属汞(Hg)可以与任何离子结合形成相应的盐。
因此,饱和甘汞电极的电极反应式具有多样性。
以氯化钾溶液为例:1. 氯离子(Cl-)Hg + Cl- ↔ HgCl2. 银离子(Ag+)Hg + Ag+ ↔ HgAg3. 溴离子(Br-)Hg + Br- ↔ HgBr4. 碘离子(I-)Hg + I- ↔ HgI六、总结以上就是关于饱和甘汞电极的电极反应式的详细介绍。
在实际应用中,我们需要根据实验需求选择不同的反应式进行测量。
同时,在使用饱和甘汞电极时,还需要注意保持其稳定性,并进行定期检查以确保准确性。
电化学

例:电位滴定法确定酸碱滴定的终点
乌梅
【含量测定】
取本品最粗粉约4g,精密称定,置锥形瓶中, 精密加水100ml,加热回流4小时,放冷,滤过, 弃去初滤液,收集续滤液。精密量取续滤液 20ml,加水至80ml,照电位滴定法,用氢氧化 钠滴定液滴定,即得。
本品含有机酸以枸橼酸计,不得少于15.0%。
5
§1 基本原理 一、Nernst方程
注 意: cOx、cRed 包括了所有参加电极反应的物质 固体或液体的活度定为1
6
二、化学电池
(一)分类(根据电极反应是否能自发进行) 1.原电池:将化学能转化为电能的装置(自发进行) 应用:直接电位法,电位滴定法 2.电解池:将电能转化为化学能的装置(非自发进行) 应用:永停滴定法
电流取决于浓度较低的 一方
37
二、基本概念 1、可逆电对:I2/I- ,外加很小电压就能电解
不可逆电对:S4O62-/ S2O32-,外加很大电压才能电解 2、可逆电对:电流取决于浓度小的型体
[Ox]=[Red]时电流最大 不可逆电对:无电流
38
三、分类: 根据滴定过程的电流变化,分为3种类型
VSP
Fe3+ + e → Fe2+
( ) f = f q + 0.059 lg aFe3+ aFe2+
应用:测定氧化型、还原型浓度或比值
10
4.膜电极(离子选择电极) 以固体膜或液体膜为传感体,用以指示溶 液中某种离子浓度的电极 应用:测定某种特定离子 例:测量溶液pH用的玻璃电极;各种离子选择 性电极
40
小结 玻璃电极的使用注意事项 pH计的使用步骤 电位法指示终点的原理(内插法) 永停滴定法终点的确定
电极电势详细资料大全

电极电势详细资料大全为了获得各种电极的电极电势数值,通常以某种电极的电极电势作标准与其它各待测电极组成电池,通过测定电池的电动势,而确定各种不同电极的相对电极电势( electrode potential)E值。
1953年国际纯粹化学与套用化学联合会(IUPAC)的建议,采用标准氢电极作为标准电极,并人为地规定标准氢电极的电极电势为零。
基本介绍•中文名:电极电势•外文名:electrode potential•提出者:能斯特•提出时间:1953年•套用学科:电化学等•适用领域范围:化学滴定分析,电池等定义来源,标准状态,影响因素,相关套用,判断氧化剂和还原剂的相对强弱,判断氧化还原反应的方向,判断反应进行的限度,电势图,定义来源双电层理论德国化学家能斯特(H.W.Nernst)提出了双电层理论(electrical double layers theory)解释电极电势的产生的原因。
当金属放入溶液中时,一方面金属晶体中处于热运动的金属离子在极性水分子的作用下,离开金属表面进入溶液。
金属性质愈活泼,这种趋势就愈大;另一方面溶液中的金属离子,由于受到金属表面电子的吸引,而在金属表面沉积,溶液中金属离子的浓度愈大,这种趋势也愈大。
在一定浓度的溶液中达到平衡后,在金属和溶液两相界面上形成了一个带相反电荷的双电层(electrical double layers),双电层的厚度虽然很小(约为10 -8厘米数量级), 但却在金属和溶液之间产生了电势差。
通常人们就把产生在金属和盐溶液之间的双电层间的电势差称为金属的电极电势(electrode potential),并以此描述电极得失电子能力的相对强弱。
电极电势以符号E(M n+/M)表示, 单位为V(伏)。
如锌的电极电势以E( /Zn) 表示, 铜的电极电势以E( /Cu) 表示。
电极电势的大小主要取决于电极的本性,并受温度、介质和离子浓度等因素的影响。
标准状态电极符号:Pt|H 2(100kPa)|H +(1mol/L) 电极反应: 右上角的符号“⊖”代表标准态。
饱和甘汞电极

饱和甘汞电极饱和甘汞电极:甘汞电极作为一种新型电极,早在上个世纪八十年代就被广泛应用于量子化学研究中。
它是一种可以直接将量子电子学模型转化为电荷分布的电极。
它具有独特的可调节、可编程、可定制的特性,是进行电荷分布的理想技术。
饱和甘汞电极是甘汞电极的变体,它可以把复杂的非线性电荷分布转化为可分析的线性电荷分布。
它的基本原理是用一种非线性的参数变量去描述电荷分布,然后用一种算法去将它转化为线性的电荷分布。
这样一来,就可以使用常用的数学和计算机工具来描述和处理电荷分布了。
饱和甘汞电极的应用主要是材料、分子研究中的电荷分布推断,可以用于将量子电子学模型转化为电荷分布,也可以说是将量子电子学模型转化为可以实际应用的结果。
此外,电极也可以用于离子蒸发分析,分子表征,及其他应用。
饱和甘汞电极技术在这几十年来受到了越来越多的关注,发展也异常迅速,研究人员们也采用了多种新技术进行改进。
研究人员也发展出了多种有用的算法,可以更加准确地描述和处理电荷分布。
另外,由于饱和甘汞电极技术的可编程性,它也可以用于其他复杂的应用中。
技术的发展和研究的进步使饱和甘汞电极技术得以深入研究,以及应用于实际应用中。
它的发展领域涉及到量子化学、材料科学、生物化学、物理化学等。
饱和甘汞电极的开发及其在研究中的应用,使研究人员们可以更加准确有效地理解量子化学模型,也更加直观地理解被研究对象的物理现象。
由于饱和甘汞电极具有良好的可调节性,可以完善地处理复杂的量子化学模型,在实际应用中也能取得很好的效果。
它的发展有助于我们更好地理解自然界,也能为我们提供更有效的分析和计算手段。
未来,饱和甘汞电极一定会得到更多的关注和应用,使更多的科学家受益于它的强大功能。
分析化学(书后习题参考答案)第八章 电位分析法

(b)pH=4.00 +
(c) pH= 4.00 +
3. 用标准甘汞电极作正极,氢电极作负极与待测的 HCl 溶液组成电池。在 25℃时, 测 得 E=0.342V。当待测液为 NaOH 溶液时,测得 E=1.050V。取此 NaOH 溶液 20.0ml,用上 述 HCl 溶液中和完全,需用 HCl 溶液多少毫升? 解:1.050 = 0.2828 — 0.059lgKw/[OH-] 0.342 =0.2828 — 0.059lg[H+] 需用 HCl 溶液 20.0ml 。 4. 25℃时,下列电池的电动势为 0.518V(忽略液接电位) : Pt H2(100kPa),HA(0.01mol·L-1)A-(0.01mol·L-1 )‖SCE 计算弱酸 HA 的 Ka 值。 解:0.518 = 0.2438— 0.059 lg Ka 0.01/0.01 Ka = 2.29×10-5 5. 已知电池:Pt H2(100kPa),HA(0.200mol·L-1)A-(0.300mol·L-1 )‖SCE 测得 E=0.672V。计算弱酸 HA 的离解常数(忽略液接电位) 。 解:0.672 = 0.2438-0.059lgKa 0.200/0.300 [OH- ]=0.100mol·L-1 [H+]=0.100mol·L-1
AgCl 开始沉淀时:[Ag+] = 1.56 × 10-10 / C mol·L-1,
mol·L-1, 相对误差=1.5×10-16C / 1.56×10-10/C = 0.0001%,这也说明 AgCl 开始沉淀时 AgI 已沉淀完全。 14. 在下列各电位滴定中,应选择何种指示电极和参比电极? 答:NaOH 滴定 HA(Ka C =10-8 ):甘汞电极作参比电极,玻璃电极作指示电极。 K2Cr2O7 滴定 Fe2+:甘汞电极作参比电极,铂电极作指示电极。 EDTA 滴定 Ca2+:甘汞电极作参比电极,钙离子选择性电极作指示电极。 AgNO3 滴定 NaCl:甘汞电极作参比电极,银电极作指示电极。
土壤氧化还原电位测定方法介绍
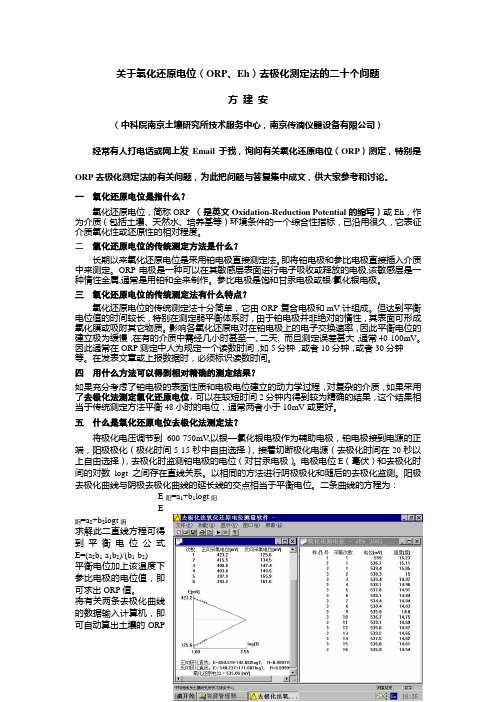
关于氧化还原电位(ORP、Eh)去极化测定法的二十个问题方建安(中科院南京土壤研究所技术服务中心,南京传滴仪器设备有限公司)经常有人打电话或网上发Email于我,询问有关氧化还原电位(ORP)测定,特别是ORP去极化测定法的有关问题,为此把问题与答复集中成文,供大家参考和讨论。
一氧化还原电位是指什么?氧化还原电位,简称ORP(是英文Oxidation-Reduction Potential的缩写)或Eh,作为介质(包括土壤、天然水、培养基等)环境条件的一个综合性指标,已沿用很久,它表征介质氧化性或还原性的相对程度。
二氧化还原电位的传统测定方法是什么?长期以来氧化还原电位是采用铂电极直接测定法。
即将铂电极和参比电极直接插入介质中来测定。
ORP电极是一种可以在其敏感层表面进行电子吸收或释放的电极,该敏感层是一种惰性金属,通常是用铂和金来制作。
参比电极是饱和甘汞电极或银/氯化银电极。
三氧化还原电位的传统测定法有什么特点?氧化还原电位的传统测定法十分简单,它由ORP复合电极和mV计组成。
但达到平衡电位值的时间较长,特别在测定弱平衡体系时,由于铂电极并非绝对的惰性,其表面可形成氧化膜或吸附其它物质。
影响各氧化还原电对在铂电极上的电子交换速率,因此平衡电位的建立极为缓慢,在有的介质中需经几小时甚至一、二天, 而且测定误差甚大,通常40-100mV。
因此通常在ORP测定中人为规定一个读数时间,如5分钟,或者10分钟,或者30分钟------等。
在发表文章或上报数据时,必须标识读数时间。
四用什么方法可以得到相对精确的测定结果?如果充分考虑了铂电极的表面性质和电极电位建立的动力学过程,对复杂的介质,如果采用了去极化法测定氧化还原电位,可以在较短时间2分钟内得到较为精确的结果,这个结果相当于传统测定方法平衡48小时的电位,通常两者小于10mV或更好。
五什么是氧化还原电位去极化法测定法?将极化电压调节到600-750mV,以银—氯化银电极作为辅助电极,铂电极接到电源的正端,阳极极化(极化时间5-15秒中自由选择),接着切断极化电源(去极化时间在20秒以上自由选择),去极化时监测铂电极的电位(对甘汞电极)。
sce的标准电极电势

sce的标准电极电势标准电极电势(Standard Electrode Potential,简称SCE)是电化学中一种重要的物理量,用于描述电化学反应的特性和电势差的大小。
在标准状态(温度为25摄氏度,溶液浓度为1 mol/L)下,不同物质的标准电极电势可进行比较和测定。
标准电极电势的测定是通过与参比电极接触,利用电池的方法来进行的。
参比电极是一个稳定电势的电极,被认为是参考标准。
常用的参比电极有饱和甘汞电极(Saturated Calomel Electrode,SCE)、饱和银-氯化银电极(Silver-Silver Chloride Electrode,Ag/AgCl)、铂电极等。
其中,SCE是最常用的标准参比电极之一,其电势被定义为0.241 V。
标准电极电势有重要的理论和实践意义。
它是与半电池的标准状态下的电势差有关的。
半电池就是两种电极间的电势差,它与物质的活性有关。
每种物质都有自己的标准电极电势,表示了该物质自发发生氧化或还原反应的趋势。
标准电极电势的正负号表示了氧化还是还原反应的可能性。
如果标准电极电势为正值,则更可能发生氧化反应;如果为负值,则更可能发生还原反应。
标准电极电势的测定可以通过测量电池的电动势来实现。
电动势是指电池两个电极之间的电势差,它是电化学反应中电子流动的驱动力。
测定电动势的方法有很多种,例如电位滴定法、电动势计法等。
通过将待测电极与参比电极组装成电池,然后测量电池的电动势,就可以计算出待测电极的标准电极电势。
据实验证明,标准电极电势与物质的结构和构成有关。
当物质的结构和构成发生变化时,其标准电极电势也会发生变化。
物质的标准电极电势可以通过对比氢气电极的电势差来测定。
氢气电极被认为是所有物质中最稳定的电极,其标准电极电势被定义为0V。
因此,通过与氢气电极接触的半电池的电势差就能够测定其他物质的标准电极电势。
标准电极电势在电化学中有着广泛的应用。
它可以用于预测电化学反应的方向和速率,以及评估电化学反应的可行性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
饱和甘汞电极和氯化银电极换算
(实用版)
目录
1.饱和甘汞电极和氯化银电极的简介
2.饱和甘汞电极的标准还原势
3.氯化银电极和饱和甘汞电极之间的换算方法
4.应用实例
5.结论
正文
一、饱和甘汞电极和氯化银电极的简介
饱和甘汞电极是一种常用的参比电极,通常被用于非水溶液中的测量,如有机溶剂、熔盐等介质中。
其标准还原势为 -0.126V,vs,sce(饱和
甘汞/甘汞纳)。
氯化银电极则是一种常用的离子选择电极,用于测量氯离子的浓度。
当以饱和甘汞电极作为参比电极时,可以进行氯化银电极和饱和甘汞电极之间的换算。
二、饱和甘汞电极的标准还原势
饱和甘汞电极的标准还原势为 -0.126V,vs,sce(饱和甘汞/甘汞纳)。
这是一个非常重要的参数,用于衡量电极的还原能力,也是进行电极换算的基础。
三、氯化银电极和饱和甘汞电极之间的换算方法
在进行氯化银电极和饱和甘汞电极之间的换算时,可以采用以下方法:
1.通过计算得出两种参比电极的电位差。
2.根据电位差,利用电极电位与浓度的关系,计算出待测离子的浓度。
四、应用实例
例如,在用氯化银晶体膜离子选择电极测定氯离子时,如果以饱和甘汞电极作为参比电极,应选用饱和甘汞盐桥。
这样,就可以利用饱和甘汞电极的标准还原势,计算出氯离子的浓度。
五、结论
饱和甘汞电极和氯化银电极之间的换算,是电化学测试中常见的一种换算方法。
