高三化学离子晶体1
高三化学复习:离子反应

高三化学复习:离子反应(一)电解质与非电解质,强电解质与弱电解质:1、电解质和非电解质a)在水溶液中或熔化状态能导电的化合物叫电解质,在水溶液中和熔化状态都不能导电的化合物叫非电解质。
b)电解质有酸、碱、盐、水、活泼金属氧化物等,其它化合物一般均为非电解质。
酸在水溶液中导电,强碱、大多数盐在熔化状态和水溶液中都导电,活泼金属氧化物只在熔化状态导电。
电解质导电靠自由移动的离子,自由移动的离子浓度越大、所带电荷越多则导电能力越强。
2、强电解质和弱电解质a)在水溶液中能全部电离不存在电离平衡的电解质为强电解质,强电解质有强碱、强酸和大多数盐。
它们的电离方程式写“===”号,多元强酸电离不分步,如:NaOH==Na++OH-Ca(OH)2===Ca2++ 2OH-H2SO4===2H++ SO42-Fe2(SO4)3===2Fe3++3SO42-b)在水溶液中部分电离存在电离平衡的电解质为弱电解质,弱电解质有弱酸、弱碱和水等。
它们的电离方程式写“可逆”号,多元弱酸电离分步,每步电离出一个H+,以第一步电离为主,如:NH3·H2ONH4++OH-CH3COOH CH3COO-+ H+H2CO3H++ HCO3-(为主),HCO3-H++CO32-H2O+H2O H3O++OH-(或简单写为H2O H++OH-)3、某些类型电解质电离的表示方法:两性氢氧化物:H+ + AlO2-+H2O Al(OH)3Al3+ + 3OH-强酸的酸式盐:NaHSO4Na+ + H+ + SO42-弱酸的酸式盐:NaHCO3Na+ + HCO3-复盐:KAl(SO4)2K+ + Al3+ + 2SO42-络合物:Ag(NH3)2OH Ag(NH3)2++OH-Na3AlF63Na++ AlF63-说明:1、电解质溶液导电的原因与金属导电的原因不同:电解质溶液导电是由于电离产生自由移动的阴、阳离子在外加电场作用下定向移动而导电,而金属导电则是由于金属晶体内部的自由电子在外加电场作用下的定向移动。
最新高三第一轮复习课件之离子反应课件ppt

离子方程式正误判断主要依据原则
1、必须符合物质反应的客观事实。
如Fe和稀盐酸反应:2Fe+6H+=2 Fe3++3H2↑× 2、必须遵守质量守恒定律;
3、必须遵守电荷守恒;
4、必须遵守定组成原理:全部参加反应的离子必 须按照反应物的组成比参加反应。
H++CO32-
(3)酸式盐的电离
NaHCO3:NaHCO3=Na++HCO3NaHSO4:NaHSO4=Na++H++SO42— 水溶液
NaHSO4=Na++HSO4- 熔融状态
四、离子反应
1.概念:
有离子参与的反应称为离子反应。离子反 应的共同特点是某些离子浓度的降低。
2.类型C、D ) A、铜和浓硫酸共热; B、煅烧大理石; C、电解熔融NaCl ; D、钠和水反应
3.离子反应的发生条件
(1)生成沉淀:熟悉常见物质的溶解性, 如Ba2+、Ca2+、Mg2+与SO42-、CO32-等反应 生成沉淀Ba2++CO32-=CaCO3↓、Ca2++ SO42-=CaSO4(微溶);Cu2+、Fe3+等与 OH-也反应生成沉淀如 Cu2++2OH-=Cu(OH)2↓, Fe3++3OH-=Fe(OH)3↓等
⑶多元弱酸的酸式盐的酸根离子在离 子方程式中不能拆开写。
例:1、NaHCO3与盐酸反应:
HCO3-+H+==H2O+CO2↑
强酸的酸式盐可以拆开 2、KHSO4与BaCl2反应:
SO42-+Ba2+==BaSO4↓
高三化学 化学工艺流程题(含答案

高高高高高高高高高高—高高高高高高高01高高高VIB高高高高高高高一、单选题(本大题共2小题,共4分)1.以铬铁矿为原料[Fe(CrO2)2]可制备K2Cr2O7和金属铬。
实验流程如下:下列说法中,不正确的是()A. 焙烧时不能使用陶瓷容器B. Na2S的作用是调节溶液的酸碱度和将重铬酸钠还原为氢氧化铬C. 在酸性溶液中CrO42−比Cr2O72−稳定D. 操作①包括过滤和洗涤。
实验室洗涤沉淀的操作是沿玻璃棒加水至浸没沉淀,待水自然滤出,重复2∼3次【答案】C【解析】【分析】本题考查实验制备方案设计,为高考常见题型,侧重考查学生的分析能力、实验能力,注意把握实验的原理以及物质的性质,把握实验操作的方法,难度中等。
【解答】A.高温下二氧化硅与碳酸钠反应,生成硅酸钠和二氧化碳,则焙烧时不能使用陶瓷容器焙烧,故A正确;B.Na2Cr2O7溶液中加入Na2S,发生氧化还原反应生成Cr(OH)3,同时调节溶液的pH,故B正确;C.在酸性溶液中Cr2O72−比CrO42−稳定,故C错误;D.实验室洗涤沉淀的操作是沿玻璃棒加水至浸没沉淀,待水自然滤出,重复2∼3次操作正确,故D正确。
故选C。
2.某电镀污泥含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量金等,某小组设计如下资源综合利用的方案:已知:碲和硫位于同主族,煅烧时Cu 2Te 发生的反应为,滤渣中TeO 2溶于稀硫酸发生的反应为TeO 2+H 2SO 4=TeOSO 4+H 2O 。
下列说法错误的是( )A. “高温煅烧”电镀污泥时铜、碲和铬元素都被氧化B. “酸化”时可向溶液中加入硫酸C. “固体1”的主要成分为CuD. “滤液3”可以循环利用【答案】C【解析】【分析】本题考查混合物分离提纯,为高频考点,把握物质的性质、混合物分离提纯方法、流程中发生的反应、实验技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大。
高三化学高考考试总复习知识点整理归纳

高三化学高考考试总复习知识点整理归纳高三化学高考考试总复习知识点11、溶解性规律——见溶解性表;2、常用酸、碱指示剂的变色范围:甲基橙<3.1红色3.1——4.4橙色>4.4黄色酚酞<8.0无色8.0——10.0浅红色>10.0红色石蕊<5.1红色5.1——8.0紫色>8.0蓝色3、在惰性电极上,各种离子的放电顺序:阴极(夺电子的能力):Au3+>Ag+>Hg2+>Cu2+>Pb2+>Fa2+>Zn2+>H+>Al3+>Mg2+>Na+>Ca2 +>K+阳极(失电子的能力):S2->I->Br–>Cl->OH->含氧酸根注意:若用金属作阳极,电解时阳极本身发生氧化还原反应(Pt、Au除外)4、双水解离子方程式的书写:(1)左边写出水解的离子,右边写出水解产物;(2)配平:在左边先配平电荷,再在右边配平其它原子;(3)H、O不平则在那边加水。
例:当Na2CO3与AlCl3溶液混和时:3CO32-+2Al3++3H2O=2Al(OH)3↓+3CO2↑5、写电解总反应方程式的方法:(1)分析:反应物、生成物是什么;(2)配平。
例:电解KCl溶液:2KCl+2H2O==H2↑+Cl2↑+2KOH配平:2KCl+2H2O==H2↑+Cl2↑+2KOH6、将一个化学反应方程式分写成二个电极反应的方法:(1)按电子得失写出二个半反应式;(2)再考虑反应时的环境(酸性或碱性);(3)使二边的原子数、电荷数相等。
例:蓄电池内的反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O试写出作为原电池(放电)时的电极反应。
写出二个半反应:Pb–2e-→PbSO4PbO2+2e-→PbSO4分析:在酸性环境中,补满其它原子。
应为:负极:Pb+SO42--2e-=PbSO4正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O注意:当是充电时则是电解,电极反应则为以上电极反应的倒转,为:阴极:PbSO4+2e-=Pb+SO42-阳极:PbSO4+2H2O-2e-=PbO2+4H++SO42-7、在解计算题中常用到的恒等:原子恒等、离子恒等、电子恒等、电荷恒等、电量恒等,用到的方法有:质量守恒、差量法、归一法、极限法、关系法、十字交法和估算法。
核心素养测评(十八) 晶体结构与性质

核心素养测评(十八) 晶体结构与性质一、选择题:本题包括12个小题,每小题仅有1个选项符合题意。
1.下列关于超分子的说法不正确的是()A.C70属于超分子B.超分子有的是有限的,有的是无限伸展的C.C60与“杯酚”可通过分子间作用力形成超分子D.超分子具有“分子识别”“自组装”两大重要特征解析:A超分子是由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。
C70是一种分子,故不属于超分子。
2.晶体是一类非常重要的材料,在很多领域都有广泛的应用。
我国现已能够拉制出直径为300毫米的大直径硅单晶,晶体硅大量用于电子产业。
下列对晶体硅的叙述中正确的是()A.形成晶体硅的速率越大越好B.晶体硅没有固定的熔、沸点C.可用X射线衍射实验来鉴别晶体硅和玻璃D.晶体硅的形成与晶体的自范性有关,而与各向异性无关解析:C A选项,晶体的形成都要有一定的形成条件,如温度、压强、结晶速率等,但并不是说结晶速率越大越好;B选项,晶体有固定的熔、沸点;C选项,X射线衍射实验能够测出物质的内部结构,根据粒子是否有规则的排列就能区分出晶体与非晶体;D选项,晶体的形成与晶体的自范性和各向异性都有密切关系。
3.下列说法中正确的是()A.离子晶体中每个离子周围均吸引着6个带相反电荷的离子B.金属导电的原因是在外电场作用下金属产生自由电子,电子定向运动C.分子晶体的熔、沸点很低,常温下都呈液态或气态D.共价晶体中的各相邻原子都以共价键相结合解析:D A项,离子晶体中每个离子周围不一定吸引6个带相反电荷的离子,如CsCl 晶体中每个Cs+吸引8个Cl-;B项,金属晶体中的自由电子不是因为外电场作用产生的;C项,常温下,分子晶体不一定是液态或气态,可能为固态,如I2、S8等。
4.(2021·湖北适应性考试) B和Al为同族元素,下列说法错误的是()A.BF3和AlF3都可以与F-形成配位键B.H3BO3为三元酸,Al(OH)3呈两性C .共价键的方向性使晶体B 有脆性,原子层的相对滑动使金属Al 有延展性D .B 和Al 分别与N 形成的共价晶体,均具有较高硬度和熔点解析:B BF 3和AlF 3中B 和Al 均有空轨道,F -有孤电子对,因此BF 3和AlF 3都可以与F -形成配位键,A 正确;H 3BO 3为一元弱酸,Al(OH)3为两性氢氧化物,具有两性,B 错误;晶体B 为共价晶体,共价键的方向性使晶体B 有脆性,Al 为金属晶体,原子层的相对滑动使金属Al 有延展性,C 正确;B 和Al 分别与N 通过共价键形成共价晶体,共价晶体具有较高硬度和熔点,D 正确。
2024北京高三一模化学汇编:晶体结构与性质章节综合
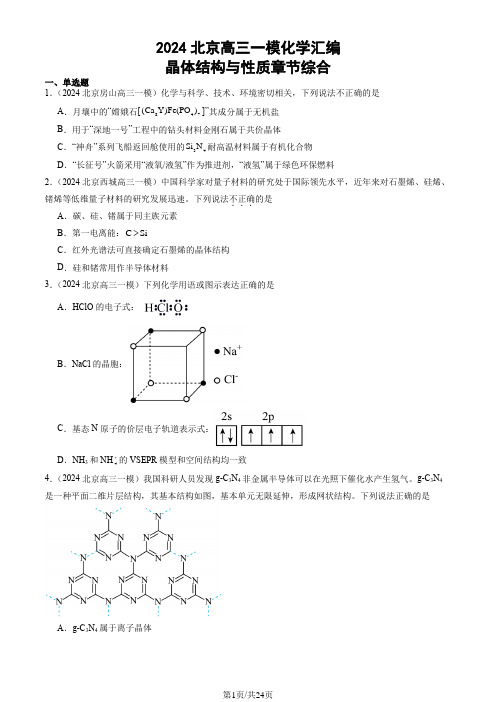
2024北京高三一模化学汇编晶体结构与性质章节综合一、单选题1.(2024北京房山高三一模)化学与科学、技术、环境密切相关,下列说法不正确的是(Ca Y)Fe(PO)]”其成分属于无机盐A.月壤中的“嫦娥石[847B.用于“深地一号”工程中的钻头材料金刚石属于共价晶体Si N耐高温材料属于有机化合物C.“神舟”系列飞船返回舱使用的34D.“长征号”火箭采用“液氧/液氢”作为推进剂,“液氢”属于绿色环保燃料2.(2024北京西城高三一模)中国科学家对量子材料的研究处于国际领先水平,近年来对石墨烯、硅烯、锗烯等低维量子材料的研究发展迅速。
下列说法不正确...的是A.碳、硅、锗属于同主族元素>B.第一电离能:C SiC.红外光谱法可直接确定石墨烯的晶体结构D.硅和锗常用作半导体材料3.(2024北京高三一模)下列化学用语或图示表达正确的是A.HClO的电子式:B.NaCl的晶胞:C.基态N原子的价层电子轨道表示式:+的VSEPR模型和空间结构均一致D.NH3和NH44.(2024北京高三一模)我国科研人员发现g-C3N4非金属半导体可以在光照下催化水产生氢气。
g-C3N4是一种平面二维片层结构,其基本结构如图,基本单元无限延伸,形成网状结构。
下列说法正确的是A.g-C3N4属于离子晶体B .其核心元素氮的氢化物分子间存在氢键,因此加热时很难分解C .g-C 3N 4中氮原子为sp 2杂化方式D .g-C 3N 4中含有手性碳原子5.(2024北京西城高三一模)研究()346Co NH SO ⎡⎤⎣⎦溶液的制备、性质和应用。
①向4CoSO 溶液中逐滴加入氨水,得到()346Co NH SO ⎡⎤⎣⎦溶液。
①分别将等浓度的4CoSO 溶液、()346Co NH SO ⎡⎤⎣⎦溶液放置于空气中,一段时间后,加入浓盐酸,前者无明显现象,后者产生使淀粉KI 溶液变蓝的气体。
①()346Co NH SO ⎡⎤⎣⎦溶液可处理含NO 的废气,反应过程如下。
高三化学高考备考专题复习有关晶体的各类计算
位置 的原子数 例1、铝单质为面心立方晶体,其晶胞参数a=0.405nm,列式表示铝单质的密度
g·cm-3(不径必计的算关出结系果)
②若合金的密度为d g/cm3,晶胞参数a=________nm。
*(2)分数坐标:(0,0,0)-顶点
(1/2,1/2,0)
3、边长(晶胞参数)和半径关系
空间利用率
3 Po 顶10点0%
球半径r 与晶胞边长 a 的关系:
3、边长(晶胞参数)和半径关系
(1)球数:8×1/8 + 6×1/2 = 4
1 、 晶 体 中 的 微 粒 数 、 化 学 式 其中,密度公式中共有四个未知量:密度,微粒摩尔质量,晶 胞体积,NA,知道3个可求另一个,因此可能围绕密度出现4种题型。
在面心立方基础上,再插入4个球,分别占据8个小立 方体中4个互不相邻的体心,
S a a sin 60 3 a2 2
V晶胞 3 a2 2 6 a
2
3
2a3 8 2r3
V球球)
V球 V晶胞 100% 74.05%
7、空间利用率
(4)金刚石空间利用率:球体积占晶胞体积的百分比
8 4 πr 3 8 4 πr 3
3
3 100% 34%
实例
NaCl 型
AB CsCl 型
Na+:6 Na+:6 Cl-: 6 Cl-: 6
Cs+:8 Cs+:8 Cl-: 8 Cl-: 8
Na+:4 Cl-: 4 Cs+:1 Cl-:1
KBr AgCl、 MgO、CaS、 BaSe
CsCl、CsBr、 CsI、TlCl
ZnS型
Zn2+:4 Zn2+:4 Zn2+:4 ZnS、AgI、 S2-: 4 S2-: 4 S2-:4 BeO
高三化学的重要知识点笔记整理
高三化学的重要知识点笔记整理只有比别人更早、更勤奋地努力,才能尝到成功的滋味。
比别人多一点努力、多一点自律、多一点决心、多一点反省、多一点学习、多一点实践、多一点疯狂,多一点点就能创造奇迹!以下是小编给大家整理的高三化学的重要知识点笔记整理,希望大家能够喜欢!高三化学的重要知识点笔记整理11.同位素具有相同质子数和不同中子数的同一元素的不同原子.如氢有3种同位素:H、D、T。
2.同素异形体(又称同素异性体)由同种元素组成性质不同的单质,互称同素异形体.如金刚石与石墨、C60,白磷与红磷,O2与O3,正交硫与单斜硫。
3.同分异构体具有相同的分子组成而结构不同的一系列化合物互称同分异构体.同分异构体的种类通常有碳链异构、位置异构、跨类异构(又称官能团异构)、几何异构(又称顺反异构)。
※你能说出中学阶段的几种跨类异构吗?4.同系物结构相似分子组成上相差一个或若干个CH2原子团的一系列化合物互称同系物。
※请总结出两种化合物互称同系物应具备的最基本条件。
5.同量物通常是指分子量相同的不同物质。
如CO2与HCHOH2SO4与H3PO4,NO与C2H6。
高三化学的重要知识点笔记整理21、固体不一定都是晶体,如玻璃是非晶态物质,再如塑料、橡胶等。
2、最简式相同的有机物:①CH:C2H2和C6H6②CH2:烯烃和环烷烃③CH2O:甲醛、乙酸、甲酸甲酯④CnH2nO:饱和一元醛(或饱和一元酮)与二倍于其碳原子数和饱和一元羧酸或酯;举一例:乙醛(C2H4O)与丁酸及其异构体(C4H8O2)3、一般原子的原子核是由质子和中子构成,但氕原子(1H)中无中子。
4、元素周期表中的每个周期不一定从金属元素开始,如第一周期是从氢元素开始。
5、ⅢB所含的元素种类最多。
碳元素形成的化合物种类最多,且ⅣA族中元素组成的晶体常常属于原子晶体,如金刚石、晶体硅、二氧化硅、碳化硅等。
6、质量数相同的原子,不一定属于同种元素的原子,如18O与18F、40K与40Ca7.ⅣA~ⅦA族中只有ⅦA族元素没有同素异形体,且其单质不能与氧气直接化合。
2020年暑假高三化学一轮大题练习晶体结构与性质测试含答案及详细解析
绝密★启用前2020年暑假高三化学一轮大题练习晶体结构与性质测试1.(1)①KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446 nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。
K与O间的最短距离为________ nm,与K紧邻的O个数为________。
②在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于________位置,O处于________位置。
(2)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为________nm。
MnO也属于NaCl型结构,晶胞参数为a′=0.448 nm,则r(Mn2+)为________nm。
2.(1)在下列物质中,________________(填序号,下同)是晶体,______________是非晶体。
①塑料②明矾③松香④玻璃⑤CuSO4·5H2O⑥冰糖⑦石蜡⑧单晶硅⑨铝块⑩橡胶(2)晶体和非晶体在外形上有差别,晶体一般都具有_______________,而非晶体___________;另外非晶体具有物理性质______________的特点,而晶体具有物理性质__________________的特点。
(3)判断物质是晶体还是非晶体,比较正确的方法是____________________(填序号)。
①从外形上来判断②从各向异性或各向同性上来判断③从导电性能来判断④从有无固定熔点来判断3.(1)氯化铝常温下为固体,熔点190℃(253kPa),易升华.实验室氯化铝蒸气的密度为11.92g•L﹣1(已折算成标准状况),据此判断氯化铝晶体为_____________晶体,其分子式为_____________.(2)氧化镁晶体的晶胞结构与NaCl晶体的晶胞结构相同.则氧化镁晶体中阴离子的配位数为_____________个;氧化镁晶体的熔点比NaCl高的原因是_____________.(3)金属铁的晶体在不同温度下有如图的两种堆积方式,面心立方晶胞和体心立方晶胞中的Fe原子的配位数之比为_____________;两种堆积方式中密度较大的是_____________立方堆积.4.有E、Q、T、X、Z五种前四周期元素,原子序数:E<Q<T<X<Z。
高三化学 化学键与晶体结构
C H H H H 专题四:化学键和晶体结构班级 姓名 学号专题目标:1、掌握三种化学键概念、实质,了解键的极性2、掌握各类晶体的物理性质,构成晶体的基本粒子及相互作用,能判断常见物质的晶体类型。
[经典题型][题型一]化学键类型、分子极性和晶体类型的判断[ 例1 ]4.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是 [ ](A)SO 2和SiO 2 (B)CO 2和H 2 (C)NaCl 和HCl (D)CCl 4和KCl[点拨]首先根据化学键、晶体结构等判断出各自晶体类型。
A 都是极性共价键,但晶体类型不同,选项B 均是含极性键的分子晶体,符合题意。
C NaCl 为离子晶体,HCl 为分子晶体 D 中CCl 4极性共价键,KCl 离子键,晶体类型也不同。
规律总结 1、含离子键的化合物可形成离子晶体2、含共价键的单质、化合物多数形成分子晶体,少数形成原子晶体如金刚石、晶体硅、二氧化硅等。
3、金属一般可形成金属晶体[例2]、.关于化学键的下列叙述中,正确的是( ).(A)离子化合物可能含共价键 (B)共价化合物可能含离子键(C)离子化合物中只含离子键 (D)共价化合物中不含离子键[点拨]化合物只要含离子键就为离子化合物。
共价化合物中一定不含离子键,而离子化合物中还可能含共价键。
答案 A 、D[巩固]下列叙述正确的是A. P 4和NO 2都是共价化合物B. CCl 4和NH 3都是以极性键结合的极性分子C. 在CaO 和SiO 2晶体中,都不存在单个小分子D. 甲烷的结构式: ,是对称的平面结构,所以是非极性分子答案:C题型二:各类晶体物理性质(如溶沸点、硬度)比较[例3]下列各组物质中,按熔点由低到高排列正确的是( )A O2 、I2 HgB 、CO 2 KCl SiO 2C 、Na K RbD 、SiC NaCl SO2[点拨]物质的熔点一般与其晶体类型有关,原子晶体最高,离子晶体(金属晶体)次之,分子晶体最低,应注意汞常温液态选B[例4]碳化硅(SiC)的一种晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的。
