高中化学铝的知识点
高中化学复习知识点:铝的钝化

A.稀硫酸与铁、铝反应,不能用铁制容器存放或用铝槽车运输,故A错误;
B.稀硝酸与铁、铝反应,不能用铁制容器存放或用铝槽车运输,故B错误;
C.浓硝酸与铁、铝发生钝化现象,阻止了反应的继续进行,常温下可用铁制容器存放或用铝槽车运输,故C正确;
D.硫酸铜溶液与铁、铝反应,不能用铁制容器存放或用铝槽车运输,故D错误;
C.插入Cu(NO3)2溶液中,Cu(NO3)2和Al2O3不反应,故C正确;
D.插入NaOH溶液中,能发生如下反应:2NaOH+Al2O3═2NaAlO2+H2O,故D错误;
故答案选C.
5.B
【解析】
【分析】
【详解】
Mg、Cu常温下与浓硝酸持续发生氧化还原反应,不会发生钝化,而常温下Fe、Al遇浓硝酸钝化,生成致密的氧化膜,阻止反应的进一步进行;上述四种金属中,铝、镁是轻金属;故遇浓硝酸发生钝化的轻金属是铝。
参考答案
1.C
【解析】
【分析】
【详解】
A.活泼金属铁、铝在常温下与浓硫酸反应发生钝化,反应生成致密氧化物薄膜阻止反应进行,A错误;
B.铝制品表面生成的氧化铝薄膜性质稳定,熔点高,起到保护内部金属的作用,铁制品在潮湿的空气中易生锈,铜在潮湿的空气中生成铜绿,B错误;
C.铝、铁、铜和氯气反应都能生成高价氯化物,C正确;
(3)放出的气体是________,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的原因是________.(写出一点即可)
(4)某同学通过一定的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是________.
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
高中化学复习知识点:铝的钝化
高中化学 第三章 第二节 铝的重要化合物课件 新人教版必修1
精品
6
3、实验室制法 见教材P58“实验3-7” Al2(SO4)3+ 6NH3.H2O==2Al(OH)3↓+3(NH4)2SO4
Al3++3NH3·H2O===Al(OH)3↓+3NH4+
能产生氢氧化铝的反应还有:
Al3++3OH-===Al(OH)3↓(OH-适量)
⑤Al(OH)3
A.①②③⑤
B.①④⑤
C.②③⑤
D.①③④
2、下列列操作不能在氧化铝坩埚中进行的
是 (B)
A.加热分解NH4HCO3 B.熔化烧碱
C.加热Na2CO3 精品
D.加热NaCl 4
(二)氢氧化铝【Al(OH)3】 1、物理性质
氢氧化铝是白色胶状沉淀,它能凝聚水中的 悬浮物,并能吸附色素。
n沉淀
n CO2
精品
15
(5)向氯化镁和氯化铝的混合溶液中加足量的氢氧化钠
原理:氢氧化钠先与氯化镁和氯化铝反应,生成 氢氧化镁和氢氧化铝沉淀,然后氢氧化铝溶解, 但氢氧化镁不溶。
n沉淀
氢氧化铝
氢氧化镁
精品
n NaOH
16
1、有一镁、铝合金,用适量稀硫酸恰好完全 溶解,再加入氢氧化钠溶液,析出沉淀的物 质的量随氢氧化钠的体积关系如下图所示, 则原合金中镁、铝物质的量比为 ( D )
第二节 几种金属的重要化合物
化学 必修1
第二课时
铝的重要化合物
精品
1
二、铝的重要化合物
(一)氧化铝(Al2O3) 1、物理性质
白色固体,不溶于水,熔点高,良好的耐火材 料。自然界中纯净的Al2O3为无色晶体,俗称刚 玉。红宝石、蓝宝石的主成份皆为氧化铝。
人教版高中化学必修2课件 探究铝热反应

探究铝热反应
实验现象:
1.镁条剧烈燃烧, 2.火花四溅, 3.放出大量的热, 4.同时纸漏斗被烧穿,有灼热 熔融物落入沙中,待熔融物冷 却后变黑色固体。
探究铝热反应
应用
1、冶炼难熔的金属 2、焊接钢轨等大截面钢材部件 3、军事上可以制作铝热弹等强杀伤性的武器 4、传统的烟火剂
探究铝热反应
•
铝热反应十分激烈,所以点燃后难以熄灭。若在 钢等其他金属物上点燃,还会熔穿金属物,加剧反 应。故常被用于制作燃烧弹,可以熔穿装甲。 铝热反应过程中放出的热可以使高熔点金属熔 化并流出,故铝热法广泛运用于焊接抢险工程之中 。另外,铝热法也是冶炼钒、铬、锰等高熔点金属 的重要手段。
铝热反应配平技巧: 取反应物和生成物中氧化物中两边氧的最小公倍数,即可
快速配平,如8Al+3Fe3O4=4Al2O3+9Fe中,可取Fe3O4和Al2O3
中氧的最小公倍数12,则Fe3O4前应为3Al2O3前应为4,底下 便可得到Al为4,Fe为9.
探究铝热反应
实验步骤:
1.取一张圆形滤纸,倒入5克炒干的氧化铁粉末,再 倒入2克铝粉。
•
探究铝热反应
除此之外,其他的金属单质与金属氧化物混合之 后点燃,也会发生强烈的氧化还原反应,效果类似 于铝热反应。其中的金属单质可以是铝、镁、钙、 钛、硅、硼,而金属氧化物可以是三氧化二硼、二 氧化硅、三氧化二铬、二氧化锰、三氧化二铁、四 氧化三铁、氧化铜和四氧化三铅等。有时这些反应 也根据反应中的还原剂而被称为“镁热法”、“硅 热法”、“钙热法”、“碳热法”等等
此外,铝热反应还可以表示铝元素置换其他金属元 素(如锰等)的氧化物置换出该金属元素
探究铝热反应
•
实验装置
高中化学复习知识点:铝制品日常使用的注意事项

【解析】
【详解】
A.铝和空气中的氧气反应生成致密的氧化物薄膜,阻止了铝的进一步氧化,所以铝片可长期放置在不密封的纸盒里,A正确;
B.漂白粉长期放置在烧杯中,Ca(ClO)2与CO2、H2O反应生成CaCO3与HClO,HClO易分解,造成变质,B错误;
C.硫酸亚铁易被氧化为硫酸铁,加入铁粉可以防止被氧化,C正确;
①糖果内包装②电线电缆③牙膏皮④氢氧化铝胶囊(作内服药)⑤用明矾和小苏打作出食物膨化剂.
A.①③④⑤B.②③④⑤C.②③⑤D.全部
3.用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升.根据实验现象判断下列说法错误的是( )
⑶.生产玻璃的原料是纯碱、石灰石和石英,石英的主要成分是二氧化硅,与碳酸钙反应生成硅酸钙和二氧化碳,与碳酸钠反应生成硅酸钠和二氧化碳,故答案为:Na2CO3;SiO2。
D.铝的硬度很大,可用作制造汽车、船舶、飞机等
8.铝元素对人体健康有害。因此,世界卫生组织正式把铝确定为食品污染源之一而加以控制。铝在下列场合使用时应加以控制的是()
①制铝合金②制电线③制炊具④制银色漆颜料⑤用明矾净水⑥明矾和小苏打制食品膨松剂⑦制易拉罐⑧用氢氧化铝凝胶制胃药⑨包装糖果和小食品
A.③⑤⑧⑨B.⑥⑧⑨C.③⑤⑨D.③⑤⑥⑦⑧⑨
9.下列物质存放方法错误的是( )
A.铝片长期放置在不密封的纸盒里
B.漂白粉长期放置在烧杯中
C.FeSO4溶液存放在加有少量铁粉的试剂瓶中
D.金属钠存放于煤油中
二、多选题
10.铝在人体中积累可使人慢性中毒,世界卫生组织将铝确定为食品污染源之一而加以控制。铝在下列使用场合中,必须加以控制的是
高中化学复习知识点:铝与强碱溶液反应

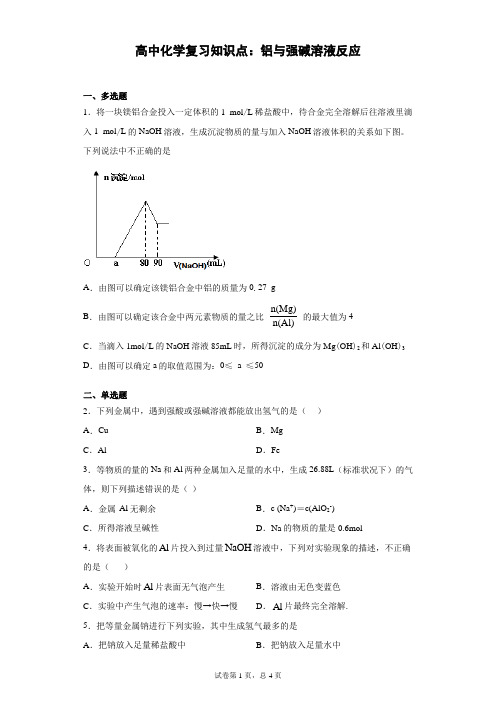
高中化学复习知识点:铝与强碱溶液反应一.多选题1.将一块镁铝合金投入一定体枳的1 mol/L棉盐酸中,待合金完全溶解后往溶液里滴入1 mol/L 的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积的关系如卞图。
下列说法中不正确的是A.由图可以确定该镁铝合金中铝的质量为0.27 gn(Mg)E.由图可以确定该合金中两元素物质的量之比-7-77的最大值为4n(Al)C.当滴入lmol/L的NaOH溶液85mL时,所得沉淀的成分为Mg (OH) 2和Al(OH) 3D・由图可以确定3的取值范闱为:0W a W50二单选题2.卞列金属中,遇到强酸或强碱溶液都能放出氢气的是()A,Cu B. MgC・Al D・Fe3.等物质的量的Na和Al两种金属加入足量的水中,生成26.88L (标准状况卞)的气体,则下列描述错误的是()A.金属A1 无剩余B. c (Na-)=c(AlO2 )C.所得溶液呈碱性D. Na的物质的量是0.6mol4.将表面被氧化的A1片投入到过量NaOH溶液中,卞列对实验现彖的描述,不正确的是()A.实验开始时A1片表面无气泡产生E.溶液由无色变蓝色C.实验中产生气泡的速率:慢T快T慢D. A1片最终完全溶解.5.把等量金属钠进行下列实验,其中生成氢气最多的是A.把钠放入足量稀盐酸中B.把钠放入足量水中C.把钠放入硫酸铜溶液中D.将钠用铝箔包好并刺些小孔,再放入水中6.卞列除去杂质的方法不正确的是()A.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥B.用过量氨水除去卩£十溶液中的少量Al3+C.Al (OH)3中混有少量Mg(OH)=:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量co:后过滤D.HgO中混有少量A1Z O3:加入足量烧碱溶液,充分反应,过滤、洗涤、干燥得到HgO7.用等质量的金属钠进行卞列实验,产生氢气最多的是()A.将钠放入足量的桶盐酸中B.将钠放入足量的桶硫酸中C.将钠放入足量的硫酸氢钠溶液中D.将钠用铝箔包好,并刺穿一些小孔,放入足量的水中8.为除去铁粉中混有的少量铝粉,所选试剂和操作都合理的是A.盐酸,蒸发B. NaOH溶液,蒸发C.盐酸,过滤D. NaOH溶液,过滤9.卞列除杂或检验的方法正确的是()A.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥B.在溶液中加KSCN,溶液显红色,证明原溶液中有Fe”,无Fe”C.氯化亚铁溶液中混有少量氯化铁:加入足量双氧水D.灼烧某白色粉末,火焰呈黄色,证明原粉末中含有N+,无K-10.将钠、铝混合物,放入足量的水中,反应停止后,还有不溶物,则此时溶液中溶质为A. NaOHB. NaAlO:C. NaOH 和NaAlO:D.无法确定三、综合题11.阅读下列材料,完成相应填空。
高中化学复习知识点:铝与强碱溶液反应
D. 若加入的是20mL 1mol/L的盐酸,则放出的氢气的物质的量减少
12.(1)碳原子2p亚层上的2个电子不相同的方面是____(选填序号)。
a.能量b.电子云形状c.电子云伸展方向d.自旋状态
14N原子与12C原子比,质子数和中子数都更多,但原子半径却更小,请解释__________________。
【详解】
将等质量的钠投入到稀盐酸、稀硫酸、硫酸氢钠溶液中,发生反应本质为钠与氢离子反应生成氢气,因为Na的质量相同,所以A、B、C放出的氢气的量相等;将钠用铝箔包好并刺一些小孔,再放入足量的水中,首先是钠与水反应生成NaOH和氢气,铝与NaOH溶液反应生成氢气,故生成氢气要比上述三种情况多,故D项中生成氢气最多;故答案选D。
B.n(Al)=n[Al(OH)3]=0.01mol,所以沉淀Al3+需要的OH﹣为0.03mol,即NaOH溶液的体积为30mL,镁离子和铝离子沉淀完全消耗的碱的体积为80﹣a,若假设盐酸不剩,所以沉淀Mg2+需要NaOH溶液的体积最大值为50mL,求出n(Mg)的最大值为0.025mol,所以该合金中镁铝两元素物质的量之比的最大值为2.5,故B错误;
D.MgO中混有少量Al2O3:加入足量烧碱溶液,充分反应,过滤、洗涤、干燥得到MgO
7.用等质量的金属钠进行下列实验,产生氢气最多的是( )
A.将钠放入足量的稀盐酸中
B.将钠放入足量的稀硫酸中
C.将钠放入足量的硫酸氢钠溶液中
D.将钠用铝箔包好,并刺穿一些小孔,放入足量的水中
8.为除去铁粉中混有的少量铝粉,所选试剂和操作都合理的是
C.当加入1mol/L的NaOH溶液85mL时,发生反应:Al(OH)3+OH﹣=[Al(OH)4]﹣,只有5mL用于氢氧化铝的溶解,氢氧化铝剩余,所得沉淀的成分为Mg(OH)2和Al(OH)3,故C正确;
高中化学-铝及其化合物(人教版必修一精编讲义 习题)

考点一铝、镁的性质及应用知识梳理1.铝的结构和存在铝位于元素周期表第三周期ⅢA族,原子结构示意图为。
铝是地壳中含量最多的金属元素。
自然界中的铝全部以化合态的形式存在。
2.金属铝的物理性质银白色有金属光泽的固体,有良好的延展性、导电性和导热性等,密度较小,质地柔软。
3.金属铝的化学性质(1)与非金属单质(如O2、Cl2)的反应(2)与某些金属氧化物反应(铝热反应)(3)与酸反应(注意钝化)(4)与强碱(NaOH溶液等)的反应:4.铝的用途纯铝用作导线,铝合金用于制造汽车、飞机、生活用品等。
【基础练习】1.正误判断,正确的打“√”,错误的打“×”(1)铝在自然界中有游离态和化合态两种形式()(2)MgO与Al粉的混合物也可称为铝热剂()(3)Mg粉与浓NH4Cl溶液反应放出H2和NH3()(4)冶炼铝时常用焦炭作还原剂()(5)1mol Al与足量的硫酸或足量的氢氧化钠溶液反应转移电子数相同()(6)铝与少量NaOH溶液反应得到铝盐,与足量NaOH溶液反应生成偏铝酸盐()题组一对比掌握铝、镁的性质1.镁粉是焰火、闪光粉、鞭炮中不可缺少的原料。
工业上制造镁粉是将镁蒸气在某种气体中冷却,有下列气体:①空气、②CO2、③Ar、④H2、⑤N2,其中可作为冷却气体的是A.①和②B.②和③C.③和④D.④和⑤2.下列关于铝单质的叙述中正确的是A.由于铝在空气中不会锈蚀,所以铝制品的使用寿命都很长B.由于铝具有强还原性,所以常用铝来冶炼某些高熔点金属C.常温下,铝被浓硫酸钝化,所以可用浓硫酸除去铝表面的铜镀层D.由于铝的导电性能比铜强,所以常用铝制造电线、电缆题组二铝与酸或碱反应的计算3.(2016·河北衡水中学高三模拟)将等物质的量的镁和铝混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是A.3mol/L HClB.4mol/L HNO3C.8mol/L NaOHD.18mol/LH2SO44.铝是中学化学学习阶段的唯一一种既能与酸(非氧化性酸)反应又能与强碱溶液反应放出H2的金属,就铝的这一特殊性质回答下列问题:(1)等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,所得H2的体积之比是________。
高中关于铝的化学方程式

1、铝单质:(1)能与酸反应a、与非氧化性酸反应生成铝盐和氢气2Al + 6 HCl = 2AlCl3 + 3H2↑2Al + 3H2SO4(稀)= Al2(SO4)3 + 3H2↑其它非氧化性酸类似b、与氧化性酸反应常温下,铝遇浓硫酸和浓硝酸会“钝化”加热时反应2 Al + 6H2SO4(浓)= Al2(SO4)3 + 3SO2↑ + 6H2O Al + 6HNO3(浓)= Al(NO3)3 + 3NO2↑ + 3H2O Al + 4HNO3(稀)= Al(NO3)3 + NO↑ + 2H2O(2)能与强碱反应生成偏铝酸盐和氢气2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑与其它强碱反应与NaOH类似。
(3)能与活泼性比铝弱的金属的盐或氧化物反应a、能把活泼性比铝弱的金属从其溶液中置换出来如:2Al + 3CuCl2 = 2AlCl3 + 3Cu2Al + 3Hg(NO3)2 = 2Al(NO3)3 + 3Hg 其它类似。
b、能把活泼性比铝弱的金属从其固体氧化物中置换出来如:2Al + Fe2O3 =高温= 2Fe + Al2O32、铝的氧化物——Al2O3能与酸和强碱反应(1)与酸反应生成铝盐和水Al2O3 + 6HCl = 2AlCl3 + 3H2O其它酸类似。
(2)与强碱反应生成偏铝酸盐和水Al2O3 + 2NaOH = 2NaAlO2 + H2O其它强碱类似。
3、氢氧化铝——Al(OH)3(1)与酸反应生成铝盐和水Al(OH)3 + 3HCl = AlCl3 + 3H2O其它酸类似。
(2)与强碱反应生成偏铝酸盐和水Al(OH)3 + NaOH = NaAlO2 + 2H2O其它强碱类似。
但NH3·H2O(一水合氨)不与氢氧化铝反应(3)电解熔融的Al2O3可生成铝单质2Al2O3(熔融)=电解(加冰晶石)= 4Al + 3O2↑4、铝盐(1)与碱反应先生成氢氧化铝沉淀,如果是过量的强碱,继续反应生成偏铝酸盐AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl(少量NaOH)AlCl3 + 4NaOH= NaAlO2 +3NaCl + 2H2O(过量NaOH)可结合前面氢氧化铝的性质如果是一水合氨,只生成氢氧化铝的沉淀,过量一水合氨,沉淀不溶解。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第 1 页 共 4 页
高中化学铝的知识点
铝元素在地壳中的含量仅次于氧和硅,居第三位,是地壳
中含量最丰富的金属元素。那么关于高中化学铝的知识点,你
掌握了多少了呢?接下来小编为你整理了高中化学必修一铝知识
点,一起来看看吧。
高中化学必修一铝知识点
(一)、铝
1.铝与NaOH溶液的反应:因它是唯一能与碱反应的金属。
2.铝箔的燃烧:现象是铝箔熔化,失去光泽,但不滴落。
原因是铝表面的氧化膜保护了铝,氧化铝的熔点(2021℃)远远
高于铝(660℃)的熔点。
3.铝、铁钝化:常温下,与浓硫酸、浓硝酸发生钝化,发
生化学反应(不是不反应),因生成了致密的氧化膜。但在加热
条件下,则能继续反应、溶解。
4.铝热反应:实验现象:剧烈反应,发出耀眼的光芒,放
出大量的热,有大量的熔化物落下来。引燃剂:镁条、氯酸钾;
铝热剂:铝粉和金属氧化物组成的混合物。
5.离子共存:加入铝能产生氢气的溶液,说明此溶液含有
大量的H+或OH-,酸溶液中不能含有NO3-、AlO2-,溶液中一
第 2 页 共 4 页
旦有了NO3-,溶液就成了HNO3,它与铝将不再产生氢气;碱溶
液中不能含有Al3+、NH4+,但可含有AlO2-。
(二)、氧化铝
1.熔点高:作耐火坩埚,耐火管和耐高温的实验验仪器
等。
2.两性氧化物:因它是化学中唯一的两性氧化物,特别与
碱的反应,更应引起重视。3.工业制备铝:2Al2O3(熔
融)=4Al+3O2↑
(三)、氢氧化铝
1.制备原理:命题角度为是离子方程式的书写;强调用氨水,
而不能用强碱。
2.两性氢氧化物:因它是化学中唯一的两性氢氧化物,特
别与碱反应,更应引起重视。
3.治疗胃酸过多:因其碱性不强,不会对胃壁产生强剌激
作用,但可与胃酸(盐酸)反应,不能用强碱如NaOH。
4.明矾净水原理:因溶液中的铝离子发生水解,生成
Al(OH)3胶体,它可以和悬浮水中的泥沙形成不溶物沉降下
来,故明矾可用作净水剂。
高中化学必修一铝方程式
1、铝和氢氧化钠溶液2Al+2NaOH+2H2o=2NaAlO2+3H2↑
2、铝热反应4Al+3MnO2=3Mn+2Al2O3(高温)
第 3 页 共 4 页
3、氧化铝和盐酸Al2O3+6HCl=2AlCl3+3H2O
4、氧化铝和氢氧化钠溶液Al2O3+2NaOH=2NaAlO2+H2O
5、氢氧化铝受热分解2Al(OH)3=Al2O3+3H2O
6、氢氧化铝和盐酸Al(OH)3+3HCl=AlCl3+3H2O
7、氢氧化铝和氢氧化钠溶液Al(OH)3+NaOH=NaAlO2+2H2O
8、三氯化铝和过量氨水
AlCl3+3NH3+3H2O=Al(OH)3↓+3NH4Cl
9、三氯化铝和过量氢氧化
AlCl3+4NaOH=NaAlO2+3NaCl+2H2o
铝的毒理性质
研究发现,铝元素能损害人的脑细胞。根据世界卫生组织
的评估,规定铝的每日摄入量为0~0.6mg/kg,这里的kg是指
人的体重,即一个60kg的人允许摄入量为36mg。我国《食品
添加剂使用标准GB2760-2021》中规定,铝的残留量要小于等
于100mg/kg。以此计算,一个体重60kg的人每天吃油条不多
于360g就不必担心。
铝在人体内是慢慢蓄积起来的,其引起的毒性缓慢、且不
易察觉,然而,一旦发生代谢紊乱的毒性反应,则后果非常严
重。因此,必须引起我们的重视,在日常生活中要防止铝的吸
收,减少铝制品的使用。铝及其化合物对人类的危害与其贡献
相比是无法相提并论的,只要人们切实注意,扬长避短,它对
第 4 页 共 4 页
人类社会将发挥出更为重要的作用。
避免方法:
避免使用铝制成的炊具
少吃炸油条、由铝包装的糖果等食品,少喝易拉罐装的软
饮料
部分药品由含铝物质制成,应减少服用含铝元素的药品,
如:可以中和胃酸的Al(OH)3。
猜你感兴趣的:
1.高中化学必修一铝知识点
2.高中化学铝的知识点
3.高中化学铝知识点
4.高一必修一化学铝硅知识点
5.高一必修一化学知识点归纳
