信号转导
信号转导(研究生)

秦燕 生理学与病理生理学教研室
第一节 概 述
多细胞生物体必须具备完善的信号转导系统统 一协调其正常的生理功能。
细胞间传递信息的物质多达几百种:如递质、 激素、细胞因子等。
代谢或功能改变
一、细胞信号转导的定义及特征
1. 定义:通常是指细胞通过细胞表面受体(或胞 内核受体)接受外界信号,通过系统级联传递机 制,将胞外信号转导为胞内信号,最终引起细胞 生理效应或诱导特定基因的表达,引起细胞的应 答反应。
(2) 细胞信号转导不仅仅是简单的信号传递,同时还具有信号 放大功能。
(3)跨膜信号转导虽然涉及多种刺激信号在多种细胞引发的多种 功能改变,但转导过程都是通过少数几种类似的途径或方式 实现的。
二、信号转导的网络化
1.不同种类受体或配体的相互作用 2.不同类型蛋白激酶的相互作用 3.不同转录因子与DNA元件的相互作用
一个受体可以激活多个G蛋白,一个G蛋白可以转导 多个信息效应机制,调节许多细胞功能。
4.细胞内受体
可穿过细胞的第一信使 亲脂性化学信号分子
产生新的mRNA 蛋白质
胞质或核内 受体结合
激活胞质或核内 的化学级联反应
胞内受体通常与抑制性蛋白结合,信号分子与受体结合后 受体与抑制性蛋白分开,受体不再受抑制,其表面暴露出 一段DNA结合区域。可直接作用于核DNA,影响转录。
如:神经营养因子受体TrK家族、某些生长因子 胰岛素的受体
3.G蛋白偶联受体 G-protein coupled receptors GPCR 由七个α螺旋组成的独立蛋白质分子
7次跨膜,6个袢 羧基、氨基内外放
G-蛋白耦联受体的数量最多,如α、β肾上腺素、 M-乙 酰胆碱、 5-羟色胺、多巴胺、阿片类、嘌呤类、前列腺素及 多肽激素的受体
细胞的信号转导(共22张PPT)

神经突触 谷氨酸,门冬氨酸,甘氨酸
7
(二)电压门控离子通道 1、涵义
接受电信号的受体,通过通道的开、关和离子 跨膜流动将信号转导到细胞内部。
2、信号转导过程
刺激 细胞膜电位的变化 电
压门控离子通道开放或关闭
离子内流或外流
新信号形成
8
Na+通道和K+通道通道作用示意图
9
(三)机械门控通道
1、由离子通道完成的跨膜信号传递过程
Na+通道和K+通道刺通道激作用示信意图号→膜通道蛋白开放→离子移动→膜电
位变化→膜内信息→细胞功能改变 几种主要的跨膜信号转导方式
Na+通道和K+通道通道作用示意图 几种主要的跨膜信号转导方式
几种主要的跨膜信号转导方式
离子内流或外流
新信号形成
刺激信号→膜通道蛋白开放→离子移动→膜电位变化→膜内信息→细胞功能改变
内有配体的结合部位,胞浆侧有结合G蛋白的部
位; 通过与配体结合后的构象变化来结合和激活G蛋
白。
11
2)G蛋白( GTP结合蛋白)
耦联膜受体与效应器的一种特定蛋白,由α、β和γ
三个亚单位组成,其中α亚单位具有鸟苷酸的结合位 点和GTP酶活性。
非活化的G蛋白在膜内与受体分离,其α亚单位结合 一分子的GDP;
磷酸二脂酶(PDE) 磷脂酶A2等
B、 离子通道:
14
4)第二信使:
它是激素、递质、细胞因子等信号分 子作用于细胞膜后细胞内产生的信号因 子,间接地把细胞外信号转入细胞内。
包括cAMP(环磷酸腺苷)、三磷酸 肌醇(IP3)、二酰甘油(DG)、环-磷酸鸟苷 (cGMP)和Ca2+等。
细胞信号转导的基本原理

细胞信号转导的基本原理细胞信号转导是生命中一个非常重要的过程,可以使细胞在环境变化的情况下进行正确的应对和响应。
该过程通过一系列的信号转导步骤传递信息,从而使接收到信息的细胞调整其生理状态或功能。
这篇文章将介绍细胞信号转导的基本原理。
第一部分:介绍细胞信号转导细胞信号转导起源于人们对细胞内部化学通讯的认识。
它是通过化学和物理相互作用来传递信号和信息的应答系统。
生物体的生长和发育、代谢调控、免疫反应以及环境适应等重要生命活动都涉及到细胞信号转导。
第二部分:信号转导的基本原理细胞内信号转导是一个复杂的过程,包含多种分子组分和信号通路。
但是,不论信号通路是多么复杂,其基本原理都是一致的。
信号转导可以分为三个基本阶段。
第一阶段:识别信号细胞膜是信号识别的地方,因为细胞膜上有许多的膜受体。
当特定的分子(如激素或神经递质)结合到膜受体上时,会引起一系列的形态和功能变化,并通过激活膜受体后的反应,进入第二个环节。
第二阶段:信号传导信号传导是信号从细胞膜到达细胞内部对应的传导分子的一个过程。
这个过程是分子间交流的过程,所涉及的蛋白质种类相当丰富,比如酶、离子通道、激酶、转录因子等。
在信号传导这个过程中,可以直接将信息传递,也可以通过中介分子来传递信息。
第三阶段:效应最后一个阶段是信号效应。
当信息穿过细胞膜并传递到细胞内部后,它会引发一系列的化学反应和生理响应,如蛋白质合成、基因表达和酶活性调节等。
这一过程中,细胞会根据特定的信号产生相应的效应。
第三部分:信号转导的类型细胞信号转导的主要类型包括两种。
一种是通过细胞外受体(如G蛋白偶联受体,酪氨酸激酶受体)将外部信号转化为细胞内信号。
另一种是细胞膜内的受体(如离子通道、酶)将信号转换为细胞内部的信号。
第四部分:信号转导的应用细胞信号转导的应用有很多。
例如,通过有针对性的手段,可以干预某些疾病的信号传导过程,从而达到治疗的效果。
通过干预细胞信号通路,多种疾病治疗药物都可以被平衡、异位和激活,同时,还可以促进恶性肿瘤的早期发现。
细胞信号传导和信号转导

细胞信号传导和信号转导在细胞生长和发育过程中起着关键作用,它们调控着细胞的 增殖、分化和凋亡等过程。
细胞信号传导和信号转导的异常会导致多种疾病,如癌症、神经退行性疾病和免疫 系统疾病等,因此对它们的深入研究有助于疾病的诊断和治疗。
信号转导是信号传导的一部分,信号转导主要关注细胞内特定分子或离子浓度的变化, 而信号传导则涉及细胞间或细胞内信号的传递和放大。
信号转导和信号传导都涉及到信号的识别、转换和传输,但信号转导更侧重于分子识 别和转换机制,而信号传导更强调信号的传递和放大过程。
信号转导和信号传导在某些情况下是相互关联的,例如在某些信号转导过程中,特定 的分子或离子浓度的变化可以触发细胞内的信号传导过程。
细胞信号传导和信号转导在维持细胞内环境稳态、细胞器的功能以及细胞器的合成与降解等方 面发挥重要作用。
细胞信号传导和信号转导对于细胞的能量代谢、物质代谢以及细胞内的氧化还原平衡等也有重 要影响。
细胞信号传导和信号转导在细胞周期调控、细胞凋亡以及细胞自噬等细胞生命活动中扮演着关 键角色,对于维持细胞的正常生命活动具有重要意义。
信号转导和信号传导都涉及到细胞内的分子和离子浓度的变化,这些变化可以影响细 胞的生理功能和行为。
信号转导主要关注信号分子如何与受体结合,引起细胞内一系列生化反应,最终导致细胞反应 的过程。
信号传导则更强调细胞如何整合来自不同信号转导途径的信息,以产生精确和特异的细胞反应。
信号转导通常涉及单个分子事件,而信号传导则涉及多个信号转导途径的整合。
离子通道型信号传导:通过离子通道的开启或关闭,引起细胞膜电位的变化,进而传递 信号。
G蛋白型信号传导:通过G蛋白偶联受体与相应的配体结合,激活G蛋白,进而激活或抑 制效应酶,传递信号。
细胞信号转导

细胞信号转导细胞信号转导是指细胞内外信息的传递和转化过程,这一过程起着调节和控制细胞生理活动的重要作用。
通过信号传递,细胞可以对外界环境做出适应性的反应,维持内部稳态,实现生长、分化和细胞命运决定等功能。
本文将从信号的产生、传递和转导机制等方面进行讨论。
一、信号的产生1. 内源性信号细胞自身产生的化学物质可以作为信号分子,以调节细胞内外环境。
例如,细胞内的离子浓度、pH值和代谢产物等,都可以通过信号传递机制发挥作用。
2. 外源性信号外界环境中的物质和刺激也可以作为细胞信号的来源。
例如,细胞表面的受体可以与激素、细菌毒素和细胞外基质等结合,引发相应的信号传递。
二、信号的传递细胞信号传递通常有三种主要方式:通过直接细胞接触、通过细胞间联系以及通过远距离的物质传递。
1. 直接细胞接触细胞表面的受体与邻近细胞的配体结合,通过接触传递信号。
这种方式在免疫系统的活化、神经细胞的传递和胚胎发育等过程中起重要作用。
2. 细胞间联系细胞通过细胞间连接物质(如细胞间隙连接、紧密连接和连接蛋白)进行信号传递。
这种方式在组织内细胞间的协调和相互影响中起到重要作用。
3. 物质传递一些信号分子可以通过远距离的物质传递,例如激素、细菌毒素和神经递质等。
它们通过血液、淋巴液和突触间隙等途径到达目的地细胞,触发相应的信号级联反应。
三、信号的转导机制1. 受体的激活和信号传导当信号分子结合至受体上时,受体会发生构象变化,从而激活相应的信号通路。
这种激活过程包括泛素化修饰、磷酸化等,促使信号传导的启动。
2. 信号通路的级联反应一旦信号通路被启动,连锁反应会引发一系列级联反应。
这些反应会通过激活一些键酶、转录因子和细胞器等,最终产生细胞内外多种生理活动的结果。
3. 信号的转导和传递信号通路中的组分和中介物质可以通过蛋白质相互作用、分子承载体和次级信号等方式,进行信号的转导和传递。
这种方式可以将信号的强度和特异性传递至下游组分,以发挥预期的生物学功能。
细胞的信号转导医学细胞生物学第
7
二、细胞的信号分子
➢信号分子(配体ligand):能与细胞内受体或膜受体结合并 产生特定生物学效应的化学物质。 ➢特点:①特异性;②高效性;③可被灭活。 ➢分子种类:短肽、蛋白质、气体分子(NO、CO)、氨基酸、 核苷酸、脂类、胆固醇衍生物。 ➢从产生和作用方式来看可分为内分泌激素、神经递质、局部 化学介导因子和气体分子等四类; ➢从信号分子性质分为:脂溶性、水溶性、气体分子三类。
配体→RTK →adaptor →GEF →Ras →Raf (MAPKKK)→MAPKK→MAPK→进入细 胞核→其它激酶或转录因子的磷酸化修饰
医学ppt
41
第三节、细胞内受体介导的信号转导
➢核受体介导的信号途径 ➢NO作为信号分子介导的信号途径
医学ppt
42
一、核受体介导的信号途径
➢核受体即细胞内受体,存在于核或胞质内,其本质 是甾类激素激活的基因调控蛋白。
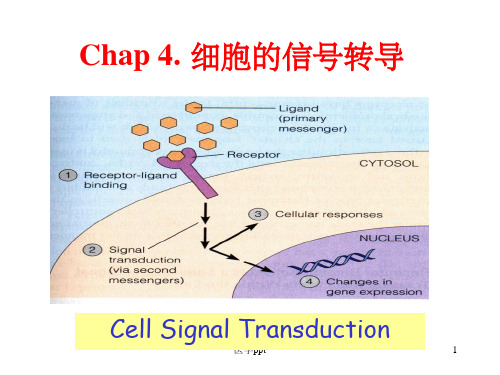
Chap 4. 细胞的信号转导
Cell Signal Transduction
医学ppt
1
细胞的信号转导(signal transduction)
概述 膜表面受体介导的信号转导 细胞内受体介导的信号转导
信号转导的特点 信号转导与医学
医学ppt
2
第一节、概述
息的现代一环的息别
系现象间方境存处在 统象是传面的在理于生 的,信递核变使系生命 进生息维酸化有统命与 化命在持和,机。是非 。的同了蛋维体一一生
的发生和组织的构建,协调细胞
的功能,控制细胞的生长、分裂、
分化和凋亡等是必须的。
医学ppt
5
细胞通讯的主要方式
细胞间隙连接 膜表面分子接触通讯 化学通讯
医学ppt
主要的信号转导途径
第三节主要的信号转导途径一、膜受体介导的信号传导(一)cAMP-蛋白激酶A途径述:该途径以靶细胞内cAMP浓度改变和激活蛋白激酶A(PKA)为主要特征,是激素调节物质代谢的主要途径。
1.cAMP的合成与分解⑴引起cAMP水平增高的胞外信号分子:胰高血糖素、肾上腺素、促肾上腺皮质激素、促甲状腺素、甲状旁腺素和加压素等。
α-GDP-βγ(Gs蛋白)激素+受体→激素-受体→↓α-GTP + βγ↓AC激活↓ATP →cAMP述:当信号分子(胰高血糖素、肾上腺素和促肾上腺皮质激素)与靶细胞质膜上的特异性受体结合,形成激素一受体复合物而激活受体。
活化的受体可催化Gs的GDP与GTP交换,导致Gs的α亚基与βγ解离,蛋白释放出αs-GTP。
αs-GTP能激活腺苷酸环化酶,催化ATP转化成cAMP,使细胞内cAMP浓度增高。
过去认为G蛋白中只有α亚基发挥作用,现知βγ复合体也可独立地作用于相应的效应物,与α亚基拮抗。
腺苷酸环化酶分布广泛,除成熟红细胞外,几乎存在于所有组织的细胞质膜上。
cAMP经磷酸二酯酶(PDE)降解成5'-AMP而失活。
cAMP是分布广泛而重要的第二信使。
⑵AC活性的抑制与cAMP浓度降低◇Gα-GTP结合AC并使之激活后,同时激活自身的GTP酶活性,Gα-GTP→Gα-GDP,Gs、AC均失活。
从而在细胞对cAMP浓度升高作出应答后AC活性迅速逆转。
⑶少数激素,如生长激素抑制素、胰岛素和抗血管紧张素II等,它们活化受体后可催化抑制性G蛋白解离,导致细胞内AC活性下降,从而降低细胞内cAMP水平。
⑷正常细胞内cAMP的平均浓度为10-6mol/L。
cAMP在细胞中的浓度除与腺苷酸环化酶活性有关外,还与磷酸二酯酶的活性有关。
举例如下:①一些激素如胰岛素,能激活磷酸二酯酶,加速cAMP降解;②某些药物如茶碱,则抑制磷酸二酯酶,促使细胞内cAMP浓度升高。
2.cAMP的作用机制――cAMP激活PKA(幻灯64)⑴cAMP对细胞的调节作用是通过激活cAMP依赖性蛋白激酶或称蛋白激酶A (PKA)系统来实现的。
生物学中的信号转导通路调节
生物学中的信号转导通路调节在生物学中,信号转导通路是一个非常重要的概念。
信号转导通路是指从细胞外部的刺激到细胞内部的反应过程,也是控制细胞命运和发育的关键环节。
信号转导通路调节是指通过不同的调节机制来调控信号转导通路的过程。
细胞内的信号转导通路是非常复杂的,它涉及到许多分子、信号传递通路、反应机制等等。
其中的调节机制也是非常多样化的。
本文将详细介绍信号转导通路调节的几种常见机制。
1.受体调节受体是信号转导通路的一个关键组分。
受体的活性与其拥有的功能是紧密相连的。
因此,调节受体活性是信号转导通路调节过程中最常见的机制之一。
受体调节的机制有许多种,其中最常见的是通过结合配体或者某些共同配体来调节受体活性。
此外,还可以通过调节受体的表达水平来控制其功能。
2.转录因子和调节子调节转录因子是指控制基因表达的蛋白质。
它们通过影响 mRNA合成和 mRNA 稳定性来控制目标基因的表达。
转录因子的调节是通过一些特殊的蛋白质来实现的,这些蛋白质被称为转录因子的调节子。
调节子具有一些特殊的结构和功能,它们能够与转录因子形成复合物,并影响转录因子的活性。
因此,调节子是通过影响转录因子到达 DNA 上、与 DNA 结合和释放的过程来实现其调节功能的。
3.磷酸化和去磷酸化磷酸化和去磷酸化是信号转导通路调节的另一个常见机制。
这两种机制能够影响信号转导通路中的多个分子。
磷酸化是将磷酸基转移至蛋白质分子上,这样蛋白质得到的信息就会发生变化。
去磷酸化是去除蛋白质中已有的磷酸基。
这样蛋白质的信息就可以重新被编码。
这些机制能够直接或者间接地影响transcriptional、translational 甚至是 DNA 结构。
4.基因拷贝数和组蛋白修饰基因拷贝数和组蛋白修饰是信号转导通路调节的另一种机制。
基因拷贝数是指同一个基因在同一细胞中的拷贝数量。
每个基因的拷贝数量是在细胞分裂和祖细胞分化过程中决定的。
组蛋白修饰是指通过添加或移除一些特定的化学基团来改变某些蛋白质的功能。
信号转导ppt课件
离 子 通道
有些离子孔道的开启机率G蛋白(Gα或 Gβγ)调控, 包括钾离子孔 道,钙离子孔道及钠离子孔道。 电压活化型及G蛋白活化 的钾离子 孔道皆由四 个亚单元组成。不过前者每一个亚单元含有六跨 膜段,后 者每一个亚单元仅含两个跨膜段。
电压活化型钙离子及钠离子孔道的主要亚 基的跨膜结构。
nAChR
20世纪80年代中期,彼得·阿格雷研 究了不同的细胞膜蛋白,经过反复研究,他 发现一种被称为水通道蛋白的细胞膜蛋白就 是人们寻找已久的水通道。为了验证自己的 发现,阿格雷把含有水通道蛋白的细胞和去 除了这种蛋白的细胞进行了对比试验,结果 前者能够吸水,后者不能。为进一步验证, 他又制造了两种人造细胞膜,一种含有水通 道蛋白,一种则不含这种蛋白。他将这两种 人造细胞膜分别做成泡状物,然后放在水中, 结果第一种泡状物吸收了很多水而膨胀,第 二种则没有变化。这些充分说明水通道蛋白 具有吸收水分子的功能,就是水通道。
乙酰胆碱 (acetylcho line )的菸 碱酸受体所 形成的离子 孔道
nAChR 孔道的概要结构 。
(a) 侧面图 。 (b) 俯视图。 (c) 一个亚基的跨膜构形 。 M2围成 孔径 。 nAChR 孔道含五个亚基 ,其活化需两个 α 亚基与两个 乙酰胆硷分子结 合 。
现年47岁的罗德里克·麦 金农(Roderick MacKinnon )1978年他在 波士顿布兰代斯大学获学 士学位,1982年在波士 顿塔夫茨大学医学院获医 学博士学位。自2019年 起,他一直担任纽约洛克 菲勒大学分子神经生物学 教授。
1988年,罗德里克·麦金农利用X射 线晶体成像技术获得了世界第一张离子 通道的高清晰度照片,并第一次从原子 层次揭示了离子通道的工作原理。这张 照片上的离子通道取自青链霉菌,也是 一种蛋白。麦金农的方法是革命性的, 它可以让科学家观测离子在进入离子通 道前的状态,在通道中的状态,以及穿 过通道后的状态。对水通道和离子通道 的研究意义重大。
7第七讲 信号转导
第一类存在于可兴奋细胞。后两类存在于大多数细胞,在 信号转导的早期表现为激酶级联(kinase cascade)事 件,即为一系列蛋白质的逐级磷酸化,籍此使信号逐级传 送和放大。
cAMP信号该信号途径涉及的反应链可表示为:
激素→G蛋白耦联受体→G蛋白→腺苷酸环化酶→cAMP→依 赖cAMP的蛋白激酶A→基因调控蛋白→基因转录
不同细胞对cAMP信号途径的反应速度不同,在肌肉细胞1秒 钟之内可启动糖原降解为葡糖1-磷酸,而抑制糖原的合成。 在某些分泌细胞,需要几个小时,激活的PKA 进入细胞核, 将CRE结合蛋白磷酸化,调节相关基因的表达。
RPTK receptor protein tyrosine kinase受体蛋白酪氨酸激酶 RPTK结合信号分子,形成二聚体,并发生自磷酸化,活 化的RPTK激活RAS,RAS引起蛋白激酶的磷酸化级联反 应 , 最 终 激 活 有 丝 分 裂 原 活 化 蛋 白 激 酶 ( mitogenactivated protein kinase,MAPK),活化的MAPK进 入细胞核,可使许多底物蛋白的丝氨酸/苏氨酸残基磷酸 化,如将Elk-1激活,促进c-fos,c-jun的表达。
细胞通讯的基本特点
由信号发射细胞发出信号(产生信号分子),由信号接收细胞(靶细胞) 探测信号,其接收的手段是通过接收分子(受体蛋白),然后通过靶细 胞的识别,最后作出应答。
细胞有三种通讯方式 ①通过信号分子; ②通过相邻细胞间表面分子的粘着或连接; ③通过细胞与细胞外基质的粘着。 后两种都需要通过细胞的接触。 信号转导(signal transduction): 指外界信号(如光、电、化学分子)与细胞细胞表面受体作 用,通过影响胞内信使的水平变化,进而引起细胞应答反应 的一系列过程。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一:Rho蛋白 Rho蛋白属于小G蛋白超家族的亚家族成员,到目前为止,已发现了20多个Rho家族成员(图7—1)。根据序列的同源程度和功能,将其分为RhoA、Racl、Cdc42及缺乏GTP酶活性等四大类。
Rho belongs to the Ras super family of low molecular weight GTPases. Fifteen Rho proteins have already been characterized a n d divided into three sub-families; the first includes Rho (A, B, C), the second, Rnd 1-3 a n d the third which includes Rac 1-3, RhoG, Cdc42Hs, Rho/TTF. TC10 a n d Chp (1-2). Rho acts as a molecular switch which turns on of off various intracellular signaling pathways such as ACK, PAKs, MEKKs ROCK (3). Rho is active when bound to GTP a n d inactive when bound to GDP (4). It is also known to participate in many physiological activities including cell migration, adhesion, cytokinesis, proliferation, differentiation a n d apoptosis a n d to a greater extend cell transformation (5). Rho蛋白 Rho家族蛋白是Ras超家族中最早被克隆出来的蛋白,它们是一组相对分子质量大约为20~25kD的三磷酸鸟苷(guanosine triphosphate,GTP)结合蛋白,具有GTP酶活性,因此,习惯被称为Rho GTP酶,Rho GTP酶在细胞骨架重组调控方面起重要作用〔1〕。近年来研究发现,Rho GTP酶在多种恶性肿瘤中高表达,并和肿瘤的发生、侵袭和转移密切相关。本文主要从肿瘤细胞形态改变,细胞与胞外基质粘附以及细胞骨架重组等几个方面,对Rho GTP酶作用于肿瘤侵袭转移的分子调控机制综述如下。 1 Rho GTP酶 到目前为止,Rho GTP酶超家族已发现约20个成员,根据结构和功能不同,大致分为5个亚家族,包括:(1)Rho亚家族,包括RhoA、RhoB和RhoC,在序列上具有高度同源性,并在多种细胞中高表达,主要参与张力纤维形成和粘着斑复合体(focal adhesion complexs,FACs)组装;(2)Rac亚家族:包括Rac1、Rac2、Rac3和RhoG,促进层状伪足和胞膜皱褶形成;(3)Cdc42亚家族,包括Cdc42、TC10、TCL、Wrch1和chp/Wrch2,其中Cdc42促进丝状伪足形成:(4)Rnd亚家族:包括Rnd1、Rnd3/RhoE和Rnd2,在细胞中组成性激活表达并具有不同的组织分布,可拮抗Rho信号通路;(5)Rho BTB亚家族,包括Rho BTB1和Rho BTB2,具体功能尚不清楚。在所有Rho GTP酶超家族成员中,Cdc42、Rac1和RhoA是目前研究最多的Rho GTP酶。Rho家族各成员在氨基酸序列上有50%~55%的同源性,在靠近催化位点处都有1个能和GTP结合的功能区,与催化GTP水解密切相关。Rho GTP酶同Ras 超家族的其他成员一样,羧基端通常具有共同结构域,即由半胱氨酸残基,脂族残基和其他氨基酸残基组成的末端,是翻译后修饰的位点〔2〕。Rho GTP酶的翻译后修饰与其质膜定位有关,只有经翻译后修饰的Rho GTP酶才具有活性并能与细胞膜上适宜的脂质分子结合。在异戊烯基转移酶的作用下,半胱氨酸的巯基和异戊二烯基团间共价形成硫醚键,并在内切酶的作用下水解掉末端其余3个残基,最后异戊二烯基化的半胱氨酸残基在甲基转移酶的作用下发生甲基化,完成翻译后的修饰。Rho家族蛋白同Ras超家族的所有成员一样在活性型/GTP限制型和失活型/二磷酸鸟苷(guanosine diphosphate,GDP)限制型构象之间循环。调节这个循环过程的3类重要蛋白是:(1)鸟苷酸交换因子(guaninenucleotide exchanging factors,GEFs),催化GDP的释放和GTP的结合,活化Rho GTP酶。不同的Rho GEF在结构上都具有相同的功能域,包含1个DH(Dbl homology domain)区和1个PH(pleckstrin homologyv domain)区,前者与Rho GTP酶结合并催化其构象改变,后者通过和细胞膜上特定的脂质作用使GEF在膜上定位;(2)GTP酶活化蛋白(GTPase activating protein,GAP),作为负向调节因子加速Rho GTP酶的水解,使Rho GTP酶由活性状态变为无活性状态;(3)GDP解离抑制因子(GDP dissociation inhibitor,GDI),阻止GDP从Rho GTP酶上分离,抑制Rho GTP酶活性。Rho GTP酶是细胞内多条信号转导通路的关键分子,作为分子开关在胞内信号转导中发挥桥梁作用。Rho GTP酶可参与对正常细胞增殖、分化、凋亡的调节,并与肿瘤的发生和转移密切相关。实验研究发现,在多种肿瘤中可见Rho GTP酶表达异常,改变细胞内Rho GTP酶的表达水平可以直接影响肿瘤细胞侵袭和转移的过程。 2Rho GTP酶与肿瘤的侵袭转移 肿瘤细胞在基质中的运动由4个循环往复的步骤组成,即头部伪足的形成和延伸,新粘附位点的建立,胞体的收缩以及尾部的退缩,通过不断重复的4个过程向前迁移〔3〕。对这一过程精确调节的分子机制非常复杂,涉及胞内多条信号转导通路。在多条信号级连反应通路中,Rho GTP酶尤其是RhoA、Rac1和Cdc42是关键的调控因子,主要参与对细胞形态改变,细胞与基质粘附及细胞骨架重组的调控,调节肿瘤细胞的侵袭转移过程〔4〕。 21 细胞形态改变 伪足形成和细胞形态改变是侵袭转移的起始步骤。Rac可诱导质膜突起形成片状样的层状伪足,而Cdc42诱导指头样突起的丝状伪足形成。在高侵袭和转移性的肿瘤细胞,还可见一种侵袭伪足形成,由于与细胞外基质降解密切相关,可能成为主要的伪足结构〔5〕。层状伪足与周围基质形成粘附连接,产生细胞向前运动的锚着位点;丝状伪足有助于细胞对周围环境的适应及确定细胞迁移的方向。WiskottAldrich综合征蛋白家族(WiskottAldrich syndrome protein,WASP)是调节细胞迁移的关键分子,包括神经组织来源WASP(neural WiskottAldrich syndrome protein,NWASP),WASP家族富含脯氨酸同源蛋白1(WASP family verprolinhomologous protein1,WAVE1),WASP家族富含脯氨酸同源蛋白2(WASP familyverprolinhomologous protein2,WAVE2)等成员,也是Rac和Cdc42下游的重要效应子,在肿瘤细胞中高表达,Rac和Cdc42通过活化WASP家族成员诱导伪足形成和基质降解〔6〕。Lorenz等〔7〕首次使用荧光共振能量传感器区分活性状态和失活状态的NWASP构象,并模拟内源性NWASP功能发现,NWASP在迁移的肿瘤细胞头部层状伪足形成中起重要作用。细胞迁移头部高度动态性伪足结构的形成依赖肌动蛋白单体聚合和肌动蛋白纤维的延长,WASP家族不同成员通过不同的结构域与Rac和Cdc42结合而活化,而肌动蛋白相关2/3复合体(actinrelated 2/3 complexs,Arp2/3 complexs)和肌动蛋白单体通过分别结合于活化的WASP家族羧基端共同的结构域,直接调控肌动蛋白单体聚合〔8〕。Arp2/3复合体是肌动蛋白组装的核心,可将肌动蛋白单体从头合成组装为肌动蛋白丝,进而促进丝状伪足和层状伪足的形成〔9〕。Arp2/3复合体与WASP的结合是调控肌动蛋白聚合的重要因素,两者在多种肿瘤细胞中共表达,对115例肺腺癌组织切片免疫组化染色发现,78例(678%)共表达Arp2/3和WAVE2,并与病人临床生存时间负相关;多变量回归分析揭示,Arp2/3和WAVE2的共表达是肿瘤复发的独立危险因素〔10〕。并且NWASP和Arp2/3复合体也是高侵袭和转移性肿瘤细胞侵袭伪足形成的主要调节子,并可能成为肿瘤治疗的重要靶位〔11〕。肌动蛋白单体的聚合和伪足形成还依赖另一种关键调节子cofilin,cofilin可使肌动蛋白单体从肌动蛋白丝的顶端解离,诱导肌动蛋白丝从头部折断,产生新的末端。Rac和Cdc42可通过活化共同的底物p21激活激酶(p21activated kinase,PAK),分别激活LIM(3种同源异型结构域蛋白lin11、isl1和mec3)激酶1(LIM kinase1,LIMK1)和LIM激酶2(LIM kinase2,LIMK2),磷酸化cofilin使其失活而抑制肌动蛋白的解聚,稳定肌动蛋白细胞骨架。 22 细胞基质粘附 伪足形成启动细胞迁移的过程,但细胞持续的迁移需依赖细胞伪足与细胞外基质(extracellular matrix,ECM)的稳定粘附,提供细胞向前迁移的牵引支点。迁移的细胞头部与ECM的粘附和尾部与ECM的去粘附的不断交替使得细胞向前迁移,Rho GTP酶对这一过程发挥精确的调节。细胞表面的整合素受体与ECM中特异的配体结合,通过整合素聚集成簇而形成FACs,而整合素受体的胞内区与桩蛋白(paxillin),纽蛋白(vinculin)和踝蛋白(talin)等多种肌动蛋白结合蛋白相互作用形成分子桥,并与细胞骨架相连,提供细胞迁移的锚着位点。活化的Rac可诱导肌动蛋白的聚合和层状伪足的形成,同时也能诱导新的FACs的形成,而FACs的形成又能反过来活化Rac,这一正反馈的失控可增加肿瘤细胞的侵袭能力〔11〕。Jung〔12〕发现,活化的Rac1和Cdc42,可通过激活PAKl磷酸化下游的粘着斑激酶(focal adhesion kinase,FAK),活化的FAK作为分子支架招募胞浆中桩蛋白,纽蛋白和踝蛋白等至FACs,促进FACs的形成。p65
