淋球菌OmpA蛋白的克隆表达、保守性及抗原表位分析
嗜水气单胞菌孔蛋白OmpF重组表达及其免疫原性分析

生物技术通报
BIOTECHNOLOGY BULLETIN
2019, 35(9):23组表达及其免疫原性 分析
高云山 刘丹丹 徐俊林 桑雨浓 梁夏夏 刘建欣 王文彬
(1. 江苏海洋大学海洋生命与水产学院,连云港 222005 ;2. 江苏海洋大学江苏省海洋生物技术重点实验室,连云港 222005)
关键词 : 嗜水气单胞菌 ;外膜蛋白 OmpF ;重组表达 ;免疫原性 DOI :10.13560/ki.biotech.bull.1985.2019-0628
Recombinant Expression and Immunogenicity Analysis of the Porin Protein OmpF of Aeromonas hydrophila
Abstract: Outer membrane protein(Omp)F in Aeromonas spp. is β-barrel like porin,and involves in the adaption of osmotic pressure and is highly conservative in this common pathogen for human and fish,thus poses a promising research value as immune-detection target. The A. hydrophila OmpF fragment published in GenBank was synthesized,and inserted into plasmid pET-28a(+). The recombinant plasmid was transformed into Escherichia coli BL21(DE3)and induced by isopropy-β-D-thiogalactoside(IPTG). The molecular size of the expressed protein was about 40 kD,which mainly expressed as inclusion bodies after optimization of inducing temperatures and IPTG concentrations. BALB/c mice were immunized with purified OmpF inclusion bodies. The results of ELISA showed that the immunized mice serum cross-reacted with 10 of 11 boiled and deactivated strains of Aeromonas spp.,the serum titers were around 1∶81 000. However,the mice serum did not react with Vibrio cholerae,Bacillus licheniformis,V. parahaemolyticus,V. vulnificus,and V. anguillarum. The above results indicate that the protein OmpF is immunogenic,conserved and was promising in developing Aeromonas cross-reactive antibodies.
肺炎链球菌假想蛋白SPD0414的表达纯化及保守性分析

肺炎链球菌假想蛋白SPD0414的表达纯化及保守性分析龚艺;崔亚利;牛司强;张雪梅;胥文春;何於娟;王虹【期刊名称】《中国免疫学杂志》【年(卷),期】2010(026)009【摘要】目的:获得纯化的肺炎链球菌(S.pn)重组假想蛋白SPD0414,并分析其在常见S.pn菌株中的保守性.方法:利用PCR方法扩增SPD0414蛋白胞外区核酸序列,将其克隆到原核表达载体ppSUMO内,转化到E.coli BL21(DE3)中,经IPTG诱导表达后Ni-NTA树脂纯化重组蛋白.用SDS-PAGE和Western blot鉴定蛋白特异性及纯度.通过纯化蛋白免疫BALB/c小鼠制备其多克隆抗体,并用间接ELISA检测多克隆抗体的效价,Western blot方法分析多克隆抗体的特异性,同时,鉴定该蛋白在6种常见肺炎链球菌分离株的保守性.结果:克隆的SPD0414序列与Gene Bank中的数据相符,并实现了重组SPD0414蛋白高水平的可溶表达纯化蛋白免疫BALB/c小鼠获得高滴度、高特异性的的多克隆抗体,Western blot验证SPD0414蛋白在6株常见肺炎链球菌菌株中均有表达.结论:成功制备了高滴度、高特异性的SPD0414多克隆抗体,证实了SPD0414在肺炎链球菌不同菌株间保守性较高,为肺炎链球菌多肽联合疫苗的研制奠定了基础.【总页数】4页(P824-827)【作者】龚艺;崔亚利;牛司强;张雪梅;胥文春;何於娟;王虹【作者单位】重庆医科大学检验系,临床检验诊断学教育部重点实验室,重庆,400016;重庆医科大学检验系,临床检验诊断学教育部重点实验室,重庆,400016;重庆医科大学检验系,临床检验诊断学教育部重点实验室,重庆,400016;重庆医科大学检验系,临床检验诊断学教育部重点实验室,重庆,400016;重庆医科大学检验系,临床检验诊断学教育部重点实验室,重庆,400016;重庆医科大学检验系,临床检验诊断学教育部重点实验室,重庆,400016;重庆医科大学检验系,临床检验诊断学教育部重点实验室,重庆,400016【正文语种】中文【中图分类】R392.1【相关文献】1.肺炎链球菌疫苗候选蛋白质谷氨酰胺tRNA合成酶的保守性与抗原性分析 [J], 闵迅;黄美容;黄健;董杰;陈特;王虹;钟文;尹一兵2.肺炎链球菌组氨酸激酶VicK的全长表达及其保守性分析 [J], 张帅;刘宇思;王虹;王哲;王维;张雪梅3.肺炎链球菌Spr0982的表达纯化及保守性分析 [J], 余维丽;鹿中华;杨翔;郑瑶;孙昀4.肺炎链球菌 TCSs 中 WalR 的克隆表达、保守性及抗原表位分析 [J], 韩道宾;骆诗露;黄健;朱杰华;陈泽慧;闵迅5.肺炎链球菌SPD1587蛋白的表达纯化及晶体生长研究 [J], 黄健;黄美容;骆诗露;朱杰华;闵迅因版权原因,仅展示原文概要,查看原文内容请购买。
犬链球菌M蛋白基因的克隆及生物信息学分析

犬链球菌M蛋白基因的克隆及生物信息学分析梁昱;刘燕霏;孙晓莉;杨建德【期刊名称】《天津农学院学报》【年(卷),期】2018(025)001【摘要】本研究对犬链球菌M蛋白(SCM)基因克隆,并对其进行生物信息学分析,预测其蛋白质结构及功能,为链球菌表位疫苗的研究及链球菌病的诊断提供参考.利用ExPASy ProtParam在线分析软件,预测犬链球菌M蛋白为亲水性蛋白质且属于稳定蛋白.使用SignalP 4.1软件推测该蛋白有信号肽.利用SOPMA中5种相互独立的方法预测其二级结构,其中α螺旋占83.53%,可知α螺旋为二级结构的主要元件.应用SWISS-MODEL在线分析软件,进行三级构造同源建模,发现其结果与二级结构预测结论大致相同.使用DNAStar预测软件中的Protean部分对SCM亲水性、蛋白质的二级结构、抗原性指数、表面可能性、柔韧性进行归纳比较分析,在第55~59和第377~379氨基酸区段存在B细胞表位.【总页数】5页(P44-48)【作者】梁昱;刘燕霏;孙晓莉;杨建德【作者单位】天津农学院动物科学与动物医学学院,天津300384;天津农学院动物科学与动物医学学院,天津300384;天津农学院动物科学与动物医学学院,天津300384;天津农学院动物科学与动物医学学院,天津300384【正文语种】中文【中图分类】S852.61【相关文献】1.马链球菌兽疫亚种中国株的类M蛋白基因抗原表位片段的克隆与表达 [J], 苏良科;陆承平2.马链球菌兽疫亚种类M蛋白的基因克隆、序列分析及其在猪源链球菌的检测 [J], 范红结;陆承平;唐家琪3.昆明犬PPARGC1A基因编码区克隆及生物信息学分析 [J], 李静;万九生;邓卫东;陈超;岳锐;黎立光4.猪链球菌rpoE基因克隆及生物信息学分析 [J], 杜炎斌;张港琛;王瑜欣;刘宝宝;宫胜龙;东笑;汪洋5.犬乳铁蛋白基因克隆及生物信息学分析 [J], 李航;陈宗艳;刘光清;李传峰因版权原因,仅展示原文概要,查看原文内容请购买。
幽门螺杆菌napA基因的克隆、表达及NAP蛋白抗原表位的研究

第一部分幽门螺杆菌napA基因的序列测定及生物信息学分析第一部分幽门螺杆菌napA基因的序列测定及生物信息学分析参照幽门螺杆菌国际测序模式株Hp26695基因组全序列设计并合成引物,以Ncrc11639基因组为模板,扩增napA基因,与克隆载体pMDl8-T连接后构建重组克隆,经双酶切鉴定后测序。
将测序结果与Genebank公布的Hp菌株的核酸序列和氨基酸序列进行同源性比对和抗原表位分析,为体外高效表达NAP蛋白奠定基础。
1.1材料1.1.1菌株、质粒Hp标准株NCTC11639、H岫临床分离株、E.coliDH5a由本室保存:pMDl8·TSimpleVector(图1-1、表1.1)为TaKaRa公司产品。
“““”…竺篡麓篙器=:::篙黧鬈’I。
-一_am^■t#产■■■∞hP●_¨m舯l::;嚣嚣7错嚣掰:州枷蹦图1-1pMDIS-T的结构啦!-1ThestructureofpMDl8-Tvector4硕士学位论文1.2.5生物信息学分析利用生物信息学软件DNAMAN,分析napA的DNA序列和编码蛋白的特性。
利用www.ncbi.nlm.nih.gov网站上的BLAST工具进行同源性搜索和分析;在Linux操作系统上进行NAP三维蛋白模型的预测。
利用harvard大学的在线软件进行抗原表位预测。
应用SignaiP3.0server(http://www.cbs.dtu.dk/serviees/SignalP)分析氨基酸序列中是否存在信号肽。
1.3结果1.3.1napA基因的扩增从apNCTCll639DNA模板中,PCR扩增获得大小为435bp的目的条带(图1-2),与预期napA基因大小相符。
图1-2napA基因PCR产物的琼脂糖凝胶电泳分析rig1-2AgarosegelelectrophoresisanalysisofPCRproductofnapAgene1:DL2000DNAmarker;2:napAgene(435bp).1.3.2napA基因T_A克隆与鉴定将napA基因PCR扩增产物纯化回收后,与pMDl8.T载体连接,转化DH5a感受态细胞,利用蓝白斑菌落筛选阳性重组克隆(图1.3)。
新型抗菌药物治疗淋病奈瑟球菌感染的研究进展
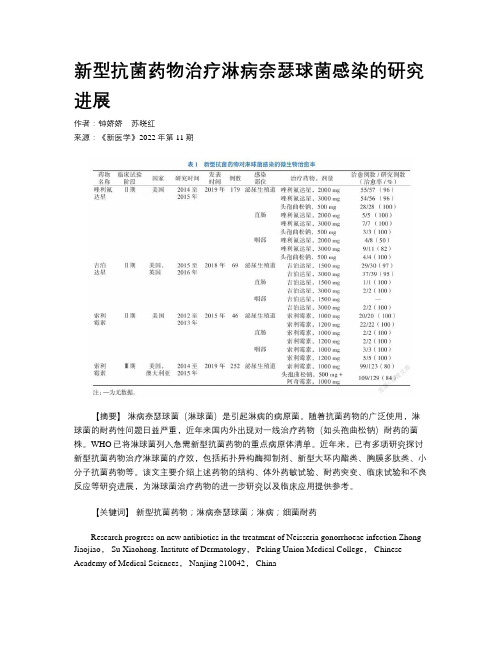
新型抗菌药物治疗淋病奈瑟球菌感染的研究进展作者:钟娇娇苏晓红来源:《新医学》2022年第11期【摘要】淋病奈瑟球菌(淋球菌)是引起淋病的病原菌。
随着抗菌药物的广泛使用,淋球菌的耐药性问题日益严重,近年来国内外出现对一线治疗药物(如头孢曲松钠)耐药的菌株。
WHO已将淋球菌列入急需新型抗菌药物的重点病原体清单。
近年来,已有多项研究探讨新型抗菌药物治疗淋球菌的疗效,包括拓扑异构酶抑制剂、新型大环内酯类、胸膜多肽类、小分子抗菌药物等。
该文主要介绍上述药物的结构、体外药敏试验、耐药突变、临床试验和不良反应等研究进展,为淋球菌治疗药物的进一步研究以及临床应用提供参考。
【关键词】新型抗菌药物;淋病奈瑟球菌;淋病;细菌耐药Research progress on new antibiotics in the treatment of Neisseria gonorrhoeae infection Zhong Jiaojiao, Su Xiaohong. Institute of Dermatology, Peking Union Medical College, Chinese Academy of Medical Sciences, Nanjing 210042, ChinaCorresponding author, Su Xiaohong, E-mail:****************【Abstract】 Neisseria gonorrhoeae is the pathogen of gonorrhea. With the widespread use of antibiotics, drug resistance of Neisseria gonorrhoeae is a growing problem. In recent years, drug-resistant strains to the first-line treatment drugs (such as ceftriaxone sodium) have emerged at home and abroad. The WHO has included Neisseria gonorrhoeae as one of the priority pathogens in urgent need of new antibiotics. In recent years, a number of studies have been conducted to evaluate the efficacy of novel antibiotics in the treatment of Neisseria gonorrhoeae, including topoisomerase inhibitors, novel macrolides, pleural polypeptides and small molecule antibacterial drugs, etc. In this article, research progress on the structure, in vitro drug sensitivity, drug resistance mutation, clinical trials and adverse reactions of these drugs was reviewed, aiming to provide references for further research on Neisseria gonorrhoeae and their clinical application.【Key words】 New antibiotics; Neisseria gonorrhoeae; Gonorrhea; Bacterial drug resistance淋病奈瑟球菌(淋球菌)是一種临床常见的性传播病原体,是引起淋病的病原菌,在全球范围内造成严重的公共卫生问题。
研究肺炎链球菌候选蛋白疫苗ClpP的保守性和抗原性

研究肺炎链球菌候选蛋白疫苗ClpP的保
守性和抗原性
ﻭ
摘要:目的:评价酪蛋白裂解酶P(ClpP)作为候选疫苗的保守性和抗原性,分析在不同血清型肺炎链球菌(SP N)中的表达情况.方法: 以TIGR4型SPN的ClpP基因序列设计引物,分别以12株不同血清型SPN的基因组DNA为模板,对ClpP基因进行聚合酶链反应(PCR)扩增、胶回收产物与PMD?18克隆载体连接后进行测序,运用生物信息学方法对其核苷酸及推测的氨基酸序列及抗原性进行分析,并利用Western Blot方法检测12株不同血清型SPN的ClpP蛋白的表达情况.结果: 12株不同血清型SPN的ClpP基因序列和GenB ank数据库对已公布的TIGR4型SPN的ClpP基因一致性ﻭ
ﻭ。
大肠杆菌外膜蛋白酶基因OmpT的克隆及表达

中国农业科技导报,2011,13(2):53-58Journal of Agricultural Science and Technology收稿日期:2010-11-29;接受日期:2011-01-26基金项目:国际科技合作项目(2008DFA32080)资助。
作者简介:董世雷,硕士研究生,主要从事微生物与分子生物学的研究。
E-mail :dsl166@126.com 。
通讯作者:王欣,研究员,博士,主要从事微生物生态与免疫方面的研究。
Tel :0571-86415126;E-mail :xxww101@sina.com 大肠杆菌外膜蛋白酶基因OmpT 的克隆及表达董世雷1,2,刘伟2,朱立颖2,王学琴3,于宏伟4,王欣2(1.浙江师范大学化学与生命科学学院,浙江金华321004;2.浙江省农业科学院植物保护与微生物研究所,杭州310021;3.内蒙古工业大学化工学院,呼和浩特010051;4.马歇尔大学微生物学与免疫学院,亨廷顿25755,美国)摘要:OmpT (Outer-membrane proteases T )是革兰氏阴性细菌分泌到细胞表面具有丝氨酸蛋白酶活性的一种重要蛋白。
利用大肠杆菌OmpT 降解抗菌肽特性来筛选和改造新型抗菌肽,可以为开发抗OmpT 蛋白酶水解新抗菌肽序列提供新的思路和创造条件。
根据大肠杆菌外膜蛋白酶OmpT 的基因序列设计一对引物,应用聚合酶链式反应(PCR )方法,从大肠杆菌K12基因组中扩增获得一段为954bp 的序列,测序结果显示此序列与已公布序列同源性达99.99%。
将其序列定向克隆到原核表达载体pET28a 上构建重组表达质粒pET28a-OmpT 。
经IPTG 诱导后,在表达宿主菌中特异性的表达出分子量约为36kDa 且具有生物活性的OmpT 蛋白。
生长曲线试验显示,抗菌肽LL37对带重组表达质粒pET28a-OmpT 的大肠杆菌生长没有影响,而对照组的生长明显受到抗菌肽的抑制作用。
猪流产嗜性衣原体MOMP基因的克隆及原核表达

猪流产嗜性衣原体MOMP基因的克隆及原核表达李西玉;许信刚;周继章;邱昌庆;曹小安;宫晓炜;王光华【摘要】[目的]克隆猪流产嗜性衣原体青海株主要外膜蛋白(Major outer membrane protein,MOMP)基因,并进行序列分析及原核表达.[方法]根据GenBank公布的猪流产嗜性衣原体MOMP基因的核苷酸序列,设计并合成4条特异性引物,用套式PCR方法扩增猪流产嗜性衣原体青海株MOMP基因,将其克隆入pMD18-T载体中,进行测序及序列分析.然后将MOMP基因亚克隆入原核表达载体pGEX4T-1中,在大肠杆菌BL21(DE3)中用IPTG诱导表达,对表达产物进行SDS-PAGE和Western blot检测.[结果]扩增到猪流产嗜性衣原体青海株1170 bp 的MOMP全长基因.序列分析结果表明,该基因与已发表的猪流产嗜性衣原体B11001株和CP/12株核苷酸同源性均为99.7%.SDS-PAGE电泳可检测到分子质量约为66 ku的融合蛋白,主要以包涵体形式存在.Western-blot分析表明,重组蛋白可被猪流产嗜性衣原体抗体识别.[结论]成功克隆了猪流产嗜性衣原体青海株MOMP基因,并进行了原核表达,表达的蛋白具有抗原活性.【期刊名称】《西北农林科技大学学报(自然科学版)》【年(卷),期】2010(038)007【总页数】7页(P33-38,43)【关键词】猪;流产嗜性衣原体;MOMP 蛋白;原核表达【作者】李西玉;许信刚;周继章;邱昌庆;曹小安;宫晓炜;王光华【作者单位】西北农林科技大学,动物医学院,陕西,杨凌,712100;中国农业科学院,兰州兽医研究所,家畜疫病病原生物学国家重点实验室,农业部兽医公共卫生重点开放实验室,甘肃,兰州,730046;西北农林科技大学,动物医学院,陕西,杨凌,712100;中国农业科学院,兰州兽医研究所,家畜疫病病原生物学国家重点实验室,农业部兽医公共卫生重点开放实验室,甘肃,兰州,730046;中国农业科学院,兰州兽医研究所,家畜疫病病原生物学国家重点实验室,农业部兽医公共卫生重点开放实验室,甘肃,兰州,730046;中国农业科学院,兰州兽医研究所,家畜疫病病原生物学国家重点实验室,农业部兽医公共卫生重点开放实验室,甘肃,兰州,730046;中国农业科学院,兰州兽医研究所,家畜疫病病原生物学国家重点实验室,农业部兽医公共卫生重点开放实验室,甘肃,兰州,730046;中国农业科学院,兰州兽医研究所,家畜疫病病原生物学国家重点实验室,农业部兽医公共卫生重点开放实验室,甘肃,兰州,730046【正文语种】中文【中图分类】S852.67衣原体是介于细菌和病毒之间的一类严格细胞内寄生性微生物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
淋球菌OmpA蛋白的克隆表达、保守性及抗原表位分析黄健;黄美容;骆诗露;肖质会;聂鑫;闵迅
【摘要】目的了解OmpA蛋白在不同型别淋球菌间的保守性,分析OmpA蛋白的B细胞抗原表位,并通过大肠杆菌表达系统获取其重组蛋白.方法从Genebank 数据库中获取不同型别淋球菌的OmpA蛋白氨基酸序列,利用ClustalX 2.1软件对序列保守性进行分析.利用DNASTAR软件预测分析OmpA蛋白B细胞抗原表位.构建ppSUMO-ompA重组表达载体,转化至大肠杆菌BL21(DE3)菌株中表达OmpA重组蛋白,以SDS-PAGE检测表达的重组蛋白.结果 OmpA蛋白在不同型别淋球菌菌株间保守性高达99.6%,OmpA蛋白抗原表位可能位于28-37、78-86、95-102、147-154、159-165、201-208、213-218等氨基酸区段.SDS-PAGE检测大肠杆菌中表达出OmpA蛋白,主要以包涵体形式存在.结论成功构建ppSUMO-ompA重组表达载体,获得包涵体形式的OmpA蛋白,且OmpA蛋白可能是一种保守性较好的淋球菌蛋白疫苗候选分子.
【期刊名称】《遵义医学院学报》
【年(卷),期】2015(038)003
【总页数】5页(P261-265)
【关键词】淋球菌;OmpA蛋白;原核表达;保守性;抗原表位
【作者】黄健;黄美容;骆诗露;肖质会;聂鑫;闵迅
【作者单位】遵义医学院附属医院医学检验科,贵州遵义563099;遵义医学院附属医院输血科,贵州遵义563099;遵义医学院医学检验系,贵州遵义563099;遵义医学
院医学检验系,贵州遵义563099;遵义医学院医学检验系,贵州遵义563099;遵义医
学院附属医院医学检验科,贵州遵义563099
【正文语种】中文
【中图分类】R378.1
淋球菌(Neisseria gonorrhoeae,NG)是淋病的唯一病原体,其主要引起泌尿生
殖系统化脓性感染 [1]。
资料显示,每年全球约有62 000 000新增淋病患者[2]。
目前,淋球菌感染仍是严重威胁公共卫生安全的一种重要的性传播疾病。
如何有效预防和控制淋病,成为全世界普遍关注的公共卫生问题。
目前,抗生素是治疗其感染的主要手段,但随着淋球菌耐药菌株的广泛出现及播散[3],对其防治带来严峻
挑战。
近年研究显示,保守的淋球菌疫苗能诱导杀菌性抗体的产生,从而能有效地清除淋球菌感染[4]。
因此,积极发展有效的淋球菌疫苗将成为预防和控制淋病的
重要手段。
OmpA(outer membrane protein A)是淋球菌的一种外膜蛋白质,研究显示其在粘附和入侵宫颈癌细胞和子宫内膜细胞扮演了一个重要作用[5]。
此外,在小鼠感
染模型中,ompA基因敲除菌株与野生型菌株相比,其感染小鼠能力显著降低[5]。
提示OmpA蛋白是淋球菌致病过程中的重要毒力因子,可能是一种较好的蛋白疫苗候选靶点。
因此,本研究拟首先对其保守性进行分析,并对其B细胞抗原表位
进行分析,最后通过大肠杆菌表达系统获取其重组蛋白,从而为下一步以OmpA
蛋白为基础的疫苗研究奠定基础。
2.2 B细胞抗原表位分析从图2可见,4种基于亲水性、可塑性、抗原指数及
表面可能性方法预测的OmpA蛋白B细胞抗原表位位置较为吻合,综合结果显示其较可能成为B细胞抗原表位的氨基酸区段为28-37、78-86、95-102、147-154、159-165、201-208、213-218。
2.3 ompA基因扩增ompA基因PCR扩增产物行1%琼脂糖凝胶电泳分析,在675bp处可见单一条带,其大小与预期相符(见图3)。
2.4 重组表达载体的构建ompA基因扩增产物克隆于ppSUMO质粒后转化大
肠杆菌DH5α,得到多个克隆,经菌液PCR鉴定,第1、2、5、8、10、11、13号克隆为阳性克隆,其余克隆为假阳性(见图4)。
ppSUMO-ompA重组质粒经EcoR I、Xho I双酶切,可见675bp大小的酶切片段(见图5)。
2.5 重组蛋白的诱导表达由图6可见,表达菌经IPTG诱导表达后可见一条明
显增粗的蛋白条带,其相对分子量约为39.4kD大小,即等于23.4kD大
小 Omp A蛋白与16kD SUMO标签蛋白的分子量之和,与预期相符。
对超声破
菌液分析显示,OmpA蛋白主要位于破菌液沉淀中,表明该蛋白主要以包涵体形
式表达(见图6)。
蛋白质疫苗以其具有保守性好、免疫原性好、生产成本低等优点,将成为未来淋球菌疫苗研究的重要方向。
筛选保守有效的蛋白质疫苗对于未来淋球菌防治具有重要现实意义。
目前,已发现一些蛋白质疫苗可以诱导宿主产生针对淋球菌的杀菌性抗体。
如Por A蛋白诱导宿主产生的抗体水平与血清抗菌活性直接相关,由于其免
疫原性及保守性好,是目前较好的疫苗候选靶点[7]。
另外,最近研究显示NspA
蛋白在小鼠模型中可以诱导产生特异性杀菌抗体及有效的调理吞噬作用[8]。
但目
前总体来说,淋球菌蛋白疫苗靶点的筛选进展还较缓慢,其中较为重要的原因是淋球菌可产生频繁的抗原变异,这对于筛选保守的蛋白疫苗靶点带来巨大挑战;此外,由于有效的抗生素治疗使得淋球菌疫苗研究投入减少[9]。
但近年来的耐药监测发现,目前已有淋病奈瑟菌对临床使用的所有抗生素产生耐药抵抗的报道,对其治疗面临无药可用的危险[10]。
因此,积极筛选保守有效的蛋白质疫苗对于未来淋球菌的防治有重要的理论与现实意义。
OmpA蛋白是淋球菌中的一种膜蛋白,在其致病过程中的发挥着重要作用。
本研
究首先对OmpA蛋白保守性进行分析,显示其在不同型别淋球菌间具有较高的保守性,提示其可能为较好的蛋白疫苗候选靶点。
进一步利用DNASTAR软件对OmpA蛋白抗原表位分析,发现本研究选取的4种方法预测的抗原表位位置较为
吻合,提示氨基酸区段28-37、78-86、95-102、147-154、159-165、201-208、213-218成为抗原表位的可靠性较大,这可为后续抗原表位鉴定奠定了结构基础。
为获取以OmpA蛋白作为免疫原的蛋白疫苗,本研究通过原核表达系统对其蛋白进行重组表达。
我们构建了ppSUMO-ompA重组质粒,并在大肠杆菌中
成功大量表达出OmpA蛋白。
对蛋白表达形式分析显示,其主要以包涵体形式表达。
蛋白包涵体的形成受翻译速率、折叠速率等因素影响,当蛋白的翻译速率远大于折叠速率时,就容易导致产生错误折叠的空间构象而导致包涵体形成[8]。
而重
组蛋白表达过程中翻译速率、折叠速率又受多种因素的影响,如诱导剂浓度、摇床的转速、诱导温度等[11]。
本研究分别采用不同诱导时间、不同诱导剂浓度、不同转速等表达条件,但均未获得以可溶形式表达的OmpA蛋白,这可能与载体在宿主表达菌株中的高水平表达有关。
包涵体的致密结构可以形成空间屏障,阻止蛋白酶的水解作用,有利于重组蛋白的保留,且通过合适的变性复性条件,在多数条件下可以从包涵体中获得纯度达90%以上的重组蛋白[12]。
因此,在下一步工作中,我们拟对包涵体进行纯化、变性、复性,以期获得纯度较好的可溶性免疫原,用于后续蛋白疫苗研究。
临床医学研究。
