环境监测碱度的计算例题
环境化学(水环境计算题)课后习题参考答案

第三章 水环境化学(P195)4.(1) 查表知pH = 6.5时, α= 1.710C T = [碱度]×α = 1.6×1.710 mmol/l = 2.736mmol/l 。
设加入的Na 2CO 3为n mmol/l查表知:当pH = 8.0时, α` = 1.018C T ` = C T + n ----------(1) C T `= [碱度]`×α` --------(2) [碱度]`= 1.6 +2 n --------(3) 由 (1)、(2)和(3)解得:n = 1.07 mmol/l 。
(2)∵加入NaOH 后C T 不变 L mmol C T/688.2028.1736.2][===α碱度碱度的增加值就应是加入的NaOH 的量。
△A = [碱度]` - [碱度] = 2.688 - 1.6 = 1.088mmol/l5.解:当pH = 7.00时,CO 3-的浓度与 HCO 3-的浓度相比可以忽略,查表pH = 7.00时, α= 1.224,则[HCO 3-] = [碱度] = 2.00×10-3mol/l/l 。
[H +] = [OH -] = 10-7 mol/l 。
[HCO 3※] = [H +][HCO 3-]/K 1 = 1.00×10-7×2.00×10-3/(4.55×10-7) = 4.49×10-4mol/l 。
[CO 3-] = K 2[HCO 3-]/[H +] = 4.69×10-11×2.00×10-3/(1.00×10-7) = 9.38×10-7mol/l 。
6.解: 查表 pH = 7.5时, α1 = 1.069, pH = 9.0时, α2 = 0.9592;C T1 = [碱度]×α1 = 6.38×1.069 = 6.82 mmol/l C T2 = [碱度]×α2 = 0.80×0.959 = 0.767 mmol/l; L mmol C C C T T T /79.3277.082.6221=+=+=混合后L mmol /59.3280.038.6][=+=碱度005.159.379.3][===碱度T C α 查表知pH = 7.587.解:由题意知 [Fe 3+] + [Fe(OH)2+] + [Fe(OH)2+] = 1.00×10-4 mol/l ; (1) [Fe(OH)2+][H +]/[Fe 3+] = 8.9×10-4(2) [Fe(OH)2+][H +]2/[Fe 3+] = 4.9×10-7 (3)SP W K H K FeOHFe==++-+33333][][]][[查表知Fe(OH)3的K SP = 3.2×10-38代入(1)得[H +] = 1.9×10-3mol/l (∵pH =2.72)∴[Fe 3+] = 3.2×104[H +]3= 3.2×104×1.9×10-3×3= 6.24×10-5mol/l ;[Fe(OH)2+] = 4.9×10-7[Fe 3+]/[H +]2 = 4.9×10-7 K SP [H +]/ K W 3 = 15.68×10-3×1.9×10-3 = 8.47×10-6mol/l ; [Fe(OH)2+] = 8.9×10-4[Fe 3+]/[H +] = 8.9×10-4K SP [H +]2/ K W 3= 28.48×(1.9×10-3)2= 2.92×10-5mol/l 。
环境监测复习资料
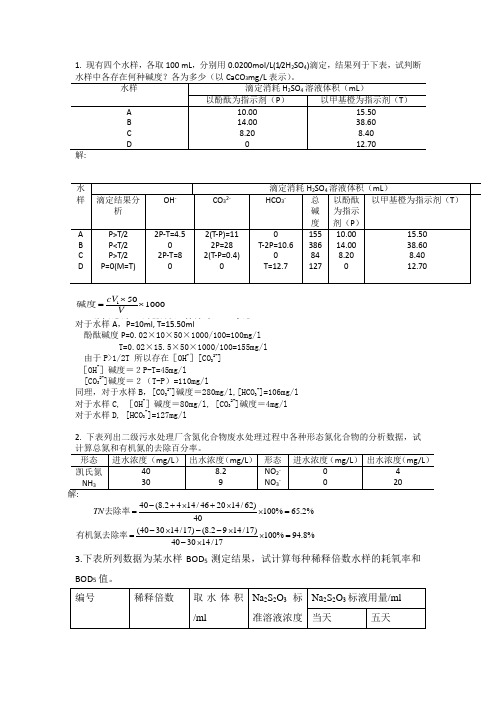
1. 现有四个水样,各取100 mL ,分别用0.0200mol/L(1/2H 2SO 4)滴定,结果列于下表,试判断水样中各存在何种碱度?各为多少(以CaCO 3mg/L 表示)。
水样 滴定消耗H 2SO 4溶液体积(mL )以酚酞为指示剂(P ) 以甲基橙为指示剂(T )A B C D 10.00 14.00 8.20 0 15.5038.608.4012.70解:水样 滴定消耗H 2SO 4溶液体积(mL )滴定结果分析 OH - CO 32- HCO 3- 总碱度 以酚酞为指示剂(P )以甲基橙为指示剂(T )A B C D P>T/2 P<T/2 P>T/2 P=0(M=T) 2P-T=4.5 0 2P-T=8 0 2(T-P)=11 2P=28 2(T-P=0.4) 0 0 T-2P=10.6 0 T=12.7 155 386 84 127 10.00 14.00 8.20 0 15.5038.608.4012.7011501000/501/2/cV Vc H mol L V mL V ml g mol +⨯=⨯碱度—酸标准液(以计)的浓度,;—所消耗酸标准的体积,;—水样的体积,;—的摩尔质量,。
对于水样A ,P=10ml, T=15.50ml 酚酞碱度P=0.02×10×50×1000/100=100mg/lT=0.02×15.5×50×1000/100=155mg/l 由于P>1/2T 所以存在[OH -][CO 32-] [OH -]碱度=2P-T=45mg/l[CO 32-]碱度=2(T-P )=110mg/l同理,对于水样B ,[CO 32-]碱度=280mg/l,[HCO 3-]=106mg/l对于水样C, [OH -]碱度=80mg/l, [CO 32-]碱度=4mg/l对于水样D, [HCO 3-]=127mg/l2. 下表列出二级污水处理厂含氮化合物废水处理过程中各种形态氮化合物的分析数据,试计算总氮和有机氮的去除百分率。
环境监测计算题

-----WORD 格式--可编辑--专业资料-------完整版学习资料分享----1、分别取10mL 、5mL 废水于A 、B 两比色管中,其中向B 管加入KMnO 4氧化水样中的Cr (Ⅲ),然后再加入NaNO2、尿素等分解过量试剂,其余操作同制作标准曲线的溶液一并进行,在b=1cm 、λ=540nm 处测吸光度,结果如下:Cr (ug )0 A B A求:(1)绘制工作曲线;(2)求水样中Cr (Ⅲ)、Cr (Ⅵ)、总Cr 的浓度。
2、测定某水样中铜的浓度。
取四份水样各10 mL ,分别加入铜标液数据如下,定容至20 mL ,测得吸光度数据如下,求该水样中铜的浓度。
编号 水样量/mL加入铜标液(10ug/ mL)体积/ mL 数吸光度A B C 10 10 10 0 2 43、取水样100.0mL ,以酚酞为指示剂,用0.100mol/L HCl 溶液滴定至指示剂刚好褪色,用去13.00mL ,再加甲基橙指示剂,继续用HCl 溶液滴定至终点,又消耗20.00 mL 。
问水样中有何种碱度?其含量为多少(CaCO 3mg/L 表示)?4、测定水样的高锰酸盐指数,取水样300 mL ,加入已知浓度为0.0400 mol/L 的高锰酸溶液 (1/5 KMnO 4)及适量酸,沸水浴加热30分钟,又加入已知浓度为(1/2 Na 2C 2O 4)的草酸钠溶液,趁热用上述高锰酸钾溶液回滴,又用去,求该水样的高锰酸盐指数。
5、废水估计COD =500,分别取废水12.0、24.0、48.0mL ,然后用稀释水稀释至1000mL ,测定当日溶解氧和五日溶解氧如下,求:该废水的BOD 5值。
DO (mg/L )稀释水废水取样量(mL )当日 第五日/6、现有一水样欲测定其Pb 2+的浓度,采用原子吸收法进行测定。
在已知25mL 水样中,加入50 μL 浓度为1 mg/mL 的Pb 2+标准溶液,然后用蒸馏水稀释所取水样至50mL ,摇匀,测定其吸光度为0.516;另取一份25mL 同样的水样,用蒸馏水稀释至50mL 后测得吸光度为0.285。
环境工程计算之水体酸碱度及电导率的计算

环境工程计算之水体酸碱度及电导率的计算引言水体的酸碱度和电导率是环境工程中常用的计算参数。
正确计算这些参数对于评估水质和环境污染很重要。
本文将介绍水体酸碱度和电导率的计算方法。
水体酸碱度的计算水体的酸碱度通常用pH值来表示。
pH值的计算方法如下:1. 准备一个水样,并测量水样的温度。
2. 使用酸碱度计测量水样的酸碱度。
3. 根据酸碱度计的测量结果,计算出水样的pH值。
水体电导率的计算水体的电导率反映了其中有多少电解质的能力。
电导率的计算方法如下:1. 准备一个测量电导率的电导计,并进行校准。
2. 将电导计置于水体中,等待数秒钟以获得稳定的读数。
3. 读取电导计的测量结果,即为水体的电导率。
注意事项在进行水体酸碱度和电导率的计算时,需要注意以下事项:1. 水样的收集应该代表性,避免受到污染。
2. 使用的仪器要进行定期的校准和维护,确保准确的测量结果。
3. 要注意水样的温度对酸碱度和电导率的影响,可能需要进行温度修正。
结论水体的酸碱度和电导率是环境工程中重要的计算参数,对于水质评估和环境污染评估具有重要意义。
正确计算这些参数需要合适的仪器和方法,并且要注意相关的操作细节。
参考文献:[1] Author 1. Title of the article. Journal Name. Year;Volume(Issue):Page numbers.[2] Author 2. Title of the book. Publisher. Year.。
最新环境化学计算题急答案

环境化学计算题急答案------------------------------------------作者xxxx------------------------------------------日期xxxx1。
在一个pH 为6。
5,碱度为1.6×10—3mol /L 的水体中,(1)需要加入多少m mol/L 的碳酸钠才能使水体的pH 上升到8.0?(2)若用Na HO 进行碱化,需要加入多少Na HO ?解:pH=6。
5,碱度=1.6×10-3mol/L;总碱度=C T (α1+2α2)+K ω/[H +]-[H +] =C T /α + K ω/[H +]-[H+]1。
6×10-3=C T/1.71+10—14/10—6。
5 —10-6.5 C T =2.74×10-3mo l/L用强碱碱化至p H=8。
0,C T不变,总碱度=2.74×10-3/1。
018 +10—6 -10-8=2.69×10-3ΔA N aO H=2。
69×10-3 – 1。
6×10-3=1。
09×10—3mol/L用N a2CO 3碱化至pH =8。
0,设加入Na 2CO 3量为x mol/L ,该过程中,C T → C T + x总碱度=1。
6×10—3 + 2x =(C T + x)/1.018, x Na2CO3=1。
07×10—3mol/L2。
具有2.00×10—3 m ol/L 碱度的水,pH 为7.0,计算[HCO 3]、[HCO 3—]、[CO 3—2]和[HO-]的浓度?解:该条件下,[HC O3-]= 碱度 = 2。
00×10-3 m ol/L 在pH=7。
00时, [H+] = [HO —] = 1.00×10-7mol/L 根据;K 1 = ]CO [H ]][HCO [H323-+= 4.45×10-7、[H +]和[HC O3-]浓度,求出 [H 2CO 3]= 4。
碱度计算方法

[H2CO3*] =CT α0 =2.2×10-5 mol/L -3 [ H CO ] C 3 T 1 ≈ 1.0×10 mol/L [CO32-] = CTα2 =4.57×10-6 mol/L
例2
某水体的pH=10.0
碱度=1.00 ×10-3 mol/L,求水中
H2CO3*、HCO3-、CO32-及OH-的浓度
4. 氧化-还原平衡
4.1 电子活度和氧化还原电位 (1)定义 酸碱反应:
pH = -lg(aH+)
aH+____ 氢离子在水溶液中的活度,它衡量溶液接受或迁移 质子的相对趋势; 还原剂和氧化剂可以定义为电子供体和电子接受体, 可定义pE为:pE = -lg(ae)
4. 氧化-还原平衡
pE 的严格热力学定义是由 Stumm 和 Morgan 提出的,基于
4. 氧化-还原平衡
(2) 氧化还原电位E与pE的关系
P56
4. 氧化-还原平衡
4.2天然水的pE-pH图
图3-7 天然水体的pE-pH图
4. 氧化-还原平衡
(1)水的氧化还原限度
• 边界条件: 氧化限度 1.0130×105Pa 氧分压 还原限度 1.0130×105Pa 氢分压
H 2 O H 2 CO 3 ( p K 0 1 . 46 )
3 3
H 2 CO HCO K1 K
HCO
23 3
3
H ( p K 1 6 . 35 )
2
CO
H (pK
10 . 33 )
[ HCO
][ H ]
[ H 2 CO 3 ]
2
2[CO 3 ][ H ] [ HCO 3 ] 3
酸碱溶液的酸度与碱度计算
酸碱溶液的酸度与碱度计算酸碱溶液的酸度与碱度是描述溶液中酸性或碱性程度的指标。
酸度和碱度的计算涉及到酸碱溶液的化学计量、酸碱滴定等相关知识。
本文将详细介绍酸碱溶液的酸度与碱度的计算方法及示例。
一、酸碱溶液的定义与性质在化学中,酸和碱是指具有特定性质的化学物质。
酸性溶液含有酸性物质,能够释放出H+离子;碱性溶液含有碱性物质,能够释放出OH-离子。
酸和碱的性质可通过酸碱滴定实验进行判定。
二、pH值与酸度计算pH值是描述溶液酸度或碱度的常用指标,其数值范围为0-14。
pH 值小于7表示酸性溶液,大于7表示碱性溶液,等于7表示中性溶液。
pH值的计算公式为:pH = -log[H+]其中[H+]表示溶液中的氢离子浓度。
例如,如果某溶液中[H+]为1×10^-3mol/L,那么该溶液的pH值可以通过以下计算得到:pH = -log(1×10^-3) = 3三、酸度计算实例现在,我们通过一个实例来计算酸度。
实例:某溶液中含有浓度为0.1mol/L的HCl溶液,请计算该溶液的酸度。
解:首先,我们知道HCl能够完全电离为H+和Cl-离子。
根据摩尔浓度的定义,该溶液中[H+]的浓度为0.1mol/L。
根据pH计算公式可得:pH = -log[H+]= -log(0.1)≈ 1因此,该溶液的酸度约为1。
四、碱度计算实例除了计算酸度,我们也可以通过类似的方法计算碱度。
下面是一个碱度计算的实例。
实例:某溶液中含有浓度为0.05mol/L的NaOH溶液,请计算该溶液的碱度。
解:NaOH溶液能够完全电离为Na+和OH-离子。
根据摩尔浓度的定义,该溶液中[OH-]的浓度为0.05mol/L。
根据pOH计算公式可得:pOH = -log[OH-]= -log(0.05)≈ 1.30由于pH + pOH = 14,因此该溶液的碱度为:碱度 = 14 - pH= 14 - 1.30≈ 12.70因此,该溶液的碱度约为12.70。
高中化学题型之酸度和碱度计算
高中化学题型之酸度和碱度计算在高中化学学习中,酸度和碱度计算是一个重要的题型。
正确理解和掌握这个题型的计算方法,不仅能够帮助学生提高解题能力,还能够加深对酸碱反应的理解。
本文将以具体的题目为例,详细分析和说明酸度和碱度计算的考点和解题技巧。
一、酸度计算1. 题目:已知100 mL的HCl溶液的浓度为0.5 mol/L,求其中HCl的质量。
解析:这个题目考察的是酸度计算中的溶液浓度和质量之间的关系。
根据浓度的定义,浓度等于溶质的物质量除以溶液的体积。
因此,我们可以用浓度和体积来计算溶液中溶质的质量。
解题步骤:1) 将体积转换为升,即100 mL = 0.1 L。
2) 根据浓度的定义,浓度等于溶质的物质量除以溶液的体积。
设HCl的质量为m,则0.5 mol/L = m/0.1 L。
3) 通过移项和计算可得,m = 0.05 mol。
答案:HCl的质量为0.05 mol。
2. 题目:已知某酸溶液的质量浓度为1.2 g/mL,求其中H2SO4的摩尔浓度。
解析:这个题目考察的是酸度计算中的溶液质量浓度和摩尔浓度之间的关系。
根据质量浓度的定义,质量浓度等于溶质的质量除以溶液的体积。
因此,我们可以用质量浓度和溶液的密度来计算溶液中溶质的摩尔浓度。
解题步骤:1) 根据质量浓度的定义,质量浓度等于溶质的质量除以溶液的体积。
设H2SO4的质量为m,溶液的体积为V,则1.2 g/mL = m/V。
2) 根据密度的定义,密度等于溶液的质量除以溶液的体积。
设溶液的质量为M,则1.2 g/mL = M/V。
3) 通过移项和计算可得,m = 1.2 M。
答案:H2SO4的摩尔浓度为1.2 M。
二、碱度计算1. 题目:已知某碱溶液的浓度为0.2 mol/L,求其中NaOH的质量。
解析:这个题目考察的是碱度计算中的溶液浓度和质量之间的关系。
与酸度计算类似,我们也可以用浓度和体积来计算溶液中溶质的质量。
解题步骤:1) 根据浓度的定义,浓度等于溶质的物质量除以溶液的体积。
excel碱度公式
excel碱度公式(原创版)目录1.引言:介绍 Excel 碱度公式2.碱度公式的定义和意义3.Excel 中碱度公式的实现方法4.碱度公式的应用实例5.结语:总结 Excel 碱度公式的重要性和实用性正文【引言】在化学实验室、工业生产以及环境监测等领域,碱度是一个非常重要的参数。
为了方便计算和分析,我们可以使用 Excel 来实现碱度公式的计算。
本文将介绍如何在 Excel 中使用碱度公式以及其应用实例。
【碱度公式的定义和意义】碱度是指水中能与强酸发生中和反应的物质的总量,通常用 mg/L 表示。
碱度是衡量水溶液中碱性物质含量的一个重要指标,对于水质分析和环境保护具有重要意义。
【Excel 中碱度公式的实现方法】在 Excel 中,我们可以通过以下步骤来实现碱度公式的计算:1.打开 Excel,新建一个工作表;2.在第一列(A 列)中输入需要计算碱度的水样编号;3.在第二列(B 列)中输入对应水样的 pH 值;4.在第三列(C 列)中输入对应水样的总硬度(以 CaCO3 计)mg/L;5.在第四列(D 列)中输入对应水样的温度(摄氏度);6.在第五列(E 列)中输入 25℃时的 Kw 值(1.000000×10^-14);7.在第六列(F 列)中输入对应水样的 pKw 值;8.在第七列(G 列)中输入对应水样的 pKsp 值;9.在第八列(H 列)中输入公式“=IF(F2>=G2,F2,G2)”以计算 pH 值对应的碱度;10.拖动 H 列右下角的填充柄,将其复制到其他行,即可得到所有水样的碱度值。
【碱度公式的应用实例】假设我们有三个水样,它们的 pH 值、总硬度和温度分别为:水样 1:pH=7.0,总硬度=50 mg/L,温度=25℃水样 2:pH=7.5,总硬度=100 mg/L,温度=25℃水样 3:pH=8.0,总硬度=200 mg/L,温度=25℃按照上述方法,在 Excel 中输入相应的数据并计算碱度,结果如下:水样 1:碱度=48.75 mg/L水样 2:碱度=98.50 mg/L水样 3:碱度=197.01 mg/L通过比较这三个水样的碱度值,我们可以发现,随着 pH 值的增加,水样的碱度也呈增加趋势。
碱度的测定(全套步骤)
一.天平的使用实验室电子天平:梅特勒-托利多AL204/011. 工作原理电磁力平衡的原理2. 基本操作使用环境:首先,放置天平的工作台应稳定牢固,远离震动源;周围没有高强电磁场;没有排放有毒有腐蚀性气体的污染源;尽可能远离门、窗、散热器以及空调装置的出风口。
其次,天平室温度和湿度应保持恒定,温度控制在20℃~28℃、湿度在40%RH-70%RH之间。
调整:开机前,首先检查天平是否处于水平状态,即天平水平仪中水平泡是否处于中心位置,如果天平未处于水平,则调节天平底脚两个水平旋钮加以校正。
如果在称重过程中不可避免的要移动天平,则每次移动后,都要重新调整水平。
开机预热:连接电源,让秤盘空载,按“On/Off”按钮。
天平开启并进行自检,自检通过显示0.0000g,进入预热。
为保证获得精确的称量结果,必须至少在校准前60 分钟开机,以达到工作温度。
但在一般情况下,天平开机后,让其保持在待机状态下,预热20 分钟,即可称量。
校准:在开机状态下,将天平称盘上的被称量物清除,按“->0/T<-”(清零/ 去皮)键,待显示器稳定显示。
接着按住“Cal”键不放,直到显示“Cal 200.0000g”字样,放入标值200g 的校准砝码在秤盘中心位置,天平自动进行校准,当“Cal 0.0000g”闪烁时,移去砝码,随后显示屏上短时间出现“CAL donE”信息,紧接着又出现“0.0000g”时,天平校准结束。
天平进入称量工作状态,等待称量。
称量:打开玻璃防风罩密封门,将待测物轻轻放在秤盘中心,关上密封门,待示值稳定后,记录下待测物的质量,再将被测物轻轻取出,关紧密封门;当称量过程中需要去皮,按去皮按钮(O/T),此时示值为“0.0000g”。
关机:称量完毕,确定天平秤盘上清洁无物后,按住“On/Off”按钮直至关机(屏幕上无显示)。
如还需要继续使用,可以不关闭天平。
3.注意事项应使用自带的电源适配器,并按说明书选择适当的电压(~220V 或110V)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
环境监测碱度的计算例题
以下是一个环境监测碱度的计算例题:
假设要测量一杯海水的碱度,海水的 pH 值为 8.0。
要求测量海水中的碳酸根离子 (CO3^2-) 和氢氧根离子 (OH-) 浓度,并通过计
算确定海水的碱度。
首先,测量海水中的碳酸根离子和氢氧根离子浓度可以使用以下公式:
CO3^2- = (Na2CO3×0.00159)÷ (pH+1)
OH- = (NaOH×0.00159)÷ (pH-1)
其中,Na2CO3 和 NaOH 是海水中碳酸根离子和氢氧根离子的基
准物质,其浓度可以使用实验室制备的标准溶液进行标定。
pH 值是
海水的酸碱度指标,其值范围为 0 到 14,pH 值越大,表示海水越酸。
在本题中,海水的 pH 值为 8.0,因此:
CO3^2- = (0.00159×0.01)÷ (8.0+1) = 0.000189mol/L
OH- = (0.00159×0.01)÷ (8.0-1) = 0.000189mol/L 接下来,我们需要计算海水的碱度。
碱度可以通过碳酸根离子和氢氧根离子的浓度计算得到:
碱度 = 0.000189mol/L×(Na2CO3/NaOH)×1000
在本题中,海水中的碳酸根离子和氢氧根离子浓度已经计算得出,因此可以直接代入公式计算出海水的碱度:
碱度 = 0.000189mol/L×(0.00159/0.005)×1000 =
0.0245mol/L
因此,海水的碱度为 0.0245mol/L。
