毕赤酵母产木聚糖酶实验方案
饲料中木聚糖酶活性测定_(1)

东莞泛亚太生物科技有限公司研发方案一、实验目的:测定颗粒饲料中木聚糖酶活性,考察饲料调质制粒过程中对木聚糖酶活性的影响。
二、试验方案⒈、饲料中木聚糖酶活性标准曲线的制作[1]根据饲料中添加木聚糖酶含量,配制梯度浓度木酶的标准酶液A;[2]空白饲料样品:从饲料厂取粉碎粒度均匀的适量未加酶制剂饲料样品,包括粉料和颗粒料,分别在调质前进料口(未接触蒸汽)、调质出口和制粒后的颗粒料取样,每个点取样本数不低于4个,且取样时间都控制在饲料混合均匀的中间阶段;[3]空白饲料样品加酶后处理:称取7 份空白饲料样品,先粉碎,(约3~4g,须预实验进一步确定保证其吸光度在0.300左右),然后加入木酶缓冲液振荡混合15min,然后依次加入6份不同体积的酶液A(其中一份饲料原料不加入酶液A),定容,摇匀,离心得到上清酶液;[4]空白饲料样品及加酶后样品的还原糖含量OD540值测定:参照APAC实验室木酶检测方法,测定[3]中上清液的OD吸光值;540[5]标准曲线的绘制:以OD540值为横坐标,以0.2ml上清液中所含木聚糖酶活力(U/g)为纵坐标Y,绘制OD 值-酶活梯度曲线。
空白:以0.20ml缓冲液替代0.2ml上清液,其它操作步骤同上。
⒉调质制粒饲料中木聚糖酶活性的测定[1]制备木聚糖酶单酶样品30000U/g,运用APAC实验室检测方法先测定木聚糖酶酶活;[2]在饲料中添加200g木聚糖酶样品,样品用玉米粉(40目)逐级稀释至20kg,再与其他原料混合(因此,要求预混料中没有酶制剂,这步骤要与兴业协商),并且饲料配方组成及原料要最大程度与上述1[2]的空白饲料样品一致;[3]分别在调质前进料口(未接触蒸汽)、调质出口和制粒后的颗粒料取样,每个点取样本数不低于4个,且取样时间都控制在饲料混合均匀的中间阶段;[4]称取3中的加酶饲料(添加木聚糖酶),先粉碎,加入木酶缓冲液定容、振荡15min、离心取上清。
随后参照标准曲线制作方法测其吸光值,并根据标准曲线计算得出其酶活;[5]根据不样品的酶活性结果计算调质、制粒过程中对酶活性的损失率。
常用试剂培养基 毕赤酵母实验技术

主要培养基:10×YNB(13.4%酵母氮源,含硫酸铵不含氨基酸):溶解13.4gYNB于100mL水中,过滤除菌,加热至YNB完全溶解,存于4℃。
500×B(0.02%生物素):溶解20mg生物素于100mL 水中,过滤除菌,放于4℃。
100×AA(0.5%各种氨基酸):溶解各50mg L-谷氨酸,L-蛋氨酸,L-赖氨酸,L-亮氨酸,L-异亮氨酸于100mL 水中,过滤除菌,存于4℃。
10×D(20%葡萄糖):溶解200g D-葡萄糖于1 000mL水中,高压灭菌15min或过滤除菌,可放1年。
500×生物素(0.02%):溶解20mg生物素于100mL水中,过滤除菌,放于4℃,可放1年。
100×H(0.4%组氨酸):溶解400mg L-组氨酸于100mL水中,低于50 度加热以促溶解,过滤除菌,可放1年。
10×M(5%甲醇):混合5mL甲醇与95mL水,过滤除菌存于4℃,可放2个月。
10×GY(10%甘油):混合100mL甘油与900mL 水,过滤或高压灭菌,室温放置,可存放1年以上。
100×AA(0.5%各种氨基酸):溶解各50mg L-谷氨酸,L-蛋氨酸,L-赖氨酸,L-亮氨酸,L-异亮氨酸于100mL 水中,过滤除菌,存于4℃,可放1年。
1mol/L磷酸钾缓冲液pH6.0:32mL 1mol/L K2HPO4,868mL 1mol/L KH2PO4,调整pH值为6.0±0.1(如果需调pH值,用磷酸或KOH)。
过滤或高压灭菌,室温下可放1年以上。
100mg/mL遗传霉素:用无菌水制备30mL 100mg/mL 遗传霉素贮存液,过滤除菌,存于-20℃。
用来制备含不同终浓度遗传霉素平板:0.25,0.5,0.75,1.0,1.5,1.75,2.0,3.0,4.0。
LB培养基:5%酵母提取物,10%胰蛋白陈,10%NaCI,pH7.0;高压灭菌后4℃保存。
木聚糖酶的酶活测定【范本模板】
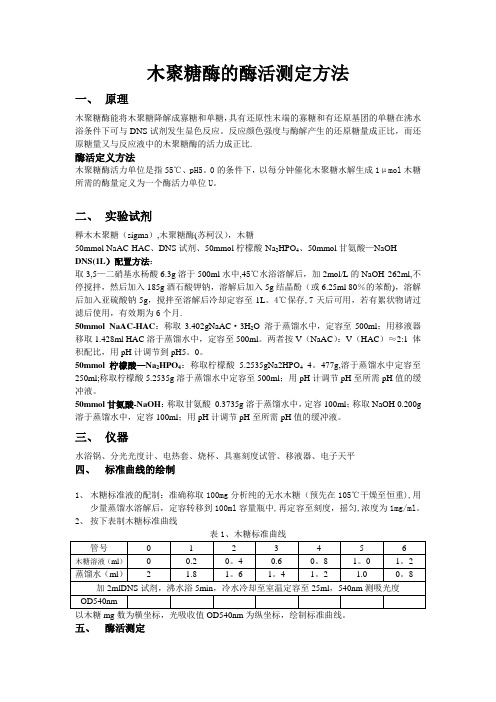
木聚糖酶的酶活测定方法一、原理木聚糖酶能将木聚糖降解成寡糖和单糖,具有还原性末端的寡糖和有还原基团的单糖在沸水浴条件下可与DNS试剂发生显色反应。
反应颜色强度与酶解产生的还原糖量成正比,而还原糖量又与反应液中的木聚糖酶的活力成正比.酶活定义方法木聚糖酶活力单位是指55℃、pH5。
0的条件下,以每分钟催化木聚糖水解生成1μmol木糖所需的酶量定义为一个酶活力单位U。
二、实验试剂榉木木聚糖(sigma),木聚糖酶(苏柯汉),木糖50mmol NaAC-HAC、DNS试剂、50mmol柠檬酸-Na2HPO4、50mmol甘氨酸—NaOHDNS(1L)配置方法:取3,5—二硝基水杨酸6.3g溶于500ml水中,45℃水浴溶解后,加2mol/L的NaOH 262ml,不停搅拌,然后加入185g酒石酸钾钠,溶解后加入5g结晶酚(或6.25ml 80%的苯酚),溶解后加入亚硫酸钠5g,搅拌至溶解后冷却定容至1L。
4℃保存,7天后可用,若有絮状物请过滤后使用,有效期为6个月.50mmol NaAC-HAC:称取3.402gNaAC·3H2O 溶于蒸馏水中,定容至500ml;用移液器移取1.428ml HAC溶于蒸馏水中,定容至500ml。
两者按V(NaAC):V(HAC)≈2:1 体积配比,用pH计调节到pH5。
0。
50mmol柠檬酸—Na2HPO4:称取柠檬酸5.2535gNa2HPO44。
477g,溶于蒸馏水中定容至250ml;称取柠檬酸5.2535g溶于蒸馏水中定容至500ml;用pH计调节pH至所需pH值的缓冲液。
50mmol甘氨酸-NaOH:称取甘氨酸0.3735g溶于蒸馏水中,定容100ml;称取NaOH 0.200g 溶于蒸馏水中,定容100ml;用pH计调节pH至所需pH值的缓冲液。
三、仪器水浴锅、分光光度计、电热套、烧杯、具塞刻度试管、移液器、电子天平四、标准曲线的绘制1、木糖标准液的配制:准确称取100mg分析纯的无水木糖(预先在105℃干燥至恒重),用少量蒸馏水溶解后,定容转移到100ml容量瓶中,再定容至刻度,摇匀,浓度为1mg/ml。
重组毕赤酵母产木聚糖酶条件的优化

重组毕赤酵母产木聚糖酶条件的优化刘明启;孙建义;翁晓燕;高慧【期刊名称】《浙江大学学报(农业与生命科学版)》【年(卷),期】2006(032)002【摘要】对基因工程菌Pichia pastoris GS115-ATx在摇瓶发酵水平产木聚糖酶条件进行了优化.结果表明,该基因工程菌产木聚糖酶的最佳碳源为麸皮,最佳氮源为牛肉膏,有机氮源促进产酶的效果优于无机氮源.GS115-ATx产木聚糖的最佳甲醇诱导浓度为0.5%,在甲醇诱导的同时补加0.5%甘油能显著提高木聚糖酶的活性.研究发现,吐温20、吐温80、甜菜碱等表面活性剂均具有促进基因工程菌GS115-ATx产木聚糖酶的作用,其中甜菜碱的作用效果较佳.经SDS-PAGE电泳分析,GS115-ATx产生木聚糖酶的分子量约为19.0 kDa.发酵液上清中的木聚糖酶活性在甲醇诱导培养96 h后达到最大值.【总页数】5页(P222-226)【作者】刘明启;孙建义;翁晓燕;高慧【作者单位】浙江大学饲料科学研究所,浙江,杭州,310029;浙江大学饲料科学研究所,浙江,杭州,310029;浙江大学,生命科学学院,浙江,杭州,310029;浙江大学饲料科学研究所,浙江,杭州,310029【正文语种】中文【中图分类】Q936【相关文献】1.重组毕赤酵母摇瓶发酵产木聚糖酶条件优化 [J], 周晨妍;张金华;王煜蘅;赵文玺;丰慧根2.毕赤酵母摇瓶产木聚糖酶发酵条件的优化 [J], 孙爱萍;谌晓华;贾伟;万红贵3.毕赤酵母产木聚糖酶发酵条件优化及其酶学特性研究 [J], 徐志旭;袁丽娟;卢洪栋;潘春梅4.重组毕赤酵母产木聚糖酶的发酵条件优化研究 [J], 袁冬华;蔡国林;任晓静;王霈虹;陆健5.响应面分析优化产木聚糖酶毕赤酵母基因工程菌培养条件 [J], 郭宁;赵伟;郑甲;田健;吴丽双;周洪波因版权原因,仅展示原文概要,查看原文内容请购买。
毕赤酵母液态木聚糖酶的酶学特性研究

毕赤酵母液态木聚糖酶的酶学特性研究陈海华;吴振【期刊名称】《食品与发酵工业》【年(卷),期】2009(035)011【摘要】研究了毕赤酵母液态木聚糖酶的部分酶学特性,包括其最适温度、最适pH、温度稳定性和热失活动力学、pH稳定性和pH失活动力学,以及金属离子、有机溶剂对毕赤酵母液态木聚糖酶酶活特性的影响.结果表明,毕赤酵母液态木聚糖酶的最适温度为55℃、最适pH为pH5.6;温度为25℃时,pH5.6-6.4该液态木聚糖酶失活速率缓慢.毕赤酵母液态木聚糖酶在50℃以下在150 min内比较稳定的,70℃在30 min内几乎全部失活.Cu~(2+),Zn~(2+),Fe~(3+)表现为不同程度的抑制作用.Mn~(2+),Mg~(2+)对木聚糖有激活作用.乙醇和甘油对毕赤酵母液态木聚糖酶有轻微的抑制作用,蔗糖和Vc对毕赤酵母液态木聚糖酶有不同程度的激活作用.【总页数】5页(P5-8,13)【作者】陈海华;吴振【作者单位】青岛农业大学食品科学与工程学院,山东青岛,266109;青岛农业大学食品科学与工程学院,山东青岛,266109【正文语种】中文【中图分类】TS2【相关文献】1.碱性木聚糖酶在毕赤酵母的表达及酶学性质研究 [J], 熊科;杨玉焕;闫子祥;王晓玲;李秀婷2.突变木聚糖酶基因xynIIC~*在毕赤酵母中的表达及酶学性质研究 [J], 周晨妍;王武;邬敏辰3.来源于盐惰菌属Halopiger xanaduensis的木聚糖酶基因在毕赤酵母中诱导表达及其酶学性质的研究 [J], 于成野;韩红娟;付晓燕;游双红;孙淼;朱恒文;彭日荷;姚泉洪4.嗜热绿色糖单孢菌木聚糖酶XyN10A基因在毕赤酵母中的分泌表达及其酶学性质研究 [J], 玉王宁;金一;谢响明;刘伟娜;郑菲;厚凌宇;王晓宇;梁迪;王伟轩;张朔;柳静言5.毕赤酵母产木聚糖酶发酵条件优化及其酶学特性研究 [J], 徐志旭;袁丽娟;卢洪栋;潘春梅因版权原因,仅展示原文概要,查看原文内容请购买。
毕赤酵母表达(pichia pastoris expression )实验手册(3)

毕赤酵母表达(pichia pastoris expression )实验手册(3)液体YPD培养基可常温保存;琼脂YPD平板在4℃可保存几个月。
加入Ze ocin 100ug / ml,成为YPDZ培养基,可以4℃条件下保存1~2周。
2.4 YPDS + Zeocin 培养基(Yeast Extract Peptone Dextrose Medi um):yeast extract 1%peptone 2%dextrose (glucose) 2%sorbitol 1 M+agar 2%+ Zeocin 100 μg/ml不管是液体 YPDS培养基,还是YPDS + Zeocin 培养基,都必须存放4℃条件下,有效期1~2周。
2.5 MGYMinimal Glycerol Medium (最小甘油培养基)(34%YNB;1%甘油;4*10-5%生物素)。
将800ml灭菌水、100ml的 10* YNB母液、2ml的500*B母液和100ml的10*GY母液混匀即可,4℃保存,保存期为2个月。
2.6 MGYHMinimal Glycerol Medium + Histidine (最小甘油培养基 + 0.004%组氨酸)在1000ml的MGY培养基中加入 10ml的100*H母液混匀,4℃保存,保存期为2个月。
2.7 RDRegeneration Dextrose Medium (葡萄糖再生培养基)(含有:1mol/L的山梨醇;2%葡萄糖;1.34%YNB;4*10-5%生物素;0. 005%氨基酸)1. 将186g的山梨醇定容至700ml,高压灭菌;2. 冷却后于45℃水浴;3. 将100ml的10*D、100ml的10*YNB;2ml的500*B;10ml的100*AA等母液和88ml无菌水混匀,预热至45℃后,与步骤2 的山梨醇溶液混合。
4℃保存。
2.8 RDHRegeneration Dextrose Medium + Histidine (葡萄糖再生培养基 + 0.004%组氨酸)在RD培养基配制的第三步中,在加入10ml的100*H母液,同时无菌水的体积减少至78ml即可,其余配制方法与RD相同。
一株产木聚糖酶菌株的筛选鉴定及产酶条件优化

一株产木聚糖酶菌株的筛选鉴定及产酶条件优化一、研究背景木聚糖是一种多糖,由若干分子的葡萄糖组成,由于其结构独特,具有非常广泛的应用价值,在医药、食品、农业、纺织、造纸等领域具有重要的应用。
产酶微生物的筛选是开发新型酶和研究其基础特性的基础,随着对木聚糖研究的不断深入,对此类微生物的筛选及鉴定也得到了越来越多的关注。
二、菌株的筛选及鉴定1. 样品的采集与处理从已知产酶菌株中,挑选生长活跃、菌体正常、并且具有产酶潜能的菌株,获得采样来源。
将来源样品经过细碎、混匀、离心等适当的处理,以瓶内置于适量的酶活性液体培养基中,进行厌氧或者静置培养等预处理操作。
2. 菌株的筛选在完成预处理后,采取厌氧或静置培养后,从培养基中取出适量样品,经过稀释、扩展等操作后,涂布到含有不同基质的固体培养基上,进行黑暗孵化培养。
待营养环境适合微生物生长时,对类群结构进行分析、筛选、架构菌落。
3. 鉴定菌株类型对筛选出的单一菌株,根据菌落形态、颜色、形状、液体蔓延情况等特征进行分类定性鉴定,以保证所筛选菌株的准确性。
经形态学鉴定后,可进行生理生化特性分析及16S rDNA序列分析,以确定该菌株的科属分类、鉴定其遗传信息和菌株在演化中的位置。
三、产酶条件的优化1. 酶活力的培养选取合适的液体培养基,调节洗涤液的pH、温度、培养时间、载体浓度等因素,尽可能地提高木聚糖酶的产量。
采用化学裂解、超声波乳化、微生物发酵等方法,对菌体进行破壁处理,提取出木聚糖酶。
3. 酶活性的检测用3,5-二硝基水杨酸(DNS)法进行木聚糖酶的酶活性检测。
先将待测酶与木聚糖底物共同孵育,然后加入碱液,使底物降解生成的还原糖与碘离子反应生成红棕色化合物,其吸光度在515nm左右。
四、总结通过以上实验,成功筛选出一株产木聚糖酶菌株,同时通过对其生长条件的优化,成功提高了其产酶量,为后续研究木聚糖的基础与应用提供了有力保障。
新型毕赤酵母分泌表达载体的构建与功能验证

新型毕赤酵母分泌表达载体的构建与功能验证收稿日期:2009-03-11基金项目:黑龙江省生物菌种资源共享平台建设(KT05A400-1)作者简介:宋庆凤(1983-),女,黑龙江人,硕士研究生,研究方向为生物化学与分子生物学。
*通讯作者:李杰,副教授,硕士生导师,研究方向为植物分子遗传学与基因工程。
E-mail:lijie_neau@宋庆凤,暴立娟,李杰*(东北农业大学生命科学学院,哈尔滨150030)摘要:巴斯德毕赤酵母(Pichia pastoris )是目前应用最广泛的外源蛋白表达系统之一。
用于毕赤酵母表达系统的表达载体种类繁多,却因需要甲醇诱导表达或者基因转化过程中引入抗生素基因而限制了其在食品行业中的应用。
研究设计以毕赤酵母组成型启动子-GAP 启动子替换毕赤酵母表达载体pPIC9上的甲醇诱导型启动子AOX ,成功构建了毕赤酵母组成型表达载体pGAPH α。
并以里氏木霉木聚糖酶基因xyn 2为报告基因进行功能验证,结果表明,该载体可实现xyn 2基因在毕赤酵母中的高效表达。
在此基础上以经密码子优化后的克鲁维酵母菊粉酶基因信号肽INU 替换载体上原有的α-Factor 信号肽,结果表明,INU 信号肽能够有效引导XYNII 的分泌。
关键词:毕赤酵母;表达载体;GAP 启动子;INU 信号肽中图分类号:文献标识码:A文章编号:1005-9369(2009)07-0055-05Construction and probation of neotype secreting expression vectors for Pichia pastoris /SONG Qingfeng,BAO Lijuan,LI Jie (College of Life Sciences,Northeast Agricul-tural Unive rsity,Harbin 150030,China )Abstract:Pichia pastor is is one of the foreign protein expression system which has been widelyused.The expression vectors for Pichia pastoris are varied,but they can not be used in food vocation,because of the need of methanol in expression and the leading-in of antibiotic gene by transformation.This research designed to replace the methanol induced AOX promoter by Pichia pastoris 's constitutional promoter,GAP promoter,and successfully constructed the secreting expression vector pGAPH αfor Pichiapastoris .The gene encoding endo-β-1,4-xylanase from Trichoderma Reesei,and xyn 2gene were used as a reporter gene,and then the function probation indicated that the xyn 2gene could be overexpressed inPichia pastoris .Based on this neotype secreting expression vector pGAPH αⅡ,we replaced the α-Factor by inulase gene's signal peptide sequence which had been optimized in codon,the results showed that the showed gene's signal peptide could also utility guide the secreting expression of xyn 2gene.Key words:Pichia pastoris ;expression vector;GAP promoter;INU signal peptide 随着蛋白异源表达的飞速发展,越来越多的表达系统被建立并得到应用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
重组毕赤酵母产木聚糖酶摇瓶培养实验
毕赤酵母简介
甲醇营养型毕赤酵母(Pichia pastoris) 表达系统是80年代初被开发和研制的一种新型酵母表达系统。
40年前,Ogata等人首次发现有些酵母能够利用甲醇作为唯一的碳源和能源进行生长。
随后,甲醇营养酵母作为潜在的单细胞蛋白(single cell protein, SCP) 来源立即引起广泛关注,最初将其作为高蛋白的动物饲料在市场上销售。
在20世纪70年代,Phillips Petroleum公司开发出毕赤酵母利用甲醇生长的培养基、发酵操作手册和高密度连续培养生产工艺。
70年代的石油危机导致了甲烷价格的急剧上升,与此同时,动物饲料蛋白的主要替代源——大豆价格的下降,导致利用甲醇生产SCP在经济上已不再合适。
在以后的10年中,PhiLLips PetroLeum公司与SIBIA公司合作开发利用毕赤酵母作为生物体表达外源蛋白的研究,研究人员分离了醇氧化酶(alcohol oxidase, AOX) 的基因和启动子,构建了表达载体和菌株,开发了毕赤酵母基因操作相关技术。
成熟的SCP发酵方法的开发,加上醇氧化酶强启动子的可调控表达特性,极大地影响着外源蛋白在毕赤酵母中的高水平表达。
1993年,Phillips Petroleum公司委托Invitrogen公司代理毕赤酵母表达系统产品。
毕赤酵母能在以甲醇为唯一碳源的培养基中快速生长,其中醇氧化酶AOX ——甲醇代谢途径的关键酶可达细胞可溶性蛋白的30%。
而在葡萄糖、甘油或乙醇作为碳源的培养细胞中则检测不到AOX。
AOX的合成是在转录水平调控的。
其基因启动子具有明显的调控功能,可用于调控外源基因的表达。
此调控作用是由一般碳源抑制/解抑制及碳源特殊诱导机制控制的。
外源基因在甲醇以外的碳源中处于非表达状态,而在培养液中加入甲醇后,外源基因即被诱导表达。
巴斯德毕赤酵母中存在着一种称为微体的细胞器,其中大量合成过氧化物酶,因此也称为过氧化物酶体。
CH 3Targeted Protein
CO 2
甲醇代谢途径
与大肠杆菌等原核表达系统相比,毕赤酵母作为一种低等真核生物,除了具有遗传操作简单、细胞生长快、易于培养等原核生物的特点外,又具有真核生物完整的蛋白表达、正确加工和修饰功能,能有效克服大肠杆菌系统表达蛋白过程中存在的不足;而与高等哺乳动物细胞相比,又具有产量高、培养成本低、产物的分离纯化简单等优点。
因此,毕赤酵母表达系统因其具有表达效率高、外源基因遗传稳定、易实现高密度培养、产物可分泌和蛋白翻译后加工等众多其它表达载体所无法比拟的优点,已成为近年来极受青睐的外源蛋白表达宿主,受到越来越多的重视和利用。
截止2005年,已有500多种外源蛋白通过毕赤酵母表达系统得到克隆表达,这些外源蛋白产品涉及食品、饲料、纺织和医药品等关系国计民生的多个行业。
然而,要实现众多新的外源蛋白产品在工业发酵罐水平下大规模商业化生产,除了构建高效、稳定的毕赤酵母生产菌株外,利用过程控制的方法和手段,最大限度地提高生物反应器中基因工程菌的总生物量,发挥菌种的最大生产潜力,提高单位体积培养液中目标蛋白的表达水平是实现大规模、商业化重组蛋白生产、提高生产效率的一个关键因素。
毕赤酵母生产表达外源蛋白的发酵过程
一般而言,毕赤酵母高密度流加培养生产表达外源蛋白过程由甘油分批培养、甘油流加培养和甲醇诱导表达三个不同阶段构成。
甘油分批培养的目的是为了积累一定的生物量,同时抑制AOX启动子及外源蛋白表达;甘油流加培养是通过限制性的甘油流加,进一步增加生物量,尽可能地获得高细胞浓度,同时解除过量甘油对AOX启动子的抑制作用,为细胞进入诱导期作准备;甲醇诱导表达阶段是通过添加诱导剂甲醇,实现AOX高水平转录和外源蛋白的高效表达。
木聚糖酶简介
木聚糖是植物细胞壁的主要成分之一,属于非淀粉多糖。
作为半纤维素的一种,在自然界中是含量仅次于纤维素的可更新多糖,存在于各种陆生植物的几乎所有部位.它从仅由β-1,4糖苷键连接的多聚糖线形分子到以α-糖甘键形成取代基支链的高度分枝的异质多糖,结构变化的范围很大。
通常,木聚糖以异质多糖形式存在并与纤维素结合在一起。
木聚糖酶是木聚糖的专一降解酶。
属于水解酶类,包括内切木聚糖酶、外切木聚糖酶和木糖苷酶三种。
内切木聚糖酶能随机切
断木聚糖主链上的木聚糖苷键,生成分子量不同的木寡糖;外切木聚糖酶则从木聚糖非还原性末端切下单个的D-木糖;而木糖苷酶则水解木寡糖生成D-木糖,且仅能水解木二糖。
三者酶解作用产生的D-木糖可以被动物吸收和利用。
近年来对木聚糖酶的研究发现,它应用于饲料中提高了饲料营养价值,突破了饲料资源开发利用的局限,增强了动物的生产与抗病能力,减少了动物排泄物造成的污染,作为一种环保添加剂,在发展环保型畜牧业中具有十分重要的意义与价值。
毕赤酵母产木聚糖酶摇瓶实验方案
培养基组成:
种子培养基(g/L):葡萄糖20,酵母粉10,蛋白胨20。
甘油生长培养基(g/L):甘油20 mL/L,MgSO4 1,K2SO4 1,(NH4)2SO4 5,CaSO4 0.1,H3PO4 2% (v/v),PTM1 10 mL/L,KOH 20,pH 6.0。
甲醇诱导培养基(g/L):甲醇10 mL/L,MgSO4 1,K2SO4 1,(NH4)2SO4 5,CaSO4 0.1,H3PO4 2% (v/v),PTM1 10 mL/L,KOH 20,pH 6.0。
PTM1组成(g/L):CuSO4·5H2O 6g,NaI 0.08g,MnSO4·H2O 3g,Na2MoO4 0.2g,H3BO3 0.02g,CoCL2 0.5g,ZnCL2 20g,FeSO4·7H2O 65g,H2SO4 5mL,生物素0.2g 培养基配置过程注意事项:
1.KOH 等其它试剂溶解后最后加人;
2.PTM1、调pH用氨水和甲醇在灭菌后、接种前添加。
具体实验操作步骤如图1:
250mL 摇瓶种子培养(30 °C ,220rpm ,24h )
每瓶种子培养基体积25mL
250mL 摇瓶甲醇诱导培养(30 °C ,220rpm )
每瓶甲醇诱导培养基体积25mL
离心(2000rpm ×2min )收集菌体,将菌体转入
等体积诱导培养基中进行诱导培养
8000rpm ×5min )后
72h (3d )
图1 毕赤酵母产木聚糖酶摇瓶实验操作流程图
检测方法:
细胞浓度的测定
采用比浊法,使用紫外分光光度仪进行测定。
将从摇瓶中所采集的样品经适当稀释,测定其在600nm 下的吸光度OD 600。
总蛋白浓度测定(考马斯亮蓝比色法):
原理:考马斯亮蓝G-250是一种染料,在游离状态下呈红色,当它与蛋白质结合后变为青色。
蛋白质含量在0~1000mg 范围内,蛋白质-色素结合物在595nm 下的吸光度与蛋白质含量成正比,故可用比色法测定A 595。
试剂配制
(1) 标准蛋白质溶液 称取100mg 牛血清白蛋白,溶于蒸馏水并定容至100mL ,制成1g/L 的原液。
(2) 考马斯亮蓝G-250蛋白试剂 称取100mg 考马斯亮蓝G-250,溶于50mL 90%乙醇中,加入 85%(m/v)的磷酸 100mL ,最后用蒸馏水定容到1000mL 。
此溶液在常温下可放置一个月。
操作步骤
标准曲线的制作
取6支带塞试管,编号后,按下表所示加入相应试剂:
盖上塞子,摇匀。
放置2min后在595 nm波长下比色测定(比色应在1h内完成)。
以牛血清白蛋白含量(g)为横坐标,以吸光度为纵坐标,绘出标准曲线。
发酵上清液样品蛋白浓度测定
吸取经适当稀释的待测发酵上清液样品1.0mL于比色管中,加入5.0mL考马斯亮蓝G-250试剂,摇匀,放置5min后,在595nm波长下比色,记录A595。
