乙烷乙烯乙炔的化学式
乙炔_乙炔
化学 性质
二、乙炔的性质
物理性质
乙炔为无色、无味的气体, 密度比空气略小,微溶于水,易 溶于有机溶剂。
化学性质
(A)氧化反应:
(1)被氧气氧化:
甲烷、乙烯、乙炔的燃烧
淡蓝色火焰
火焰明亮 带有黑烟
火焰很明亮带 有浓烈黑烟
实验现象:火焰很明亮,带有浓烈黑烟 完全燃烧方程式:
2C2H2+5O2 点燃 4CO2+2H2O
观察分析上面的热化学方程式,并思考生产中 为什么常用氧炔焰来切割或焊接金属,而不用 氧烷焰或氧烯焰呢?
乙炔完全燃烧所需氧的物质的量最少,生成水的 物质的量也最少,因此燃烧时用以提高氧温度以 及水气化所消耗的反应热也最少,所以乙炔火焰 温度最高。
(2)被酸性KMnO4溶液氧化。
2KMnO4 + 3H2SO4 + C2H2 → 2MnSO4 + K2SO4 + 2CO2 + 4H2O
b.与H2加成
催化剂
CHCH + H2
CH2=CH2 + H2
催化剂
CH2=CH2
CH3CH3
c.与HCl加成
CHCH + HCl nCH2 = CHCl
催化剂
CH2= CHCl
氯乙烯
催化剂
加温、加压
CH2CH
n
Cl
聚氯乙烯
聚乙烯:用聚乙烯薄膜做成塑料袋是无毒的,可
以用来盛装食物,只是强度差些,且不能经受80℃ 以上的高温,并有一定的透气性,不宜长期用来盛 装茶叶、香料等。
四、乙炔的用途
1、乙炔燃烧时产生的氧炔焰可用来切割或 焊接金属。 2、 乙炔是一种重要的基本有机原料,可 以用来制备氯乙烯、 聚氯乙烯和乙醛等。
乙炔基本化学知识点总结

乙炔基本化学知识点总结乙炔基本化学知识点总结乙炔是一种有机化合物,化学式为C2H2,它的结构式为H-C≡C-H。
乙炔是最简单的炔烃,也是一种重要的工业原料和有机合成中的重要中间体。
本文将对乙炔的基本化学知识进行总结,包括乙炔的制备、性质及反应等方面。
一、制备乙炔乙炔的制备方法有多种,其中较为常见的有以下几种:1. 石灰石法:将石灰石(CaCO3)与焦炭(C)加热至高温,然后通过输送氮气或空气进行高温分解反应,生成氧化钙(CaO)和一氧化碳(CO)。
接着,将二氧化钙(CaO)与焦炭(C)加热至1400℃左右,反应生成乙炔。
CaCO3 + C → CaO + COCaO + C → CaC2 + CO2. 乙炔仪法:利用乙炔仪将水合乙酸或乙腈等物质电解制备出乙炔。
CH3COOH + H2O → C2H2 + CO22CH3CN + 2H2O → C2H2 + 2NH33. 液体乙炔法:通过各类液体烃类(如乙烯)的脱氢反应,得到乙炔。
二、乙炔的性质乙炔是无色、无臭的气体,与空气具有较大的爆炸范围。
乙炔可以溶解于水、酒精、丙酮、苯等有机溶剂中,不溶于丙酮和水。
乙炔具有较强的不稳定性,在高温、高压、阳光等条件下容易发生爆炸。
乙炔的燃烧产生高温和暴露的炽热火焰,可用于切割金属。
三、乙炔的反应乙炔具有丰富的化学反应性,主要反应有:1. 加成反应:在适当的条件下,乙炔可以和H2、Cl2、Br2、HCl、HBr等发生加成反应。
例如,乙炔与H2发生加成反应生成乙烯:C2H2 + H2 → C2H42. 氢化反应:乙炔可以通过催化加氢反应得到乙烯。
常用的催化剂有铂、钯等贵金属。
C2H2 + H2 → C2H43. 氧化反应:乙炔可以与氧气发生燃烧反应,生成二氧化碳和水。
当乙炔含有不完全燃烧产物时,也可能生成一氧化碳等有毒气体。
2C2H2 + 5O2 → 4CO2 + 2H2O4. 卤素化反应:乙炔与卤素(Cl2、Br2)反应可以生成卤代烃。
乙炔知识点复习

CCHHH CCC F 3120o180O煤化工和乙炔一、乙炔的组成和结构:分子式:C 2H 2 电子式:结构式:H —C ≡C —H 结构简式:CH ≡CH 乙炔:直线型,键角180°[例题] CH 3—CH==CH —C ≡C —CF 3分子结构的下列叙述中,正确的是( B C ) A 、6个碳原子有可能都在一条直线上B 、6个碳原子不可能都在一条直线上C 、6个碳原子都在同一平面上D 、6个碳原子不可能都在同一平面上解析:该物质空间结构可表示为:注:该物质并不是所有原子均共面,如—CH 3中的3个氢原子,—CF 3中的3个氟原子均类CH 4中氢原子,是空间的。
甲烷、乙烯、乙炔结构的比较结构简式 CH 3—CH 3CH 2==CH 2 HC ≡CH 键角 109°28′(约) 120° 180° 碳碳键长(m ) 1.54×10--10 1.33×10--10 1.20×10--10碳碳键能(KJ/mol )384615812乙炔的键能812<3×384,也比C —C 单键和C==C 双键键能之和小,所以说明乙炔的C ≡C 中有两个键易断裂。
三键中一个为C —C δ键,两个为π键。
二、乙炔的实验室制法:1、原料:电石(CaC 2中常含CaS 、Ca 3P 2)、饱和食盐水电石来源:CaCO 3一一→CaO + CO 2↑ CaO + 3C 一一→CaC 2 + CO ↑(电炉中进行)2、反应原理:CaC 2 + 2H 2O Ca(OH)2 + C 2H 2↑ 离子型碳化物,与水的反应相当于水解 [解释]乙炔为无色、无味气体,常因含有H 2S 、PH 3等杂质而有特殊难闻的臭味。
副反应: Ca 3P 2 + 6H 2O 3Ca(OH)2 + 2PH 3↑ CaS +2H 2O Ca(OH)2 + H 2S ↑H 2S 、PH 3气体具有还原性,会影响C 2H 2的检验,应注意除杂(用CuSO 4除H 2S ,PH 3,CuSO 4可氧化PH 3。
浩海学校高二化学乙炔炔烃

涝酒州涉消市浩海学校高二化学 乙炔、炔烃人教版【同步教育信息】 一. 本周教学内容乙炔、炔烃 二. 重点、难点1. 掌握的乙炔的实验制法。
2. 了解氧炔焰作用。
3. 了解乙炔的结构特征。
4. 掌握乙炔的化学性质。
5. 了解炔烃的结构特征、通式和主要的用途。
6. 了解用乙炔制取聚氯乙烯的反应原理。
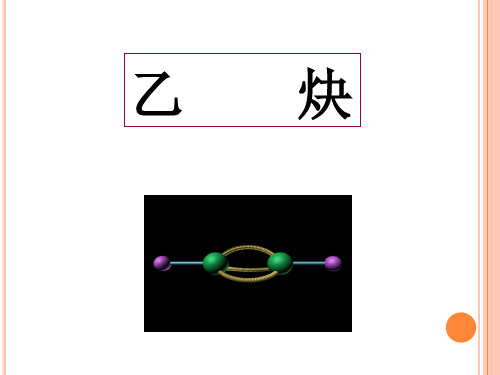
三. 具体内容(一)乙炔的分子组成和结构分子式:C 2H 2 电子式:H C C H::结构式:H —C ≡C —H 结构简式:HC ≡CH 乙炔的空间结构是直线型 乙炔、乙烯、乙烷键参数比较 乙烷 乙烯 乙炔C —C C=C C ≡C键长(m 1010-)1.54 1.33 1.20键角 109°28′ 120° 180° 键能(kJ/mol ) 348 615 812结构决定性质,碳碳叁键决定了乙炔类似于乙烯又不同于乙烯的性质。
(二)乙炔的实验室制法 1. 原料:碳化钙 水 2. 原理:+2H-OH→Ca(OH )2+C 2H 2↑3. 装置:制取乙炔气体装置 (1)反应速率太快,难以控制;(2)反应放热,若使用启普发生器,会使热量来不及散失而使启普发生器炸裂; (3)生成糊状的物质,若使用启普发生器,使反应不能随时停止,随时发生。
4. 收集:排水法 5. 备注:(1)用分液漏斗代替简易装置中的长颈漏斗控制流量。
(2)饱和食盐水代替水减缓反应速率。
(3)因电石中含有 CaS 、Ca 3P 2等,也会与水反应,产生H 2S 、PH 3等气体,所以所制乙炔气体会有难闻的臭味。
(三)乙炔的性质: 1. 物理性质:乙炔是无色无味的气体,但由于制取原料中有杂质,导致乙炔气体里混有硫化氢等 杂质气体,所以我们闻到了特殊的臭味。
2. 化学性质: (1)氧化反应① 可以燃烧2C 2H 2+5O 2→4CO 2+2H 2O ② 使高锰酸钾溶液褪色 (2)加成反应:CH≡CH+Br 2→CHBr=CHBrCHBr=CHBr+Br 2→CHBr 2—CHBr 2(使溴水褪色) CH≡CH+2H 2→CH 3CH 3(用于制乙烷) CH≡CH+HCl →CH 2=CHCl (制氯乙烯) CH≡CH+H 2O →CH 3CHO (制乙醛) (四)炔烃1. 定义:链烃分子里含有碳碳叁键的不饱和烃叫做炔烃2. 通式:炔烃的官能团是碳碳叁键(C≡C),炔烃的通式为22-n n H C (n≥2)。
乙炔

乙炔的分子组成和结构
分子式: C2H2 电子式: H∶C C∶H
结构式:H—C C—H
结构简式:HC CH
实验式: CH
乙炔属于 不饱和 “不饱和烃”)
(填“饱和烃”或
根据乙炔的结构你猜测乙炔会 有什么性质呢?将你的猜测及 实验设计方案写在学习卡上。
乙炔性质自主学习卡
◆ 物理性质:__色、__味的__体,密度比 空气___,溶解性____。
A、用溴水 B、用酸性KMnO4溶液 C、点燃 D、与H2加成
2、由乙炔为原料制取CHClBr—CH2Br , 下列方法中最可行是( )
A、先与HBr加成再与HCl加成
B、先与HCl加成再与Br2加成 C、先与Br2加成再与Cl2加成 D、先与Cl2加成再与HBr加成
聚氯乙烯薄膜
返回
催化剂
nCHCH 加温、加压
CH=CH n
乙炔在一定条件下还能与H2、 HCl等加成,请写出乙炔与氢 气加成反应的化方程式。
注意:加成比例为 1∶2 , 1mol的 乙炔最多可与2mol其它分子加成
你知道乙炔有什么用 途吗?
白色警告
我国市场上目前大量使用的塑料制品都是 不可降解塑料,以发泡聚氯乙烯、聚乙烯或聚 丙烯为原料,分子量达2万以上。只有分子量降 低到2000以下,才能被自然环境中的微生物所 利用,变成水和其它有机质,而这一过程需要 200年;如果将其填埋,将会影响农作物吸收养 分和水分,导致减产;对其焚烧会释放出多种 化学有毒气体,其中有一种叫二恶英的化合物, 毒性极大,即使在摄入很小量的情况下,也能 使鸟类和鱼类出现畸形和死亡,对生态环境造 成破坏,同时对人体有着很大危害。
◆ 化学性质:
化学 实验 实验
结论
高中乙炔知识点总结

高中乙炔知识点总结一、乙炔的基本介绍乙炔是一种无色、易燃气体,化学式为C2H2,属于炔烃类化合物。
乙炔是一种重要的工业原料,在化工、金属加工、冶金、焊接和照明等领域有广泛的应用。
二、乙炔的物理性质1. 密度:乙炔的密度为0.91g/cm3,略轻于空气,能够漂浮在空气中。
2. 沸点和凝固点:乙炔具有较低的沸点和凝固点,沸点为-84°C,凝固点为-81°C。
3. 溶解度:乙炔几乎不溶于水,但可以溶于一些有机溶剂,如乙醚、乙醇等。
4. 燃烧性:乙炔具有很高的燃烧性,与空气中的氧气混合后能够产生高温的火焰,因此常被用作焊接和切割金属。
三、乙炔的化学性质1. 燃烧反应:乙炔与氧气反应生成二氧化碳和水,放出大量的热能。
化学方程式为:C2H2 + 2.5O2 → 2CO2 + H2O2. 加成反应:乙炔与氢气发生加成反应生成乙烯。
化学方程式为:C2H2 + H2 → C2H43. 氢化反应:乙炔与氢气反应生成乙烷。
化学方程式为:C2H2 + 2H2 → C2H64. 脱氢反应:乙炔可以发生脱氢反应生成环戊二烯。
化学方程式为:C2H2 → C5H4五、乙炔的制备方法1. 乙炔是通过电石法制备的。
电石法是将石灰石和焦炭加热到高温,然后用电解法得到电石,再将电石与水反应生成乙炔。
2. 乙炔也可以通过水合物的分解来制备。
水合物是一种含氢和乙炔的化合物,加热水合物可以释放乙炔气体。
六、乙炔的应用1. 化工原料:乙炔可以作为合成氨、乙烯和丙烯等化工品的原料,广泛用于塑料、橡胶、纺织等工业领域。
2. 金属加工:乙炔在金属加工领域有着重要的应用,可以用于切割、焊接等工艺。
3. 照明:乙炔可以用于照明和热源,比如乙炔灯。
4. 医药:乙炔也有医药用途,可以用于合成药物和医疗器械。
七、安全注意事项1. 因为乙炔易燃,需要储存于防爆容器中,远离火源。
2. 乙炔气体具有窒息性,密闭空间中积聚乙炔气体会引起窒息,应注意通风。
乙炔的分子结构和物理性质
8 思考:该分子结构中至少可以有——个原子在 10 同一个平面?最多可以有——个原子在同一个 平面?
H H
H
C 2H 4
H:C::C:H H H
H H C— C — H H
H H
H
H:C:C:H
H— C— C— H H H
CH3CH3
ቤተ መጻሕፍቲ ባይዱ
CH2=CH2
思考:经实验测定,在相同条件下,乙炔气体密度是 氢气的13倍,又知它的含碳量为92.3%,求该烃 的分子式?
一、乙炔的分子组成和结构
分子式: C2H2 电子式: H∶C C∶H
均为 C、H C2H4
C2H2 CH
C6H6 CH
CH2
CnH2n+2 CnH2n CnH2n-2 通式 (n≥1) (n≥2) (n≥2)
一、结构
甲烷 结构 式 乙烯 乙炔
HCCH
苯
结构 简式 分子 构型
CH4 CH2=CH2 CH≡CH 正四 面体
平面型 直线型 平面型
乙炔的物理性质
纯的乙炔是 (1)无色
乙炔的分子结构和物理性质乙炔物理性质乙炔的物理性质乙炔的化学性质乙炔分子式乙炔的性质聚乙炔衍生物分子m乙炔性质乙炔结构式乙炔结构简式
第二章 烃和卤代烃
第一节 脂肪烃
乙炔的分子结构和物理性质(9)
氧炔焰
复习思考 写出乙烷、乙烯的分子式、电子式、结构 式和结构简式。 乙烷 乙烯
分子式: 电子式 结构式 结构简式: C 2H 6
(2)无味
(3)气体
(4)比空气稍轻
(5)微溶于水,易溶于有机溶剂。
物理性质的对比
甲烷 乙烯 无色 乙炔 无色 苯 无色
颜色 无色
乙烷构造式
乙烷构造式乙烷,化学式为C2H6,是一种无色、无臭的气体。
它是烷烃家族中最简单的一员,由两个碳原子和六个氢原子组成。
乙烷是一种非极性分子,具有很低的沸点和冰点,常温下为气态。
乙烷的构造式可以用化学式C2H6来表示。
其中,C代表碳原子,H 代表氢原子。
乙烷由两个碳原子通过共价键连接而成,每个碳原子上分别连接了三个氢原子。
这种结构使得乙烷呈现出线性分子的形态。
乙烷是一种在常温下易挥发的气体。
它的沸点为-88.6℃,冰点为-183.3℃。
乙烷具有较低的密度,相对分子质量为30.07,密度为0.544 g/cm³。
由于乙烷分子中只有碳和氢两种元素,不含其他杂质,因此它是一种非常纯净的化合物。
乙烷是一种燃料,可以被用作燃气或者燃烧剂。
它的燃烧产物主要是二氧化碳和水,释放出大量的热能。
由于乙烷的能量密度较高,燃烧时产生的热量可用于供暖、烹饪等领域。
除了作为燃料,乙烷还有其他许多用途。
它可以用作溶剂,在化学实验和工业生产中起到溶解、稀释和清洗的作用。
乙烷也可以用作原料,用于合成其他有机化合物,如乙烯和乙醇等。
此外,乙烷还可以用于制备乙炔和硅烷等化合物。
乙烷的制备方法有多种,常见的方法包括从石油和天然气中提取和裂解烃类原料。
石油和天然气中富含碳氢化合物,通过加热和分馏等工艺可以将其中的乙烷分离出来。
此外,乙烷还可以通过甲烷和氧气的催化氧化反应得到。
乙烷在生活中有着广泛的应用。
它作为一种重要的燃料被广泛用于家庭、工业和交通等领域。
乙烷还可以用于制备塑料、橡胶、溶剂等化学品,对于工业生产和日常生活都起到了重要的作用。
乙烷是一种简单而重要的化合物。
它的构造式为C2H6,由两个碳原子和六个氢原子组成。
乙烷是一种无色、无臭的气体,具有较低的沸点和冰点。
它是一种重要的燃料和溶剂,广泛应用于家庭、工业和化工领域。
乙烷的制备方法多种多样,可以从石油和天然气中提取或者通过化学反应得到。
乙烷在现代社会中扮演着重要的角色,对于人类的生活和工业发展都有着重要的意义。
乙炔
6.下列烯烃和 下列烯烃和HBr发生加成反应所得的产物有同分异构体的是 下列烯烃和 发生加成反应所得的产物有同分异构体的是 ( BD ) A.CH2=CH2 B.CH3CH=CH2 C.CH3CH=CHCH3 D.CH3CH2CH=CH2 7.1mol某链烃最多能和 某链烃最多能和2molHCl发生加成反应,生成 发生加成反应, 某链烃最多能和 发生加成反应 生成1mol氯 氯 代烷, 该氯代烷能和6molCl2发生取代反应,生成只 发生取代反应, 代烷,1mol该氯代烷能和 该氯代烷能和 含有碳元素和氯元素的氯代烃,该烃可能是( 含有碳元素和氯元素的氯代烃,该烃可能是( B ) A.CH3CH=CH2 B. CH3C≡CH C.CH3CH2C≡CH D. CH2=CHCH=CH2
点燃
化 学 性 质
3.乙炔的用途 3.乙炔的用途
(1)乙炔是一种重要的基本有机原料,可以 乙炔是一种重要的基本有机原料, 乙炔是一种重要的基本有机原料 用来制备氯乙烯、聚氯乙烯和乙醛等。 用来制备氯乙烯、聚氯乙烯和乙醛等。 催化剂
CH≡CH + HCl ≡ nCH2=CH Cl
CH2=CHCl
催化剂 加温、 加温、加压
CH2=CHCl
甲烷氧化反应
(1) 在空气或在氧气中燃烧 完全氧化 — C2H2 + O2 → CO2 + H2O 乙炔燃烧时产生的氧炔焰可用来切割或 乙炔燃烧时产生的氧炔焰可用来切割或 氧炔焰可用来切割 焊接金属 金属。 焊接金属。 (2) 被氧化剂氧化 使酸性KMnO 溶液褪色 使酸性KMnO4溶液褪色
乙炔 炔烃
三、乙炔 1、乙炔的分子结构
电子式 结构式 结构简式 空间构型
∷ H : C‥ C : H
炔烃
高中化学炔烃编稿老师佘平平一校黄楠二校杨雪审核王艳会【考点精讲】一、乙炔1. 结构(1)四式:分子式:C2H2电子式:结构式:H-C≡C-H结构简式:CH≡CH(2)空间构型:直线型,呈对称结构,故为非极性分子。
(3)键参数:键长:1.20×10-10m(比单键和双键都短);键角:180°键能:812kJ/mol(不等于三个单键键能之和,分子中有两个键比较弱)2. 实验室制法和化学性质(1)药品:电石(CaC2)和水(2)装置:(3)注意事项:a. 原理和特点:尽管它是用块状固体与液体反应且不需加热,但实验室不能用启普发生器的原因有三点:①该反应较剧烈,不易控制。
②反应放出的热量大,易损坏启普发生器。
③反应后生成的石灰乳是糊状,可夹带少量CaC2进入启普发生器底部,堵住球形漏斗和底部容器之间的空隙,使启普发生器失去作用。
b. 实验室一般用简易装置制备乙炔。
一般情况下用电石得到的乙炔气中夹杂着H2S、PH 3、AsH 3等有特殊臭味的气体,可用CuSO 4溶液除去杂质气体。
c. 为得到平稳乙炔气流,控制反应速度,可用饱和食盐水代替水。
(4)化学性质: ① 氧化反应:a. 可燃性:2C 2H 2+5O 2−−→−点燃4CO 2+2H 2O (液)+2600kJ 现象:火焰明亮、带浓烟燃烧时火焰温度很高(>3000℃),用于气焊和气割。
其火焰称为氧炔焰。
b. 被KMnO 4氧化:能使紫色高锰酸钾溶液褪色。
② 加成反应:可以跟Br 2, H 2, HX 等多种物质发生加成反应。
现象:溴水褪色可用酸性KMnO 4溶液或溴水褪色区别烷烃。
二、炔烃的通式和性质1. 通式:C n H 2n -2,与二烯烃通式和环烯烃的通式相同,说明有一个叁键或两个双键或有一个双键和一个环则减少四个氢原子。
2. 性质:具有同乙炔类似的性质——氧化反应、加成反应等。
【典例精析】例题1 已知烯烃、炔烃在臭氧作用下发生以下反应:CH 3—CH =CH —CH 2—CH =CH 222OH O−−−→①②CH 3CHO +OHC —CH 2—CHO +HCHO CH 3—C≡C—CH 2—C≡CH 32OH O−−−→①②CH 3COOH +HOOCCH 2COOH +HCOOH 某烃的化学式为C 10H 10,在臭氧作用下发生反应:C 10H 1032O H O−−−→①②CH 3COOH +3HOOC —CHO +CH 3CHO (1)C 10H 10分子中含_______________个双键,_______________个叁键。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
乙烷乙烯乙炔的化学式
乙烷乙烯乙炔(Ethylacetylene)是一种用作起始原料的有机化合物,其化学式为C₄H₆。
它是由三个分子碳原子和六个分子氢原子组成的烷烃类有机分子,通常表示为CH3-C≡C-CH3,其中C≡C是一个双键。
乙烷乙烯乙炔是一种清晰、无色、极易挥发的液体,具有刺激性气味,在
室温下沸点为12.7℃,密度为0.8373g/L,折射率为1.3878,相对蒸
汽压为169.7mmHg,溶解性较差,可溶于醇和醚,不溶于水和固体脂肪。
乙烷乙烯乙炔可以通过气相聚合法合成,也可以从乙烯进行气相烷基
化而得到。
它是苯乙烯的重要加氢前体,也是合成有机颜料、聚合物
催化剂和乳化剂的重要原料,并可用于生产润滑油和润滑剂、橡胶及
研究有机合成反应。
此外,乙烷乙烯乙炔可以在质谱仪中用作参考物质,也可以用作医药中的化学试剂和检测分析材料。
乙烷乙烯乙炔的使用需要遵守一定的安全措施,如操作过程中需要通风,使用者应穿上有效的保护服装、手套等,使用者的眼睛需佩戴防
护眼罩,以防止粉尘飞溅,该物质如遇强烈火焰或加热会致爆,操作
前需把区域内的易燃物都进行清理,使用时应谨慎注意安全,及时进
行检查、维护。
总之,乙烷乙烯乙炔是一种重要的有机化合物,它的化学式为C₄H₆,具有无色、清晰、极易挥发、具有刺激性气味等特性,可用于合成有机
颜料、聚合物催化剂和乳化剂等,但乙烷乙烯乙炔的使用需要遵守一
定的安全措施,以保证安全使用。
