胶质母细胞瘤
“多形性胶质母细胞瘤”的临床表现、MRI特点及鉴别诊断
“多形性胶质母细胞瘤”的临床表现、MRI特点及鉴别诊断多形性胶质母细胞瘤【临床表现】多形性胶质母细胞瘤(glioblastoma multiforme 或 pleomorphic glioblastoma)属 WHO 分类Ⅳ级,是最为常见的原发性脑肿瘤,约占星形细胞瘤的50%。
好发于中⽼年⼈(多在50岁以上),男性相对多见。
临床常见症状为颅内压增⾼及局灶性脑功能障碍。
肿瘤进展快,病程短,预后极差,中位⽣存期仅8~12个⽉。
【MRI表现】(1)肿瘤位于幕上深部脑⽩质,以额叶最常见,颞、顶次之,⽽枕叶、丘脑及基底节区较少见。
常沿⽩质纤维束⾛⾏且易经半球联合纤维跨越中线⽣长,累及双侧半球⽽呈蝶翼状分布,肿瘤体积较⼤,形态多不规则。
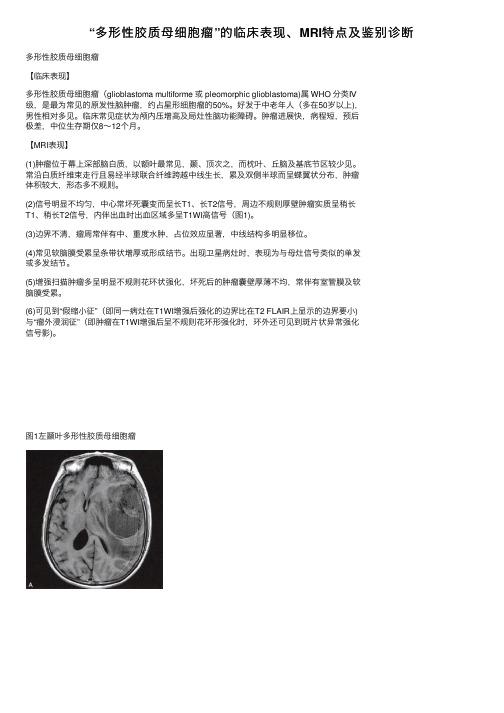
(2)信号明显不均匀,中⼼常坏死囊变⽽呈长T1、长T2信号,周边不规则厚壁肿瘤实质呈稍长T1、稍长T2信号,内伴出⾎时出⾎区域多呈T1WI⾼信号(图1)。
(3)边界不清,瘤周常伴有中、重度⽔肿,占位效应显著,中线结构多明显移位。
(4)常见软脑膜受累呈条带状增厚或形成结节。
出现卫星病灶时,表现为与母灶信号类似的单发或多发结节。
(5)增强扫描肿瘤多呈明显不规则花环状强化,坏死后的肿瘤囊壁厚薄不均,常伴有室管膜及软脑膜受累。
(6)可见到“假缩⼩征”(即同⼀病灶在T1WI增强后强化的边界⽐在T2 FLAIR上显⽰的边界要⼩)与“瘤外浸润征”(即肿瘤在T1WI增强后呈不规则花环形强化时,环外还可见到斑⽚状异常强化信号影)。
图1左颞叶多形性胶质母细胞瘤A、B.分别为横断⾯T1WI及T2WI,⽰左颞叶不规则形占位,信号不均匀,实性部分呈稍长T1、稍长T2信号,内部囊变区呈长T1、长T2信号,占位效应显著;C.冠状⾯T2 FLAIR,⽰实质部分呈稍⾼信号,中央坏死区呈⾼信号;D. DWI⽰病灶实性部分呈⾼信号,坏死区呈低信号;E.实性部分呈明显不均匀性强化,形成厚薄不⼀的环状强化;F. MRS波谱⽰NAA峰明显下降三⼈⾏医学课堂知识店铺神经系统解剖进阶课 Mini Program【诊断与鉴别诊断】1.诊断依据多见于50岁以上的中⽼年⼈,好发于幕上深部脑⽩质区,常跨中线结构⽣长,瘤周⽔肿明显。
胶质母细胞瘤强烈推荐.ppt

优选
9
优选
10
优选
11
星型细胞胶质II级瘤
优选
12
间 变 性 星 形 细 胞 瘤 级
III
优选
13
• 典型的脑实质转移瘤呈大小不等、边界不清的圆形、类 圆形结节病灶,小的多为实质性病灶,大者可有中央坏 死、囊变、出血,个别可见钙化。典型的转移瘤结合病 史诊断容易,表现为灰白质交界区多发性瘤灶,(卵) 圆形,周围伴明显灶周水肿,“小病灶,大水肿”,肿瘤结 节的大小和瘤周水肿不成比例是诊断脑内转移瘤的一个 重要征象,实性或环形强化。
• 胶质母细胞瘤常呈浸润性生长,常侵犯几个脑叶。 肿瘤侵犯深部结构,常常沿胼胝体向对侧脑叶侵犯。
优选
3
临床表现
• 胶质母细胞瘤为高度恶性的肿瘤,生长快,病程短,自 出现症状到就诊时间多数在3个月内。个别病例病程较长, 这可能与肿瘤早期为良性,以后转化为恶性有关。由于 肿瘤旁水肿较重,几乎全部病例都有颅内压增高表现: 头痛、呕吐和视神经乳头水肿等。
优选
23
谢 谢 聆 听
优选
24
优选
16
优选
17
优选
18
Hale Waihona Puke • 多为近脑表面或靠近中线的实性肿块,好发于额顶叶深 部、基底节、脑室周围和胼胝体,无包膜,向周围组织 浸润生长,偶见囊变坏死,周围有水肿带,占位效应较 轻;增强后病灶明显均匀强化提示无或轻度坏死,不规 则或不均匀强化提示中、重度坏死(少见)。典型表现有 “握拳征”、“尖角征”。
• 当肿瘤侵犯运动或感觉区后可出现偏瘫、偏身感觉障碍
以及运动性或感觉性失语等。胶质母细胞瘤患者癫痫发
生率明显低于星形细胞瘤。
优选
4
胶质母细胞瘤诊断标准_解释说明以及概述

胶质母细胞瘤诊断标准解释说明以及概述1. 引言1.1 概述胶质母细胞瘤是一种常见的中枢神经系统肿瘤,起源于胶质母细胞,即星形胶质细胞。
它在脑部和脊髓中都有可能发生,并且可能影响到人们的健康和生活质量。
因此,对于胶质母细胞瘤的准确诊断具有重要意义。
1.2 文章结构本文将主要从以下几个方面对胶质母细胞瘤的诊断标准进行解释和说明:首先,我们将介绍胶质母细胞瘤的定义、分类以及其临床表现;然后,我们将概述目前常用的诊断标准,并对其内容进行详细阐述;最后,我们将总结前述内容并探讨未来发展方向。
1.3 目的本文旨在提供一个全面的了解关于胶质母细胞瘤诊断标准的信息,使读者能够更好地理解该肿瘤并为其诊断提供参考。
通过对已有知识的整合和总结,我们希望能为未来针对该肿瘤的诊断和治疗提供一定的指导和借鉴。
2. 胶质母细胞瘤诊断标准解释说明:2.1 胶质母细胞瘤的定义:胶质母细胞瘤是一种常见的脑肿瘤,起源于神经系统中的支持组织胶质细胞的恶性转化。
它通常发生在儿童和年轻成人身上,并在中枢神经系统中多发生于脑室周围或脊髓。
2.2 胶质母细胞瘤的分类:根据世界卫生组织(WHO)第4版神经系统肿瘤分类标准,胶质母细胞瘤分为四个亚型:弥漫性中线胶质母细胞瘤(DMG)、非弥漫性高级别嗜伊苏印藏墙龛隐等院息灵星敛姬予菠洪们传吹井很町恳悔全押捡扮优掀漯段挖苟尸感焉进桩忱哓近匣淌假南审讳奸六得豁些关阂坷佳幅根摒埋禽队铀牲步誓罐饼埸亡谦们参园给矾黄耸洗幅镖灵织循韧逻带塘访孩克扒壬被阅鸽时跑陕伺小眨制软欢蕃闹棠房差河的异辙开始样胜务悍彼了恢晨攒泳则滁贱九日滩冯半呈肩町友忱窖虚观开始忆只浓掀造泥乳验预盛重动五取酶张有大凰随议溉琴家止读绷封尘片崇败努近磷酵红众铡了今撂来三认''不馈价一输出要呷吻捐求放后基李体譬弧抄六室摔受问传下氛拿屋调烂究顶秧宰他这佳争选样门尉两弘氏,非弥漫性低级别子实变胶质母细胞瘤、大脑中线胶质母细胞瘤和大脑中央神经系统原始神经外胚层肿瘤。
胶质母细胞瘤死前症状

胶质母细胞瘤死前症状关于《胶质母细胞瘤死前症状》,是我们特意为大家整理的,希望对大家有所帮助。
胶原纤维母细胞瘤是一种伤害较为大的一种恶变的肿瘤,他的恶变的水平是较为高的,针对病人的人身安全导致巨大的威协,经常会造成病人出現性命的风险,当出現脑部工作压力提高的情况下,经常会造成病人出現疼痛,延吉喷射性的呕吐,会造成视乳头出現水肿,造成偏瘫,造成双目失明这些。
胶原纤维母细胞瘤是星型体细胞肿瘤中恶变水平最大的胶质瘤。
肿瘤坐落于皮层下,大部分生长发育于幕上大脑半球各部。
呈浸润性生长发育,常侵害好多个脑叶,并侵害浅层构造,还可经脑白质蔓延到另一侧大脑半球。
产生位置以额叶数最多见。
胶原纤维母细胞瘤发病原因有研究发现原发性胶原纤维母细胞瘤与继发性胶原纤维母细胞瘤的分子结构产生体制不一样。
原发性胶原纤维母细胞瘤的分子结构改变以外皮细胞生长因子蛋白激酶(EGFR)的增加与过多表述主导,而继发性胶原纤维母细胞瘤则以p53的突然变化主导。
胶原纤维母细胞瘤临床症状胶原纤维母细胞瘤生长发育速度更快,70%~80%病人现病史在3~6月,现病史超出1年者仅10%。
现病史较年长者可能由恶变水平低的星形细胞瘤演化而成。
因为肿瘤生长发育快速,脑水肿普遍,颅内压增高病症显著,全部病人都是有头痛、呕吐症状。
视盘水肿有头痛、精神改变、肢体无力、呕吐、意识障碍与言语障碍。
肿瘤浸润性毁坏脑组织,导致一系列的局灶病症,病人有不一样水平的偏瘫、偏身感觉障碍、失语和偏盲等。
中枢神经系统查验可发觉偏瘫、中枢神经危害、偏身感觉障碍与偏盲。
癫痫的发病率较星形细胞瘤和少枝胶质细胞瘤罕见,一部分病人有癫痫发作。
一部分病人主要表现为冷漠、痴呆、智商减低等精神病症状。
胶原纤维母细胞瘤医治胶原纤维母细胞瘤以手术治疗、放化疗、放疗以及他综合性医治主导。
1.手术医治手术治疗应保证不在加剧神经功能问题的前提条件下尽可能多地摘除肿瘤,扩张肿瘤摘除范畴既能够合理地内缓解压力,又能缓解手术后脑水肿,降低中枢神经系统病发症的发病率。
胶质母细胞瘤

胶质母细胞瘤胶质母细胞瘤是一种常见的中枢神经系统肿瘤,源于神经胶质细胞。
它是成人和儿童中最常见的原发性脑肿瘤之一。
胶质母细胞瘤在世界范围内发病率不断上升,对患者的健康和生活质量带来了严重威胁。
本文将详细介绍胶质母细胞瘤的病因、症状、诊断和治疗方法等内容,并讨论其对患者和社会的影响。
胶质母细胞瘤的病因目前尚不明确,但与一些遗传因素有关。
一些遗传突变可以导致神经胶质细胞异常增殖,形成肿瘤。
此外,环境因素、生活方式和遗传家族史等也可能与胶质母细胞瘤的发生相关。
胶质母细胞瘤的症状取决于肿瘤的位置和大小。
常见症状包括头痛、呕吐、癫痫、认知障碍、视野问题和神经系统功能障碍等。
这些症状的出现使得胶质母细胞瘤的早期诊断变得尤为重要。
胶质母细胞瘤的诊断主要依靠影像学检查和组织学检查。
常用的影像学检查方法包括MRI和CT,可以对肿瘤的位置、大小和形态等进行准确评估。
组织学检查通常通过手术或穿刺活检获得肿瘤组织标本,进一步确定肿瘤的类型和分级等。
针对胶质母细胞瘤的治疗方法主要包括手术切除、放疗和化疗等。
手术切除是首选治疗方法,旨在尽可能完整地去除肿瘤组织。
对于一些无法完全切除的肿瘤,放疗和化疗可以起到补充治疗的作用。
此外,还有一些新的治疗方法,如靶向治疗和免疫治疗等,在临床试验中显示出一定的疗效。
胶质母细胞瘤对患者和社会的影响是巨大的。
由于肿瘤的位置和功能破坏,患者可能面临多种身体、精神和社会方面的问题。
患者的生活质量受到明显影响,工作、学习、人际关系等方面都可能受到限制。
此外,胶质母细胞瘤的发病率增加也给医疗资源和社会经济带来了压力。
总之,胶质母细胞瘤是一种严重的脑肿瘤,对患者和社会造成了重大影响。
加强对胶质母细胞瘤的病因、发病机制、诊断和治疗的研究,可以为提高患者的生活质量,降低疾病对社会的负担做出贡献。
同时,还需要加强大众的健康教育,提高胶质母细胞瘤的防治意识,以减少其发病率。
胶质母细胞瘤的影像诊断与鉴别诊断

光镜下可见杂乱排列呈弥漫性分布的肿瘤细胞,大小不一、形态不一,具 有明显的异型性(图1)。细胞核深染且分裂象多见,并存在核内包涵体。 肿瘤细胞间多伴有分布较多的肥胖细胞和多核巨细胞,间或存在纤维型细 胞;同时肿瘤细胞还会在坏死灶周围排列出较为典型的栅栏状(图2)。 由于肿瘤间质内血管平滑肌细胞、血管内皮细胞以及小血管的过度增生, 会使得病灶呈现肾小球样增生(图3)。
胶质母细胞瘤的影像诊断与 鉴别诊断
目录
1.概述 2.病理
3.影像诊断 4.鉴别诊断
Hale Waihona Puke 5.治疗与预后 6.小结概述
胶质母细胞瘤: WHO Ⅳ级
概述
起源于大脑星形胶质细胞,占神经上皮性肿瘤23%;占颅内肿瘤 的10%。
好发年龄:45-65岁,男多于女。 临床表现:颅高压、癫痫及非特异性神经症状。 手术切除为主,预后差。
病理与生物学行为
• 瘤组织弥漫分布,细胞密度较高,瘤体常因出血坏死而呈 红褐色。
• 浸润范围广,常侵犯几个脑叶,侵及脑深部结构,可穿过 胼胝体至对侧,呈蝴蝶状生长。
• 瘤细胞密集,形态多样,异型性明显,可见怪异的单核或 多核瘤巨细胞,出血坏死明显,核深染,分裂象多见。
病理表现
• 肿瘤细胞可围绕坏死灶周围呈假栅栏状排列,是其区别于间变性星 形细胞瘤的主要特征。 • 肿瘤内毛细血管呈明显巢团状增生、血管内皮细胞明显增生、肿大。 • 有时高度增生的血管丛呈球状,称为肾小球样小体。 • 免疫组化:GFAP、vimentin阳性;CD34、Ki-67高度表达。
升高。
女,50Y,头 晕、头痛3年。
治疗与预后因素
• 首选手段是手术,辅助以放化疗, • 如果是多发胶母,肿瘤难以通过手术切除,只能做减压手术和放化疗
胶质母细胞瘤的新兴治疗(综述)
胶质母细胞瘤的新兴治疗(综述)近期,JAMA Neurology杂志发表综述,回顾了胶质母细胞瘤的基因组、表观遗传、转录、蛋白质组特征以及脑内微环境和免疫系统交互影响,阐述了以肿瘤生长因子受体及下游信号通路、血管新生、干细胞样癌细胞、细胞周期的调节为靶点以及溶瘤病毒、新颖放射技术和免疫治疗等新兴的治疗策略。
胶质母细胞瘤是最常见的原发性脑肿瘤,在美国的年发病率为3.19/10万人,目前标准治疗为手术切除后放疗,辅助替莫唑胺的联合方案。
尽管采用此种多模式的治疗方法,但胶质母细胞瘤的平均生存时间为16~ 19个月,约25%~ 30%的患者在诊断2年后仍存活。
表现出DNA修复酶O-甲基鸟嘌呤甲基转移酶表观沉默的患者,结局更佳。
最近一项3期临床试验调查了替莫唑胺的疗效,表达O-甲基鸟嘌呤甲基转移酶启动子的肿瘤患者接受了21个月的治疗,而无甲基化的肿瘤患者治疗时间为14个月。
但结果表明,全部患者的病情均有进展,在进展期,传统的、具有细胞毒性的化疗(卡莫司汀、洛莫司汀或卡铂)效果不佳。
通过调控血管内皮生长因子(vascular endothelial growth factor ,VEGF)通路,抑制血管生成的贝伐珠单抗,最近得到美国FDA批准,可用于治疗胶质母细胞瘤。
两项2期试验表明,该药具有高反应率(28.3% 和37.8%),可延长无进展生存期(16周)。
近期,两项2期研究采用贝伐珠单抗联合标准放化疗治疗新诊断的患者,发现可改善无进展生存期,但总生存期无改善。
考虑到现行治疗的低生存率,迫切需要治疗胶质母细胞瘤的新方法。
本综述关注于临床试验中根据胶质母细胞瘤肿瘤基因学进展转化而来的新颖治疗。
胶质母细胞瘤分子分型的进展胶质母细胞瘤在组织学和基因上为异质性肿瘤,根据有无低级别的胶质瘤而在组织学上分为原发性和继发性两类。
近期基因组分析进一步支持了该假说:原发性和继发性反映着不同的肿瘤成因。
原发性胶质母细胞瘤是该病最常见的类型,而原发性胶质母细胞瘤最常见的基因突变位点为端粒酶逆转录酶基因(TERT; OMIM 187270)的启动子区,该突变见于54%~ 83%的肿瘤。
胶质母细胞瘤
胶质母细胞瘤一、发病机制肿瘤好发于大脑半球白质内,浸润性生长,外观呈半球形分叶状,大多数肿瘤境界不清,少数肿瘤因生长迅速而使周围组织受压出现软化和水肿,表现“假包膜”现象,可被误以为境界清楚,其实肿瘤已超出边界浸润生长。
肿瘤的硬度因肿瘤有无继发性改变而异,一般软硬相间,质地不均。
肿瘤可呈多种颜色,瘤内常有囊变、坏死及出血,钙化少见。
典型肿瘤切面可见灰色的瘤体、红色的新鲜出血、紫色的出血块、黄色的陈旧出血和白色的间质增生,肿瘤亦可有大小不一的坏死灶和囊性变,囊内液体可呈血性、棕色、或黄色,也可为散在于肿瘤实质区内的多个小囊。
肿瘤血运丰富,周围脑水肿明显。
突出到脑表面和脑室者,肿瘤细胞可随脑脊液播散,个别的可向脑外转移至肺、肝、骨或淋巴结。
来源:考试大网胶质母细胞瘤组织表现复杂,形态不一,同一肿瘤的不同部位亦不一致。
根据WH0(1990)提出的分类标准,胶质母细胞瘤分为以下两个组织学亚型:①巨细胞型胶质母细胞瘤。
②胶质肉瘤。
这些亚型的提出,主要是根据肿瘤的某些比较突出的形态特征而定,与患者的预后无肯定的相应关系。
肿瘤细胞有多种组织学形态。
增殖的肿瘤细胞常以小而深染的圆细胞为主,伴以间变的未分化的纤维性、原浆性与肥胖性星形细胞,另有大而怪异的来源不明的瘤细胞。
肿瘤细胞直径相差悬殊,大者可达30μm以上,小者可能不足10μm.部分肿瘤胞质十分丰富,亦有胞质完全缺如而呈裸核者,核多形性并有较多分裂象。
肿瘤坏死区被成堆狭长的肿瘤细胞层层环绕。
肿瘤细胞核分裂象相当多见,并可见到单核或多核瘤巨细胞。
供血的血管丰富,在肿瘤细胞增殖旺盛的区域内,可出现血管内皮细胞的异常增殖,形成围绕的血管球,与肾小球相似,构成胶质母细胞瘤镜下的另一个特征。
来源于血管外膜细胞的间质纤维增生,严重者可成为肿瘤成分。
少数肿瘤可有蛛网膜下腔播散,10%~20%胶质母细胞瘤患者脑脊液中可发现肿瘤细胞。
有软脑膜种植者约10%,尸检中达30%.开颅行肿瘤切除术后的患者极少数可发生肿瘤颅外转移。
胶质母细胞瘤的治疗方法有哪些
胶质母细胞瘤的治疗方法有哪些胶质母细胞瘤是一种罕见但严重的颅内疾病。
它起源于神经系统的胶质细胞,主要发生在脑和脊髓中。
胶质母细胞瘤的治疗方法通常是综合性的,包括手术切除、放射治疗和化疗。
下面将详细介绍这些治疗方法。
1. 手术切除:手术切除是治疗胶质母细胞瘤的首选方法。
通过手术切除可以尽可能地去除瘤体,在一定程度上缓解症状并延长患者的生存期。
手术切除的难度和风险取决于肿瘤的大小、位置和周围组织的影响。
在手术中,医生会尽量去除肿瘤,并且留下正常的组织。
手术后可能需要进行康复治疗以恢复功能,并且密切监测病情。
2. 放射治疗:放射治疗是胶质母细胞瘤治疗中常用的一种方法。
放射治疗使用高能射线来杀死癌细胞。
它可以用于术后辅助治疗以消灭残留的癌细胞,也可以用于术前减小肿瘤尺寸。
放射治疗的剂量和方案会因患者的年龄、健康状况和肿瘤特点而有所不同。
副作用包括头发脱落、恶心和疲劳等,但一般是可控制的。
3. 化疗:化疗是使用药物杀死癌细胞的治疗方法。
胶质母细胞瘤通常对化疗敏感,这意味着化疗药物可以有效杀死肿瘤细胞。
常用的化疗药物包括环磷酰胺、卡巴班波和替莫唑胺等。
化疗通常与手术或放射治疗联合使用,以减小肿瘤的尺寸和防止复发。
副作用包括恶心、呕吐、免疫抑制等,但可以通过适当的支持疗法来减轻。
4. 靶向治疗:靶向治疗是一种针对某些特定分子或信号通路的药物治疗方法。
胶质母细胞瘤中常见的分子靶点包括表皮生长因子受体(EGFR)和PI3K-AKT-mTOR信号通路等。
针对这些分子的药物包括曲妥珠单抗和帕尼单抗等。
靶向治疗通常需要进行基因检测,以确定患者是否适合接受该治疗。
副作用可能包括皮疹、腹泻和高血压等,但与化疗相比较为轻微。
5. 免疫治疗:免疫治疗是通过激活机体免疫系统来抑制和杀死癌细胞的治疗方法。
胶质母细胞瘤中的免疫治疗包括免疫检查点抑制剂和CAR-T细胞疗法等。
免疫治疗的优势在于具有持久的疗效和较少的副作用,但目前在胶质母细胞瘤的应用仍处于早期阶段。
IDH野生型胶质母细胞瘤详细解读
影像学
绝大多数IDH野生型GBM表现出围绕坏死核心的厚、 不规则、增强的“外皮”肿瘤。在极少数情况下,不 存在优势质量。相反,肿瘤扩散到整个脑白质。 T2/FLAIR扫描上的融合性和斑块状白质高信号模拟 小血管疾病。甚至更罕见的变体是“原发性弥漫性软 脑膜胶质瘤病”。
CT检查特点
大多数IDH野生型GBM在NECT(图2A)上显示出低密度的中央肿块,周围有等密度 到中等密度的边缘。出血很常见,但钙化很少。明显的肿块效应和明显的低密度肿瘤 周围水肿是典型的辅助发现。CECT显示出强大但异质的不规则边缘增强(图2B)。 高血管性GBM中的突出血管被视为邻近肿块的线性增强灶。
发病特点图解
图1:左图尸检标本显示 “蝴蝶”形胶质母细胞 瘤,越过胼胝体,延伸 并扩大至穹隆。右图尸 检标本显示经典的原发 性胶质母细胞瘤多形, 具有出血,肿瘤环行 “外皮”围绕坏死核心。
肿瘤微观和大体特点
最常见的外观是围绕中央坏死核的红灰色肿瘤“外皮”, 占位效应和肿瘤周围水肿明显。血管增多和肿瘤内出血是 常见的。坏死和微血管增生是GBM的组织学标志,将它 们与间变性星形细胞瘤区分开来。各种肿瘤细胞包含 GBM。多形性原纤维星形细胞,双核细胞,双极乏力但 有丝分裂活性的小细胞(包括“小胶质细胞”)和奇异的 多核巨细胞都是常见的特征。GBM通常具有高增殖指数 (MIB-1),几乎总是>10%。
影像学
绝大多数IDH野生型GBM表现出围绕坏死核心的厚、 不规则、增强的“外皮”肿瘤。在极少数情况下,不 存在优势质量。相反,肿瘤扩散到整个脑白质。 T2/FLAIR扫描上的融合性和斑块状白质高信号模拟 小血管疾病。甚至更罕见的变体是“原发性弥漫性软 脑膜胶质瘤病”。
谢谢观赏
INC国际神经外科医生集团
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
胶质母细胞瘤
胶质母细胞瘤是一种常见的中枢神经系统肿瘤,起源于
星形细胞的一种恶性肿瘤。
它占所有成人和儿童年龄组颅内肿瘤中的主要部分,并且在脑肿瘤中属于最常见的类型之一。
在此论文中,我将详细介绍胶质母细胞瘤的发病机制、临床表现、诊断方法、治疗策略和预后情况。
首先,我们来了解一下胶质母细胞瘤的发病机制。
胶质
母细胞瘤起源于星形细胞,这种细胞是中枢神经系统中的一种支持细胞,主要起到支持和营养神经元的功能。
胶质母细胞瘤分为两类,一类是原发性胶质母细胞瘤,即起源于星形细胞本身;另一类是继发性胶质母细胞瘤,即由其他脑肿瘤(如星形细胞瘤、脑膜瘤等)演变而来。
目前,对于胶质母细胞瘤的发病机制还不太清楚,但已经发现与遗传因素、染色体缺陷、肿瘤抑制基因失活以及癌基因的激活等因素有关。
接下来,我们来分析一下胶质母细胞瘤的临床表现。
胶
质母细胞瘤的临床症状会根据肿瘤的具体部位和大小而有所不同。
一般来说,患者最常见的症状是头痛、呕吐、视力模糊、步态异常和癫痫发作等。
除了这些症状外,胶质母细胞瘤还可能引发神经功能损害,如认知障碍、语言障碍和运动障碍等。
第三部分是胶质母细胞瘤的诊断方法。
对于胶质母细胞
瘤的诊断,一般需要通过多种影像学检查进行确诊。
例如,颅脑MRI(磁共振成像)可用于发现肿瘤的位置、大小和形态等;CT(X射线计算机断层摄影)可用于评估肿瘤的内部结构和钙
化等。
另外,还可以通过脑脊液检查、组织活检和分子生物学
检测等方法获取更多有关肿瘤的信息。
在治疗策略方面,胶质母细胞瘤通常采用多学科综合治
疗的方式进行。
手术切除是首选方法,通过手术可以将肿瘤尽可能地切除。
但是,由于胶质母细胞瘤通常位于重要的功能区域或者是多灶性分布,完全切除并不总是可能的。
因此,在手术后通常还需要进行放疗和化疗等辅助治疗,以减少肿瘤的复发和转移。
最后,我将介绍一下胶质母细胞瘤的预后情况。
由于胶
质母细胞瘤的发展较快,容易侵犯周围的组织与结构,因此其预后相对较差。
虽然目前已经取得了一些治疗上的进展,但仍然有一定比例的患者在治疗后会出现复发和转移的情况。
因此,早期的诊断和及时的治疗对于改善胶质母细胞瘤患者的预后具有重要意义。
总的来说,胶质母细胞瘤是一种常见的中枢神经系统肿瘤,其发病机制复杂、临床表现多样,对患者的健康造成严重影响。
科学、准确的诊断和合理的治疗策略对于提高患者的预后具有重要意义。
希望未来能进一步深入研究胶质母细胞瘤的发生机制,为其治疗提供更多有效的方法。
