(完整word版)金属的化学性质 知识点和考点归纳(非常全面和详细)
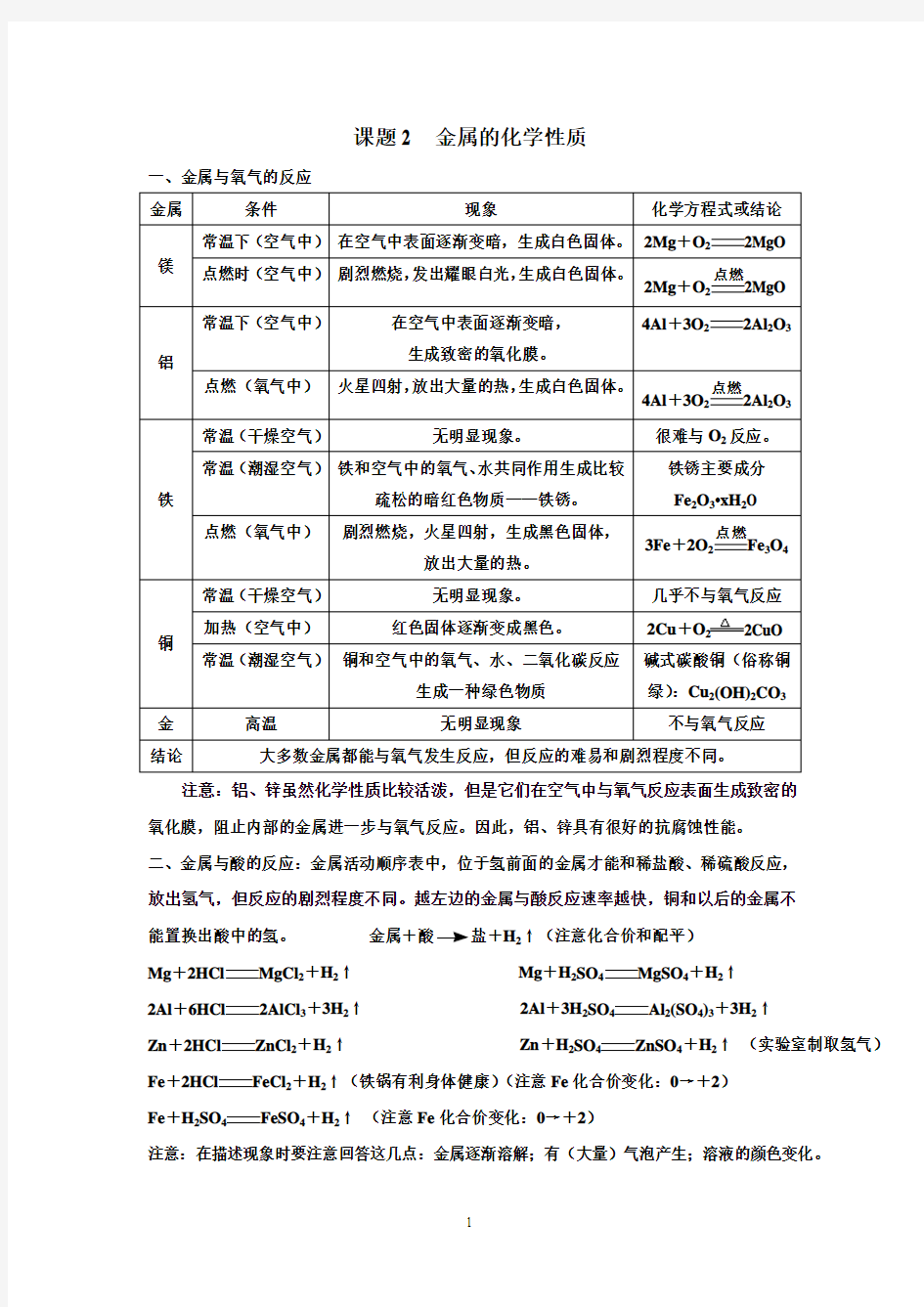

课题2 金属的化学性质
一、金属与氧气的反应 金属
条件 现象 化学方程式或结论
镁 常温下(空气中) 在空气中表面逐渐变暗,生成白色固体。 2Mg +O 22MgO 点燃时(空气中) 剧烈燃烧,发出耀眼白光,生成白色固体。
2Mg +O 2点燃2MgO 铝 常温下(空气中)
在空气中表面逐渐变暗, 生成致密的氧化膜。
4Al +3O 22Al 2O 3 点燃(氧气中) 火星四射,放出大量的热,生成白色固体。
4Al +3O 2点燃2Al 2O 3 铁 常温(干燥空气) 无明显现象。 很难与O 2反应。
常温(潮湿空气) 铁和空气中的氧气、水共同作用生成比较疏松的暗红色物质——铁锈。 铁锈主要成分 Fe 2O 3?xH 2O
点燃(氧气中) 剧烈燃烧,火星四射,生成黑色固体, 放出大量的热。
3Fe +2O 2点燃Fe 3O 4 铜 常温(干燥空气)
无明显现象。 几乎不与氧气反应 加热(空气中) 红色固体逐渐变成黑色。 2Cu +O 22CuO
常温(潮湿空气) 铜和空气中的氧气、水、二氧化碳反应
生成一种绿色物质
碱式碳酸铜(俗称铜绿):Cu 2(OH)2CO 3 金
高温 无明显现象 不与氧气反应 结论 大多数金属都能与氧气发生反应,但反应的难易和剧烈程度不同。
注意:铝、锌虽然化学性质比较活泼,但是它们在空气中与氧气反应表面生成致密的氧化膜,阻止内部的金属进一步与氧气反应。因此,铝、锌具有很好的抗腐蚀性能。
二、金属与酸的反应:金属活动顺序表中,位于氢前面的金属才能和稀盐酸、稀硫酸反应,放出氢气,但反应的剧烈程度不同。越左边的金属与酸反应速率越快,铜和以后的金属不能置换出酸中的氢。 金属+酸
盐+H 2↑(注意化合价和配平) Mg +2HCl
MgCl 2+H 2↑ Mg +H 2SO 4MgSO 4+H 2↑ 2Al +6HCl
2AlCl 3+3H 2↑ 2Al +3H 2SO 4Al 2(SO 4)3+3H 2↑ Zn +2HCl
ZnCl 2+H 2↑ Zn +H 2SO 4ZnSO 4+H 2↑ (实验室制取氢气) Fe +2HCl
FeCl 2+H 2↑(铁锅有利身体健康)(注意Fe 化合价变化:0→+2) Fe +H 2SO 4FeSO 4+H 2↑ (注意Fe 化合价变化:0→+2)
注意:在描述现象时要注意回答这几点:金属逐渐溶解;有(大量)气泡产生;溶液的颜色变化。
三、金属与盐溶液的反应:金属活动顺序表中,前面的金属能将后面的金属从它的盐溶液
中置换出来。(钾钙钠除外)金属+盐新金属+新盐
Fe+CuSO4Cu+FeSO4(铁表面被红色物质覆盖,溶液由蓝色逐渐变成浅绿色)
(注意Fe化合价变化:0→+2)不能用铁制器皿盛放波尔多液,湿法炼铜的原理
Cu+2AgNO32Ag+Cu(NO3)2(铜表面被银白色物质覆盖,溶液由无色逐渐变成蓝色)
Fe+2AgNO32Ag+Fe(NO3)2(铁粉除去硝酸银的污染,同时回收银)(注意Fe化合价变化:0→+2)现象的分析:固体有什么变化,溶液颜色有什么变化。
四、置换反应:一种单质和一种化合物反应,生成另一种单质和另一种化合物的反应。
单质+化合物新单质+新化合物 A +BC B +AC
初中常见的置换反应:(1)活泼金属与酸反应:如Zn+H2SO4ZnSO4+H2↑
(2)金属和盐溶液反应:如Fe+CuSO4Cu+FeSO4
(3)氢气、碳还原金属氧化物:如H2+CuO Cu+H2O C+2CuO2Cu+CO2↑
五、金属活动顺序表
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强到弱
应用:1、在金属活动顺序表中,金属位置越靠前(即左边),金属的活动性越强。(即越靠近左
边,金属单质越活泼,对应阳离子越稳定;越靠近右边,金属单质越稳定,对应阳离子越活泼。)
2、在金属活动顺序表中,位于氢前面的金属能将酸中的氢置换出来,氢以后不能置换出酸中的氢。
注意:(1)浓硫酸、硝酸除外,因为它们与金属反应得不到氢气。
(2)铁和酸反应化合价变化:由0价→+2价。
3、在金属活动顺序表中,前面的金属能将后面的金属从它的盐溶液中置换出来。【可以理
解为弱肉强食,弱的占位置(离子或化合物的位置)占不稳,被强的赶走;强的占位置占
得稳,弱的不能将它赶走!】
注意:(1)K、Ca、Na除外,因为它们太活泼,先和水反应。如2Na+2H2O2NaOH+H2↑(2)变价金属Fe、Cu、Hg发生这种置换反应,化合价变化:由0价→+2价。
金属化学性质的中考考点知识:
1、比较金属活动性强弱方法:弱肉强食,能反应的是强的把弱的赶走,与酸反应越剧
烈,说明活动性越强;不能反应的是弱的赶不走强的。
例:X、Y、Z是三种不同的金属,将X、Y分别放入稀盐酸中,只有X表面产生气泡;将
Y、Z分别放入硝酸银溶液中,一会儿后,Y表面有银析出,而Z无变化。根据以上实验事
实,判断三种金属的活动性顺序为( )
A 、X >Y >Z
B 、X > Z > Y
C 、Z > X >Y
D 、Y >Z >X
分析:X 、Y 与酸反应得出X >H >Y ,Y 、Z 与硝酸银反应得出Y >Ag >Z ,在金属活动表中画出
Z Ag Y H X
2、设计实验探究和验证金属活动性顺序
【规律方法】初中阶段,金属活动性的比较主要是针对两种金属或三种金属。它们的活动性比较在设计上有一定的规律和技巧。
1.两种金属活动性的比较
(1)采用“一金一盐”方法(K 、Ca 、Na 除外):即一种是金属单质,另一种金属则采用其盐溶液。操作是将该金属单质 A 放入到另一金属 B 的化合物溶液中,如果能反应,则活动性:A >B ,如果不能反应,则活动性:A <B 。
(2)采用“二金一酸”方法(适用于至少一种氢前金属): 即两种都是金属单质,再加上一种酸(稀盐酸或稀硫酸)。操作是将两种金属单质A 、B 分别放入到酸溶液中,如果A 能反应而 B 不能反应,或 A 比 B 放出氢气速率快,则活动性:A >B ,反之,则活动性:A <B 。
2.三种金属活动性的比较
(1)排好金属活动性顺序后,采用“两边金属中间盐”。
(2)排好金属活动性顺序后,采用“中间金属两边盐”。
例、某研究性学习小组,设计实验一次性验证铁、锌、铜三种金属活动性的实验,每种方案如下,可行的方案是( )
A .锌、硫酸铜溶液、硫酸亚铁溶液
B .铁、锌、硫酸铜溶液
C .锌、铜、硫酸亚铁溶液
D .铁、铜、硫酸锌溶液
分析:活动性顺序:Zn >Fe >Cu ,两边金属中间盐:Zn 、Cu 、FeSO 4溶液
中间金属两边盐:Fe 、ZnSO 4溶液、CuSO 4溶液
金属化学性质的拓展知识:
1、金属与酸反应放出氢气的规律:
(1)金属越靠近左边,与酸反应越剧烈,放出氢气的速率越快,在图像上表现为越陡。
(2)金属与足量的酸反应产生相同质量的氢气,则金属质量与转化为+2的金属相对原子质量成正比。
(3)相同质量的金属与足量的酸反应产生的氢气质量比与转化为+2的金属相对原子质量
t Mg
m Al m Mg t Al Al m t Mg t Mg m Al 成反比(即与倒数成正比)。
(4)相同质量的酸完全反应,产生的氢气质量相等(不管和什么金属反应,酸中的H +全部转化为H 2,所以质量相等)
(5)金属与酸反应,溶液质量逐渐增加,密度逐渐增大(溶液体积的变化忽略不计)。 小结:金属M (假设化合价为+n ),与酸反应产生氢气可以用下列两个关系式表示:
n 2M ~2H +~H 2 M ~nH +~2
n H 2 例1、Mg 、Al 与足量的酸反应产生的氢气质量相等,则Mg 、Al 的质量比为 分析:Mg ~ H 2
32Al ~ H 2 24 2 3
2×27=18 2 ∴Mg 、Al 质量比为24:18=4:3(即与转化为2价的金属相对原子质量成正比)
例2、相同质量的Mg 、Al 与足量的酸反应产生的氢气质量比为
分析: 令金属的质量为单位1,则由关系式可得
Mg ~ H 2
3
2Al ~ H 2 24 2 3
2×27=18 2 1 x =2×241 1 y =2×18
1 ∴产生氢气质量比为241:181=3:4(即与转化为2价的金属相对原子质量成反比) 例3、室温下,等质量的镁片和铝片分别与足量的稀硫酸反应,产生氢气的质量(m)与时间(t)的关系图正确的是 ( )
A. B. C. D.
分析:由金属活泼性可得,Mg >Al ,所以镁比铝图像要陡;
Mg ~ H 2 3
2Al ~ H 2 24 2 18 2 ∴成反比Al 产生氢气多,故选C 。
例4、由两种金属组成的混合物共20g ,与足量的稀盐酸充分反应后,共放出氢气1g ,则原混合物可能是( )
A 、Zn 和Cu
B 、Zn 和Fe
C 、Zn 和Mg
D 、Mg 和Al
分析:方法1:极值法 假设20g 全部是一种金属,应该放出氢气的质量如下
Zn ~ H 2 Cu 产生氢气为0 Fe ~ H 2 Mg ~ H 2 3
2Al ~ H 2 65 2 56 2 24 2 18 2
20g 1g 20g 1g 20g 1g 20g 1g
方法2:极值法 假设1g 氢气全部是一种金属产生的,应该需要的金属质量如下
Zn ~ H 2 无论多少铜都 Fe ~ H 2 Mg ~ H 2 3
2Al ~ H 2 65 2 不能产生1g 氢气 56 2 24 2 18 2 20g 1g 铜>20g 20g 1g 20g 1g 20g 1g 方法3:平均相对分子质量法:假设金属的化合价为+2
M ~ H 2 Zn ~ H 2 Fe ~ H 2 Mg ~ H 2 3
2Al ~ H 2 铜不产生氢气 x =40 2 65 2 56 2 24 2 18 2 认为相对原子 20g 1g 质量无限大
2、金属和盐溶液反应的规律:
(1)几种金属同时放入一中弱盐溶液中,活动性强的先反应(可以理解为弱的先被最强的赶走);一种金属放入几种弱盐的混合溶液中,先和最弱的盐溶液发生反应(可以理解为强的先赶走最弱的)。总之,隔得远的先反应。
如:将Zn 、Fe 同时放入CuSO 4溶液中,锌先和硫酸铜溶液反应,然后铁再和硫酸铜溶液反应。将Fe 放入Cu(NO 3)2和AgNO 3的混合溶液中,铁先和硝酸银溶液反应,然后再和硝酸铜溶液反应。
(2)金属与盐溶液的反应,若金属质量增加,则盐溶液质量减少,密度减小(溶液体积变化忽略不计);若金属质量减小,则盐溶液质量增大,密度增大(溶液体积变化忽略不计)。要根据对应的化学方程式,根据差量法进行判定。
例:在AgNO 3和Cu(NO 3)2的混合溶液中加入一定量的铁粉,充分反应后,过滤,下列情况不可能成立的是( )
A 、滤液成分为Fe 2+、Ag +和Cu 2+,滤渣成分为Ag
B 、滤液成分为Fe 2+和Cu 2+,滤渣成分为Ag 和Cu
C 、滤液成分为Fe 2+和Cu 2+,滤渣成分为Ag 、Cu 和Fe
D 、滤液成分为Fe 2+和Cu 2+,滤渣成分为Ag
分析:发生两个反应先后顺序为:Fe +2AgNO 3
2Ag +Fe(NO 3)2 ……① Fe +Cu(NO 3)2
Cu +Fe(NO 3)2 ……②
可能出现的情况:
(1)①中Fe 不足,②不发生。滤液:Fe 2+、Ag +和Cu 2+ 滤渣:Ag
(2)①恰好完全反应,②不发生。滤液:Fe 2+ 和Cu 2+ 滤渣:Ag
(3)①反应后,②中Fe 不足。 滤液:Fe 2+ 和Cu 2+ 滤渣:Ag 、Cu
(4)①反应后,②恰好完全反应。滤液:Fe 2+ 滤渣:Ag 、Cu
(5)①②反应后,Fe 过量。 滤液:Fe 2+ 滤渣:Ag 、Cu 、Fe 小结:分析反应后的成分问题,我们应该考虑生成什么,剩余什么.........。. 这种类型的题目,我们首先写出化学方程式,第一个反应一定发生,一定有Ag 和Fe 2+,其余成分只需考虑滤液和滤渣不发生化学反应即可。本题中C 选项Fe 能和Cu 2+反应,所以不可能出现该情况。
例2、把锌片分别插入一定浓度的足量FeSO 4、CuCl 2、AgNO 3三种溶液中,假定单位时间
内消耗Zn 质量相等,剩余的锌片和附着的金属质量(即固体质量)如图所示。则A 表示 溶液,B 表示 溶液,C 表示 溶液。 分析:Zn +FeSO 4
Fe +ZnSO 4 65 56 Zn +CuCl 2Cu +ZnCl 2
65 64 Zn +2AgNO 3
2Ag +Fe(NO 3)2 65 216
A B C 反应时间固
体质
量
