鸭瘟病毒(DPV)核酸检测试剂盒使用说明
新冠核酸检测试剂盒产品说明书

新冠核酸检测试剂盒产品说明书1. 引言新冠病毒(COVID-19)自2019年末在全球范围内爆发以来,已经造成了严重的公共卫生危机。
为了及时、准确地检测新冠病毒的感染情况,本公司开发了新冠核酸检测试剂盒产品,并特此出具本产品说明书。
2. 产品概述新冠核酸检测试剂盒是一种用于检测新冠病毒感染的重要工具。
该产品基于核酸检测技术,通过检测样本中的病毒核酸片段来确定是否感染了新冠病毒。
该产品具有以下特点: - 高灵敏度:能够在感染初期及时发现新冠病毒感染。
- 高特异性:能够准确识别新冠病毒并排除其他相关病毒感染。
- 快速检测:样本处理简便,检测时间短,结果快速可靠。
3. 适用范围本产品适用于医疗机构、公共卫生部门以及相关科研机构等场所进行新冠病毒感染的检测。
它可以用于急诊筛查、病例诊断、流行病学调查等用途。
4. 产品组成新冠核酸检测试剂盒由以下组成部分组成: 1. 核酸提取试剂盒:用于从样本中提取病毒核酸。
2. 核酸扩增试剂盒:用于扩增提取到的病毒核酸片段。
3. 荧光染料:用于标记扩增产物,并进行荧光信号检测。
4. 标准控制品:用于质控和检测结果的验证。
5. 检测步骤5.1 样本采集:采集患者咽拭子、鼻拭子或痰液样本,并将样本置于采集管中。
5.2 核酸提取:使用核酸提取试剂盒,按照说明书中的步骤进行核酸提取。
5.3 核酸扩增:将提取到的核酸样本加入核酸扩增试剂盒中,放入PCR仪中进行扩增反应。
5.4 荧光信号检测:将扩增产物与荧光染料混合,放入荧光检测仪中,测量样品中的荧光信号。
5.5 结果分析:根据荧光信号的强度判断样品中是否存在新冠病毒。
6. 结果解读本产品根据荧光信号的强度来判断样品中是否存在新冠病毒,具体结果如下: - 阳性结果:荧光信号强烈,说明样品中存在新冠病毒感染。
- 阴性结果:荧光信号弱或未检测到,说明样品中不存在新冠病毒感染。
- 无效结果:无论荧光信号强弱,均无法判断样品中是否存在新冠病毒感染,需重新检测。
病毒核酸纯化试剂盒说明书百度文库
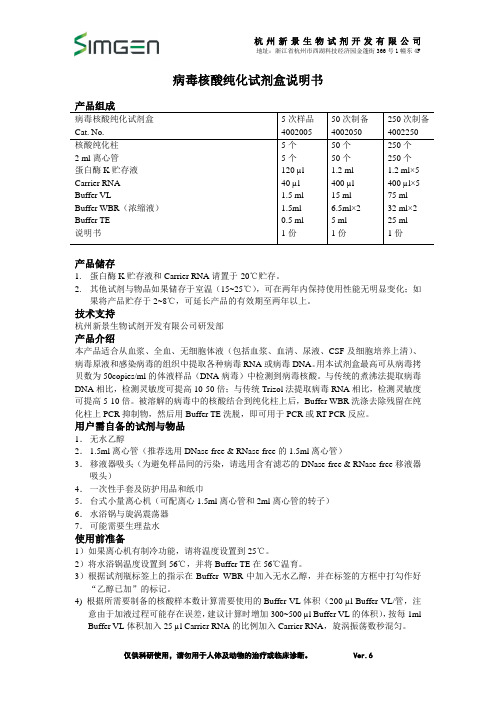
病毒核酸纯化试剂盒说明书病毒核酸纯化试剂盒Cat. No. 5次样品400200550次制备4002050250次制备4002250核酸纯化柱2 ml离心管蛋白酶K贮存液Carrier RNABuffer VLBuffer WBR(浓缩液)Buffer TE说明书5个5个120 µl40 µl1.5 ml1.5ml0.5 ml1份50个50个1.2 ml400 µl15 ml6.5ml×25 ml1份250个250个1.2 ml×5400 µl×575 ml32 ml×225 ml1份产品储存1.蛋白酶K贮存液和Carrier RNA请置于-20℃贮存。
2.其他试剂与物品如果储存于室温(15~25℃),可在两年内保持使用性能无明显变化;如果将产品贮存于2~8℃,可延长产品的有效期至两年以上。
技术支持杭州新景生物试剂开发有限公司研发部产品介绍本产品适合从血浆、全血、无细胞体液(包括血浆、血清、尿液、CSF及细胞培养上清)、病毒原液和感染病毒的组织中提取各种病毒RNA或病毒DNA。
用本试剂盒最高可从病毒拷贝数为50copies/ml的体液样品(DNA病毒)中检测到病毒核酸。
与传统的煮沸法提取病毒DNA相比,检测灵敏度可提高10-50倍;与传统Trizol法提取病毒RNA相比,检测灵敏度可提高5-10倍。
被溶解的病毒中的核酸结合到纯化柱上后,Buffer WBR洗涤去除残留在纯化柱上PCR抑制物,然后用Buffer TE洗脱,即可用于PCR或RT-PCR反应。
用户需自备的试剂与物品1.无水乙醇2.1.5ml离心管(推荐选用DNase-free & RNase-free的1.5ml离心管)3.移液器吸头(为避免样品间的污染,请选用含有滤芯的DNase-free & RNase-free移液器吸头)4.一次性手套及防护用品和纸巾5.台式小量离心机(可配离心1.5ml离心管和2ml离心管的转子)6.水浴锅与旋涡震荡器7.可能需要生理盐水使用前准备1)如果离心机有制冷功能,请将温度设置到25℃。
新冠检查试剂盒使用方法

新冠检查试剂盒使用方法新冠检查试剂盒是目前用于检测新冠病毒的重要仪器。
正确地使用试剂盒能够准确地确定感染的情况,有效地帮助防控疫情。
以下是新冠检查试剂盒的使用方法,以供参考。
1.准备好样本先准备好需要检查的样本。
常见的样本有咽拭子、鼻拭子、口腔拭子和红细胞沉降率等。
在采集样本时,要注意避免采集过程中的污染。
采样前,应保持双手干净,佩戴口罩、手套等防护用具。
2.使用试剂盒前准备在使用试剂盒前,需要准备好相关耗材,如试剂、探针等。
使用试剂盒需要保证所有仪器和材料都在有效期内,并且已经储存妥当,以避免因材料老化而影响检查结果。
3.打开试剂盒在准备好样本和试剂之后,打开试剂盒并按照说明书上的指示进行操作。
为了避免操作有误,应严格按照说明进行操作,确保每一步都正确地完成。
4.样本操作将样本加入试剂液中,使用试剂盒内的探针在样本中混合均匀。
注意不要使试剂液溅出或污染,以确保操作的精准性和安全性。
5.试剂盒的读取将试剂液放入仪器中,启动仪器进行读取。
在读取过程中,注意仪器显示的结果,并按照说明书上的建议进行后续操作。
具体结果需要参考说明书中的标准值。
6.严密保管材料在使用完试剂盒后,应将试剂盒内的材料密封恰当地保存。
为了避免材料污染或损坏,建议使用后立即弃用。
总之,正确使用新冠检查试剂盒是保证检测结果准确的关键。
使用试剂盒的时候,需要遵循相关操作指南,严格按照前述步骤进行操作。
如果有任何疑问,应及时咨询专业人员求助。
仅有正确地检测和筛查才能更好的控制疫情的传播。
核酸提取试剂盒说明书

核酸提取试剂盒说明书标题:核酸提取试剂盒说明书一、产品概述本产品是一款适用于各种生物样本的核酸提取试剂盒,能够高效、快速地从各种类型的样本中提取出高质量的DNA/RNA。
广泛应用于基因检测、分子生物学研究、疾病诊断等领域。
二、产品组成1. 核酸提取液A:用于裂解细胞和溶解核酸。
2. 核酸提取液B:用于去除蛋白质等杂质。
3. 洗涤液:用于洗涤核酸。
4. 乙醇溶液:用于沉淀核酸。
5. RNA酶抑制剂:防止RNA降解。
6. DNA/RNA分离柱:用于核酸的吸附和洗脱。
三、操作步骤1. 样本处理:根据样本类型进行相应的前处理。
2. 核酸提取:将处理后的样本加入到核酸提取液A中,涡旋混合后静置,然后加入核酸提取液B,再次涡旋混合并静置。
3. 细胞破碎与核酸释放:将混合液离心,取上清液转移到新的离心管中。
4. 去除杂质:向上述上清液中加入洗涤液,涡旋混合后离心。
5. 核酸吸附:将上清液转移到DNA/RNA分离柱中,离心吸附核酸。
6. 洗涤核酸:使用洗涤液对DNA/RNA分离柱进行洗涤,以去除剩余的杂质。
7. 核酸洗脱:加入适量的无菌水或TE缓冲液到DNA/RNA分离柱中,离心洗脱核酸。
8. 核酸保存:将提取出的核酸立即使用或-20℃保存。
四、注意事项1. 所有操作应严格遵守实验室生物安全规定。
2. 核酸提取过程中应避免产生气溶胶,以防交叉污染。
3. 提取后的核酸应尽快使用,长期保存时要避免反复冻融。
4. 试剂盒中的所有成分都应在室温下回温至室温后再使用。
五、质量保证我们承诺该产品经过严格的质量控制,如有任何质量问题,请联系我们的客户服务部。
六、联系方式感谢您选择我们的产品,如有任何问题或需要进一步的信息,请随时联系我们。
病毒检测试剂盒说明书

加上额外的损失量。可以用网状带,搅拌器,研钵或者其他的研磨装置研磨样品,如果使用 研钵和研杵在研磨不同的样品时要彻底的清洗干净。
试验步骤 1、加入样品:根据下载的表格,在每个样品孔内加入 100 微升样品液,在阳性对照样品孔 和提取液样品孔个加入 100 微升阳性对照和缓冲液。如果有阴性对照在阴性样品孔加入 100 微升阴性对照。 2、孵化酶标板:加完样品后,用小塑料袋将酶标板装好,放入室温孵化 2 小时或者 2-8 度 过夜。 3、准备酶标抗体溶液:注意:使用前 10 分钟准备酶标抗体溶液。 酶标抗体溶液时浓缩液,因此必须用酶标缓冲液稀释,建议的稀释比例在标签上,在专用的 容器内加入适量的酶标缓冲液。为了确保需要,1 毫升溶液用于 8 个样品孔,一个酶标板需 要 10 毫升缓冲液。然后根据标签比例加入酶标抗体。 举例:如果标签上写着 1:100,并且你准备 10ml 酶标抗体溶液,首先需要准备 10ml 酶标缓冲 液然后加入 100 微升抗体到缓冲液内。 加入抗体后,充分混匀,此步非常重要。 4、洗板:样品孵育完成后洗板,快速倾倒溶液到没有其他液体的水池或者废容器内。 每孔加入 200 微升的 1 倍 PBST,快速倒空酶联板,重复 7 次。 洗板结束后,在吸水纸上吸干残余液体。 检查酶联板,所有的样品孔没有样品残渣,如果还有样品残渣再重复洗板并吸干。 5、加酶标抗体溶液:向每个样品孔加 100 微升酶标抗体溶液。 6 孵育酶标板:室温条件下在湿润的箱子中孵育 2 小时。 7、准备底物溶液:每份底物基片能配置 5 毫升底物溶液,浓度为 1 毫克每毫升,大约够 5 排 8 个样品孔。 大约孵育完成前的 15 分钟,为每个基片量取 5 毫升室温下的 1 倍缓冲液,不能直接用手接 触基片,加基片到缓冲液里。 注意:不能接触基片或者底物溶液暴露在强光下,光及污染会使阴性对照的背景颜色加深。 8、洗板:如前面,用 1 倍洗液洗板 8 次。 检查样品孔存在的气泡,用吸水纸巾吸干残存的液体及气泡,如果还有气泡存在可以用干净 的吸头扎破。 9、加底物溶液:每个样品孔加 100 微升底物溶液。(此步要快,保证显色时间一致) 10、孵育酶联板:闭光孵育酶联板 60 分钟。 11、结果判读:肉眼判断或用酶标仪在 405 纳米读数。在光线下存在气泡会改变测试结果, 因此建议在读数前消除气泡。 样品孔的颜色可以判定测试结果。样品孔的颜色不明显判定为阴性,判定结果只有在阳性对 照颜色明显,缓冲液无色的条件下才有效。 结果可能在孵育 60 项 禁止皮肤或者眼睛直接接触,或吞咽其有效成分。为误食该试剂应了解注意事项,用过该试 剂之后要彻底的冲洗双手。
新冠测试盒怎么用

新冠测试盒怎么用
1. 仔细阅读使用说明,检查试剂盒包装以及有效期,如有破损或过期等,需要立即更换;
2. 清洁双手,清洁鼻腔;
3. 打开包装,取出鼻拭子、采样管、检测卡等物品分别摆放好;
4. 头稍后仰,手持鼻拭子缓缓深入一侧鼻腔,进入1-1.5厘米后贴鼻腔旋转至少4圈,然后用同样手法对另一侧鼻腔进行操作,中间不需要更换鼻拭子;
5. 将鼻拭子插入样本提取管中,在断点处折断拭子,拧紧盖子静置一分钟;
6. 将提取管顶部的透明盖取下,向加样孔中滴入4滴样本液,10-15分钟内可以观察结果。
鸭 瘟(DP)

4、流泪和眼睑水肿:特征性病变。病初留 浆液性、后流粘性或脓性分泌物,常将眼 睑粘连不能睁开。严重者,眼睑肿胀翻于 眼外。 5、部分病鸭头颈部肿胀,俗称“大头瘟” 或“肿头瘟”。 6、鼻腔流出分泌物,呼吸困难,有鼻塞音, 叫声嘶哑。 7、小鸭死亡前出现神经症状。
DPV在9-12日龄鸭胚和13-15日龄鹅胚中生 长繁殖和连续传代,于接种后4-5d可致胚 胎死亡,在致死胚中可见胚体水肿、充血、 出血,最具特征的是肝脏有灰白色坏死灶。 DPV对外界抵抗力不强,怕热, 56℃10min失去感染力,夏季直射9h失去 感染力。
(二)流行病学
(三)临床症状
(六)防制措施
1、避免从疫区引进鸭苗和种蛋鸭; 2、禁止在鸭瘟流行区域野水禽出没区域放牧; 【处方1】预防用 鸭瘟鸭胚化弱毒苗雏鸭20日龄首免,4-5月龄二 免 【处方2】 鸭瘟高免血清 1ml 用法:1次皮下或肌内注射 说明:也可用抗鸭瘟高免卵黄抗体2ml,皮下或肌内注射。
鸭 瘟(DP)
一、概 述
鸭瘟(DP)是由鸭瘟病毒引起的鸭、鹅及 其他雁形目禽类均可发生的一种急性、败 血性传染病。本病流行广泛、传播迅速、 发病率和死亡率在90%以上。又称为鸭病 毒性肠炎。
(一)病 原
鸭瘟病毒(DPV)为疱疹病毒科疱疹 病毒属的滤过性病毒,双股DNA,有 囊膜,无血凝特性。 鸭瘟病毒广泛存在于病鸭体内的各组 织、器官、分泌物及排泄物中,以肝、 脾、脑中含病毒量最高。
朝云帆病原微生物抗原定量检测方法

病原微生物抗原定量检测试剂盒使用说明
检测方法1(快速检测):
1、从试剂盒中取1个铝箔袋撕开,取出试纸卡、吸管、棉签,试纸卡水平放置
(或者直接圆头插入荧光检测仪);
2、从配套缓冲液中取1瓶溶液旋开瓶盖,将棉签插入犬肛门内(犬瘟在眼角内)
轻转3下,再将棉签在小瓶缓冲液中充分搅拌,将棉签在瓶壁挤压后丢弃;
3、用吸管从小瓶上层液体中吸取少量样品溶液,缓慢滴加4滴于试纸卡的加样
孔(小孔),滴加结束后即刻启动秒表计时,试纸卡静置15分钟(期间别挪动试纸卡),在仪器上选择该试纸卡对应批次试剂盒的标准曲线(或者直接插入试剂盒中标曲芯片);
4、倒计时结束时将试纸卡的圆头插入荧光检测仪,启动检测,检测完成后将显
示样品中病毒的浓度,按打印键即打印报告。
检测方法2(标准检测):
1、从试剂盒中取出标曲芯片,插入荧光检测仪(或者在仪器上选择该试纸卡对应批次试剂盒的标准曲线),选择标准测试,从试剂盒中取1个铝箔袋撕开,取出试纸卡,圆头插入荧光检测仪;
2、从配套缓冲液中取1瓶溶液旋开瓶盖,将棉签插入犬肛门内(犬瘟在眼角内)轻转3下,再将棉签在小瓶缓冲液中充分搅拌,将棉签在瓶壁挤压后丢弃;
3、用吸管从小瓶上层液体中吸取少量样品溶液,缓慢滴加4滴于试纸卡的加样孔(小孔),滴加结束后即刻启动标准测试,荧光检测仪将自动进入倒计时;
4、倒计时结束时荧光检测仪将自动开始检测,检测完成后将显示样品中病毒浓度,按打印键即打印报告。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
鸭瘟病毒(DPV)核酸检测试剂盒使用说明
Diagnostic Kit for Duck Plague Virus DNA
货号:D6081
规格:48份/盒
保存:-20℃±5℃,避光保存、运输、反复冻融少于5次,有效期12个月。
产品内容:
名称规格
核酸提取液 1.5ml×2管
DPV反应液 1.05mL×1管
DPV阳性质控品50μl×1管
阴性质控品250μl×1管
说明:不同批号的试剂盒组分不可交互使用。
产品说明:
鸭瘟病毒(DPV)核酸检测试剂盒适用于检测从病鸭血液、口腔伪膜及溃疡处粘液、肝、脾、肾等组织样品等标本中分离出的鸭瘟病毒DNA,用于鸭瘟病毒的辅助诊断,其检测结果仅供临床参考。
鸭瘟病毒(DPV)核酸检测试剂盒用一对鸭瘟病毒特异性引物,对鸭瘟病毒DNA进行体外扩增检测,用于临床上对可疑感染者的病原学诊断。
所需仪器:PCR仪、电泳仪、紫外凝胶成像仪等
标本采集:在发病早期,无菌采集病鸭血液或刮取口腔伪膜及溃疡处粘液;在动物死亡后,无菌采集肝、脾、肾等组织样品。
保存和运输:上述标本短期内可保存于-20℃,长期保存可置-70℃,但不能超过6个月,标本运送应采用2~8℃冰袋运输,严禁反复冻融。
使用方法:
1.样品处理(样本处理区)
1.1样本前处理
组织样品:每份组织分别从3个不同的位置称取样品约1g,手术剪剪碎混匀后取0.05g 于研磨器中研磨,加入1.5mL生理盐水后继续研磨,待匀浆后转至1.5mL灭菌离心管中,8000rpm离心2min,取上清液100uL于1.5mL灭菌离心管中;粘液直接取100uL提取。
1.2DNA提取
对上述处理好的标本加入等体积核酸提取液(固体标本加入50uL核酸提取液),100℃恒温处理10分钟,13,000rpm离心5分钟,取上清液转移至新的1.5mlEP管,-20℃保存。
2.试剂配制(试剂准备区)
根据待检测样本总数,设所需要的PCR反应管管数为N(N=样本数+1管阴性
对照+1管阳性对照;样品每满7份,多配制1份),每测试反应体系配制如下表:
试剂DPV反应液
用量(样本数为N)21μl
3.加样(样本处理区)
将步骤1提取的DNA、阳性质控品、阴性质控品各取4μl,加入相应的反应管中,盖好管盖,混匀,短暂离心。
4.PCR扩增(核酸扩增区)
4.1将待检测反应管置于PCR仪反应槽内;
4.2推荐循环参数设置:
步骤循环数温度时间11cycle94℃2min
235cycle 94℃30sec 58℃30sec 72℃30sec
反应体系为25ul;
5.电泳检测
1)2%琼脂糖凝胶配制:秲释50倍TAE缓冲液至1倍(取20ml50倍TAE,加980ml双蒸水至1L),称4g琼脂糖放于500mL锥形瓶中,1倍TAE缓冲液200ml,置入微波炉中加热熔解(避免加热沸腾溶液外溢),再加入10μl染料充分混匀。
在电泳槽内放好梳子,倒入琼脂糖凝胶,待凝固后使用。
2)电泳:用移液器取PCR扩增产物10μl于琼脂糖凝胶孔中,以5V/cm电压,1倍TAE缓冲液中电泳,紫外灯下观察结果。
6.结果判定
阳性质控品出现446bp条带,阴性质控品不出现条带或出现片段较小的引物二聚体条带,实验结果成立。
被检样品出现446bp条带,判断为阳性,否则为阴性。
注意事项:
所有操作严格按照说明书进行;
试剂盒内各种组分使用前应自然融化,完全混匀并短暂离心;
反应液应避光保存;
反应中尽量避免气泡存在,管盖需盖紧;
使用一次性吸头、一次性手套和各区专用工作服;
样本处理、试剂配制、加样需在不同区进行,以免交叉污染;
实验完毕后用10%次氯酸或75%酒精或紫外灯处理工作台和移液器;
试剂盒里所有物品应视为污染物对待,并按照《微生物生物医学实验室生物安全通则》进行处理。
