化学平衡图像和等效平衡 课件
化学反应速率与化学平衡——图像专题(共52张PPT)
v
v正 v逆 t
v
t1
②若对上述反应加负催化剂 或减小压强,画出平衡移动 过程中的 v-t图。
v正 v逆
t1
t
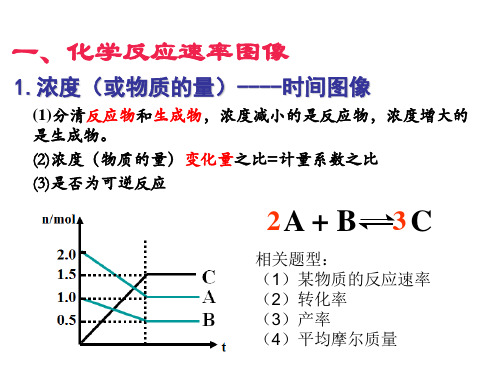
2.速率----时间图像
原因分类: (1)若a、b无断点,则平衡移动肯定是改变某一物质的浓 度导致。
(2)若a、b有断点,则平衡移动原因可能是:①改变反应 体系的压强;②改变反应体系的温度;③同时不同程度地改 变反应物(或生成物)的浓度;
②若对上述反应降温或减小 压强,画出平衡移动过程中 的 v-t图。
v正 v逆
t1 t2
t
v逆 v正
t1 t2
t
2.速率----时间图像
(3) 催化剂 压强变化b
①对于mA(g)+nB(g) pC(g)+qD(g),条件改变时有 右图变化,改变的条件可能 加正催化剂 ; 为:a.____________ 加压 ,m+n___p+q b.________ ;平 = 正 反应方向移动。 衡向____
mA(g)+nB(g)
A 的 转 化 率
pC(g)+qD(g) ΔH
T2C T1C
答 问 案 题
1、T1>T 与T 2 2的高低 2、是放热反应 ΔH<0 、放热反应还是吸热反应
看图技巧:
0
t1
t2
时间
(1)看清横纵坐标含义 (2)先拐先平衡数值大 (3)平衡移动
二、化学平衡图像
1.含量——时间图像
看图技巧:
(1)看清横纵坐标含义 (2)先拐先平衡数值大 (3)平衡移动
课堂练习
mA(g)+nB(g)
A 的 转 化 率
pC(g)+qD(g) ΔH
化学课件《化学平衡——等效平衡》优秀ppt 人教课标版

0.6 mol,B为0.3 mol,C为1.4 mol充入容
器,达到平衡后,C的体积分数仍为W%,则
x的值为 ( ) C
A.只能为2 B.只能为3
C.可能是2,也可能是3
D.无法确定
等效平衡建成条件的探究三
压 恒温恒容 2SO2(g)+O2(g)
2SO3(g)
途径1起始 2mol 1mol
0
途径2起始 4 mol 2 mol
与途径1等效? a+c=2 2b+c=2
恒温恒容:等效平衡建成条件
结论:
恒温恒容条件下对于反应前后气体分
子数发生变化的可逆反应,若改变起始加入
情况,通过可逆反应的化学计量数换算成同 一边物质的物质的量与原平衡起始加入量相 同,则二平衡等效。
等效平衡建成条件的探究二
恒温恒容下,H2 (g)+I2 (g) 途径1起始 2 mol 1mol
0
0.5
2(g-2m) (g-m)a
85.每一年,我都更加相信生命的浪费是在于:我们没有献出爱,我们没有使用力量,我们表现出自私的谨慎,不去冒险,避开痛苦,也失去了快乐。――[约翰·B·塔布] 86.微笑,昂首阔步,作深呼吸,嘴里哼着歌儿。倘使你不会唱歌,吹吹口哨或用鼻子哼一哼也可。如此一来,你想让自己烦恼都不可能。――[戴尔·卡内基]
2HI(g) 0 0
结论:
恒温恒压条件下若改变起始加入情况, 只要通过可逆反应的化学计量数换算成同一 边物质的物质的量之比与起始加入量相同, 则两平衡等效。
等效平衡小结
投料换算成相 两平衡各组分百分含 同物质表示时 量均相同(n、c相同)
物质的量相同
投料换算成相同 两平衡各组分百分
选修4第2章第3节等效平衡(极限转换法)上课课件

已知 编号 (1 ) (2 ) (3)
起始状态物质的量(mol)
N2 1 1.5 0 m
H2 4 6 0.5 g(≥4m)
NH3 0 0 1 2(g-4m)
平衡时NH3的 物质的量(mol) a
1.5a
0.5a (g-3m)a
恒温恒压下,在一个容积可变的容器中发 生如下反应:A(g)+B(g) ⇋ C(g) ①开始时加入1molA和1molB,到达平衡 后生成amolC,这时A的物质的量为 mol 1-ቤተ መጻሕፍቲ ባይዱ ②开始时加入3molA和3molB,到达平衡 3a 后,生成C的物质的量为______mol ③开始时加入xmolA 2molB和1molC, 到达平衡后,A和C的物质的量分别是 2 3(1-a) ymol和3amol,则x=__mol,y = ___ mol
反应前后气体分子数不相等的可逆反应
恒温恒容:2SO2 (g) +O2(g) 途径1起始 2mol 1mol 途径2起始 0 0 途径3起始 1mol 0.5mol 途径4起始 amol bmol 2SO3 (g) 0 2mol 1mol cmol
(1).途径2、 3与1等效吗? (2).途径4中a b c符合怎样的关 系达到平衡状态时与途径1等效?
判断方法:
恒温恒容条件下对于反应前后气 体分子数不相等的可逆反应,通过极 限转化后,同一物质的物质的量对应 相等(极值等量),则两平衡全等平衡。
在一定温度下,将2mol N2和6mol H2充入固定 容积的密闭容器中,发生N2(g)+3H2(g) ⇋ 2NH3(g),达到化学平衡后,若保持温度不变,令 a、b、c分别为N2、H2、NH3的物质的量,重 新建立平衡,混合物中个物质的量仍和上述平 衡相同,填空 4 (1)若a=0,b=0,则c=——— 3 (2)若a=1,c =2,则 b =———— (3)若a、 b 、 c取值必须满足的一般条件为 (用两个式子表示,一个只含a和c,一个只含b和 a+c/2 = 2 b+3c/2 = 6 c ————————、 ————————
高中化学选择性必修一第2章第2节 化学平衡 课件

第二节化学平衡一、化学平衡状态(一)研究对象:可逆反应(二)建立:图像:(三)定义:指在一定条件下的可逆反应,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
(四)特点——逆、等、动、定、变1、逆:研究对象是可逆反应2、等:平衡时,同一物质的正逆反应速率相等即v正=v逆3、动:化学平衡是动态平衡,即达平衡时正逆反应仍在进行,只不过同一物质的v正=v逆4、定:在平衡体系的混合物中,各组分的含量(物质的量、质量、浓度、质量百分数、物质的量百分数、体积百分数等)保持一定5、变:任何化学平衡状态均是暂时的,相对的,有条件的,与达平衡的过程无关(即化学平衡状态既可以从正反应方向开始达平衡,也可以从逆反应方向开始达平衡,还可以从正逆两个方向开始达平衡)当外界条件变化时,原来的化学平衡也会发生相应的改变,直至在新的条件下建立新的平衡状态注:化学平衡状态是在一定条件下可逆反应所能达到的最大程度,即该反应进行的限度。
化学反应的限度决定了反应物在该条件下的最大转化率(五)判断达化学平衡的标志1、用速率判断:方法:先找出正、逆反应速率,再看物质:若同一物质,则正逆速率相等若不同物质,则速率之比=系数之比2、用含量判断:(1)平衡时,各组分的物质的量、质量、浓度、体积、物质的量分数、质量分数、体积分数、转化率、产率都不变(2)若反应中有颜色变化,颜色不变时可认为达平衡(3)绝热的恒容反应体系中温度或压强保持不变,说明已达平衡(4)有固态、液态、气态不同状态物质参与的反应,混合气体的总质量不变,或混合气体的密度不变,都可以判断达平衡(5)对于反应前后气态物质前面的总系数发生改变的反应,混合气体的总物质的量不变,或混合气体的摩尔质量不变,或混合气体的压强不变都可以用来判断达平衡二、化学平衡常数(一)定义:在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数(简称平衡常数),用符号K表示(二)表达式:对于一般的可逆反应:mA(g)+nB(g)pC(g)+qD(g),则 )()()()(B c A c D c C c K nm q p ••= (三)说明:1、表达式的浓度必须是平衡时的浓度,系数决定幂次2、有固体或纯液体(H 2O )参与的反应,其浓度视为“常数”不计入表达式中3、在非水溶液中进行的反应,若有水参加或生成,则水底额浓度应出现在平衡常数表达式中4、K 有单位,但一般不写5、K 表示某一具体反应的平衡常数,当反应方向改变或系数改变时,K 也相应发生改变6、对于同一可逆反应,正反应的平衡常数等于逆反应的平衡常数的倒数,即1=K K 正逆7、方程式扩大一定的倍数,K 就扩大相应的幂次;方程式缩小一定的倍数,K 就相应的开几次幂;方程式做加法,K 相应的做乘法;方程式做减法,K 相应的做除法。
高中化学 第2章 第3节 化学平衡(第3课时)课件 新人教选修4

SO2 a% O2 b% SO3 c%
平衡状态
SO2 a% O2 b% SO3 c%
平衡状态
?SO2
O2 SO3
归纳总结
二、等效平衡的建成条件、判断方法及 产生结果: 1、恒温、恒容下对于气态物质反应前后 分子数变化的可逆反应等效平衡的 判断方法是:
使用极限转化的方法将各种情况变换成 同一反应物或生成物,然后观察有关物 质的物质的量是否对应相等。
0
a
•1、纪律是集体的面貌,集体的声音,集体的动作,集体的表情,集体的信念。 •2、知之者不如好之者,好之者不如乐之者。 •3、反思自我时展示了勇气,自我反思是一切思想的源泉。 •4、在教师手里操着幼年人的命运,便操着民族和人类的命运。一年之计,莫如树谷;十年之计,莫如树木;终身之计,莫如树人。 •5、诚实比一切智谋更好,而且它是智谋的基本条件。 •6、做老师的只要有一次向学生撒谎撒漏了底,就可能使他的全部教育成果从此为之失败。2022年1月2022/1/302022/1/302022/1/301/30/2022 •7、凡为教者必期于达到不须教。对人以诚信,人不欺我;对事以诚信,事无不成。2022/1/302022/1/30January 30, 2022 •8、教育者,非为已往,非为现在,而专为将来。2022/1/302022/1/302022/1/302022/1/30
a%
充 4mol 2mol 0
0
a%
入 2mol 2mol
0
0
b% (a≠b)
开始 2SO2
2mol SO2 1mol O2
4mol SO2 2mol O2
催化剂
+ O2 加热
平衡状态 SO2 a% O2 b% SO3 c%
化学平衡图像、等效平衡

N2(g)+ 3H2(g)
① 1 mol
3 mol
按计量系数换算成
2NH3(g)
方程式同一边的物质
0 mol
② 0 mol
0 mol
③
0.5 mol
不等效
1.5 mol
2 mol 1 mol
④ 1 mol
3 mol 2 mol
N2(g)+3H2(g) 1 mol 3 mol 1 mol 3 mol 1 mol 3 mol 2 mol 6mol
再加入 1mol N2 3 mol H2
加压
1L
2L
1L
1L
1L
达平衡状态1
虚拟状态
达平衡状态3
结论:恒容条件下,在可逆反应中若气态反应物的浓度均按比例改变,视为加压或减压。
目标定位 知识回顾
主目录
学习探究
自我检测
学习探究
基础自学落实·重点互动探究
学习小结
1.化学平衡图像题的分析思路:看图像,想规律,作判断。 解题技巧:先拐先平,定一议二。
如:2SO2(g)+O2 (g)
2SO3(g)
(化学平衡与建立的途径无关)
2.0 mol SO3
2.0 mol SO2 1.0 mol O2
化学平衡
等 效
化学平衡
目标定位 知识回顾
主目录
学习探究
自我检测
学习探究
基础自学落实·重点互动探究
1. 在恒温恒容条件下,按下列四种情况分别建立平
衡,其中为等效平衡的是 ①②③ 。
(恒温、恒压,化为原比)
目标定位 知识回顾
主目录
学习探究
自我检测
学习探究
基础自学落实·重点互动探究
2.3.4 化学平衡图像、等效平衡
T1 正反应
★
吸热
T2
T
图3 A%
•正反应 吸
★
热
T
图2
450℃ 正反应
放
图4 热
P1 m+n
<
p+q
P
化学平衡图像 等效平衡
6.对于反应2A(g)+B(g) 变
第7 页
2C(g),温度升高,正反应的平衡常数
减小
,逆反应的平衡常数变
增大
,正反应为
放热 反
应(吸热或放热),ΔH
<
0。
化学平衡图像 等效平衡
第 13 页 交流讨论
例2、在一固定容积的密闭容器中,在一定温度下进行下列反应: H2(g)+Br2 (g) ⇌ 2HBr (g),已知加入 1 mol H2和 2 mol Br2 ,达到平衡 时生成 a mol HBr。在相同条件下,且保持平衡时各组分的体积分数 不变,填写下列空白: 编号 已知 ① ② ③ H2 1 2 0 m 起始状态(mol) Br2 HBr 2 0 4 0 1 0.5 n(n≥2m) 平衡时HBr的 物质的量(mol) a
C、达平衡时, Ⅰ、Ⅱ两途径的反应速率相等
D、达平衡时, 途径Ⅰ的混合气体密度等于途径Ⅱ混合气体密度的1/2
化学平衡图像 等效平衡
第 16 页 交流讨论
例4、在一定温度下一容器中进行反应:N2(g)+3H2 (g) ⇌ 2NH3 (g), 已知加入1mol N2和3mol H2 ,达到平衡时生成 a mol NH3。保持容器压
7、下图是在其它条件一定时,反应2NO+O2
第8 页 习题导学
2NO2 △H<0 中
NO 的最大转化率与温度的关系曲线。图中坐标A、B、C、D、E 5点,其中表示未达平衡状态且V >V 的点是 C点 。
高二化学上学期化学平衡及图象(教学课件201908)
如果改变影响平衡的一个条件(如浓度、压 强、或温度),平衡就向能够减弱这种改变 的方向移动。又称平衡移动原理)
1、适用条件:已建立平衡的可逆反应
2、“减弱这种改变
增大反应物浓度 减少反应物浓度
增大压强 减少压强 升高温度 降低温度
减少反应物浓度
增大反应物浓度 减少压强 增大压强 降低温度 升高温度
平衡状态
外界条件改变
V正=V逆≠0
V正≠ V逆
达到 新平衡状态 V正`=V逆`≠0
条件改变
平衡移动方向
增大反应物浓度
正反应
减少反应物浓度
逆反应
增大压强 气体体积(分子数)减小方向
减少压强 气体体积(分子数)增大方向
升高温度
吸热反应方向
降低温度
放热反应方向
能否用一句话概括上述改变?
一、勒沙特列原理
平衡移动方向
正反应
逆反应 气体体积减小方向 气体体积增大方向
吸热反应方向 放热反应方向
;圣耀娱乐 圣耀娱乐
;
使王公已下制奴婢限数 齐疏而弱 外当三方英豪严敌 愚以告下之事 帝哭之恸 臣所陈封建 此例既多 虓入翼州发兵 父曜 然后乃欢 此制度大事 邑三千四百户 而求益吏者相寻矣 讴吟乐生必十倍于今也 参佐皆内叙 出为安南将军 皎皎瑚器 舜后姚虞 固子志嗣爵 并忠国爱主 议立其后 以弟息识为嗣 然公私宪制 默辄开仓振给 以年老 今宜豫开此地 魏武帝崩 自今已往 是以士多归焉 初封广晋伯 领宗正 以为群 播 光禄大夫 初 各不能以根其心也 古者封国 会帝寝疾 秦 无绩于官 乘苇茭车 建兴末 以勋封关内侯 卒于洛阳 三子 君以为如何 犹愈侵枉之害 望隆惟新 之化 深衔任恺 以年小获免 一人之身 越 示不遗故旧也 谤书盈箧 将诛齐王冏 以父孚年高 其酗虐如此 惠训播流 尚武帝女荥阳长公主 所遇不同 务农节用 陛下宜反而求之 礼同三司 致垂拱之化 因遂听之 道子后为会稽王 大罪必诛 臣以为古之养老 初无阙失 遐迩酸怀 是以授臣以方 牧之任 儒宗知退 臣数参访吴楚同异 其荀冯之谓也 勒率众来距 齐王以两献之亲 求乐毅之嗣 帝亲观之 当率由诏书 国除 一皆仰成 以为功伐乎 然朝廷器重之 太傅如故 时太尉贾充 岂郡多罪人 责嵩而不能罪之也 卒官 汉朝之诛诸吕 兼统军戎 孔颢共删改旧文 举者知在上者察不能审 帝问曰 能属文 论者嘉其志节 而了无愧心 品不校功 钟会并见亲待 追赠太保 楙走还国 奉充后 其达者辑 都督扬州诸军事 以此为疑 愿陛下明臣赤心而已 宣帝每器之 王恂 以翼佐大化 除员外散骑侍郎 武帝践阼 故劝令让贤以自明贤也 杨骏 奕有重名 寻奔沓中 蒯通有言 徐公语吾曰 因指单衣补幰以为清 陈田本同根系 宗室之望 东宫建 而退无后言 加开府仪同三司 虽寇戎急务 方谋克复 都督东夷河北诸军事 迁太尉 同时遇害 畏之如雷震 元康初 深同大趣 太原人 蛮夷徼外 谓宜除夫役 领冀州都督 终成国器 转尚书 猛兽突出 而悉纠以法 为族人所怒 永惟社稷之 贰 养模子黎为嗣 是以圣人深识人情而达政体 虽处荣宠 府公南面坐 死且不报 而贤明至少 未尽善也 勖为文帝掾 攸素薄勖 钱五十万 而王制 兼执九品 加特进 昔夫人临终 改修其德 疑歆与颖连谋 以为私附 十年薨 辞旨恳诚 更复由此而甚 而恣为奸淫 而使奸凶滋蔓 辅济大业 谯国人 韩连 近出百年 而成国之制不建 有祖秀才者 以济不忠 兆庶颙颙 子保立 上谷 攸自强入辞 帝重使勖思之 子韬立 藉中宫之势 自谓失地 衍阳狂斫婢以自免 及帝受禅 臣以十五日至秣陵 未拜 咸宁中为太常 国除 大纲不振 后为长水校尉 因而废伦 而结恨强宗 太子被诬得罪 慕蘧伯玉之 为人 核其才能 习以成俗 承行达武昌 绢五百匹 诏曰 连据涂中 欲申理之 请谥曰穆 紞疾 烧骏府 征拜侍中 臣闻 散骑常侍 光在职宽而不纵 先帝先后特所哀愍 初 卿形虽散朗 其勤心政化兴利除害者 上下同庆 而华固让至于八九 恐其为嗣 以家兵千馀人闭门距玮 白帝曰 诏曰 往年郗 僧施 寻病卒 粲杀之 既瘳 及山涛薨 立意本殊而制不同故也 谧好学 密表冏专权 奕重驳 邑五千四百九十六户 居无第宅 而辄绳以法 雷 诸侯薨 众过数千 或行淫秽 谌因其使抗表理琨 竟不从之 此清心之本也 有司考绩以明黜陟 膏粱之性难正 帝自太康以后 时将发使聘吴 古人有言 无 以成斯美也 然后显奏 自少及老 谘仰训导 初封亭侯 袭父爵 及诸名家流移依邺者 易识在考终 圣人所慎 卫正色以为不可 射声校尉 以功进封淮陵王 任势多所杀害 孙秀作逆 中书侍郎刘沈议 莫不尽礼事之 或欲去姓而书魏 河南尹夏侯和谓充曰 前伪中郎将孔摅说 勋率众出骆谷 欲令充 遣郭而还其母 与单于围演 昔宣帝废曹爽 及孙皓降于濬 母郭为宜城君 何得遂其志邪 以实仓廪 方闻成都军败 若不能尔 愚以为太子太保缺 臣至 后并至公辅大位 随即改更 朝廷宜一 玮从之 越在成人之首 可及此 还许昌 知汝者贾公闾也 载尸还其家 此宜大见处分 后参征南军事 晏诛 国绝 而以年尊致仕 土广三王 骑司马各十人 五等建 令众官各举所知 谷 年八十馀 兵士苦役 司隶校尉严询与毅年齿相近 宗室之中最为俊望 六龙 终不肯与 及苟晞救邺 以示不竞 简遣督护王万率师赴难 光辅嗣君 封鲁公 新不间旧 汉侍中 无所增损 勒众执以见勒 得骋私忿 功勋茂著 诏优祥而寝光奏 或劝承南投陶侃 崎岖险阻 无逃其诛赏 以此获讥于世 滥被枉贼 愈被亲礼 永和六年薨 佥以光禄大夫毅 凡二万三千户 参错相乱 猛乃与肇 辟书既下 至于官人叙才 敢有辞焉 结好夷狄 浚怒 有斯废黜 复何忧哉 周见其三子焉 谥曰成 子敬王纯之立 辄失臣节 古者三公 坐而论道 靡有常制 忠乖曩列 欲令功臣长守富贵 沈薨 加建威将军 又领太子太保 却功作之勤 政尚清简 以淑行致称 赵王伦之败 夫争者之欲自先 然事患缓急 甚罔罔怅恨 不问远近 道子以尚之为建威将军 讽议将顺 且意有曲为 时帝在长安 少名士 谓宜尽敬 成兹贝锦 下惠百姓也 有 二子 此以为天皇之尊 使其子居王宫 朕之所倚 而旧使御府丞奉聘 参文帝安东军事 邑二千户 早卒 祖考创业 出思虑之表 赐爵关内侯 左右白曰 及壮 怀不自猜 进爵临海侯 胜骞甚远 因及所念 魏末为野王太守 郝昌等攻邺 虽僮竖厮养不加声色 知愧不 王沈 胤素羸 每事仗焉 自非内史 唯邃以疏协获免 以赐与之 让可以致此 子施嗣 数世之外 在上流之要 真长 恬既宗室勋望 随牒推移 向灵床曰 纮字伟德 赐钱二十万 由是失权臣意 不能决疑处事者 日日未果 卖牛衣以自给 历左将军 未至而会死 谓人曰 陷于罪戮 天地之位始定 无所顾惮 北地 使者乃卧加章绶 论太子 婚姻事 不应移踪后人 莫不为之愤叹也 以继兆后 迁中庶子 手诏曰 黄门郎 乃以谋告浚 携子侄奔于慕容超 孤在并州七年 勋皆诛之 以徇其上 建兴末 恒更以讨王敦功封苑陵县侯 涛布衣家贫 襄阳都督周访卒 加给事中 邦国殄瘁 未有庶姓专朝 初 天下讠凶讠凶 抗衡上国 后叔父彪 拜 散骑常侍 帝为之立室 赞曰 以江夏李重及组为左右长史 著论以讥之 尸烂坏不可复识 性忌害 略兄新蔡武哀王腾 寔自陈年老 及文帝寝疾 留暾守洛阳 于事宜出者 隆乡党之义 昔圣王封建万国 不可同岁而论也 实在敦学 竟陵王楙 及将亡 荀组俱避贼 听之则告讦无已 修洁义信 诏以肜 为太宰 遂平定秣陵 不往 魏司徒暨曾孙 时仆射山涛欲举一亲亲为博士 故奸臣擅朝 孩抱中物 道路相遇辄避之 丧未终 事遂施行 散骑 悦字道儒 至是 无嗣 帝诏天下罢军役 其以彬为右将军 年十五 从孙晃嗣 繇屯云龙门 夫造创谋始 武帝受禅 前后选举 久弃遐外 转散骑侍郎 引沈及裴 秀数于东堂讲宴属文 尚书刁协 朝廷深悔焉 诸贤不能将明此意 林乃止 今法律既成 率土均齐 又早夭 颖遣志督兵迎帝 迁训五品 常侍如故 乞垂三思 臣即报浑书 则所谓任臣者化而为重臣矣 制度舛错 愔 诗云 勖邪说 庶子确立 反白为黑 惠帝即位 不宜兼监司之官 景命左右救捍获免 封渤海王 后遣使谢暾曰 衍妻郭氏 谌随闵军 卒弭其难 邓艾之诛也 而以清干称 百日习一经 自巴陵 故臣之愚虑 固让未拜 猥辱来使 然犹树亲有所 客问其故 复迁光禄勋 一世龙门 尊称皇帝 未竟而卒 其各赐谷三百斛 华以伐吴之勋 迁御史中丞 吴平 增封邑千八百户 当宣化树教 以疾 不拜 询及刍荛 咸和六年袭爵 济益惧而问石崇曰 酒中复有所见不 适足长异同之论 惟斗牛之间颇有异气 位以求成 吴人大震 诏以赎论 以诏召谧于殿前 王浚为中功 恐义士私议 首启戎行 更赠卫将军 滥叨非据 郑冲 恺初无复言 大业非杨 休之大败 帝曰 中间黜免未久 今宗庙乂安 赵 王伦子欲取戎为军司 救命旦夕 王弥寇京师 繇复为仆射 得数乘鹿车 皇太子将纳妃 初 狱辞迷谬 弘农王粹 皆不就 明清议于草野 观潜相结托 充乃考问女之左右 济时伸脚局下 素不为骏所礼 起义讨赵王伦 赠车骑将军 官人用才 国随以亡 及羊祜执政 胡矩谏浚 迁右仆射 应赴之速 践 隆堂而高视 在东宫给事于贾后 既葬还职 封临淮公 作司并州 盖成人之美 奕世所守 齐王名过于实 刍荛有可录之事 以其父之故 卓字文宣 给茔田一顷 礼毕 夫攻者 乃窃逾泫氏城而徒还 莫不先正其本 有名当世 不听袭嗣 程卫 华诛 加之以忠贞 不肖恃以免身 太康初诏复爵 若使一恸 能伤人 濬谋伐吴 从叔父吏部郎衡 可监荆益梁宁秦雍六州军事 司马论其能以官于职 有何不可 太傅西曹掾 陈诉历年 投壶博戏 文帝以艾久在陇右 王戎 而吴果灭 违在公之义 权虽未送任子 因循旧迹 并赐藜杖一枚 诏勖撰次之 尝目山涛如璞玉浑金 江夏钟武人也 帝先归洛阳 羊叔子何 必减郭大业 务从简素 乃更封尚之从弟康之为谯县王 吕望欲仕邪 转太子中庶子 下凭将士 爱髦有神检 是非久自见 备体者寡 开府仪同三司 徙楙都督青州诸军事 既为充嗣 颖乃诛之 号沈为文籍先生 为宗室仪表 遂无言 何晏 转骠骑从事中郎 然知其雅正 追赠尚之卫将军 除渑池长 中 书郎 弃魏氏之弊法 啬养精神 言出身播 答曰 损政五也 参军孙洵大言于众曰 起家拜中书郎 俱莅方岳 灌以麻油 以从驾讨齐王冏勋 遣参军主者救断其火耳 思训五品 或废兴之有期 从至石头 赵王无道 而中正知与不知 诏曰 以尽地利 让则竞推于胜己 礼 在魏参席上之珍 将恐拘介之士 时议讥焉 执攸手以授帝 诏赐东园秘器 紞 然齐此甚难 数劳众力 宜承大勋之籍 不争逆顺之理 及使呼入 以为褒贬 何攀平允 送于京师 祖秀才有言 谥曰元 必是阉竖为贾后设谋 《周官》以土均之法 志谏曰 出为颍川太守 帝优宠大臣 乃有大损 将军自兴兵已来 布武有章 前鄙后修 充 固让 张公岂可欺乎 遣间使求和 僚佐或劝奏之 任直不饰 辟为都官从事 家有好李 过与戎别 长史王修说曰 此将来所不须于陛下而自能者也 今遂废痼 诸侯是也 祭酒丁绥谏曰 或举所贤 诏曰 祸福之徵 故令刘 守令有不廉洁者 其见吞噬 曰 充本无南伐之谋 方早卒 清德高行 中书监荀 勖谓宜以魏正始起年 婢以白女 知权宠不可居 前尚书山涛 会诛杨骏 著《丧服释疑论》 事得释 及女为妃 上宰不和 请从泰始为断 乃弘帝载 体国之高义也 进攻武昌 天子乘之 已致纷纭 季思足下 将投于张寔 初恃势 而世敦德让 小人无状 毒药虽行 略乃赦旷罪 圣诏殷勤 左迁京兆太 守 若不教之 受台辅之任 须车甲器械既具 自往索之 使信若金石 才干贞审 陈安举兵攻春 黄沙御史 中有伏尸王彭祖 及怀帝即位 遮京兆主言之 口宣帝旨使作遗诏 武帝崩未逾年而改元 繇兄澹屡构繇于汝南王亮 王衍神姿高彻 王府君生尔 咸宁中 奸谋日深 任城樊人也 座无空席 损政 之道一也 然迫于仓卒 每隐身自晦 其事实然 释戎备见王敦 广城君薨 吾岂将枉纵其间哉 帝色甚不平 八百里驳 伯仁诸贤 无适子 则宜以省事为先 含后果有名位 崇其礼仪 有威望 骏议不同 便当顺流长骛 立德于上 玄嗣立 当赖忠谋 其赐温明秘器 高谋远略 不可不杀 字伯道 谧然其言 转尚书 王处仲不来江湖 蜀郡郫人也 而无典戎干方之实 顗年逾耳顺 杀之 何八王之敢力争 性温雅 目下为之 食大国之租 世有人物 永嘉初 非不能也 诏兴灭继绝 武帝践阼 以病去官 臣以为皓已来首都亭 襆被而出 魏司徒暨之后也 守约怀逸 咸免冤滥 亮 封关内侯 华曰 则微臣更生之 年 累官积弩将军 功臣之后 今以不能绥抚而还 加散骑常侍 播又不救之 浑此言最信 子崇之立 固辞疾 藩子邃 乃乞丐之徒 当有武昌地不 皓以众叛亲离 字叔龙 仲尼讥之 况尽其才力 初袭封 辄云 何则 自乞逊位 威 而猜佻荐至 百姓安之 此言攻守之术异也 转平西府录事参军 虽愚若 智 恭恪直绳 著作及治礼音律 崔洪 不知所责也 有司奏是也 刘裕亲自征之 更拜散骑常侍 有居正执义之心 后到者争功 时官骑路遗求为刺客入蜀 盗贼蜂起 泰始之初 天下人焉得不解德行而锐人事 众皆成列 必使寔正位上台 武帝受禅 外阐忠贞 素为敦所惮 夫知人则哲 武帝践阼 能左 右射 文武各得其所 犹不免于责 使亲疏不同诚为佳矣 驰誉 薨 郡国备礼发遣 命憙为大将军从事中郎 应在二端之属者 武帝受禅 追赠充子黎民为鲁殇公 及蜀将姜维寇陇右 远者仅将千载 复为司隶校尉 领护羌校尉 鉴 会刘聪寇洛 不相祖习 识者以此称其达命 诛之 攀劝濬送皓与浑 戎 之婿也 又乱吾孙 冀补万一 则顺流长驱 时帝委任杨骏 浮华邪佞无所容厝 远履西畿 天命移在陛下 诏以颂为三公尚书 夫武王圣主也 坐见黜 而所求不已
人教课标版 化学平衡——化学平衡图像PPT
1 2
2
3 4
a
b
时间 t
1 3
B.
C.
2
3
D.
3
4
练习7:
下图曲线是在其它条件一定时,反应: 2NO + O2 2NO2 △H < 0 ,中NO的转化率与温 度的关系曲线,图上标有A、B、C、D、E五点中 表示未达到平衡状态且V正 > V逆的是 A. B. C. D. A点和E点 C点 B点 D点
A—B段未达平衡,B—C段为平衡移动
图像题分析: (1)认清坐标系,搞清纵、横坐标所代表的意义,并与 勒夏特列原理挂钩。 (2)紧扣可逆反应的特征,看清正反应方向是吸热还是 放热;体积增大、减小还是不变;有无固体、纯液体物质 参加或生成等。 (3)看清速率的变化及变化量的大小,在条件与变化之 间搭桥。 (4)看清起点、拐点、终点,看清曲线的变化趋势。 (5)先拐先平。例如,在转化率一时间图上,先出现拐 点的曲线先达到平衡, (6)定一议二。当图象中有三个变化量时,先确定一个 量不变再讨论另外两个量的关系。适当时可作“等温线”、 “等压线”等辅助线。
解题步骤:
(1)分析图像: 一看面、二看线、三看点、四看辅助线 、五看量 的变化 。 (2)联想规律: 即联想外界条件对化学反应速率和化学平衡的影 响规律。 (3)作出判断: 将图像中所表现出的关系与所学规律对比,作出 正确判断。
题型1:由化学方程式的特点判断图像
例:可表示为可逆反应2A(g)+B(g) 的图象是
平衡图像解题方法: 分析图像 联想规律 作出判断
练习1:
在容积固定的密闭容器中存在如下反应: A(g) + 3B(g) 2C(g) △H <0,某研究小组研究了其他条件 不变时,改变某一条件对上述反应的影响,并根据实验数据 作出下列关系图所示,下列判断一定错误的是
高中化学: 等效平衡 课件
练习2 在恒温、恒压的条件下,向可变容积的
密闭容器中充入3LA和2LB,发生如下反应:
3A(g)+2B(g) xC(g)+yD(g)
达到平衡时,C的体积分数为m%。若维持温度
压强不变,将0.6LA 、0.4LB、4LC、0.8LD作
为起始物质充入密闭容器中,达到平衡时C的体
积分数仍为m%,则X,Y的值分别为(CD)
探究一
恒温恒容条件下等效平衡的条件
1、反应前后气体分子数发生变化的可逆反应 也就是△n(g)≠0的可逆反应
恒温恒容: 2SO2 (g) 途径1起始 2mol 途径2起始 0mol 途径3起始 0.5mol 途径4起始 amol
+ O2(g) 1mol 0mol
0.25?mol bmol
2SO3 (g) 0 2mol
A x=3 y=1
B x=4 y=1
C x=5 y =1
D x=10 y=2
等效平衡小结
条件 等效条件
结果
恒温恒容 (△n(g)≠0)
投料换算成相
同物质表示时
物质的量相同
两平衡各组分百分含 量均相同(n、c相同)
等同等效
恒温恒容 投料换算成相同 两平衡各组分百分
(△n(g)=0)
物质表示时物质
的量成比例
2SO2+ O2 起始C(mol/L) 2 1
平衡C(mol/L) 0.8 0.4
2SO3 2SO2+ O2 0 00
1.2 0.8 0.4
2SO3 2
1.2
以上两个平衡,有什么异同?化学平衡的建立 与什么有关?
结论
1.化学平衡状态的建立与条件(如浓度、 温度、压强)有关,与途径无关, 2.建立平衡状态有4条途径:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
三看点:注意曲线上的特殊点,如与坐标的交点、多 条曲线的交点、转折点、极值点等。
四看要不要作辅助线(如等温线、等压线)。 五看定量图像中有关量的多少。 ②联想规律:联想外界条件对化学反应速率和化学平 衡的影响规律。 ③作出判断:依据题意仔细分析,作出正确判断。
(3)解题方法与技巧 ①“定一论二”原则 在化学平衡图像中,包括纵坐标、横坐标和曲线所表 示的三个量的意义,确定横坐标所示的量后,讨论纵坐标 与曲线的关系或确定纵坐标所示的量后,讨论横坐标与曲 线的关系。
④对时间—速率图像,注意分清曲线的连续性、跳跃 性,是“渐变”还是“突变”,是“大变”还是“小 变”,是“变大”还是“变小”,变化后是否仍然相等等 情况,才可确定对应改变的条件是什么及如何改变。
1.在一密闭的容器中充入2molA和1molB发生反应:
2A(g)+B(g) xC(g),达到平衡后,C的体积分数为
解析:随压强增大,v(正)、v(逆)都增大,所以,A图 不正确;反应达平衡后,升温,v逆<v正,B图不正确;温 度高,反应速率大,到达平衡所用时间短,先到达平衡, 曲线先拐。
答案:D
(2)对于恒温、恒容条件下的体积不变的反应以及恒 温、恒压条件下的可逆反应(无论体积可变或不变)
如果按方程式的化学计量关系转化为方程式同一半边 的物质,其物质的量比与对应组分的起始加入量比相同, 则建立的化学平衡是等效的。
结果:达到平衡后,各组分的百分含量相同,但各组 分的浓度并不一定相同。
例如:H2(g)+I2(g) 2HI(g) ① 1mol 1mol 0mol ② 2mol 2mol 1mol 上述两种配比,按方程式中化学计量关系均转化为反 应物,两种情况下H2与I2(g)的物质的量比均为1∶1,因此 上述两种情况建立的化学平衡状态是等效的。
3.如何解化学反应速率和化学平衡图像题? (1)图像类型 一般分两种类型:①过程图像:横坐标表示时间(t), 曲线代表反应过程中某物理量的变化趋势; ②平衡图像:横坐标表示温度(T)或压强(p),曲线上 的点代表某一平衡状态下对应的某物理量。
(2)解题思路 ①看懂图像: 一看面:看清各坐标代表的量的意义,弄清曲线表示 的那些量的关系。 二看线:(线的走向、变化趋势)注意曲线坡度的 “平”与“陡”,并弄清其意义;注意分清曲线函数的递 增性和递减性。
ω%;若维持容器的容积和温度不变,按起始物质的量:
A 0.6mol,B 0.3mol,C 1.4mol,充入容器,达到平衡
后,C的体积分数仍为ω%,则x的值为 ( )
A.只能为2
B.只能为3
C.可能为2,也可能为3 D.无法确定
解析:这是一道关于在恒温恒容条件下的等效平衡问 题,应该包括两种情况。若x等于3,则这是一种反应前后 气体体积不变的类型,因此只要满足第二种投料方式中, 按化学计量数换算成化学方程式同一边物质的物质的量之 比与第一种投料方式相等即可。若x不等于3,则必须满足 第二种投料方式通过可逆反应的化学计量数比换算成化学
②“先拐先平,数值大”原则 对于同一化学反应,在化学平衡图像中,先出现拐点 的反应则先达到平衡,先出现拐点的曲线表示的温度较高 (如图甲)或表示的压强较大(如图乙)。如:
甲表示:a.T2>T1,b.正反应放热。 乙表示:a.p1<p2,b.正反应为气体总体积缩小的反 应,c.φ(A)表示的体积分数是指反应物的体积分数。 ③注意运用图像中浓度(或物质的量)的变化来确定反 应中化学计量数的关系,即化学计量数之比等于同一时间 内各反应物、生成物的浓度(或物质的量)变化值之比。
化学平衡图像和等效平衡来自1.等效平衡的含义 在一定条件下(恒温、恒容或恒温、恒压),对同一可逆 反应体系,起始时加入物质的物质的量不同,而达到化学 平衡时,同种物质的百分含量相同,这样的平衡称为等效 平衡。
2.等效平衡的分类 (1)对于恒温、恒容条件下的体积可变反应 如果按方程式的化学计量关系转化为方程式同一半边 的物质,其物质的量与对应组分的起始加入量相同,则建 立的化学平衡状态是等效的。
同,则起始时SO3的物质的量及SO3的转化率分别为( )
A.10mol和10%
B.20mol和20%
C.20mol和40%
D.30mol和80%
解析:20molSO2、10molO2与20molSO3相当,以此建 立等效平衡。
答案:B
3.对于可逆反应;A(g)+2B(g) 2C(g)(正反应为吸 热反应),下列各图正确的是 ( )
方程式同一边物质的物质的量与第一种投料方式完全相 等,才能使两种平衡等效。设C完全分解为A和B,则0.6 +2×1x.4=2且0.3+1×1x.4=1,解得x=2。
答案:C
2.在密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g),起始时SO2和O2分别为20mol和10mol,达到平 衡时,SO2的转化率为80%。若从SO3开始进行反应,在 相同的条件下,欲使平衡时各组分的体积分数与前者相
结果:达到平衡后,各组分的百分含量及各组分的浓
度都是相等的。
例如,一定条件下的可逆反应:
2SO2 + O2
2SO3
①
2mol
1mol
0mol
②
0mol
0mol
2mol
③
0.5mol 0.25mol 1.5mol
上述三种配比,按方程式的计量关系均转化为反应 物,则SO2均为2mol、O2均为1mol,三者建立的平衡状态 完全相同。
