神经干细胞的增殖与分化调控机制研究
Notch信号通路与神经干细胞的增殖分化

Notch信号通路与神经干细胞的增殖分化
张琦;郑志竑
【期刊名称】《国际遗传学杂志》
【年(卷),期】2004(027)002
【摘要】Notch信号通路是调节细胞增殖分化的一条古老的途径,传统观点认为它是通过"旁侧抑制"发挥作用的,近来许多研究表明,Notch系统也有激活和指导细胞分化的作用.神经干细胞是一种有自新能力的多能干细胞,是神经元和神经胶质细胞的共同前体细胞,对于它的研究是一个全新的领域.这一老一新的结合可使我们从一个不同以往的角度看待一些神经系统疾病,如Alzheimer's病等疾病的发病机制和治疗方案.
【总页数】4页(P68-71)
【作者】张琦;郑志竑
【作者单位】350004,福州,福建医科大学分子医学研究中心;350004,福州,福建医科大学分子医学研究中心
【正文语种】中文
【中图分类】Q343
【相关文献】
1.Notch细胞信号通路在神经干细胞增殖分化中的作用 [J], 刘浩;赵燕;张念平;张晓;张琳
2.神经干细胞增殖分化的JAK/STAT与Notch信号通路串话机制 [J], 庄述娟;李
旭;李克琴;刘庆山
3.高压氧及Notch信号阻断剂对大鼠颅脑损伤后海马区神经干细胞增殖分化的影响 [J], 杨永凯;张帆;韦浩;周晓辉;陈春美;王春华;涂献坤
4.神经干细胞增殖分化过程中Notch通路信号分子的表达 [J], 张琦;林玲;胡建石;郑志竑
5.大鼠脑缺血预处理后Notch信号通路对神经干细胞增殖分化的影响 [J], 蒋琼;陈丽;黄宽;王容;吴正华
因版权原因,仅展示原文概要,查看原文内容请购买。
细胞生物学_14细胞增殖与其调控过程分析
二、细胞周期中各个不同时期及主要事件
⒈G1期(DNA合成前期) G1期合成细胞生长所需要的各种蛋白质、糖
类、脂类等 ,但不合成DNA。 在G1期的晚期 阶段有一个特定时期。通过这个特定时期,细 胞分裂进入S期。在芽殖酵母中,这个特定时期 被称为起始点。在其它真核细胞中叫检验点或 限制点(R点)。
G1期时间变化较大的根本原因具有一个调节 细胞增殖周期开和关的“阀门”,即限制点。
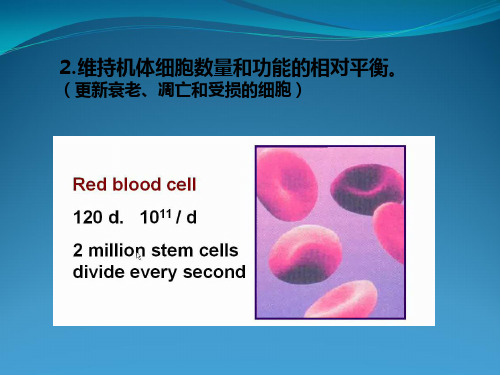
⒉维持机体细胞数量和功能的相对平衡。
(更新衰老、凋亡和受损的细胞)
大剂量的X射线照射老鼠,老鼠几天内死亡。
(导致干细胞大量死亡,个体在细胞数量上特别是 功能上受损。)
➢细胞增殖是通过细胞周期来实现的,细胞周 期的有序运行是通过相关基因的严格监视和调 控来保证的。
➢细胞无限制增长对个体来说意味着癌症,个 体无限制繁殖对地球来说意味着灾难。
检验点不仅存在于G1 期,也存在于其他时期, 如S期检验点、G2期检 验点、纺锤体检验点等。 这些特异的监控机制 (检验点)可以监别细 胞周期中的错误,并诱 导产生特异的抑制因子, 阻止细胞周期进一步运 行。
⒉S期 S期即DNA合成期。新的组蛋白也是在S期合
成的。DNA的起始和复制过程受到多种细胞周 期调节因素的严密调控。
㈡诱导同步化 ⒈DNA合成阻断法:用DNA合成抑制剂可逆 地抑制DNA合成而不影响其它各期细胞沿细 胞周期运转,最终将细胞群体阻断在S期。 TdR双阻断法最常用,细胞最终阻断于G1/S 交界处。
应用过量的TdR阻断法进行细胞周期同步化
⒉中期阻断法
某些药物可抑制微管的聚合,因而抑制有丝 分裂器的形成,将细胞阻断在有丝分裂的中期。 同DNA合成阻断法相比,中期阻断法的非平衡 生长的问题并不十分明显,因M期大分子合成 基本停止。但此种阻断法的可逆性较差,阻断 时间较长,获得的细胞中的一些细胞将不能完 成正常的有丝分裂而出现异常分裂。常用的阻 断药物是秋水仙素或秋水仙酰胺。
Wnt信号通路与神经干细胞

来源于小鼠大脑皮质的神经干细胞转基因后超
表达 W n-t 7a 或 B-caten in, 即 使 在 培 养 液 中 加 入 FGF 2, 依然大量向神经元分化。阻断 W n t信号通路 后导致神经 元分化被抑制。研究另外发 现 B- caten in /TCF复合物通 过直接作用于 neurogenin 1 的表 达, 从而调控神经干细 胞的分化 [ 5 ] 。 L ee等 [ 6] 使用 转基因小鼠进行体内实验发现稳定表达活化 B- caten in可以促 进神经嵴 干细胞 ( neura l crest stem ce l,l NCSC ) 分化 成为感 觉神经 元。 B-ca ten in 基因突 变 后, 感觉神经元大量缺失。体外培养发现 W n-t 1 促 使 76. 4% 的神经嵴干细胞分化成为神经细胞, 其中 95. 4% 的为感觉神经元, 而且细胞的增殖不受影响。
神经管发育与神经干细胞

神经管发育的调控机制
01 神经管发育的调控机制涉及多种基因、信 号分子和细胞因子的相互作用。
02
基因表达的调控对于神经管发育至关重要 ,包括转录因子、表观遗传修饰等。
03
信号分子如生长因子、激素等在神经管发 育过程中发挥重要作用。
04
细胞间的相互作用和细胞内信号转导也参 与神经管发育的调控。
02
神经系统的结构和功能。
此外,神经干细胞还能通过产生 神经营养因子来支持神经元的生 长和存活,进一步促进神经系统
的发育和成熟。
神经管发育与神经干细胞相互影响的机制
神经管发育与神经干细胞之间的相互作用是一个复杂的过 程,涉及到多种分子和信号通路的协同作用。
胚胎微环境中的信号分子、激素以及生长因子等对神经干 细胞的命运决定起着关键作用,同时神经干细胞的分化也 会影响这些信号分子的表达和分布。
转基因动物模型
通过转基因技术,将特定基因导入动物模型中,建立转基 因动物模型,用于研究神经管发育和神经干细胞的生物学 特性。
基因表达分析
利用分子生物学技术,如qPCR和基因芯片,检测神经管 发育和神经干细胞中基因的表达情况,分析相关基因的功 能和调控机制。
06
未来展望
神经管发育与神经干细胞研究的前景
阿尔茨海默病
阿尔茨海默病是一种以记忆力减退为 主要症状的神经系统退行性疾病,与 神经干细胞数量减少和功能异常有关 。
神经管发育ห้องสมุดไป่ตู้神经干细胞疾病的研究进展
01
基因治疗
针对神经管发育异常和神经干细胞异常相关疾病的基因治疗研究正在不
断深入,旨在通过基因工程技术修复缺陷基因或增强相关基因的表达,
改善疾病症状。
干细胞培养与分化实验
细胞因子和生长因子对神经元发育的调节作用

细胞因子和生长因子对神经元发育的调节作用随着生物技术的发展,科学家们逐渐发现了越来越多的微观分子,这些分子在生物体内具有非常重要的作用。
细胞因子和生长因子就是其中非常重要的两种分子,它们可以调节细胞的分化、增殖和存活等过程。
在神经元的发育过程中,细胞因子和生长因子扮演着极其重要的角色。
细胞因子是一种蛋白质分子,由各种细胞合成,分泌到体液环境中,发挥特定的调节细胞生命活动的功能。
细胞因子主要分为趋化因子、生长因子、介导因子等几类。
细胞因子通过与膜上受体分子结合,通过细胞内信号转导通路,影响细胞的生长、分化、凋亡等生命活动。
细胞因子的研究确定了许多细胞的基本特征和生命活动的调控机制,并成为细胞生物学、免疫学、生物化学等研究领域的热点。
生长因子是指一类多种分泌蛋白和糖蛋白,它们通过作用于受体而促进细胞生长、增殖和分化的作用物质。
它们作用于细胞表面的膜受体,在受体结构的激活下,启动一系列的下游信号传导,从而形成一组复杂的调节网络。
生长因子对于各类细胞的分化、增殖、存活和细胞外基质合成等有着非常重要的作用。
同时,生长因子也被广泛应用于细胞培养、再生医学等重要研究领域。
神经元是人体中非常重要的细胞类型,它们具有无数的分支和突起,能够传递和接收大量的电信号,同时还能够分泌各类分子信号调节周围细胞的活动。
神经元的发育过程非常复杂,需要经历着多次分化、迁移、突触形成等程序。
在神经元发育的过程中,生长因子和细胞因子也扮演着关键的作用。
首先,生长因子和细胞因子可以调节神经元的增殖分化。
在神经元的起源部分,神经干细胞经过增殖和分化等过程形成神经元前体细胞,然后再分化为不同类型的神经元。
一些重要的生长因子和细胞因子如神经营养因子(NGF)、神经元特异性烯醇化醛去氢酶(ALDH1A1)、前胶质细胞/星形胶质细胞糖蛋白2(GCP2)、肌球蛋白重链(MHC)等能够通过信号通路调节神经元的增殖与分化,进而影响神经元建立和调节神经系统的完整性。
干细胞的分化与定向诱导技巧

干细胞的分化与定向诱导技巧干细胞是具有自我更新能力和多向分化潜能的一类基础细胞。
在医学领域,干细胞具有广阔的应用前景,可以用于组织重建、疾病治疗以及新药研发等方面。
干细胞的分化与定向诱导是实现这些应用的关键步骤,本文将介绍干细胞分化的基本原理和常用的定向诱导技巧。
干细胞分化的基本原理是指通过调控细胞内外环境来引导干细胞向特定细胞类型分化的过程。
在自发分化过程中,干细胞通过自身的遗传调控和信号传导路径来实现分化。
而定向诱导技巧则是通过外部介入,利用特定的因子和技术手段来控制干细胞的分化方向,使其转变为目标细胞类型。
在干细胞分化的过程中,存在内源性和外源性两种分化信号。
内源性信号是指体内存在的调控因子,如基因表达调控和细胞信号通路等。
外源性信号则是指通过外部途径引入的调控因子,如特定细胞因子和生化材料等。
这些信号可以单独或联合作用,通过激活或抑制细胞内特定信号通路,从而实现干细胞向特定细胞类型的转变。
定向诱导技巧主要包括生化诱导和物理诱导两种方法。
生化诱导是利用生物化学因子来诱导干细胞的分化。
常见的生化诱导因子包括生长因子、转录因子和化学物质。
生长因子可以通过激活特定信号通路促进细胞增殖和分化,转录因子则可以通过与DNA结合来控制基因表达,进而诱导细胞分化。
化学物质则可以改变细胞内的环境,如酶抑制剂和分化诱导剂等。
生化诱导的优势在于可以精确地调控分化的时间和程度,但其不足之处在于需要优化诱导因子的浓度和时间,以及需要解决因子稳定性和细胞毒性等问题。
物理诱导是利用物理力学原理来诱导干细胞的分化。
常见的物理诱导方法包括微环境模拟和力学刺激。
微环境模拟是通过模拟细胞自然生长环境,如细胞外基质、细胞间隙和培养基等,来提供合适的生长条件和机械性刺激,从而引导干细胞的分化。
力学刺激是通过应用机械压力、牵拉力或剪切力等来调节细胞内外环境,从而影响干细胞的分化。
物理诱导的优势在于可以模拟细胞自然生长环境,更好地保持细胞功能和生化特性,但其不足之处在于需要优化刺激力的强度和时间,以及需要解决刺激对细胞的毒性和特异性等问题。
中药有效化学成分促进干细胞增殖与分化作用研究进展
传 统 中 医 药 在 治 疗 人 类 疾 病 和 保 障健 康 长 寿 方 面 的 作 用 深 入 人 并 推 测 体 外 三 七 总 皂 甙 可 能 通 过 促 进 胎 鼠皮 层 神 经 干 细 胞 或 前 体 细 心 , 传 统 中 医 药 有 效 化 学 成 分 调 控 干 细 胞 的 增 殖 、 化 和 凋 亡 作 用 胞 b G B N 自身 合 成 增 加 , 过 自分 泌 或 旁 分 泌 作 用 , 进 其 存 用 分 F F、 D F 通 促 增 分 独 具 中 国特 色 。 国 外 近 年 来 , jl ow r 人 合 成 的 吲 哚 脂 肪 醇 类 活 、 殖 、 化 和 自我更 新 。 DaiC o a 等 l 三 七 皂 甙 根 据 甙 元 不 同 , 以 分 为 A B C 三 种 类 型 , 两 种 甙 元 可 ,, 前 化 合 物 调控 神 经 干 细胞 的分 化 作 用 显 著 [ X 1 uWu 等 人 报 道 了 1:
C doeo 对 胚 胎 干细 胞 的分 化 作 用 [ r a ignl 2 1 合 我们 的研 究 工 作, 文综 在 其 同 属 植 物 人 参 中也 含有 ,而 c型 皂 甙 则 是 人 参 属 中 的一 种 新 皂 。结 本 9” -。 述 了传 统 中 医药 有 效 化 学 成 分 调 控 干 细 胞 的 增 殖 、 化 和 凋 亡 作 用 的 甙[ 分 2 ( ) 原 人 参 三 醇 型— — A型 0 S一 近期研究进展。 根 据 文 献 资 料 . 文介 绍几 类 能促 进 干 细胞 增 殖 与 分 化 的 中药 有 本
科技信息
0 临床 与 医疗 O
S IN E&T C NO O CE C E H L GYI F MA I N N OR T O
Wntβ-catenin 途径是调控细胞生长增殖的关键途径
于Wnt/β-catenin是否参与低氧诱导的海马NSCs增殖,将在下一部分进行探讨。
质内大量聚集,当胞内β-catenin达到一定的水平时,形成的游离的β-catenin进入胞核
内,取代抑制蛋白与转录因子LEF1/TCF结合,调控下游基因的转录
[11-12]
。
Wnt/β-catenin途径是调控细胞生长增殖的关键途径,在胚胎发育中起着重要作用
[13]
。新近的研究表明,Wnt/β-catenin信号可通过激活下游靶基因(如cyclinD1和c-myc)
间接表明低氧增加NSCs中β-catenin的含量。
本研究从蛋白水平进一步检测低氧条件对β-catenin和靶基因cyclinD1表达的影
响。结果表明,低氧培养12 h和24 h后,β-catenin和cyclinD1的蛋白含量均增加。
表明低氧可以增加β-catenin和cyclinD1的表达。
综上所述,新生GFP转基因小鼠海马NSCs具备对Wnt信号反应的能力。经低氧
报道。
本实验首先采用RT-PCR法检测常氧条件下的新生GFP转基因小鼠海马NSCs中
Wnt/β-catenin通路分子的表达情况。结果显示,Wnt/β-catenin通路中的主要分子,
包括Frz1,β-catenin,Axin1,GSK-3β和LEF1均可检测到,表明新生GFP转基因
小鼠海马NSCs具备对Wnt信号反应的能力。
cyclinD1/c-myc刺激癌细胞的增殖而促进肿瘤的进展。肿瘤细胞生存的微环境中存在
着共性,即由于细胞的过度增生而血供相对不足,因此处于缺氧的状态,进一步提示,
简述神经干细胞的定义及其特点
简述神经干细胞的定义及其特点神经干细胞(neural stem cells,NSCs)是一类存在于神经系统中的多能干细胞,具有自我更新和多向分化的能力。
它们是神经系统发育和维持的重要组成部分,对于治疗神经系统疾病和损伤具有巨大的潜力。
神经干细胞的定义:神经干细胞是指具有自我更新能力和多向分化潜能的细胞,能够产生神经元、神经胶质细胞和少数其他细胞类型的干细胞。
它们具有能够自我更新的能力,即通过对自身进行对称分裂,产生两个与原细胞相同的干细胞,从而保持干细胞群体的稳定。
同时,神经干细胞还能够分化为多种细胞类型,包括神经元和神经胶质细胞,以及一些非神经细胞,如血管内皮细胞和胆管上皮细胞等。
神经干细胞的特点:1. 自我更新能力:神经干细胞具有自我更新的能力,能够通过对称分裂产生两个与原细胞相同的干细胞,从而维持干细胞群体的稳定。
这种能力使得神经干细胞能够不断地进行增殖和分化,为神经系统的发育和修复提供持续的细胞源。
2. 多向分化潜能:神经干细胞具有多向分化的潜能,能够分化为多种细胞类型,包括神经元和神经胶质细胞等。
神经元是神经系统的基本功能单位,负责传递和处理信息,而神经胶质细胞则起支持和保护神经元的作用。
神经干细胞的多向分化潜能使得它们能够在神经系统发育和损伤修复中发挥重要作用。
3. 环境依赖性:神经干细胞的增殖和分化受到周围微环境的调控。
神经干细胞所处的微环境中存在着多种细胞因子和信号分子,它们能够通过调节基因表达和细胞信号传导途径,影响神经干细胞的增殖和分化行为。
这种环境依赖性使得神经干细胞能够根据需要进行增殖和分化,以满足神经系统发育和修复的需求。
4. 分布广泛:神经干细胞广泛分布于神经系统的不同区域,包括胚胎期的神经管和成体的神经系统。
在胚胎期,神经干细胞主要存在于胚胎的神经管中,负责神经系统的形成和发育。
而在成体神经系统中,神经干细胞主要存在于神经系统的特定区域,如脑室周围区域和海马等。
这种广泛的分布使得神经干细胞能够参与到神经系统的发育和修复的各个方面。
SVZ神经干细胞和祖细胞
另一个细胞黏附分子是神经胶质黏附分子 (NgCAM),使用抗NgCAMFab会破坏SVZ 祖细胞的迁移。细胞黏附因子的另一家族整 合素家族也参与了A细胞链的迁移,但似乎 不影响A细胞迁移方向的决定,只影响A细 胞的迁移动力学。正常SVZ祖细胞的迁移速 度在80--120µm/hr之间,RMS在30µm/hr左 右,使用整合素的抗体封闭后祖细胞的迁移 速度减慢到对照组的20%-30%,但A细胞链 仍然存在,迁移方向亦不改变。
三、SVZ干细胞和祖细胞 的增殖、迁移和分化机制
(一)胶质细胞在SVZ神经干细胞和祖细胞 胶质细胞在 神经干细胞和祖细胞 增殖迁移中作用 SVZ中星形胶质细胞(B细胞)本身可 能就是干细胞,在Ara-C除去SVZ中A细胞 和C细胞后,2天即可重构C细胞,2周后重 现A细胞链。由于SVZ星形胶质细胞具有典 型的胶质细胞特征,包括形态学、超微结构 和免疫学等方面特点,因而这种SVZ中出现 的双重性质的B细胞究竟是因为SVZ星形胶 质细胞本身就是神经干细胞抑或为星形胶质 细胞向神经干细胞的逆向诱导尚不清楚。
二、SVZ细胞构筑 细胞构筑
以大鼠为例介绍SVZ细胞构筑: SVZ在光镜下为室管膜下明暗相间的 细胞成分组成,至少含有A、B、C、E四 类不同形态学表现、电镜结构和免疫学特 征的细胞群,尚可见少量D细胞 (Tanycyte细胞)、小胶质细胞和一些致 密细胞。现介绍如下:
A细胞:光镜下颜色较暗,胞体较小,1细胞: 细胞
3)放射状胶质细胞和SVZ区胶质细胞也可 产生神经元,引发了人们对胶质细胞的重新 认识; 4)成年个体SVZ区和海马区神经干细胞对 损伤和疾病具有反应能力,在损伤、疾病、 应激或外界刺激时可以分裂增殖、迁移并分 化为皮层神经细胞,部分地重建神经功能。 此外借助于体外或体内神经干细胞模型 结合分子生物学、细胞生物学等技术手段在 神经发育的分子机制也取得了重要成果。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
神经干细胞的增殖与分化调控机制研究
神经干细胞是具有自我复制和分化潜能的干细胞,可以分化为多种神经元和神经胶质细胞。
神经干细胞的增殖和分化调控是神经发育和再生的基础,对于神经系统相关的疾病的治疗和康复具有重要意义。
本文将介绍神经干细胞增殖和分化的调控机制,包括细胞内信号通路、外环境因素以及表观遗传学等方面的研究进展。
一、细胞内信号通路
神经干细胞增殖和分化的调控主要是由一系列复杂的信号通路调节的。
其中,Wnt、Notch和Hedgehog等信号通路起着重要的作用。
Wnt信号通路是最为熟知的神经干细胞生长因子之一,对神经干细胞的增殖和分化都具有调节作用。
Wnt信号的激活可以导致β-catenin的稳定和聚集,从而激活与之相关的基因,包括c-myc、cyclin D1等。
同时,Wnt信号还可以通过Axin-LRP5/6-Fz复合物的形成促进神经干细胞的自我更新。
Notch信号通路也是调节神经干细胞生长和分化的重要信号通路之一,通过Notch与Delta或Jagged等配体的结合,激活Notch受体并抑制神经干细胞向神经元的分化,同时促进胶质细胞的分化。
Hedgehog信号通路是最近发现的重要的神经干细胞增殖和分化调控因子,具有复杂的信号调节机制。
Hedgehog信号通路与Ptc、Smo、Gli等分子相互作用,调节神经干细胞的增殖和分化。
目前Hedgehog信号通路在神经系统肿瘤的治疗方面已经得到了广泛的应用。
二、外环境因素
神经干细胞增殖和分化的调控不仅受到内部信号通路的调节,还受到外部环境因素的影响。
细胞外基质、化学物质、神经因子等因素都是影响神经干细胞增殖和分化的重要因素。
细胞外基质的组成和刚度对于神经干细胞增殖和分化的影响已经成为了一个新
兴的研究领域。
细胞条件培养下,刚度为1-100kPa的基质可以促进神经干细胞向
神经元的分化;而刚度为1-10kPa的基质则可以促进神经干细胞向胶质细胞的分化。
此外,细胞外基质中的天然物质如胶原蛋白、Laminin等可以通过与细胞表面分子
相互作用来调节神经干细胞增殖和分化。
化学物质也是调控神经干细胞增殖和分化的重要因素,包括细胞因子、生长因
子等。
神经因子如BDNF、NT-3等可以促进神经干细胞向神经元的分化,同时抑
制其向胶质细胞的分化。
三、表观遗传学
近年来的研究表明,表观遗传学在神经干细胞增殖和分化调控中也发挥着重要
的作用,包括DNA甲基化、组蛋白修饰和非编码RNA等。
DNA甲基化是常见的表观遗传学修饰方式之一,常常用于对基因转录的调节。
研究发现,神经干细胞与神经元和胶质细胞之间差异的一个重要原因就是DNA甲
基化水平的差异,而且在神经干细胞的自我更新、分化和成熟过程中也发挥着重要作用。
组蛋白修饰也是一种常见的表观遗传学调节机制。
组蛋白的修饰形式包括磷酸化、甲基化、乙酰化等,可以影响到基因的转录和表达。
目前研究发现,HDACs、HATs、DNMTs等基因参与的组蛋白修饰通路可以影响神经干细胞的增殖和分化。
非编码RNA也开始成为神经干细胞增殖和分化调控的新热点。
非编码RNA分为microRNA和lncRNA两类,它们可以调节细胞的基因表达和代谢。
研究发现,
在神经干细胞的增殖和分化中,microRNA和lncRNA都具有重要的调节作用。
总结:
神经干细胞的增殖和分化调控机制包括细胞内信号通路、外环境因素以及表观
遗传学等多个方面,各个方面之间影响密切,共同调节神经干细胞的生长和分化。
未来,针对神经系统相关疾病的治疗和康复,研究神经干细胞的增殖和分化调节机制将成为一个重要的研究方向。
