42核外电子运动状态的描述
核外电子的运动状态

核外电子的运动状态电子在原子中的运动状态,可n,l,m,ms四个量子数来描述.(一)主量子数n主量子数n是用来描述原子中电子出现几率最大区域离核的远近,或者说它是决定电子层数的.主量子数的n 的取值为1,2,3…等正整数.例如,n=1代表电子离核的平均距离最近的一层,即第一电子层;n=2代表电子离核的平均距离比第一层稍远的一层,即第二电子层.余此类推.可见n愈大电子离核的平均距离愈远.在光谱学上常用大写拉丁字母K,L,M,N,O,P,Q代表电子层数.主量子数(n)1234567电子层符号KLMNOPQ主量子数n是决定电子能量高低的主要因素.对单电子原子来说,n值愈大,电子的能量愈高.但是对多电子原子来说,核外电子的能量除了同主量子数n有关以外还同原子轨道(或电子云)的形状有关.因此,n值愈大,电子的能量愈高这名话,只有在原子轨道(或电子云)的形状相同的条件下,才是正确的.(二)副量子数l副量子数又称角量子数.当n给定时,l可取值为0,1,2,3…(n-1).在每一个主量子数n中,有n个副量子数,其最大值为n-1.例如n=1时,只有一个副量子数,l=0,n=2时,有两个副量子数,l=0,l=1.余此类推.按光谱学上的习惯l还可以用s,p,d,f等符号表示.l 0 1 2 3光谱符号s p d F副量子数l的一个重要物理意义是表示原子轨道(或电子云)的形状.L=0时(称s轨道),其原子轨道(或电子云)呈球形分布(图4-5);l=1时(称p轨道),其原子轨道(或电子云)呈哑铃形分布(图4-6);…图4-5 s电子云图4-6 p电子副量子数l的另一个物理意义是表示同一电子层中具有不同状态的亚层.例如,n=3时,l可取值为0,1,2.即在第三层电子层上有三个亚层,分别为s,p,d亚层.为了区别不同电子层上的亚层,在亚层符号前面冠以电子层数.例如,2s是第二电子层上的亚层,3p是第三电子层上的p亚层.表4-1列出了主量子数n,副量子数l及相应电子层、亚层之间的关系.表4-1 主量子数n,副量子数l及其相应电子层亚层之间的关系n电子层l亚层1101s2202s12p3303s13p23d4404s14p24d34f对于单电子体系的氢原子来说,各种状态的电子能量只与n有关.但是对于多电子原子来说,由于原子中各电子之间的相互作用,因而当n相同,l不同时,各种状态的电子能量也不同,l愈大,能量愈高.即同一电子层上的不同亚层其能量不同,这些亚层又称为能级.因此副量子数l的第三个物理意义是:它同多电子原子中电子的能量有关,是决定多电子原子中电子能量的次要因素.(三)磁量子数m磁量子数m决定原子轨道(或电子云)在空间的伸展方向.当l给定时,m的取值为从-l到+l之间的一切整数(包括0在),即0,±1,±2,±3,…±l,共有2l+1个取值.即原子轨道(或电子云)在空间有2l+1个伸展方向.原子轨道(或电子云)在空间的每一个伸展方向称做一个轨道.例如,l=0时,s电子云呈球形对称分布,没有方向性.m只能有一个值,即m=0,说明s亚层只有一个轨道为s轨道.当l=1时,m可有-1,0,+1三个取值,说明p电子云在空间有三种取向,即p亚层中有三个以x,y,z轴为对称轴的px,py,pz轨道.当l=2时,m可有五个取值,即d电子云在空间有五种取向,d亚层中有五个不同伸展方向的d 轨道(图4-7).图4-7 s,p,d电子云在空间的分布n,l相同,m 不同的各轨道具有相同的能量,把能量相同的轨道称为等价轨道.(四)自旋量子数ms原子中的电子除绕核作高速运动外,还绕自己的轴作自旋运动.电子的自旋运动用自旋量子数ms表示.ms 的取值有两个,+1/2和-1/2.说明电子的自旋只有两个方向,即顺时针方向和逆时针方向.通常用“↑”和“↓”表示.综上所述,原子中每个电子的运动状态可以用n,l,m,ms四个量子数来描述.主量子数n决定电子出现几率最大的区域离核的远近(或电子层),并且是决定电子能量的主要因素;副量子数l决定原子轨道(或电子云)的形状,同时也影响电子的能量;磁量子数m决定原子轨道(或电子云)在空间的伸展方向;自旋量子数ms决定电子自旋的方向.因此四个量子数确定之后,电子在核外空间的运动状态也就确定了.量子数,电子层,电子亚层之间的关系每个电子层最多容纳的电子数2 8 18 2n^2主量子数n 1 2 3 4电子层K L M N角量子数l 0 1 2 3电子亚层s p d f每个亚层中轨道数目1 3 5 7每个亚层最多容纳电子数2 6 10 14核外电子的分布:1. 原子中电子分布原理:(两个原理一个规则):(1)、泡利(Pauli)不相容原理在同一原子中,不可能有四个量子数完全相同的电子存在.即每一个轨道最多只能容纳两个自旋方向相反的电子.(2)、能量最低原理多电子原子处于基态时,核外电子的分布在不违反泡利原理前提下,总是尽先分布在能量较低的轨道,以使原子处于能量最低状态.(3)、洪特(Hund)规则原子在同一亚层的等价轨道上分布电子时,尽可能单独分布在不同的轨道,而且自旋方向相同(或称自旋平行).基态原子中电子的分布1、核外电子填入轨道的顺序应用近似能级图,根据“两个原理一条规则”,可以准确地写出91种元素原子的核外电子分布式来.在110种元素中,只有19种元素原子层外电子的分布稍有例外:它们是若再对它们进一步分析归纳还得到一条特殊规律——全充满,半充满规则:对同一电子亚层,当电子分布为全充满(P6、d10、f14)、半充满(P3、d5、f7)或全空(P0、d0、f0)时,电子云分布呈球状,原子结构较稳定,可挑出8种元素,剩余11种可作例外.多电子原子结构1、核外电子排布三原理(1)泡利不相容原理:解决各电子层电子数目问题.◆在任何一个原子中,决不可能有两个电子具有四个完全相同的量子数,即在同一个原子中,不可能有运动状态完全相同的电子.◆当n一定时,L可取(n-1)个值,而在L限定下,原子轨道可有(2L+1)个伸展方向,即(2L+1)个轨道,而每个轨道可容纳两个电子,所以每层最多容纳电子数为电子层1 2 3 4电子数2 8 18 32(2)最低能量原理:解决电子排布问题◆多电子原子在基态时,核外电子总是尽可能地先占据能量最低的轨道,以使体系能量最低.◆轨道能级规律①当角量子数相同时,随主量子数增加,轨道能级升高1s<2s<3s<4s; 2p<3p<4p<5p; 3d<4d<5d②当主量子数相同时,随角量子数增加,轨道能级升高ns<np<nd<nf③当主量子数与角量子数都不同时,能级次序比较复杂,有时出现“能级交错”现象,即某些主量子数较大的原子轨道其能级可以比主量子数较小的原子轨道低.如4s<3d, 5s<4d , 6s<4f<5d<6p◆鲍林近似能级图鲍林根据大量光谱数据以及某些近似的理论计算,得到了多电子原子的原子轨道能级的近似图能级组:按照能级高低的顺序,把能量相近的能级划成一组,称为能级组.按照1、2、3能级组顺序,能量依次增高.电子分布式:核外电子的分布表达式,如K:Ti:鲍林近似能级顺序并不是所有元素轨道能级的实际顺序,它只不过是表示在考虑电子分布时,随核电荷数的增加的一个电子应分布在一哪一个轨道的一般规律,它不代表核外电子的实际分布情况,如钛原子的近似能级顺序为:而其电子分布式为:(3)洪特规则:解决同一电子层电子排布问题◆处于主量子数和角量子数都相同的轨道中的电子,总是尽先占据磁量子数不同的轨道,而且自旋量子数相同(自旋平行)◆两个电子同占一个轨道,这时电子间的排斥作用会使系统能量升高,两个电子只有分占等价轨道时,才有利于降低系统的能量,所以洪特规则可认为是最低能量原理的补充如P:3P轨道上的3个电子分布应为:↑↑↑(4)特殊情况◆有19种元素原子的电子分布式不完全符合近似能级顺序,如:它们的3d轨道电子分别为10和5,处于全满或半满状态,原子比较稳定,对于p、f轨道,半满状态为p3和f7,全满状态为p6和f14◆外层电子构型即外层电子分布式,对于原子来说:主族元素:最外层的电子分布式,如:副族元素:最外层S电子和次外层d电子的分布式,如:◆元素离子的外层电子构型:当原子失去电子成为阳离子时,一般是能量较高的最外层的电子失去,而且往往引起电子层数的减少.如:当原子得到电子成为阴离子时,电子总是分布在最外电子层上,如:元素离子的外层电子构型(1)8电子构型(2)9~17电子构型(3)18电子构型(4)18+2电子构型</np<nd<nf。
《核外电子分布及运动》 讲义

《核外电子分布及运动》讲义一、引言在我们探索物质的微观世界时,原子的结构是一个重要的研究领域。
而原子中核外电子的分布和运动规律,对于理解物质的化学性质、物理性质以及各种化学反应的发生机制都具有至关重要的意义。
二、核外电子的分布原子是由位于中心的原子核以及围绕原子核运动的核外电子组成。
原子核带正电荷,核外电子带负电荷。
核外电子在原子核外的分布并非是随意的,而是遵循一定的规律。
1、能层与能级能层,也称为电子层,是根据电子出现概率最大的区域离核的远近划分的。
一般来说,我们用字母 K、L、M、N、O、P、Q 来表示从内到外的不同能层。
在每个能层中,又分为不同的能级。
能级的符号通常用 s、p、d、f 等表示。
例如,第一能层只有一个能级,即1s;第二能层有两个能级,分别是 2s 和 2p;第三能层有三个能级,分别是 3s、3p 和 3d,以此类推。
2、构造原理原子的核外电子在填充能层和能级时,遵循构造原理。
即电子按照能级顺序依次填充,先填充能量较低的能级,再填充能量较高的能级。
例如,氢原子只有一个电子,它处于 1s 能级;而碳原子有 6 个电子,其电子排布式为 1s²2s²2p²。
3、泡利原理在一个原子轨道里,最多只能容纳两个电子,且它们的自旋方向相反。
这就是泡利原理。
4、洪特规则当电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,且自旋方向相同。
三、核外电子的运动核外电子并不是沿着固定的轨道做圆周运动,而是在一定的区域内以概率的形式出现。
1、电子云电子云是用来形象地描述电子在原子核外空间出现的概率分布的图像。
电子云密度大的地方,表示电子在该区域出现的概率大;电子云密度小的地方,表示电子在该区域出现的概率小。
2、核外电子的运动状态核外电子的运动状态由能层、能级、原子轨道和自旋方向四个方面来决定。
四、核外电子分布与元素性质的关系1、化合价元素的化合价与原子的核外电子排布密切相关。
(化学课件)原子核外电子的运动状态

讨论:见课本P5
一个小黑点仅表示电子在此出现了一次。
小黑点的疏密仅表示电子出现几率的大小。
即小黑点较稀的地方表示电子在此出现的机 会少;小黑点较密的地方表示电子在此出现 的机会多。
(三)、决定核外电子运动状态的因素
1、电子层: 在多电子的原子里,它们的运动区域 也不同。能量低的电子通常在离核较近的空间范 围运动,能量高的电子通常在离核较远的空间范 围内运动,
[说明]1、自左向右、自上而下,轨道能量依次递增。
2、每个能级组以ns轨道开始、以np轨道结束。
(3)为什么每个电子层所能容纳的电子数最 多为2n2(n为电子层数)?
1、4d轨道中最多容纳电子数为
A、2
B√ 、 10 C、 14 D、 18
2、下列轨道含有轨道数目为3的是
A、1s B√ 、2p √C、3p D、4d
3、第三电子层含有的轨道数为 A、3 B、 5 C、 7 D√ 、 9
五、电子亚层的能量比较规律
1、相同电子层上电子亚层能量的高低: ns<np<nd<nf
2、形状相同的电子亚层能量的高低: 1s<2s<3s<4s…… 2p<3p<4p<5p…… ……
3、电子层和形状相同的电子亚层的能量相等: 如2px = 2py =2pz
/ / / / / / 1s<—2s<—2p<3—s<3—p<—4s<3d<4—p<5—s<4d<5—p<—6s<4f<5d<6—p<7—s<5f<6d<—7p
结合电子云的形状及伸展方向显然可知:S亚层有 1个轨道,P亚层有3个轨道, d 亚层有5个轨道, f亚层有7个轨道。
四、电子自旋
无机化学 原子核外电子的运动状态

1
能量最低原理
排布 规律
2
泡利不相容原理
3
洪特规则及特例
第五章 原子结构与元素周期律 第一节 原子核外电子的运动状态与排布
2.1 原子核外电子排布-基态原子中电子的排布原理 1.能量最低原理 核外电子的分布总是尽量先分布在能量较低的轨道, 使整个原子处于能量最低的状态。只有当能量最低的轨 道已占满后,电子才能依次进入能量较高的轨道。
m——电子质量
h——普朗克常数
E——体系总能量 V——电子的势能
第五章 原子结构与元素周期律 第一节 原子核外电子的运动状态与排布
1.4 原子核外电子的运动状态-电子云
电子运动有规律,但无法确定其运动轨迹。 概率—在核外某些区域电子出现的机会;某些 区域电子出现的机会多,概率大;某些区域电 子出现的机会少,概率小。 概率密度——电子在原子核外某处单位体积内 出现的概率
第五章 原子结构与元素周期律 第一节 原子核外电子的运动状态与排布
1.1 原子核外电子的运动状态-量子化 波尔氢原子模型 成功地解释了氢原子和类氢原子(如He+、Li2+) 的光谱现象, 推动了原子结构的发展。 严重的局限性。只能解释单电子原子(或离子) 光谱的一般现象,不能解释多电子原子光谱。
波尔理论的缺陷,促使人们去研究和建立能 描述原子内电子运动规律的量子力学原子模型。
而是表示电子出现在各点的几率高低。
第五章 原子结构与元素周期律 第一节 原子核外电子的运动状态与排布 1.4 原子核外电子的运动状态-电子云 电子云的图形表示:
电子云图
电子云界面图
(电子出现几率>95%的 区域)
电子云 等密度面图
第五章 原子结构与元素周期律 第一节 原子核外电子的运动状态与排布 1.5 取原子核外电子的运动状态-四个量子数
选择填空题及答案

选择填空题 化学热力学2.选择题(1)一瓶盛有N 2和H 2的混合气体,当选择H 2作为体系时,则环境为( A )。
A. N 2、瓶子及瓶外其他物质 B. 瓶子及瓶外其他物质 C. N 2和瓶子 D. N 2(2)H 2和O 2在绝热钢瓶中生成水,则( B )。
A. ΔH = 0 B. ΔU = 0 C. ΔS = 0 D. ΔG = 0(3)封闭体系的内能变化ΔU 体系和环境的内能变化ΔU 环境之间的关系为( A )。
A.∣ΔU 体系∣=∣ΔU 环境∣ B.∣ΔU 体系∣>∣ΔU 环境∣ C.∣ΔU 体系∣<∣ΔU 环境∣D. ΔU 体系 = ΔU 环境(4)孤立体系中,下列说法正确的是( D )。
A. ΔU = W 体系>0B. ΔU = W 环境>0C. ΔU = W 体系D. ΔU = 0(5)体系不做非体积功的等压过程,吸收的热Q p 与体系焓变关系为( C )。
A. Q p >ΔH B. Q p <ΔH C. Q p = ΔH D. Q p = ΔU(6)一个体系倾向于取得最大的混乱度,因为( A )。
A. 变为混乱状态的途径多 B. 变为有序状态的途径多 C. 变为混乱状态的途径少D. 变为有序状态必放热(7)相变H 2O(s) → H 2O(g)的ΔH 和ΔS 为( C )。
A. ΔH 为正,ΔS 为负B. ΔH 为负,ΔS 为正C.均为正值D.均为负值 (8)不受温度影响的放热自发反应的条件是( B )。
A. 任何条件下B. 熵增过程C. 熵减过程D. 高温下(9)相同条件下,由相同反应物变为相同的产物,反应由两步与一步完成相比( D )。
A.放出热量多B.内能增多C.熵增多D.焓、熵、内能变化相等 (10)标态下,N 2(g)与H 2(g)反应生成1.0g NH 3(g)时,放热a kJ ,故NH 3的mf H ∆Θ值是kJ·mol -1( C )。
A. a B. -a /17 C. -17a D. 17a(11)已知H 2O(l)的mf G ∆Θ= -237.19 kJ·mol -1,水的分解反应2H 2O(l) = 2H 2(g) + O 2(g),在标准状态下,该反应的吉布斯函数变是( D )kJ·mol -1。
核外电子的空间运动状态

在20世纪90年代,随着计算机技术的发展,人们开始关注核外电子的空间运动状态。
这是一种感兴趣的物理问题,因为它可以用来量化核外电子作为其空间运动状态的可能性,并可以用来模型处理各种量子化学和物理过程。
最先研究这个问题的是一位挪威科学家,他发明了一种称为“抛物”的数学模型,用于描述核外电子的空间运动状态。
在抛物模型中,电子的空间运动可以以“轨道”的形式来描述,它可以根据电子与原子核的静电力耦合和空间的局部结构来定义,并且可以在抛物模型的基础上进行计算和研究。
从这一角度看,核外电子被视为受电子云和电子环绕在原子内部结构中所困扰的粒子和晶体,它们都拥有不同的能量水平、形状和受力情况。
用抛物模型来描述核外电子的空间运动状态,通过计算其能量水平、形状和运动状态,用户可以尝试到达绝对最低能量状态。
抛物模型描述的核外电子空间运动状态对许多量子化学和物理过程都具有重要的作用。
例如,可以用抛物模型来分析电子散射过程,可以用来模拟原子间的化学反应,还可以用它来研究量子物理学中涉及的各种过程。
总之,通过引入“抛物模型”,人们可以非常精确地模拟核外电子的空间运动状态,这对研究量子化学和物理学的诸多过程都具有十分重要的作用。
《核外电子分布及运动》 讲义

《核外电子分布及运动》讲义一、引言在我们探索物质的微观世界时,原子的结构是一个关键的部分。
而核外电子的分布和运动则是理解原子性质和化学行为的基础。
这一领域的知识不仅在化学学科中至关重要,对于物理学、材料科学等众多领域也有着深远的影响。
二、核外电子的分布(一)电子层原子就像一个小小的宇宙,核外电子围绕着原子核在不同的区域运动,这些区域被称为电子层。
电子层按照距离原子核的远近,依次被命名为 K、L、M、N、O、P、Q 等。
离原子核越近的电子层,其能量越低;离原子核越远的电子层,其能量越高。
(二)电子亚层在每个电子层中,电子还分布在不同的亚层。
常见的亚层有 s、p、d、f 等。
s 亚层呈球形,p 亚层呈哑铃形,d 亚层和 f 亚层的形状则更为复杂。
(三)电子排布规律1、能量最低原理电子总是优先占据能量最低的轨道,这样可以使原子处于最稳定的状态。
2、泡利不相容原理在同一个原子中,不可能有两个电子的四个量子数完全相同。
这意味着每个轨道最多只能容纳两个电子,且它们的自旋方向相反。
3、洪特规则在等价轨道(相同电子亚层、相同能量的轨道)上的电子,将尽可能分占不同的轨道,且自旋方向相同。
三、核外电子的运动(一)电子云由于电子的运动具有不确定性,我们无法确切地知道电子在某一时刻的位置和速度。
但我们可以通过概率统计的方法来描述电子在原子核外出现的可能性。
这种概率分布的形象表示就是电子云。
电子云密集的地方,表示电子出现的概率大;电子云稀疏的地方,表示电子出现的概率小。
(二)电子的运动状态电子的运动状态可以用四个量子数来描述:1、主量子数(n)决定电子所处的电子层,n 越大,电子离原子核越远,能量越高。
2、角量子数(l)决定电子所处的亚层,l 的取值范围是 0 到 n 1。
3、磁量子数(m)决定电子在亚层中的具体轨道,m 的取值取决于 l,取值范围是 l 到+l。
4、自旋量子数(ms)表示电子的自旋方向,取值为+1/2 或-1/2。
(全)原子核外电子运动状态PPT资料
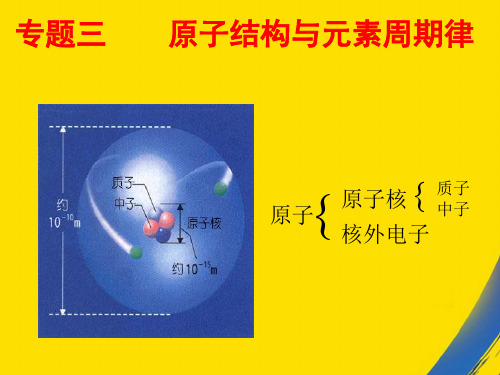
一、原子核外电子的运动状态
练习1:写出19号元素、35号元素的原 子结构示意图
练习2:写出Mg、N、Cl、O2、NH3 的电子式
1、能层—电子层〔energy shell)
即n2
(5〕每个轨道最多容纳2个电子。
(6〕每个能层最多容纳电子数: 2 n 2
4、电子的自旋:
原子核外电子除绕原子核高速运动外,还像地 球一样绕自己 的轴自转,自转只有两种相反的 方向---顺时针方向和逆时针方向
总结:原子核外没有运动状态完全相同 的两个电子。
例、钠原子核外电子运动状态有几种? 氯离子核外电子运动状态有几种?
子结构示意图
(2〕能级的表示:s 、p 、d 、f、 核原外子电 核子外运电动子状除态绕用原波子函核数高描速述运,动即外电,子还云像模地型球。一样绕自己 的轴自转,自转只有两种相反的方向---顺时针方向和逆时针方向
一的、电原 子子式核外电子的运动状态 原核子外核 电外子电运子动除状绕态原用子波核函高数速描运述动,外即,电还子像云地模球型一。样绕自己 的轴自转,自转只有两种相反的方向---顺时针方向和逆时针方向 (总5结〕:每原个子轨核道外最没多有容运纳动2状个态电完子全。相同的两个电子。 (N层2〕:各有能4个级能原级子4轨s、道4形p、状4及d伸、展4f 方向:
K层:只有1个能级1s 练匀习称1地:分写布出在1一9号些元同素心、环3上5号,元他素引的入原量子化条件,成功地解释了氢原子光谱。
子(结6〕构每示个意能图层最多容纳电子数: 2 n 2 1为9了13描年述,电玻子尔云综的合形了状普人朗们克把的电量子子出理现论概,率爱约因为斯9坦0%的的光空子间理圈论起和来卢,瑟得福到的电原子子云模的型轮,廓提图出,了人新们的把原电子子模云型的:轮在廓原图子称核为的原周子围轨,道电。子被 匀核称外地 电分子布运在动一状些态同用心波环函上数,描他述引,入即量电子化云条模件型,。成功地解释了氢原子光谱。
