生物技术大实验部分操作程序-易
微生物学实验一 微生物制片及形态观察
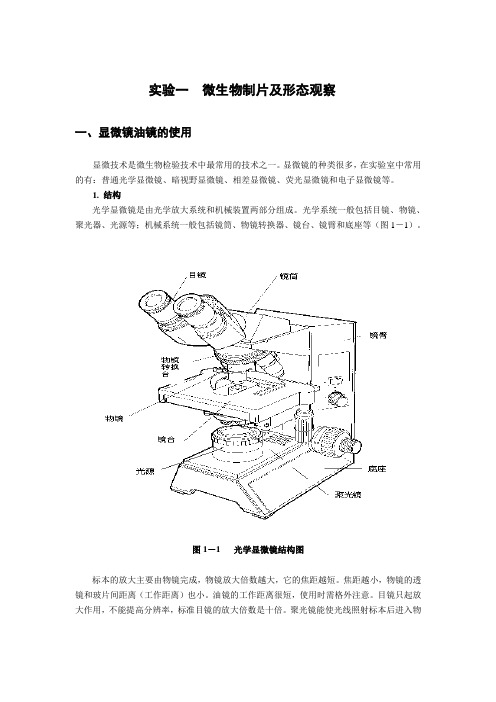
实验一微生物制片及形态观察一、显微镜油镜的使用显微技术是微生物检验技术中最常用的技术之一。
显微镜的种类很多,在实验室中常用的有:普通光学显微镜、暗视野显微镜、相差显微镜、荧光显微镜和电子显微镜等。
1. 结构光学显微镜是由光学放大系统和机械装置两部分组成。
光学系统一般包括目镜、物镜、聚光器、光源等;机械系统一般包括镜筒、物镜转换器、镜台、镜臂和底座等(图1-1)。
图1-1 光学显微镜结构图标本的放大主要由物镜完成,物镜放大倍数越大,它的焦距越短。
焦距越小,物镜的透镜和玻片间距离(工作距离)也小。
油镜的工作距离很短,使用时需格外注意。
目镜只起放大作用,不能提高分辨率,标准目镜的放大倍数是十倍。
聚光镜能使光线照射标本后进入物镜,形成一个大角度的锥形光柱,因而对提高物镜分辨率是很重要的。
聚光镜可以上下移动,以调节光的明暗,可变光栏可以调节入射光束的大小。
显微镜用光源,自然光和灯光都可以,以灯光较好,因光色和强度都容易控制。
一般的显微镜可用普通的灯光,质量高的显微镜要用显微镜灯,才能充分发挥其性能。
有些需要很强照明,如暗视野照明、摄影等,常常使用卤素灯作为光源。
2. 原理显微镜的放大效能(分辨率)是由所用光波长短和物镜数值口径决定,缩短使用的光波波长或增加数值口径可以提高分辨率,可见光的光波幅度比较窄,紫外光波长短可以提高分辨率,但不能用肉眼直接观察。
所以利用减小光波长来提高光学显微镜分辨率是有限的,提高数值口径是提高分辨率的理想措施。
要增加数值口径,可以提高介质折射率,当空气为介质时折射率为1,而香柏油的折射率为1.51,和载片玻璃的折射率(1.52)相近,这样光线可以不发生折射而直接通过载片、香柏油进入物镜,从而提高分辨率。
显微镜总的放大倍数是目镜和物镜放大倍数的乘积,而物镜的放大倍数越高,分辨率越高。
3. 使用方法1)低倍镜观察先将低倍物镜的位置固定好,然后放置标本片,转动反光镜,调好光线,将物镜提高,向下调至看到标本,再用细调对准焦距进行观察。
高中生物基因工程的基本操作程序

高中生物基因工程的基本操作程序2019年3月20日(考试总分:130 分考试时长: 120 分钟)一、单选题(本题共计 20 小题,共计 100 分)1、(5分)下图是将人的生长激素基因导入细菌B细胞内制备“工程菌”的示意图。
已知细菌B细胞内不含质粒A,也不含质粒A上的基因。
判断下列说法正确的是A.将重组质粒导入细菌B常用的方法是显微注射法B.将完成导入过程后的细菌涂布在含有氨苄青霉素的培养基上,能生长的只是导入了重组质粒的细菌C.将完成导入过程后的细菌涂布在含有四环素的培养基上,能生长的就是导入了质粒A的细菌D.目的基因成功导入的标志是受体细胞能产生生长激素的mRNA2、(5分)下列关于生物工程中常见的几种酶的叙述,正确的是A.DNA连接酶可把目的基因与载体的黏性末端的碱基黏合,形成重组DNAB.限制性核酸内切酶将一个DNA分子切成两个片段需产生两个水分子C.Taq酶是用PCR仪对DNA分子扩增过程中常用的一种耐高温的DNA连接酶D.纤维素酶和果胶酶处理植物细胞获得原生质体,便于植物组织培养3、(5分)下列不属于基因工程成果的是A.乳腺生物反应器生产药用蛋白 B.从大肠杆菌体内获得白细胞介素C.从大肠杆菌内获得生长激素 D.用高产青霉菌生产青霉素4、(5分)下列关于转基因技术应用的叙述,错误的是A.可以将抗病虫害基因转入农作物细胞中,使其具有相应的抗性B.可以使用DNA重组的微生物生产稀缺的基因药物C.可以通过转基因技术使奶牛的乳汁中富含某种营养物质D.将不同生物的DNA进行转移和重组,可以创造出新物种5、(5分)下列关于基因工程应用的叙述,正确的是A.基因诊断的基本原理是DNA分子杂交B.基因治疗就是把缺陷基因诱变成正常基因C.一种基因探针能检测水体中的各种病毒D.原核生物基因不能用来进行真核生物的遗传改良6、(5分)下列有关基因身份证的说法,正确的是A.基因身份证上可以检测到个人的所有基因B.基因身份证只对少数、个别基因进行检测C.用基因身份证去看病或预见将来已经实践应用D.有基因身份证就可以治疗任何疾病7、(5分)水母发光蛋白由236个氨基酸构成,其中有三种氨基酸构成发光环,现已将这种蛋白质的基因作为生物转基因的标记。
《基因工程的基本操作程序》教案

《基因工程的基本操作程序》教案一、教学目标1. 知识目标了解基因工程的概念及其应用领域。
掌握基因工程的基本操作程序和原理。
理解基因工程在生物技术和农业上的重要性。
2. 技能目标能够运用基因工程的原理和技术,设计和实施基因改造实验。
能够分析基因工程实验结果,并提出合理的解释和结论。
3. 情感目标培养对基因工程技术的兴趣和好奇心,提高对生物科学的热情。
培养学生的团队合作意识和批判性思维能力。
二、教学内容1. 基因工程概述介绍基因工程的概念和定义。
讨论基因工程在生物技术和农业上的应用领域。
2. 基因重组技术解释基因重组技术的原理和步骤。
介绍基因重组技术在基因工程中的应用实例。
3. 基因克隆与表达讲解基因克隆的概念和过程。
探讨基因表达的调控机制和表达水平的优化方法。
4. 基因编辑技术介绍基因编辑技术的原理和操作步骤。
探讨基因编辑技术在基因工程中的应用实例和前景。
5. 基因工程实验设计学习基因工程实验设计的基本原则和方法。
练习设计和实施基因改造实验。
三、教学方法1. 讲授法通过教师的讲解,引导学生掌握基因工程的基本概念和原理。
结合实例讲解基因工程技术的应用和实验设计方法。
2. 实验法安排基因工程实验课程,让学生亲手操作,实践基因改造技术。
引导学生分析实验结果,培养学生的实验操作和数据分析能力。
3. 小组讨论法分组让学生讨论基因工程技术的应用和实验设计问题。
培养学生的团队合作意识和批判性思维能力。
四、教学评价1. 课堂参与度观察学生在课堂上的发言和提问情况,评估学生的参与度。
2. 实验报告评估学生在基因工程实验中的操作技能和实验结果分析能力。
3. 小组讨论报告评估学生在小组讨论中的表现和提出的观点,包括团队合作意识和批判性思维能力。
4. 课后作业和测验布置相关基因工程主题的课后作业和测验,评估学生对知识点的掌握情况。
五、教学资源1. 教材和参考书选择适合基因工程课程的教材和参考书,为学生提供全面的学习资源。
生物医学实验知识点

生物医学实验知识点生物医学实验知识点三篇生物医学实验篇一:生物医学综合实验报告生物医学综合实验报告学院(系):年级:学号:学生姓名:实验一脉搏信号采集功能I.实验目的1.掌握检测脉搏传感器特性和使用方法。
2.掌握正向、反向放大电路的应用。
3.掌握脉搏测量的硬件电路原理。
4.掌握表征脉搏参数波形及特征点的识别方法。
II.实验内容通过脉搏传感器将信号外接进入本系统,检测人体脉搏信号经单片机处理以后,其信号波形可以LCD上实时显示、或者由PC显示。
拓展内容:对输入的脉搏信号进行处理,计算脉率。
III.实验器材1.示波器2.脉搏传感器IV.实验步骤脉搏功能测试电路布局如下:1.电路的调试:I.第一级运放的调试与计算:把示波器的探头一端与E20连接,另一端接GND。
通电,不接外部传感器,观察示波器显示的信号。
如信号不在“0V”时,通过调节旋转电位器RP5,同时观察示波器显示的信号的变化,直至示波器的信号在“0V”时,停止调节电位器RP5。
之后,关电取下示波器的探头;II.低通的选择与计算:此脉搏功能模块在低通滤波部分设置了“10Hz低通滤波”“1KHz低通滤波”两大部分,可以通过连线选择其中的一种。
选择操作如下:a.10Hz低通滤波:第一、把示波器的探头一端与E21连接,另一端接GND;第二、通过实验导线把P1与P2相连接;第三、通电;第四、脉搏传感器与J1正确连接。
观察示波器显示的波形。
b.1KHz低通滤波:第一、把示波器的探头一端与E22连接,另一端接GND;第二、通过实验导线把P1与P3相连接;第三、通电;第四、脉搏传感器与J1正确连接。
观察示波器显示的波形。
III.放大倍数的调试与计算:此脉搏功能模块的放大倍数是通过旋转电位器RP7来实现的。
在I、II的基础上来实现以下功能。
选择操作如下:第一、把示波器的探头一端与E23连接,另一端接GND;第二、根据低通滤波来决定具体的连线。
选择了“10Hz低通滤波”,通过实验导线把P4与P6相连接;选择了“1KHz低通滤波”,通过实验导线把P5与P6相连接。
生理实验

实验设计
• 实验设计的基本程序
• 实验设计(experimental design)是科学研究的一个组成 部分,是根据立题而提出的实验方法和实验步骤,这是完 成课题的实施方案。实验设计包括立题→实验动物选择与 分组→实验动物处理方案→选择观察指标→数据收集和分 析→实验结果的处理和研究报告的撰写。
• 随机(randomization)原则随机不是随便而是随机遇而定, 也就是指被研究的样本是由总体中任意抽取的,即在抽取 时要使每一样本有同等机会被抽取,随机抽样是缩小抽样 误差的基本方法。
• 按微生物被控制程度分级有①一级:普通动物 ( conventional animal , CV ) ; ② 二 级 : 清 洁 级 动 物 ( clean animal , CL ) ; ③ 三 级 : 无 特 定 病 原 体 动 物 ((specific pathogen free (SPF)animal,SPF);④四 级:无菌动物(germ free (GF) animal,GF)。
人体及动物生理实验
董守良、常民、马明
• 生理学实验概论 • 生理学常用仪器和设备
• 动物实验基本操作技术 • 研究性实验的程序和基本要求
一、生理学实验概论
• 生理实验教学的性质、任务和目的
通过实验获得知识的科学,属于实验科学。生理医学知 识来源于科学实验,是一门实践性很强的实验科学。17 世 纪初,英国Harvey 首先在动物身上用活体解剖和科学实验 的方法研究了血液循环,证明心脏是循环系统的中心,血液 由心脏射入动脉,再由静脉回流入心,不断循环。1628 年, Harvey 的著作《心与血的运动》出版,是历史上第一本基 本实验证据的生理学著作,标志着生理学成为一门独立的学 科。因此,科学实验创立和发展了生理学理论,是研究生理 学的基本方法。要真正学好生理学,必须同时重视理论课和 实验课的学习,两者相辅相成,不可分割。
微生物染色技术

Page 27
(六)革兰氏染色各步骤的要求
1、载玻片的要求
载玻片应清洁干净。 常规工作中可将载玻片清洗干
净后浸泡在95%酒精中,随 用随取。
28
Page 28
2、涂片的要求
滴一滴无菌水在载玻片中央, 准备涂片;或用接种环沾3-4 环无菌水,用于涂片。
无菌水不宜过多,否则后续的 干燥时间增多。
红色
2#
球状
紫色
结果判断 G-杆菌 G+球菌
报告:经镜检,该细菌为G-(革兰氏阴性) 杆菌。
26
Page 26
(五)操作注意事项
1、载玻片要洁净无油迹。涂片时,滴生理盐 水不要过多,挑菌量宜少,涂片要均匀,菌
? 膜宜薄。
2、革兰氏染色成败的关键是酒精脱色。 3、染色过程中勿使染色液干涸。 4、选用幼龄的细菌。
17
Page 17
(一)革兰氏染色流程
涂片 → 干燥 → 固定 → 染色 → 镜检
初染 → 媒染 → 脱色 → 复
结晶紫初染1min,水洗
染
碘液媒染1min,水洗
乙醇脱色20秒,立即水洗至无色
番红复染1min,水洗
18
Page 18
(二)革兰氏染色原理
革兰氏染色后镜检,显微镜下 观察发现,有些种类细菌呈红 色,有些种类呈紫色。
31
Page 31
5、涂片为什么要薄而均匀,不能过厚?
涂片过于浓厚,可能会脱色不 足,导致假阳性结果,菌量过 大也不利于菌体排列方式的观 察。
左下角,太厚而不能脱色
同理,不均匀也会在局部过厚, 颜色不一,难以判断。
32
Page 32
5、涂片为什么要薄而均匀,不能过厚?
土壤中微生物的分离与鉴定实验报告

Sdu微生物大实验土壤微生物的分离纯化与鉴定【实验目的】1、从各地区土壤中筛选含几丁质酶的真菌及含果胶酶的菌株;2、通过从土壤中分离纯化菌株,掌握培养基的制备与灭菌技术、微生物的筛选、分离纯化方法和无菌操作技术。
3、复习以前学过的各种染色方法,掌握生理生化试验的原理与方法。
4、掌握微生物的鉴定技术、菌种保藏技术。
【实验原理】1、微生物的分离与纯化:从混杂的微生物群体中获得只含有某一种或某一株微生物的过程称为微生物的分离与纯化。
此次实验采取平板分离法,该方法操作简便,普遍用于微生物的分离与纯化,其基本原理主要包括两个方面:a.选择适合于待分离微生物的生长条件或加入某种抑制剂造成只利于待分离微生物生长,而抑制其它微生物生长的环境,从而淘汰大部分不需要的微生物。
b.微生物在固体培养基上生长形成的单个菌落可以是由一个细胞繁殖而成的集合体,因此可通过挑取单菌落而获得一种纯培养。
获得单菌落的方法可通过稀释涂布平板法或平板划线法等技术来完成。
微生物的观察可以用显微镜观察其细胞形态,也可以用肉眼观察其菌落形态。
前者是微生物的显微镜观察技术,后者是微生物的肉眼观察技术。
2、霉菌:霉菌可产生复什分枝的菌丝体,分基内菌丝和气生菌丝,气生菌丝生长到一定阶段分化产生繁殖菌丝,由繁殖菌丝产生孢子。
霉菌菌丝体(尤其是繁殖菌丝)及孢子的形态特征是识别不同种类霉菌的重要依据。
霉菌菌丝和孢子的宽度通常比细菌和放线菌粗得多(约 3-10μm ),常是细菌菌体宽度的几倍至几十倍,因此,用低倍显微镜即可观察。
观察霉菌的形态有多种方法,常用的有直接制片观察法、载玻片培养观察法和玻璃培养观察法三种方法,本实验采用载玻片培养观察法。
3、果胶酶筛选培养基:配制以果胶为唯一碳源的筛选培养基,在该培养基上,只有能分解利用果胶的菌株才能够生长,依此来从土壤中筛选出能够产果胶酶的菌株。
刚果红(Congo Red,简称CR)是一种染料,它可与果胶形成红色复合物,但并不和果胶水解后的产物发生这种显色反应,在含有果胶的培养基中加入刚果红时,刚果红能与培养基中的果胶形成红色复合物。
食品微生物检验技术W4304沙门氏菌检验-检验操作程序及要点-传统鉴定-4-微教材

《农产品/食品微生物检验》课程-微教材知识讲解沙门氏菌操作程序及要点——传统鉴定沙门氏菌操作程序及要点分为检验程序和操作步骤一、检验程序根据国标,沙门氏菌的检验程序为: 检样经无菌处理后,称取25 g(mL)样品加入到225 mL BPW中36±1℃培养8~18h;取培养物1mL 接种到10mL的TTB中同时取1mL 接种到10mL 的SC中,分别于42±1℃和36±1℃培养18~24h;取培养后的增菌液分别划线接种于BS琼脂平板和XLD琼脂平板(或HE琼脂平板、显色培养基平板)中,于36±1℃培养18~24h,BS 需延长至40~48h;培养后挑取可疑菌落做生化试验。
挑取2 个以上典型或可疑菌落——接种三糖铁琼脂,赖氨酸脱羧酶试验管和对照管、供做靛基质试验的色氨酸肉汤、尿素(pH7.2),KCN试验管和对照管,同时划线营养琼脂平板——如5项生化都符合——则直接判定为沙门氏菌——如五项中靛基质阳性——则补做甘露醇和山梨醇试验,如果两项均为阳性——为可疑沙门氏菌,但需结合血清学鉴定结果进行判定——如五项中H2S阴性——则需补做ONPG试验,ONPG阴性,同时赖氨酸脱羧酶阳性——为沙门氏菌——也可在三糖铁和赖氨酸脱羧酶试验初步判断结果后,使用商品化的生化鉴定系统进行生化鉴定——判定是否为沙门氏菌——如果5项反应中有2项以上不符合——则沙门氏菌阴性——最后报告结果二、操作步骤主要分为:1、样品处理与前增菌;2、增菌;3、分离;4、传统生化鉴定试验;5、系统生化鉴定试验;6、血清学鉴定。
其中传统生化鉴定试验又分为三糖铁和赖氨酸脱羧酶试验,靛基质、尿素和氰化钾试验、甘露醇、山梨醇以及ONPG试验三个部分。
本片以鸡肉为样品,演示沙门氏菌检验的样品处理和前增菌的操作过程。
1、前增菌:在无菌室内,以75%酒精擦拭样品外包装,尤其是包装的开口处,用无菌剪刀在样品封口处剪开包装袋,换用一个无菌剪刀将鸡肉样品剪碎至无菌罐内,用无菌镊子称取25 g样品至盛有225 mL BPW的样品瓶中,再转入注明样品信息、检测人员以及检测日期的均质袋中,密封,用拍击式均质器拍击2 min。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1 生物技术大实验操作指南 注意事项 1、 工作服穿戴,禁止吃东西和大声喧哗和串门聊天。 2、 用电、气安全注意事项。 3、 节约用水,安全用水,有毒、害废水的正确处理。 4、 实验室、台卫生,最后离开实验室的同学检查水电门窗。 5、 实验报告,正确记录原始数据,分析结果得出合理的结论。
实验一 鸡输卵管总RNA提取(溶菌酶基因的提取) 一、原理:组织细胞在冰浴中剪碎(最好有液氮),加Trizol快速匀浆碾磨,加一定体积的氯仿振荡,离心,取水相,加等体积的异戊醇(或无水乙醇)沉淀,75%乙醇洗涤,晾干,无RNase的ddH2O溶解。 二、试剂与设备: TotalRNAExtractor(Trizol)或RNAsimple Total RNA Kit,氯仿,异戊醇,无水乙醇,ddH2O Free RNase。研钵,玻璃匀浆器,16000转低温冷冻离心机。 三、步骤: 1、新鲜鸡输卵管膨大部,50mg,预冷的研钵中剪碎,加1ml Trizol冰浴中匀浆,RT 5-10 Min。 2、加200ul 氯仿,振荡15 Sec,RT 3 Min。 3、4℃ 12000rpm,离心10Min,吸取上层水相,转入新的离心管。 4、加500ul 异戊醇柔和混匀,RT沉淀30Min,离心同上,留取沉淀。 5、加1ml 75%乙醇洗涤沉淀 2次,勿剧烈振荡,离心同上,收取沉淀,RT晾干3-5Min。 6、50ul ddH2O Free RNase 溶解沉淀。 7、检测RNA纯度与浓度。
四、结果
五、讨论 2
实验二 溶菌酶基因第一链cDNA合成 一、 原理: mRNA经M-MuLV催化,以Oligo dT为引物,将mRNA反转录合成cDNA,此cDNA为单链。 二、 试剂与设备:M-MuLV第一链cDNA合成试剂盒,恒温水浴锅,掌上离心机。 三、 步骤: 1.在冰浴的试管中加入如下反应混合物: 总RNA 或 Poly(A)+ RNA或特异性RNA Xμg Oligo dT (0.5μg/μL) (20 pmol) 1μL RNase free ddH2O 定容至12μL 2. 轻轻混匀后离心3~5 s,反应混合物在65℃温浴5 min后,冰浴30 s,然后 离心3~5 s。 3.将试管冰浴,再加入如下组分: 5×Reaction Buffer 4μL RNase Inhibitor ( 20 U/μL) 1μL dNTP Mix(10 mmol/L) 2μL M-MuLV RT(200 U/μL) 1μL 注:若5×Reaction Buffer出现白色结晶,需37℃温浴数分钟至白色结晶完全溶解,震荡混匀。 4.轻轻混匀后离心3~5 s。 5.在 PCR 仪上按下列条件进行反转录反应cDNA 合成 42℃ 30-60 min 6.终止反应 95℃ 5 min(酶失活),处理后,置于冰上放置或-20℃保存。 * M-MuLV RT酶最后加。
四、结果
五、讨论 3
实验三 鸡溶菌酶基因的PCR扩增 一、原理:利用耐热Taq酶(一种DNA聚合酶),以四种dNTP为底物,在引物的诱导下,经过变性、退火、延伸三步反应,体外合成DNA双链分子。 二、试剂与设备:2X PCR Plus MasterMix,ddH2O,模板,上、下游引物,掌上离心机,PCR仪。 三、步骤: 1、反应体系如下: 模板DNA (第一链cDNA) X ul(<1ug) 引物1(10 uM) 1 ul 引物2(10 uM) 1 ul 2X PCR Plus MasterMix 12.5ul ddH2O 10.5-X ul Total 25 ul 如果体系变化,可按此比例添减。 2、PCR反应条件: 95℃ 5 Min 95℃ 30Sec 56错误!未找到引用源。 30Sec 30 Cycles 72错误!未找到引用源。 30Sec 72错误!未找到引用源。 10Min 3、结果检验 取3-8ul,PCR产物,1%Agarose 电泳。(切下目的条带-20错
误!未找到引用源。保存) 四、结果
五、讨论
实验四 PCR产物的回收纯化 一、 原理:PCR产物经过琼脂糖电泳分离,切取含目的产物的胶条,用胶回收试剂盒回收。 二、 试剂与设备:DNA胶回收试剂盒,TBE电泳Buffer,琼脂糖,Goldview染料,2000 DNA Ladder,无水乙醇,TE或ddH2O,恒温水浴锅,水平电泳仪,高速冷冻离心机等。 三、 步骤: 1、通过琼脂糖凝胶电泳尽可能将目的DNA片段与其它片段分开,用干净的手术刀片将含目的DNA片段的琼脂糖凝胶块切下,放入1.5 ml离心管中,称重。 2、根据胶块的重量和浓度,按每100 mg琼脂糖(如胶块不足100 mg则用水补充至100 mg)加300- 600 μl的比例加入Binding Buffer II。 3、将离心管置于55℃水浴5-10 min,间或混匀,直至胶块完全溶化。 4、当目的片段 < 500 bp时,加入所使用的Binding Buffer II 1/3体积的异丙醇,混 4
匀。当目的片段 ≥ 500 bp时,此步骤可以省略,直接进行步骤5。 5、将溶化好的溶液全部移入吸附柱,室温放置2 min,8,000 rpm 离心1 min。倒掉收集管中的液体,将吸附柱放入同一个收集管中。 6、向吸附柱中加入500 μl Wash Solution,10,000 rpm 离心1 min。倒掉收集管中的液体,将吸附柱放入同一个收集管中。 7、重复步骤6一次。 8、将空吸附柱和收集管放入离心机,12,000 rpm 离心2 min 9、将吸附柱放入干净的1.5 ml离心管中,在吸附膜中央加入30-50 μl Elution Buffer,室温静置1-2 min,12,000 rpm 离心1 min。将所得到的DNA溶液置于-20℃保存或用于后续试验。 四、 结果
五、讨论
实验五 PCR产物-T载体连接与扩增 一、原理:T Vector是一种高效克隆PCR产物(TA Cloning)的专用载体,该载体的3’端具有突出的“T”末端;DNA聚合酶在进行PCR扩增时会在PCR产物双链DNA每条链的3’端加上一个突出的A,T载体的两端就可以和PCR产物的两端进行正确的AT配对,在连接酶的催化下,就可以把PCR产物连接到T载体中,形成含有目的片断的重组载体,该载体即可导入宿主菌扩增。 二、试剂与设备:T-载体,目的DNA片段,掌上离心机,冰瓶(低温恒温仪)等。 三、步骤: 1、反应体系 在0.2 ml PCR管中配制下列连接体系: 反应组分10 μl 反应体系 插入的目的片段 X μl(0.2 pmol) pUCm-T Vector 1 μl(50 ng) 10×Ligation Buffer 1 μl 50% PEG 4000 1 μl T4 DNA Ligase 1 μl Sterilized ddH2O 补足至10 μl (一般最后加入T4 DNA Ligase。) 2、16℃连接1-12 h(建议连接过夜)。 3、连接产物转化进感受态细胞,涂板培养,挑选/鉴定阳性克隆;或将连接产物-20℃保存。
四、结果
五、讨论 5
实验六 感受态细胞的制备与转化 一、原理:受体细胞经过一些特殊方法(如:电击法,CaCl2等化学试剂法)处理后,使细胞膜的通透性发生变化,成为能容许外源DNA分子通过的感受态细胞;细菌处于0℃,CaCl2的低渗溶液中,菌细胞膨胀成球形,转化混合物中的DNA形成抗DNase的羟基-钙磷酸复合物粘附于细胞表面,经42℃短时间热冲击处理,促使细胞吸收DNA复合物,进入细胞的DNA分子通过复制、表达实现遗传信息的转移,使受体细胞出现新的遗传性状。 二、试剂与设备:LB培养基,0.1M CaCl,冰水,平皿,试管,恒温水浴锅,低温冷冻离心机,无菌工作台等。 三、步骤: (一)感受态细胞的制备: 1.前一晚接种受体菌(DH5α或其他),挑取单菌落于LB培养基中37℃摇床培养过夜(约16小时)。
2.取1ml过夜培养物转接于100ml LB(1:100)培养基中,在37℃摇床上剧烈振荡培养约2.5-3小时(250-300rpm),直至OD600为0.4-0.6。
3.将 0.1M CaCl2 溶液置于冰上预冷;以下步骤需在超净工作台和冰上操作。 4.吸取 1.5ml培养好的菌液至1.5ml离心管中,在冰上冷却10分钟。 5.4℃下3000g冷冻离心5分钟。 6.弃去上清,加入 100μl预冷0.1M CaCl2 溶液,用移液枪轻轻上下吸动打匀,使细胞重新悬浮,在冰放置20分钟。
7.4℃下3000g冷冻离心5分钟。 8.弃去上清,加入 100μl预冷0.1M CaCl2 溶液,用移液枪轻轻上下吸动打匀,使细胞重新悬浮。
9.细胞悬浮液可立即用于转化实验或添加冷冻保护剂( 15% - 20%甘油)后超低温冷冻贮存备用(-70℃)。
(二)细胞转化: 1、将100 μl感受态细胞置于冰上解冻后,加入实验五的连接液 10 μl,轻轻混匀,冰上放置30 min。
