九年级化学中考模拟试卷及答案
2014九年级中考化学模拟试卷及答案
一填空题(每题2分,共20分请将每题选项填写在下面的表格中)
1.下列变化中,前者属于物理变化,后者属于化学变化的是()
A干冰升华,钢铁生锈B、牛奶变酸,塑料降解
C、酒精挥发,石油蒸馏
D、光合作用,蜡烛熔化
2.现有5种物质:①浓盐酸②烧碱③食盐④浓硫酸⑤铁把它们长期露置在空气中,其中发生化学变化且质量增加的是()
A.①② B.②⑤ C.③④ D.③⑤
3.下列实验的实验现象与实验结论都正确的是( )
实验操作实验现象实验结论
A 将一根未打磨的铝条放入
硫酸铜溶液中
无紫红色固体析出铝不如铜活泼
B 将带火星的木条伸入氧气中木条复燃氧气能支持燃烧
C 将CO通过灼热的氧化铜黑色氧化铜变成红色CO具有可燃性
D 将氢氧化钠固体加入水中溶液温度升高该反应放热
4.给病人注射用的生理盐水是按H2O∶NaCl=110∶1质量比配制而成的,则生理盐水溶质的质量分数是()
A.0.88% B.0.9% C.0.85% D.0.91%
5.生活中常见的柠檬汁、蕃茄汁,柑桔汁、酸奶等物质的水溶液都有一定的酸性,这是由于它们
( )
A.溶于水时生成了盐酸B.水溶液中含有酸分子
C.组成中含有氢元素D.溶于水时,在水中解离产生了氢离子
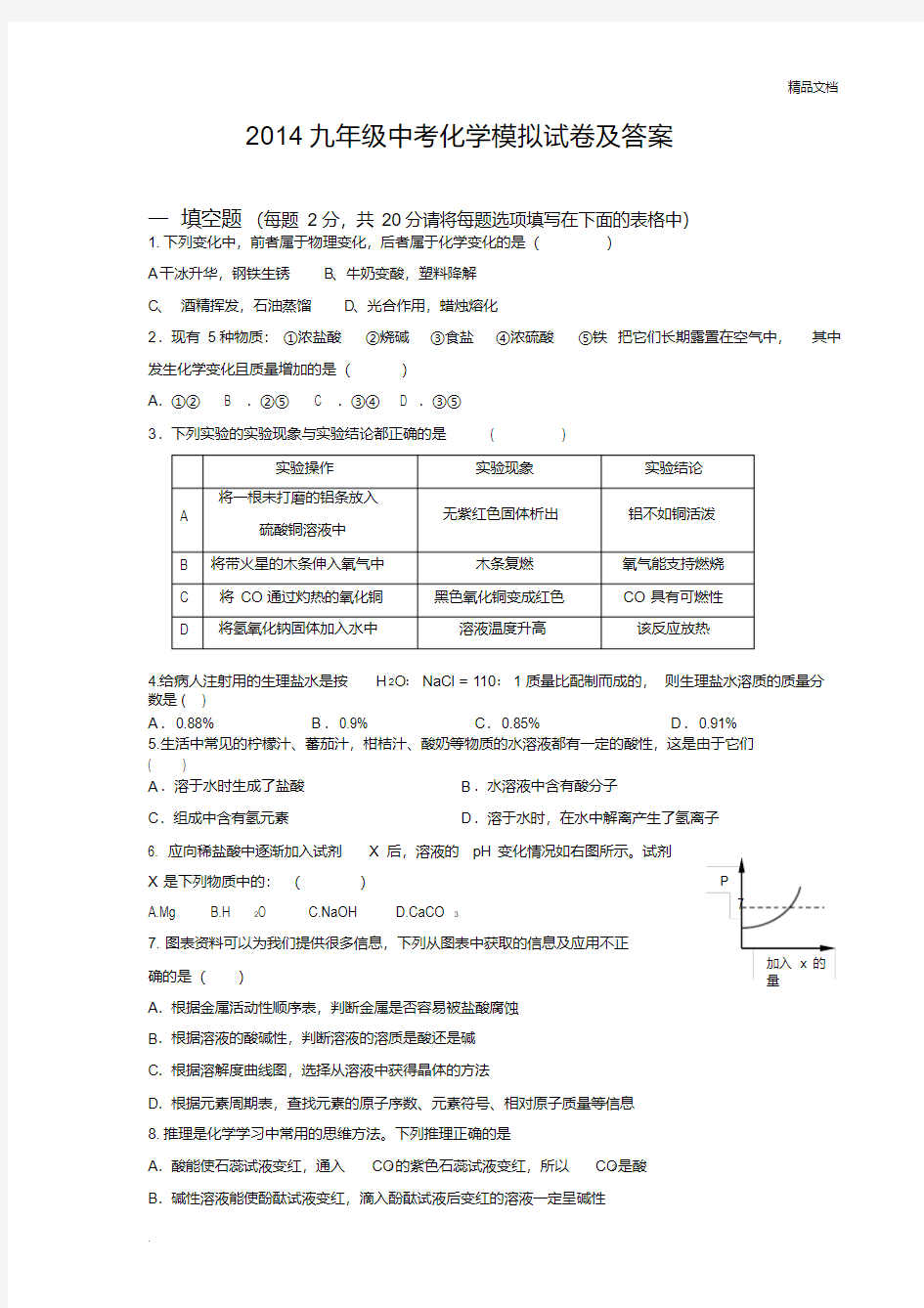
6. 应向稀盐酸中逐渐加入试剂X后,溶液的pH变化情况如右图所示。试剂
X是下列物质中的:()
A.Mg
B.H2O
C.NaOH
D.CaCO3
7.图表资料可以为我们提供很多信息,下列从图表中获取的信息及应用不正确的是()
A.根据金属活动性顺序表,判断金属是否容易被盐酸腐蚀
B.根据溶液的酸碱性,判断溶液的溶质是酸还是碱
C.根据溶解度曲线图,选择从溶液中获得晶体的方法
D.根据元素周期表,查找元素的原子序数、元素符号、相对原子质量等信息8.推理是化学学习中常用的思维方法。下列推理正确的是
A.酸能使石蕊试液变红,通入CO2的紫色石蕊试液变红,所以CO2是酸B.碱性溶液能使酚酞试液变红,滴入酚酞试液后变红的溶液一定呈碱性
7
加入x的
量
P
C.锌和铜均是金属,锌与稀硫酸反应生成氢气,则铜也能与稀硫酸反应生成氢气
D.溶液中有晶体析出,其溶质质量减小,所以溶质的质量分数一定减小
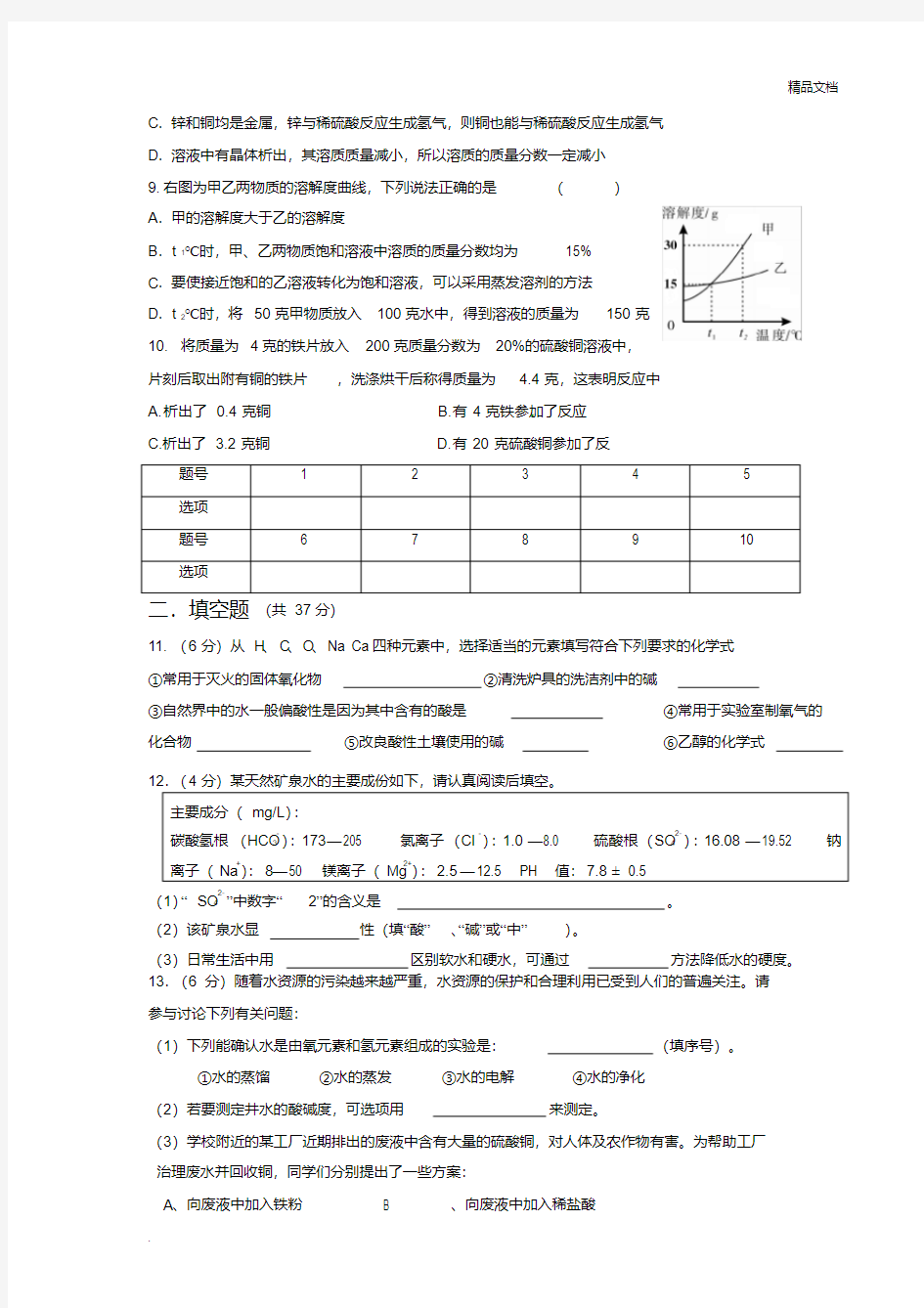
9.右图为甲乙两物质的溶解度曲线,下列说法正确的是()
A.甲的溶解度大于乙的溶解度
B.t1℃时,甲、乙两物质饱和溶液中溶质的质量分数均为15%
C.要使接近饱和的乙溶液转化为饱和溶液,可以采用蒸发溶剂的方法
D.t2℃时,将50克甲物质放入100克水中,得到溶液的质量为150克
10.将质量为4克的铁片放入200克质量分数为20%的硫酸铜溶液中,
片刻后取出附有铜的铁片,洗涤烘干后称得质量为 4.4克,这表明反应中
A.析出了0.4克铜
B.有4克铁参加了反应
C.析出了 3.2克铜
D.有20克硫酸铜参加了反
题号 1 2 3 4 5
选项
题号 6 7 8 9 10
选项
二.填空题(共37分)
11.(6分)从H、C、O、Na Ca四种元素中,选择适当的元素填写符合下列要求的化学式
①常用于灭火的固体氧化物②清洗炉具的洗洁剂中的碱
③自然界中的水一般偏酸性是因为其中含有的酸是④常用于实验室制氧气的
化合物⑤改良酸性土壤使用的碱⑥乙醇的化学式
12.(4分)某天然矿泉水的主要成份如下,请认真阅读后填空。
主要成分(mg/L):
碳酸氢根(HCO3-):173—205 氯离子(Cl-):1.0—8.0 硫酸根(SO42-):16.08—19.52 钠离子(Na+):8—50 镁离子(Mg2+):2.5—12.5 PH值:7.8±0.5
(1)“SO42-”中数字“2”的含义是。
(2)该矿泉水显性(填“酸”、“碱”或“中”)。
(3)日常生活中用区别软水和硬水,可通过方法降低水的硬度。13.(6分)随着水资源的污染越来越严重,水资源的保护和合理利用已受到人们的普遍关注。请
参与讨论下列有关问题:
(1)下列能确认水是由氧元素和氢元素组成的实验是:(填序号)。
①水的蒸馏②水的蒸发③水的电解④水的净化
(2)若要测定井水的酸碱度,可选项用来测定。
(3)学校附近的某工厂近期排出的废液中含有大量的硫酸铜,对人体及农作物有害。为帮助工厂
治理废水并回收铜,同学们分别提出了一些方案:
A、向废液中加入铁粉
B、向废液中加入稀盐酸
C、向废液中加入氢氧化钠
D、向废液中加入活性炭
你认为最合理的方案是。
(4)水是常用的溶剂。若要配制50g 5%的氯化钠溶液,需要进行如下的操作:①计算(需要氯化钠2.5g);②用托盘天平称量 2.5g氯化钠;③用(填“10mL”或“50mL”)量筒量取 mL水;④将两者置于烧杯中,用玻璃棒搅拌。
(5)茶杯内的纱网,可将茶与茶水分离,便于饮用。该设计与化学实验中的操作原理是一致的。
14.(5分)甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答:
(1)25℃时,将25g甲固体加入到50g水中,充分溶解并恢复到原温度
后,得到溶液的质量为 g。
(2)要使35℃时接近饱和的甲溶液变成该温度下的饱和
溶液,可采用的一种方法是。
(3)现有操作步骤: a.溶解 b.过滤 c.降温结晶
d.加热浓缩;若甲固体中含有少量乙,则提纯甲的操作步骤是
(填字母序号)。
(4)将35℃时丙的饱和溶液降温到25℃,则其溶液的溶
质质量分数(填“变大”、“变小”或“不变”)。
(5)向100g35℃的水中加入45g甲固体,发现全部溶解,一段时间后又有部分甲的晶体析出。你
认为“全部溶解”的原因可能是。
15.(7分)小红同学想探究实验室中碳酸钙和盐酸制取二氧化碳后废液中溶质的成分,请你一同
参与探究并回答横线上的七个问题。
.....
【提出问题】废液中的溶质是什么物质?
【作出猜想】小红认为废液中溶质只有CaCl2。
你认为还可能含有的溶质是(填化学式)。
【查阅资料】CaCl2溶液呈中性。
【实验与结论】
(1)请你写出实验室制取二氧化碳的化学方程式。
(2)分别取少量该废液和CaCl2溶液加入到两支试管中,并向其中分别滴入无色酚酞试液做对比试
验,结果两支试管中溶液均无色,于是小红认为自己的猜想是正确的。
(3)你认为小红的实验(填“能”或“不能”)证明她的猜想,理由是
。
(4)如果要证明你的猜想是正确的,你选择(填字母:A、石蕊试液 B、氢氧化钠溶液 C、稀盐酸)来代替酚酞试液,理由是。
(5)若实验证明了你的猜想是正确的,向废液中加入过量的,反应完成后过滤就可得
到只含CaCl2一种溶质的溶液
16.(9分)某研究性学习小组的同学在用硫酸溶液处理废锌片时发现产生的气体具有刺激性气味,
这种现象引起同学们的思考和研究。
【提出猜想】对生成的气体进行猜想:
猜想1:可能是H2 ;猜想2:可能是SO2;猜想3:可能是。
【查阅资料】SO2易溶于水,能与NaOH溶液反应生成Na2SO3。
【实验方案】研究性学习小组的同学设计了下图所示的装置进行探究(夹持仪器已
省略,假设装置中的反应都进行完全)。
【问题讨论】
(1)如果装置A没有明显实验现象,装置C的现象为,则猜想成立。(2)如果装置A的现象为,装置C没有明显实验现象,则猜想成立。
(3)猜想3成立的实验现象是。
(4)装置B中浓硫酸的作用是。
【思维拓展】(1)实验室中可以用氢氧化钠溶液吸收二氧化硫,反应的化学方程式是。
(2)小组内一同学又设计了判断SO2与NaOH溶液能否发生反应的装置(如右上图),实验时发现试管内液面上升,就得出SO2与NaOH溶液发生反应的结论,其他同学认为这一结论不严谨,理由是
__________________________________________。要得到科学严谨的结论,仍利用该装置,需做的
对比实验
三.计算题(7分)
17. 100克稀盐酸恰好与80克10%的氢氧化钠溶液完全反应。求:
(1)稀盐酸中溶质的质量分数是多少?
(2)反应后所得溶液中溶质质量分数是多少?
附答案
一ABBBD CBBCC
二11 CO2NaOH H2CO3H2O2 Ca(OH)2C2H5OH
12 每个硫酸根离子带两个单位的负电荷碱肥皂水煮沸
13 ③ PH试纸 A 50 47.5 过滤
14 65g 降温(蒸发溶剂,加入甲物质) adcb 不变
甲物质溶解时放热,后冷却降温
15 HCl CaCO3 + 2HCl=== CaCl2 + H2O + CO2↑
不能酚酞在酸性溶液中还是无色
A 石蕊在酸性溶液中会由紫色变成红色
CaCO3
16 H2 和SO2
黑色粉末变成红色 1
红色变浅或消失 2
A中红色变浅或消失 C中黑色粉末变成红色
吸水(干燥)
2NaOH+SO2=Na2SO3+H2O
SO2溶解于水也会出现这种现象采用同样装置,烧杯放水做对比试验17 设盐酸中含HCl质量为x,生成NaCl质量为y
HCl +NaOH= NaCl +H2O
36.5 40 58.5
X 80×10﹪y
36.5/x=40/80×10﹪
40/80×10﹪=58.5/y
分别解得 x=7.3g y=11.7g
(1)稀盐酸中溶质的质量分数是7.3/100g×100﹪=7.3﹪
(2)反应后所得溶液中溶质质量分数是11.7g/180g×100﹪=6.5﹪
