课堂新概念2016届高考化学一轮复习12富集在海水中的元素_氯讲义
高考化学第一轮考向分析10《富集在海水中的元素—氯》复习课件 人教版
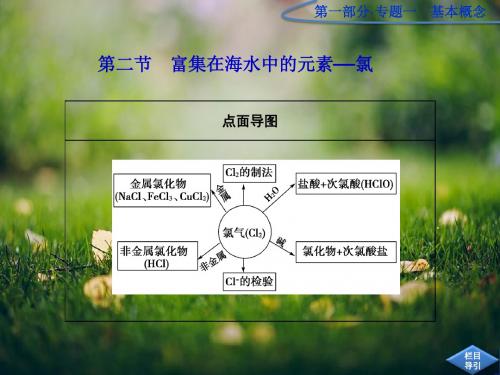
第一部分·专题一 基本概念
【精讲精析】 氯气溶解于水,发生反应:Cl2+H2O HCl + HClO , 生 成 的 HCl 与 CaCO3 发 生 反 应 : 2H + + CaCO3===Ca2 + + CO2↑ + H2O , 滴 加 盐 酸 产 生 Cl2 , HCl + HClO===Cl2↑+H2O。 实验三中为了减少Cl2的溶解用饱和NaCl溶液吸收杂质气体, 用排液法收集装置,应将导管口插入管底,减少Cl2的溶解。 【答案】 (1)HClO Ca2+ Cl2 (2)饱和NaCl A (3)CaCO3+2Cl2+H2O===2HClO+CaCl2+CO2↑
栏目 导引
第一部分·专题一 基本概念
3.应用及原理 (1)制盐酸:利用H2在Cl2中燃烧生成HCl,然后溶于水制盐酸。
(2)制漂白液:利用Cl2与_____________溶液反应制备,其有效 成分为_____________。 NaOH (3)制漂白粉Na:C利lO用Cl2与____________乳浊液反应制备,其有 效成分为_______________。Ca(OH)2
栏目 导引
第一部分·专题一 基本概念
(4)实验开始时,先点燃A处酒精灯,打开分液漏斗旋塞和Ⅰ处 活塞,让氯气充满整个装置,再点燃G处酒精灯,回答下列问 题: ①怎样证明氯气已充满了整个装置?____________________ __________________________________________________。 ② 下 列 装 置 中 的 现 象 是 : C________ ; D________ ; E________;F________。 (5)G装置的硬质玻璃管内盛有碳粉,发生氧化还原反应,其产 物为二氧化碳和氯化氢,写出G中反应的化学方程式______ __________________________________________________。 装置F的作用是________。
2016年高考化学一轮复习第四章第2讲富集在海水中的元素_卤素

第2讲 富集在海水中的元素——卤素[考纲要求] 1.了解氯元素单质及其重要化合物的主要性质及应用。
2.了解氯元素单质及其重要化合物对环境质量的影响。
3.卤族元素的性质递变规律及与化工生产相结合的资源综合利用。
考点一 氯及其化合物的性质和应用1.氯气的物理性质颜色 状态 气味 密度 毒性 溶解性 黄绿色气体刺激性比空气大有毒1体积水溶解 约2体积Cl 2注意 实验室里闻有毒气体及未知气体气味的方法是用手在瓶口轻轻扇动,仅使极少量气体飘进鼻孔。
(如图所示)2.从氯的原子结构认识氯气的化学性质——氧化性――→得1e-H 2,Fe ,I-(1)与金属反应:与变价金属反应生成高价金属氯化物。
①与铁反应:2Fe +3Cl 2=====点燃2FeCl 3。
②与铜反应:Cu +Cl 2=====点燃CuCl 2。
(2)与非金属反应与H 2反应:H 2+Cl 2=====点燃或光照2HCl 。
现象—⎪⎪⎪⎪――→燃烧时安静燃烧,发出苍白色火焰,瓶口有白雾――→光照时剧烈反应,发生爆炸,瓶口有白雾(3)与还原性无机化合物反应:①与碘化钾溶液反应:Cl 2+2KI===2KCl +I 2。
②与SO 2水溶液反应:Cl 2+SO 2+2H 2O===H 2SO 4+2HCl 。
③与FeCl 2溶液反应:Cl 2+2FeCl 2===2FeCl 3。
3.从化合价的角度认识Cl 2的化学性质——歧化反应氯气与水或碱反应,氯的化合价既有升高又有降低,因而氯气既表现氧化性又表现还原性。
(1)与水反应氯气与水反应的化学方程式:Cl 2+H 2O HCl +HClO 。
(2)与碱反应(完成下列化学方程式)①与烧碱反应:Cl 2+2NaOH===NaCl +NaClO +H 2O 。
②制取漂白粉:2Cl 2+2Ca(OH)2===CaCl 2+Ca(ClO)2+2H 2O 。
漂白粉的主要成分是Ca(ClO)2、CaCl 2,有效成分是Ca(ClO)2。
高考化学大一轮复习11富集在海水中的元素--氯新人教版

4.某学习小组设计了以下四个实验来探究氯水的成分,请根据下表回
答问题。
序号
实验方法
实验现象
结论
① 将氯水滴加到 AgNO3 溶液中 生成白色沉淀 将氯水滴加到含有酚酞的
② NaOH 溶液中
淀粉 KI 试纸变 氯水中含有
③
蓝色
Cl2
④ 将足量的氯水滴加到 Na2CO3 溶液中
氯水中含有 H+
(1)指出实验①得出的结论___氯__水__中__含__有___C_l_-____。
(2)指出实验②和实验④中的“实验现象”: ②___溶__液__褪__色______,④__有__气__泡__生__成_____。
(3) 实 验 ③ 中 “ 实 验 方 法 ” 的 具 体 操 作 过 程 和 现 象 _取__一__片__淀__粉___K_I_试__纸__,__置__于__表__面__皿__或__玻__璃__片__上__,__用__洁__净__的__玻__璃__棒__蘸__取__氯__水__, _滴__在__试__纸__上_________。
(4)通过实验②的“实验现象”,同学们得出两个不同的结论,这两个 结 论 可 能 是 a . __氯__水__中__含__有__H__C_l_O_,__其__漂__白__作__用__使__溶__液__褪__色____ , b.___氯__水__中__含__有__H__+_,__中__和__O__H_-_使__溶__液__褪__色____________________。
(6)注意药品与装置的合理选择 若用 MnO2 与浓 HCl 加热制 Cl2、KMnO4 与浓 HCl 制 Cl2,Байду номын сангаас者的装置 有所不同。
微诊断 判断正误,正确的画“√”,错误的画“×”。 1.1 mol Cl2 参加反应转移 2 mol 电子( × ) 警示:在 Cl2+2NaOH===NaCl+NaClO+H2O 反应中 1 mol Cl2 参加 反应转移 1 mol 电子。
高考化学一轮复习 第4章 非金属及其化合物 第2节 富集在海水中的元素-氯

颜色
气味
毒性 密度 特性
黄绿色 强烈刺激性气味 有毒 比空气大 易液化
2.化学性质 化学性质(写出反应的化学方程式和部分反应现象,指出在反应中表现氧化 性还是还原性)
典例引领 [典例1] (2014·江苏高考)在探究新制饱和氯水成分的实验中,下列根据实 验现象得出的结论不.正确的是( ) A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含 有Cl- C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有 HClO
2.氯水的性质分析
题组强化 ● 题组1—氯气的氧化性 1.(2016·潍坊高三联考)氯气是一种化学性质很活泼的非金属单质,它具 有较强的氧化性,下列叙述中不正确的是( ) A.红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 B.通常状况下,干燥的氯气能和Fe反应 C.纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶瓶口呈现雾 状;光照H2和Cl2的混合气体时,因迅速化合而爆炸 D.氯气能与水反应生成HClO和HCl,久置氯水最终变为稀盐酸
考
考
点
点
1
3
第二节 富集在海水中的元素——氯
分
层
限
时
考
跟
点
踪
2
练
十
三
[考纲展示] 1.了解氯单质及其重要化合物的主要性质及应用。 2.了解氯 单质及其重要化合物对环境质量的影响。 3.掌握氯气的实验室制法(包括所用 试剂、仪器,反应原理和收集方法)。
考点1| 氯气的性质及应用 固本探源
1.物理性质 当发生氯气泄漏时,人应向 高处 (填高处或低处), 逆 (填顺或逆)风 方向躲避。氯气的物理性质如下表:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
富集在海水中的元素——氯 1.了解氯单质及其重要化合物的主要性质及应用。(高频) 2.了解氯单质及其重要化合物对环境质量的影响。 3.掌握氯气的实验室制法(包括所用试剂、仪器,反应原理和收集方法)。(中频)
氯气的性质、制法和应用 1.物理性质 氯气是一种有强烈刺激性气味的有毒气体,能溶于水,但在饱和食盐水中的溶解度很小,所以可用排饱和食盐水法收集氯气。 2.化学性质(写出有关化学方程式)
3.Cl2的制法 (1)实验室制法
化学方程式:MnO2+4HCl(浓)=====△MnCl2+Cl2↑+2H2O。 (2)工业制法(电解法)
化学方程式:2NaCl+2H2O=====电解2NaOH+Cl2↑+H2↑。 4.应用 (1)制盐酸:利用H2在Cl2中燃烧生成HCl,然后溶于水制盐酸。 (2)制漂白液:利用Cl2与NaOH溶液反应制备,其有效成分为NaClO。 (3)制漂白粉:利用Cl2与Ca(OH)2乳浊液反应制备,其有效成分为Ca(ClO)2。 (4)制含氯有机物,如Cl2与CH4反应可生成CH3Cl、CH2Cl2、CHCl3、CCl4有机物。
氯的重要化合物 1.次氯酸
(1)不稳定性:2HClO=====光2HCl+O2↑ 氯水须现用现配,保存在棕色试剂瓶中,置于冷暗处。 (2)强氧化性: ①能将有色物质氧化为无色物质,有漂白性。 ②杀菌、消毒。 (3)弱酸性: NaClO溶液中通少量CO2,化学方程式为:2NaClO+CO2+H2O===2HClO+Na2CO3。 2.次氯酸盐 (1)
(2)
3.今天人们不直接用Cl2作漂白剂而常用漂白液或漂白粉的理由是Cl2在水中的溶解度不大而且生成的HClO不稳定,难以保存,使用不方便,效果不理想。
卤素及卤离子检验 1.卤素(包括F、Cl、Br、I等)简介 (1)单质物理性质的递变规律 ①单质颜色逐渐变深(F2:淡黄绿色气体;Cl2:黄绿色气体;Br2:深红棕色液体;I2:紫黑色固体)。 ②密度逐渐增大;熔、沸点逐渐升高。 (2)单质及化合物的化学性质 ①单质(从F2至I2): 氧化性逐渐减弱,与氢气化合越来越难,与H2O反应逐渐减弱。 ②化合物(从F至I): HX稳定性逐渐减弱,X-的还原性逐渐增强。 (3)卤素单质性质的特殊性 ①Br2是常温下唯一呈液态的非金属单质;液溴易挥发且有毒,通常用水液封来保存。 ②I2易升华,I2遇淀粉变蓝。 ③Br2和I2都可被某些有机溶剂(如四氯化碳、苯)萃取。 ④氟元素无正价,F2与H2O发生置换反应生成O2(2F2+2H2O===4HF+O2)。 2.卤离子(Cl-、Br-、I-)检验 (1)AgNO3溶液——沉淀法
未知液――→滴加AgNO3溶液和稀硝酸生成白色沉淀,则有Cl-浅黄色沉淀,则有Br-黄色沉淀,则有I- (2)置换——萃取法 未知液――→加适量新制饱和氯水振荡 ――→加入CCl4(下层)或汽油(上层)振荡
有机层呈红棕色或橙红色,表明有Br-紫色、浅紫色或紫红色,表明有I-
1.易误诊断(正确的打“√”,错误的打“×”)。 (1)H2、Cu、Fe在Cl2发生的反应均是燃烧反应( ) (2)燃烧反应一定是O2参加的氧化还原反应( ) (3)Cl2与H2O或NaOH的反应中氯气既是氧化剂又是还原剂( ) (4)漂白粉和明矾都常用于处理自来水,二者的作用原理是不同的( ) (5)漂白粉在空气中久置的过程中不可能发生氧化还原反应( ) (6)氯水是Cl2的水溶液,溶液中只含有Cl2和H2O( ) (7)要证明Cl2无漂白性而HClO有漂白性的实验方法,可以先让干燥Cl2通入干燥的有色布条,再通入湿润的有色布条看是否褪色( ) (8)Cl2氧化性比Br2强,故还原性Cl->Br-( ) 【答案】 (1)√ (2)× (3)√ (4)√ (5)× (6)× (7)√ (8)× 2.写出下列反应的离子方程式: (1)Cl2与H2O反应:_____________________________________________________。 (2)Cl2与NaOH溶液反应:_______________________________________________。 (3)Cl2与FeCl2溶液反应:_______________________________________________。 (4)Cl2与NaBr溶液反应:_______________________________________________。 (5)NaClO溶液中通入过量CO2:___________________________________________。 (6)Ca(ClO)2溶液中加入稀HCl:____________________________________________。
【答案】 (1)Cl2+H2OH++Cl-+HClO (2)Cl2+2OH-===Cl-+ClO-+H2O (3)Cl2+2Fe2+===2Fe3++2Cl- (4)Cl2+2Br-===Br2+2Cl- (5)ClO-+CO2+H2O===HClO+HCO-3 (6)ClO-+H+===HClO 3.84消毒液的有效成分是_____。向稀释后的84消毒液中加入3~4滴紫色石蕊试液的现象为________, 原因是(用离子方程式表示)_______________________________________。
【答案】 NaClO 溶液先变蓝,后褪色 ClO-+H2OHClO+OH- 3种颜色:Cl2为黄绿色;氯水为淡黄绿色;H2在Cl2中燃烧火焰为苍白色。 Cl2的4个应用相应反应 ①制氯化氢:H2+Cl2=====点燃2HCl ②制氯水:Cl2+H2OHCl+HClO ③制漂白液:Cl2+2NaOH===NaCl+NaClO+H2O ④制漂白粉:2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
Cl2制备的4个装置:制气—净化—收集—尾气吸收
氯水中3分子4离子:H2O、Cl2、HClO、H+、Cl-、ClO-、OH-
氯及其化合物的性质和转化关系 1.氯及其化合物的性质及转化关系
2.氯水的成分和性质 成分 性质 表现 Cl2 氧化性 能够氧化Fe2+、Br-、I-、S2-、SO2等 Cl- 生成沉淀 加入硝酸银溶液产生白色沉淀 HClO 不稳定性 在光照下氯水中有气泡产生
HClO 强氧化性 ①使湿润的有色布条或品红溶液褪色; ① 使紫色石蕊溶液先变红后褪色; ③杀菌消毒
H+ 酸性 ①使紫色石蕊溶液变红; ②加碳酸盐产生气泡
3.液氯、新制氯水、久置氯水的比较 液氯 新制氯水 久置氯水 分类 纯净物 混合物 混合物 颜色 黄绿色 浅黄绿色 无色 性质 氧化性 酸性、氧化性、漂白性 酸性 粒子种类 Cl2 Cl2、HClO、H2O、H+、Cl-、ClO-、OH- H2O、H+、Cl-、OH
(1)氯水的保存:密封保存在棕色试剂瓶中,并放在阴暗处。 (2)Cl2尽管有较强的氧化性,但没有漂白性,氯水具有漂白性的原因是Cl2与水反应生成的HClO具有强氧化性,使有色物质被氧化而褪色。 (3)离子共存问题:ClO-与Fe2+、I-、S2-、HS-、SO2-3等在水中因发生氧化还原反应不能大量共存。
(2012·上海高考)下图所示是验证氯气性质的微型实验,a、b、c、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。 已知:2KMnO4+16HCl===2KCl+5Cl2↑+2MnCl2+8H2O
对实验现象的“解释或结论”正确的是( ) 选项 实验现象 解释或结论 A a处变蓝,b处变红棕色 氧化性:Cl2>Br2>I2 B c处先变红,后褪色 氯气与水生成了酸性物质 C d处立即褪色 氯气与水生成了漂白性物质 D e处变红色 还原性:Fe2+>Cl- 【解析】 a处变蓝,b处变红棕色,说明Cl2分别与KI、NaBr作用生成I2、Br2,可证明氧化性:Cl2
>I2、Cl2>Br2,无法证明I2与Br2之间氧化性的强弱,A项错误;c处先变红,说明氯气与水生成酸性物质,
后褪色,则证明氯气与水生成具有漂白性的物质,B项错误;d处立即褪色,也可能是氯气与水生成酸性物质中和了NaOH,C项错误;e处变红说明Cl2将Fe2+氧化为Fe3+,证明还原性:Fe2+>Cl-,D项正确。 【答案】 D
考向1 氯及其化合物的主要性质 1.(2014·福建晋江联考改编)化学与生活是紧密相联的,下列说法中正确的是________。 A.氯气可用作消毒剂和漂白剂,是因为氯气与水反应生成的次氯酸具有强氧化性 B.二氧化氯具有还原性,可用于自来水的杀菌消毒 C.地震灾区和洪涝灾区都用漂白粉消毒,主要是利用漂白粉溶液的碱性和氧化性 D.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂 E.能用同一原理解释ClO-与Fe2+、H+均不能大量共存 F.能用同一原理解释SO2、Cl2均能使品红溶液褪色 G.能用同一原理解释漂白粉和水玻璃长期露置在空气中变质 【解析】 B选项,ClO2具有强氧化性,错误;C选项,主要利用漂白粉的强氧化性,错误;E选项,ClO-与Fe2+因发生氧化还原反应而不能大量共存,ClO-与H+因为生成不稳定的HClO不能大量共存;F选项,SO
2
使品红溶液褪色是因为与有色物质结合生成不稳定的无色物质,Cl2能使品红溶液褪色是Cl2与水生成的HClO
的强氧化性;G选项,漂白粉变质既发生复分解反应也发生氧化还原反应,而水玻璃变质只发生复分解反应,不发生氧化还原反应。 【答案】 AD
