Ch-3
1-3有机物的命名

H2C=CH2
CH3-CH=CH2
CH3C=CH2
CH3
乙烯
丙烯
1CH2 2 CH
异丁烯 2-甲基-1-丙烯
C2H5
CH 2CH3 HC=CCH2CH CH 2 3
2 3 4 1 CH3 5 6
CH3CH2CHCH2CH2CH3
3 4 5 6
3-乙基-1-己烯
3-乙基-2-己烯
三、苯的同系物的命名:
系统命名法:
步骤
(原则)
选主链,称某烷(长,多,简) 观察下列烷烃的名称,总结系统命名法的方法 编碳号,定支位(近,小) CH3CHCH2CH2CH3 CH3CH2CH2CH2CH2CH3 写全称,位支母(先简后繁) CH3 己烷 CH3CH2CHCH2CH3 CH3 3-甲基戊烷 CH3 CH3 C CH2 CH3 2-甲基戊烷
2,2,3–三甲基丁烷
练习3
7CH3 CH2CH3 6CH2 5 CHCH2 C CH2CH3 4 3 2 1 CH3 CH3
3,5-二甲基-3-乙基庚烷
CH3 1 2 3 4 5 6 CH3–C–CH2–CH–CH2–CH3 CH3 CH2–CH3
2,2-二甲基-4-乙基己烷
练习4:写出下列各化合物的结构简式: CH2–CH3 CH3–CH2–C–CH2–CH3 CH2–CH3 H3C CH3 CH3–C–CH–CH3 CH3
CH3 CH CH CH3 CH3CH碳原子数 3 逗号 如何 2,3二甲基丁烷 短线 确定? 2,2-二甲基丁烷
母体名称 CH3 支链位置 支链数 支链名称
1.选主链的方法:遵循“长、多”
CH3 CH3 CH2 CH C CH2 CH2 CH3 CH3 CH3
常见氧化剂还原剂和催化剂的应用
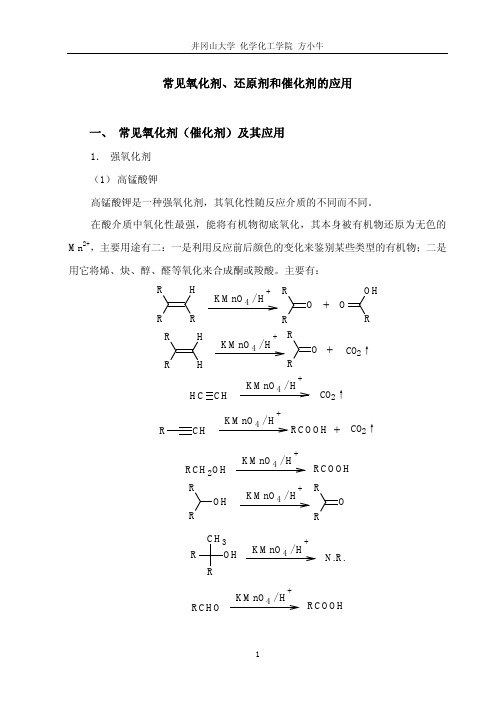
常见氧化剂、还原剂和催化剂的应用一、 常见氧化剂(催化剂)及其应用1. 强氧化剂 (1) 高锰酸钾高锰酸钾是一种强氧化剂,其氧化性随反应介质的不同而不同。
在酸介质中氧化性最强,能将有机物彻底氧化,其本身被有机物还原为无色的Mn 2+,主要用途有二:一是利用反应前后颜色的变化来鉴别某些类型的有机物;二是用它将烯、炔、醇、醛等氧化来合成酮或羧酸。
主要有:R H KMnO 4 / H+OROR OH+ R RHH KMnO 4 / H++O RRCO 2↑KMnO 4 / H+C H CH CO 2↑KMnO 4 / H++CHRCO 2↑RCOOHKMnO 4 / H+RCOOHRCH 2OHOH RRKMnO 4 / H+O RROHRR CH 3KMnO 4 / H+N.R.KMnO 4 / H+RCOOH RCHOKMnO 4 / H +N.R.RCOR' KMnO 4 / H+CO 2↑COOH COOH高锰酸钾在中性或碱性介质中的氧化性稍弱,在控制条件下可以将 π 键氧化而不断裂 σ 键,主要用于从烯烃制备邻二醇(反应的立体化学特征是顺式加成)。
四氧化锇的作用与此类似。
OO MnO(2) 重铬酸钾K 2Cr 2O 7 / H 2SO 4溶液的氧化性能与KMnO 4 / H +相似,用途也相似。
除用以氧化醇、醛等含氧衍生物外,主要用于将芳环氧化成醌。
如:O OCrO 3-H 2SO 4CrO 3-H 2SO 4OOK 2Cr 2O 7 / H 2SO 4RCH 2OHRCHO 边氧化边蒸馏(3) 稀硝酸稀硝酸具有强氧化性,它可以将芳环的侧链氧化和将醇氧化,如:Ar-CH 3Ar-COOH 稀HNO 3稀HNO 3OHO△HO 2C-(CH 2)4-CO 2H2. 温和氧化剂 (1) 二氧化锰MnO 2-H 2SO 4是一种中强氧化剂,可将甲苯氧化成苯甲醛:C 6H 5-CH 3C 6H 5-CHOMnO 2-H 2SO 4活性MnO 2则是一种温和的氧化剂,能将烯丙式醇氧化成醛而不影响C=C 双键:CH 3CH 3CH 3CHOMnO 2石油醚(2) 三氧化铬-吡啶络合物三氧化铬-吡啶络合物(CrO 3-C 5H 5N )又称为Sarett 试剂,是一种温和的氧化剂,能将醇(尤其是烯丙式的)氧化成为醛,而不影响其它基团。
药物合成反应-3烃化反应

第二章 烃化反应
(Hydrocarbylation Reaction,Alkylation)
一、概念
《药物合成反应》
用烃基取代有机物分子中的氢原子,包括某些 官能团或碳架上的氢原子,均称为烃化反应。
引入的烃基包括: 饱和的、不饱和的烃基 脂肪的、芳香的烃基 含有各种取代基的烃基 举例 NaOH
O CH2OCOC17H33
O
O
/KOH /H2 O
CH2OCOC17H33 O(CH2CH2O)p H
HO OH
OH (75.5%)
H(OCH2CH2)mO (13 )
(m、n、p均约为20)
O(CH2CH2O)nH
四、烯烃为烃化剂
《药物合成反应》
醇可与烯烃双键进行加成反应生成醚, 也可理解为烯对醇的O-烃化。但对烯烃双 键旁没有吸电子基团存在时,反应不易进 行。只有当双键的α-位有羰基、氰基、酯 基、羧基等存在时,才较易发生烃化反应。 例如醇在碱存在下对丙烯腈的加成反应。
HOOC NH
HX
CuSO4/NaOH,pH5~6
F3C NH2
HOOC Cl
Cu/无水K2CO3 HCl
F3C
HOOC NH
pH4
二、酯类为烃化剂
《药物合成反应》
1.硫酸酯为烃化剂
OH COOCH3 S O NH O
(CH3)2SO4/NaOH 25 ,10h
OH COOCH3 S O N CH3 O
ห้องสมุดไป่ตู้
七、溶剂对烃化位置有较大影响:
《药物合成反应》
酚类在DMSO、DMF、醚类、醇类中烃化时,主要 得酚醚(O-烃化产物),而在水、酚或三氟乙醇中 烃化时,则主要得到C-烃化产物。
胺类化合物 第一组

胺的酰基化反应
伯胺、仲胺易与酰氯或酸酐等酰基化剂作用生成酰 胺.酰胺是具有一定熔点的固体,在强酸或强碱的水 溶液中加热易水解生成酰胺。因此,此反应在有机 合成上常用来保护氨基。(先把芳胺酰化,把氨基 保护起来,再进行其他反应,然后使酰胺水解再变 为胺)。
RNH 2 (A r) R2NH R'COCl or (R'CO) 2O R'COCl CH 3COCl RNHCOR' R2NCOR' NCOCH 3 CH 3
O 苯胺黑 O
卤代反应 苯胺很容易发生卤代反应,但难控制在一元阶段。
NH2 + Br2(H2O)
磺化反应
NH2 H2SO4 NH3HSO4 H2O
NH2 Br Br
+ 3HBr
Br 2,4,6- 三溴苯胺(白 ), 可用于鉴别苯胺
NHSO 3H 180 ℃ NH2 NH3
SO3H
SO2O
硝化反应 芳伯胺直接硝化易被硝酸氧化,
(4)胍(CH5N3)可看做是脲分子中的氧原子被
亚氨基(=NH)取代而生成的化合物。胍分子中除去一 个氢原子后的基团叫胍基(CH4N3),除去一个氨基后 的基团叫脒基(CH3N2)。
胍是一个有机强碱,其碱性与无机强碱相当,碱 性与氢氧化钠相近。它能吸收空气中的二氧化碳 生成碳酸盐。 胍在碱性条件下不稳定,易水解为氨和尿素,在 酸性条件下比较稳定。故一般制成其盐保存。 用途 胍一般以盐的形式使用,是有机合成(合成杂环化 合物)、药物、染料合成的中间体。
必须先把氨基保护起来(乙酰化或成盐),然 后再进行硝化。
NHCOCH 3 HNO 3
NH2
OH / H 2O NO 2 (主要产物)
有机化学 第三章 环烷烃
张力学说( 一、Baeyer张力学说(strain theory) 张力学说 )
假定成环碳原子都在同一平面上 并排成正多边形。 同一平面上, ※ 假定成环碳原子都在同一平面上,并排成正多边形。 碳原子间的夹角必偏离正常键角。这种由于键角偏离 碳原子间的夹角必偏离正常键角。 正常键角而引起的张力称为角张力。 正常键角而引起的张力称为角张力。 角张力 。 碳环中碳原子键角偏离正常键角越大,角张力越大, ※ 碳环中碳原子键角偏离正常键角越大,角张力越大, 分子越不稳定,反应活性也越大。 分子越不稳定,反应活性也越大。
E
CH3 CH3 CH CH3
CH3 CH3
1
4-甲基环己烯 5-乙基-1,3-环己二烯 - -乙基- , -
顺-1,3-二甲基环丁烷 , -
第二节 环烷烃的性质
一、物理性质
n = 3,4 , 气态 n=5 ※状态 液态 n≥6 固态 ※m.p.: 环烷烃比直链烷烃能够更紧密地排列于晶格中 .: 同数碳原子的直链烷烃。 故m.p.>同数碳原子的直链烷烃。 同数碳原子的直链烷烃 0.688<d<0.853 ※d: 环烷烃不溶于水 ※s: 环烷烃不溶于水
在不同的环烃中键角大于或小于109° ,而正常的SP ※在不同的环烃中键角大于或小于 °28′,而正常的 3 杂化轨道之间的夹角为109°28′即C-C之间的电子云没有达 ° 即 - 之间的电子云没有达 杂化轨道之间的夹角为 到最大程度的重叠。 到最大程度的重叠。 1
( 109 °2 8′- 6 0°) = 24°64′ - ) 2 1 ( 1 09°28 ′- 90 °) = 9 °44 ′ - ) 2 1 ( 109 °2 8′- 1 08°) = 0°44′ - ) 2 1 1 09°28′- 120 °) = -5°1 6′ - ) 2(
第三章 烯烃

3.1.2 烯烃的命名规则(系统命名):
(1)主链选择:选择含碳碳双键的最长碳链为主 链(母体),根据含碳数目称为某烯. (2)主链编号:从最靠近双键的一端开始给主碳 链编号. (3)双键位置:将双键位置标明在烯烃名称前面 (只标出位次较小双键碳原子位置). (4)其它同烷烃的命名规则.
Naming alkenes
B.碳正离子的结构和稳定性 ----马尔科夫尼科夫(Markovnikov,s rule)规律 CH3
2 C=CH2 CH3 2-甲基丙烯
CH3 CH3 + 2HCl C-CH3 + CH-CH2Cl CH3 Cl CH3
主要产物
马尔科夫尼科夫规律 --卤化氢与不对称烯烃加成时, 可以得到两种不同的产物,以H原子加到含氢较多的双 键C原子上,而卤素原子加到含氢较少或不含氢的双键 碳原子上的那种产物为主. Why?
>C=C< + Y-X -C-C( sp2) Y Z
(sp3)
例1: CH2=CH2 +Cl-Cl CH2Cl-CH2Cl H= -171kJ/mol 例2: CH2=CH2 +Br-Br CH2Br-CH2Br H= -69kJ/mol
• 加成反应往往是放热反应,往往需要较低的活化能. 所以烯烃容易发生加成反应是烯烃的一个特征反应.
在烯烃名称前加顺(cis-)或反(trans-)字表示,例如:
CH3 CH3 CH3 CH3
C=C
H H H
C=C
Cl
顺-2-丁烯
CH3 C=C H
顺-2-氯-2-丁烯
CH3CH2 C=C CH3
H
CH3
H
H
反-2-丁烯
爆炸性气体混合物的分级和分组
T3 T4 T4 T4 T2 T2 - T2 T2 - T3 T2 T2 T2 T3 T3 T3
147
焦炉煤气 五.含卤化合物
T1
148 149 150
四氟乙烯 1-氯-2.3-环氧丙烷 硫化氢
T4 T2 T3
ⅡC级
151 152 153 154 155
氢 乙炔 二硫化碳 硝酸乙酯 水煤气
H2 C2H2 CS2 C2H5ONO2
(3)按引燃温度分组
组别
引燃温度 t(℃) 450<t 300<t≤450 200<t≤300 135<t≤200 100<t≤135 85<t≤100
T1 T2 T3 T4 T5 T6
2.防爆型电器类型—隔爆型
—
d
3.爆炸危险场所的分区
(1)0区:连续地出现爆炸性气体环境,或预计会长期出现或短期频繁地出现爆炸性气体环境的区域。 (2)1区:在正常操作时,预计会周期地(或偶然地)出现爆炸性气体环境的区域。 (3)2区:在正常操作时,预计不会出现爆炸性气体环境,即使发生也仅可能是不频繁并短时出现的区域。
59 60
乙醛 聚乙醛 酮类
CH3CHO (CH3CHO)n
T4 -
61 62 63 64 65 66 67
丙酮 2-丁酮(乙基甲基酮) 2-戊酮(甲基丙基甲酮) 2-己酮(甲基丁基甲酮) 戊基甲基甲酮 戊间二酮(乙酰丙酮) 环己酮 酯类
(CH3)2CO C2H5COCH3 C3H7COCH3 C4H9COCH3 C5H11COCH3 CH3COCH2COCH3 CH3(CH2)4CO
T1 - T1
130 131 132 133 134 135 136 137 138 139 140 141 142 143 144 145 146
三羧酸循环
CH2 COOH H2O
* *
柠檬酸 90 :
顺乌头酸 4 :
异柠檬酸 6
3. 异柠檬酸氧化脱羧形成a-酮戊二酸 CO2 (异柠檬酸脱氢酶催化)
异柠檬酸 脱氢酶 异柠檬酸 脱氢酶
NAD+ NADH+H+
HO CH COOH CH COOH
*
NAD+ NADH+H+
HO CH COOH CH COOH
丙酮酸脱氢酶系
CoASH CO2 NAD+
O
CH3-C-SCoA
(乙酰CoA)
丙酮酸
NADH+H+
氧化磷酸化 (线粒体)
三羧酸 循环
一、由丙酮酸形成乙酰CoA
丙酮酸进入线粒体转变为乙酰CoA,这是连接糖酵 解和三羧酸循环的纽带: 丙酮酸+CoASH+NAD+ 乙酰CoA+ CO2+NADH+H+ 反应不可逆,分4步进行,由丙酮酸脱氢酶复合体 (丙酮酸脱氢酶系)催化。
地点:三羧酸循环在线粒体基质中进行。
柠檬酸循环是糖、脂肪、和氨基酸等 氧化所共同经历的途径。此外,柠檬酸循 环生成的中间物质也是许多生物合成的前 体。因此柠檬酸循环是两用代谢途径 (amphibolic pathway)。
葡萄糖有氧氧化的反应过程:
(EMP) 葡萄糖 C=O
(细胞液) CH3
COOH
硫辛酰胺 将乙酰基转移到CoA
二氢硫辛酸脱氢酶 E3
12
FAD
将还原型硫辛酰胺 转变为氧化型
分步反应
①
O CH3 C COOH + TPP
E1
OH CH3 C TPP + CO2 H
习题11(醛酮)
P379 习题11.1 命名下列化合物:(1) HOCH 2CH 2CHO (2)CH 3CHBrCOCHBrCH 33-羟基丙醛2,4-二溴-3-戊酮(3) CH 3COCH=CHCOCH 3(4) OCH 33-己烯-2,5-二酮4-甲基环己酮(5) CHOBr(6) C CH 3CH 3O4-溴苯甲醛对甲氧基苯乙酮(7)CHOC CH 3O(8)CHOHOOCH 34-乙酰基苯甲醛 4-羟基-3-甲氧基苯甲醛 (9) C O环己基苯基甲酮习题11.2 写出下列化合物的构造式:(1) 甲基异丁基酮(2)丁二醛CH 32CH(CH 3)2OCH 2CH 2H HO O(3) 三甲基乙醛 (4)β-环己二酮(CH 3)3CCHOOO(5) β-羟基丁醛 (6)对羟基苯丙酮CH 3CHCH 2CHOOHHOC CH 2CH 3OP336 习题11.3 选择合适的原料及条件合成下列羰基化合物:(1) 2-己酮解:CH 3(CH 2)3OHCH 3CH 2CH 2CH 2MgBr Mgdry etherCH 3(CH 2)3Br3dry etherH O +CH 3CH 2CH 2CH 23OMgBrCH 3CH 2CH 2CH 23OHCH 3CH 2CH 2CH 23OK Cr O 24或者:HC CNa+ BrCH 2CH 2CH 2CH 3HC CCH 2CH 2CH 2CH 3CH 32CH 2CH 2CH 3OH O244(2) 丁醛解:CH 3CH 2CH 2CH 2OH CH 3CH 2CH 2CHO [(CH )CHO]Al , (CH )C=O66或者:CH 3CH 2CH 2CH 2OHCH 3CH 2CH 2CHO CrO Pyridine(3)O解:OH BrOHH O24∆OOH[(CH )CHO]Al , (CH )C=O66或者:OO BrONaOH/ C H OH23(4)CHO ClCl解:CH 3CH 33HCH 3ClClCH 33HClCl242Fe ,H 2O/H +180 CoCHOCl ClCrO + (CH CO)O(5)O 2NO 2N O解:COOHO 2NO 2NSOCl H 2SO 44COOHCH 3O 2NO 2NO O 2NO 2NO Cl3(6)2CH 2COOH O解:C O O O+32CH 2COOH O(7) CH 3OCHO解:HOCH 3Oor : (CH 3)2CO 3CH 3INaOHCH 3OCHO CO + HCl AlCl 3-Cu 2Cl 2习题11.4 完成下列转变:(1) 间二甲苯 →CHOCH 3解:CHOCH 3CH 3CH 32(1) CrO Cl(2)COClCH 33CH 3CHOCH 3CH 3CH 3解:COClCH 33CH 3CHOCH 3CH 3CH 32Pd/BaSO 4或者:COClCH 33CH 3CHOCH 33CH 3(1) LiAl(OBu-t)H , Et O, -78 C(2) H 2O/H +P398 习题11.5 完成下列反应式:(1)2C 2H 5OH +OOC 2H 5OC 2H 5?不反应?(2)O N 2OH 2NNH NH 2O+(3) HOCH 2CH 2CH 2CH 2CHO OOH(4)CHO NO 2NO 2H 2NNH+CH NO2NO 2NNH(5)MgBr + CH 3CHO(1) ether 23OH(6)饱和CHOOHCHOHSO 3NaNaHSO (7)CHOCHO+Ph 3P=CH Ph 3P=CH(8)CH=PPh 3O+CH习题11.6 给下列反应一个可能的机理。
CH_(3)NH_(3)HgI_(3)晶体的形貌模拟与结构分析
1理论计算
1.1 BFDH模型形貌预测
CH3NH3HgI属于单斜晶系,其空间群为 P2]/n,其中犪=9. 093 A,犫=7. 010 A,c = 14. 832
由[HgI]2-基本单元构成,其结构为一维扭折 链状,如图1所示。
图1 CH3NH3HgI的晶胞模型 Fig. 1 Cell model of CH3 NH3 HgI3
形貌特征;形核阶段晶核的随机形貌存在针状、柱状和块状晶体;沿[HgI]2-四面体链延伸方
向‘CHsNHsHgI易于形成状或柱状的晶体形貌。
关键词:CH3NH3HgI3晶体;晶体形貌;附着能;BFDH模型;封端法辅助切面法
中图号: O766
文献标志码: A
文章编号: 1673-9965(2021)03-0263-06
第41卷第3期 2021 年6 月
西安工业大学学报 JournalofXi'anTechnologicalUniversity
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Support pédagogique Politique et Stratégie d'Entreprise © MEZGHANI L., FSEG-Sfax Chapitre 3 : LE CHOIX D'UNE STRATEGIE GÉNÉRIQUE
1. INTRODUCTION AU CONCEPT DE STRATEGIE GENERIQUE – La troisième étape (choix d'une stratégie générique) de la démarche classique de la réflexion stratégique consiste à choisir une stratégie parmi un ensemble particulièrement limité de stratégies dites génériques ou types qu'une entreprise peut mettre en œuvre pour construire un avantage concurrentiel durable sur le segment considéré.
– Parmi les stratégies génériques, quelle est la plus appropriée pour l'entreprise, compte tenu de son profil concurrentiel d'une part, et des exigences spécifiques du segment d'autre part ?
– Le concept ou l'approche des stratégies génériques revient à Porter. Conçu en 1980, il l'a lui-même complété en 1985.
• L'avantage concurrentiel provient soit de "coûts moins élevés", soit de la "différenciation". • Le champ concurrentiel visé est soit une "cible large" portant sur tout le secteur, soit une "cible étroite" visant uniquement une partie de celui-ci.
• Les stratégies génériques possibles sont selon Porter, version 1980, au nombre de trois : stratégie de domination par les coûts, stratégie de différenciation, stratégie de niche (concentration fondée sur des coûts réduits ou stratégie de concentration fondée sur la différenciation, Porter 1985).
Avantage concurrentiel Coûts moins élevés Différenciation
Champ Cible largeDomination par les coûts Différenciation
concurrentiel Cible étroite
Concentration
fondée sur des coûts réduits
Concentration fondée sur la différenciation
– Un avantage concurrentiel provient soit de coûts moins élevés, soit d'une différenciation. D'où le concept ou l'approche des "stratégies génériques" ou des "stratégies concurrentielles".
2. LES STRATEGIES DE COUTS
– Elles orientent de façon prioritaire tous les efforts de l'entreprise vers un objectif considéré comme primordial : la minimisation de ses coûts complets (fabrication, conception, marketing, distribution, financiers, administratifs, etc.)
– L'avantage concurrentiel de l'entreprise dépend donc de sa capacité à minimiser ses coûts. – L'entreprise la plus compétitive est celle dont les coûts sont les plus bas. Exemple : Si le prix du marché est imposé, elle aura la marge la plus importante.
2.1. La courbe d'expérience (B.C.G., 1970) – La théorie de l'effet d'expérience : Le coût unitaire total d'un produit décroît d'un pourcentage constant chaque fois que la production cumulée de ce produit par l'entreprise est multiplié par deux.
– La représentation graphique de l'effet d'expérience est une courbe d'expérience. Chapitre 3 page 2/10 Support pédagogique Politique et Stratégie d'Entreprise © MEZGHANI L., FSEG-Sfax – Exemple : Courbe d'expérience dans la construction aéronautique civile à l'échelle décimale (Strategor, 1997)
– Exemple : Courbe d'expérience dans la construction aéronautique civile à l'échelle logarithmique (Strategor, 1997)
– Une courbe d'expérience donnée n'est pas propre à une entreprise, mais caractéristique d'un certain domaine d'activité : elle s'impose à l'ensemble des entreprises en concurrence sur ce secteur. Chapitre 3 page 3/10 Support pédagogique Politique et Stratégie d'Entreprise © MEZGHANI L., FSEG-Sfax – Pour avoir l'expérience la plus forte, les entreprises chercheront à avoir la production la plus grande et donc la part de marché la plus importante.
Coût Unitaire
Production Cumulée – Les causes de l'effet d'expérience • Les économies d'échelle (étalement des frais fixes) • Effet de taille (pouvoir de négociation) • Effet d'apprentissage (temps écoulé + volume de production cumulé) • Innovation (l'expérience peut entraîner l'amélioration du produit et/ou du processus)
2.2. Les stratégies de prix et le stade de maturité de l'activité – L'effet de l'expérience dépend de la croissance du domaine de l'activité. (explications : voir Strategor, 1997, pages 66 à 69)
Coûts et prix Démarrage Croissance Maturité Déclin Prix Coûts
Volume Cumulé
Prix du marché Coût Expérience
