第1章 化学变化与能量转化重点知识整理 (定稿)
部编人教版高二化学选修4《第1章化学反应与能量第1节化学反应与能量的变化第1课焓变反应热》ppt课件

返回
2.微观角度——从本质上认识 由于在化学反应过程中,当反应物分子间的化学键 断裂时,需要克服原子间的相互作用,这需要吸收 能量;当原子重新结合成生成物分子时,即新化学 键形成时,又要释放能量,则生成物分子形成时所 释放的总能量与反应物分子断裂时所吸收的总能量 的差即为该反应的反应热.
返回
点击此图片进入训练全程跟踪
返回
返回
[特别关注] 浓H2SO4、固体NaOH溶于水时有热量放出,但不属
于放热反应,NH4NO3固体溶于水时吸热,但不属于吸热 反应.
返回
返回
考查点一 焓变、反应热
[例1] 对于放热反应2H2(g)+O2(g)===2H2O(l),下列说
法正确的是
()
A.生成物H2O所具有的总焓高于反应物H2和O2所具有 的总焓
B.946 kJ/mol
C.649 kJ/mol
D.896 kJ/mol
返回
解析:化学反应的本质是反应物分子旧键断裂(吸收能量), 生成物分子新键形成(放出能量),反应热等于生成物的键 能之和减去反应物的键能之和. 设N≡N键的键能为E(N≡N),则有 2 mol×3×391 kJ/mol-1 mol·E(N≡N)-3 mol×436 kJ/mol=92.4 kJ 解得E(N≡N)=946 kJ/mol. 答案:B
上等于 恒压 条件下的焓变),用 ΔH 表示. (2)单位:ΔH的单位常用kJ/mol.
返回
1.焓变和反应热是什么关系? 提示:在恒压条件下进行的反应,其反应热就是焓 变.因此它们的符号均为ΔH,单位也相同.
第一章化学反应及其能量变化
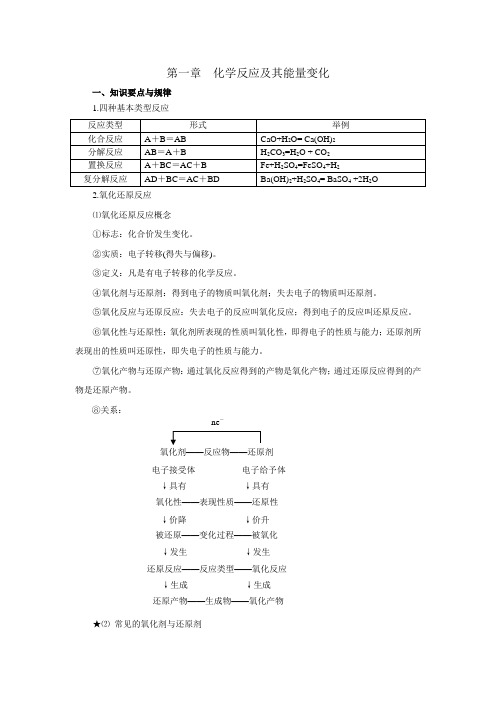
第一章 化学反应及其能量变化 一、知识要点与规律 1.四种基本类型反应 反应类型 形式 举例 化合反应 A+B=AB CaO+H2O= Ca(OH)2 分解反应 AB=A+B H2CO3=H2O + CO2 置换反应 A+BC=AC+B Fe+H2SO4=FeSO4+H2 复分解反应 AD+BC=AC+BD Ba(OH)2+H2SO4= BaSO4 +2H2O
2.氧化还原反应 ⑴氧化还原反应概念 ①标志:化合价发生变化。 ②实质:电子转移(得失与偏移)。 ③定义:凡是有电子转移的化学反应。 ④氧化剂与还原剂:得到电子的物质叫氧化剂;失去电子的物质叫还原剂。 ⑤氧化反应与还原反应:失去电子的反应叫氧化反应;得到电子的反应叫还原反应。 ⑥氧化性与还原性:氧化剂所表现的性质叫氧化性,即得电子的性质与能力;还原剂所表现出的性质叫还原性,即失电子的性质与能力。 ⑦氧化产物与还原产物:通过氧化反应得到的产物是氧化产物;通过还原反应得到的产物是还原产物。 ⑧关系:
★⑵ 常见的氧化剂与还原剂 还原反应——反应类型——氧化反应 被还原——变化过程——被氧化 还原产物——生成物——氧化产物 ↓发生 ↓发生
↓生成 ↓生成
氧化剂——反应物——还原剂 电子接受体 电子给予体
氧化性——表现性质——还原性 ↓具有 ↓具有
↓价降 ↓价升
ne- 常见氧化剂及其对应的产物 常见还原剂及其对应的产物 氧化剂 还原产物 还原剂 氧化产物 O2 OH—、H2O 金属单质 金属阳离子 X2 X—- S2- S S S2- I— I2 MnO4—(H+) Mn2+ Fe2+ Fe3+ HNO3(稀) NO C CO2或CO HNO3(浓) NO2 H2 H2O或H+ H2SO4(浓) SO2 CO CO2 Fe3+ Fe2+ ⑶氧化还原反应中电子转移关系的表示
①双线桥法:
CuO为氧化剂,H2为还原剂。 ★②单线桥法:
⑷氧化还原反应的基本规律及应用 ①守恒律: 化合价有升必有降,电子有得必有失。对于一个完整氧化还原反应,化合价升高的总数与降低的总数相等。 应用:有关氧化还原反应的计算及配平。 ②价态律: A.元素处于最高价,只有氧化性; B.元素处于最低价,只有还原性; C.元素处于中间价态,既有氧化性又有还原性,但主要呈现一种性质。 D.物质若含有多种元素,其性质是这些元素的综合体现。 应用:判断元素或物质氧化性或还原性的有无。 ③强弱律: A.较强氧化性的氧化剂跟较强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物:即氧化剂+还原剂=还原产物+氧化产物,满足强+强=弱+弱。
高中化学选修四第一章《化学反应与能量》知识点总结

高中化学选修四第一章《化学反应与能量》知识点总结
考点1:吸热反应与放热反应
1、吸热反应与放热反应的区别
特别注意:反应是吸热还是放热与反应的条件没有必然的联系,而决定于反应物和生成物具有的总能量(或焓)的相对大小。
2、常见的放热反应
①一切燃烧反应;
②活泼金属与酸或水的反应;
③酸碱中和反应;
④铝热反应;
⑤大多数化合反应(但有些化合反应是吸热反应,如:N2+O2=2NO,CO2+C=2CO等均为吸热反应)。
3、常见的吸热反应
①Ba(OH)2·8H2O与NH4Cl反应;
②大多数分解反应是吸热反应
③
等也是吸热反应;
④水解反应
考点2:反应热计算的依据
1.根据热化学方程式计算
反应热与反应物各物质的物质的量成正比。
2.根据反应物和生成物的总能量计算
ΔH=E生成物-E反应物。
3.根据键能计算
ΔH=反应物的键能总和-生成物的键能总和。
4.根据盖斯定律计算
化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与反应的途径无关。
即如果一个反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的。
温馨提示:
①盖斯定律的主要用途是用已知反应的反应热来推知相关反应的反应热。
②热化学方程式之间的“+”“-”等数学运算,对应ΔH也进行“+”“-”等数学计算。
5.根据物质燃烧放热数值计算:Q(放)=n(可燃物)×|ΔH|。
▍ 编辑:Wulibang(ID:2820092099)▍ 来源:综合网络。
高一化学第一册第一章化学反应中的能量变化知识点

精心整理
高一化学第一册第一章化学反应中的能量变化知识点
一、反应热
1、定义:在反应过程中放出或吸收的热量叫反应热。
放出热量的反应叫放热反应。
吸收热量的反应叫吸热反应(化学反应过程中,不仅4、)-H(反应物5(1)和298K 。
(2)(3)热化学方程式中的化学计量数不表示分子个数,而是表示物质的量,所以,它可以是整数,也可以是分数。
相同物质发生的同一个化学反应,当化学计量数改变时,其⊿H 也同等倍数的改变,但⊿H 的
单位不变,仍然为kJ/mol。
若将化学方程式中反应物和生成物颠倒,则⊿H的数值和单位不变,符号改变。
(4)热化学方程式一般不需要写反应条件,也不用标“↑”和“↓”。
因为聚集状态已经表示出来了,固态用“s”液态用“l”,气态用
6
应
(2)
定义:在稀溶液中,酸跟碱发生中和反应而生成1molH2O时的反应热。
注意事项:(1)必须是“稀溶液”,因为浓溶液在稀释过程中会放出热量,影响中和热。
(2)中和热不包括离子在水中的水合热,物质的溶解热,电解质电离所伴随的
热效应。
(3)中和反应的实质是氢离子和氢氧根离子起反应生成水,若反应过程中有其
他物质生成,这部分不属于中和热。
(4)稀的强酸和稀的强碱反应的中和热为57.3kJ/mol.若是弱酸或弱
应,。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第1章 化学变化与能量转化 重点知识整理
1、(1)书写热化学方程式需注意哪些问题?(4点------状态、△H三部分--符号,数值,单位、
注明温度、系数--只表示物质的量,可用分数)
(2).计算反应焓变△H有哪些方法?(盖斯定律、E生成物—E反应物等)
(3)分别从能量和化学键两个角度,分析化学反应能量的变化
2、列表比较原电池、电解池、电镀池(定义、装置举例、形成条件、电极名称及判断、电
极反应、电子流向、电解质溶液中阴阳离子移动的方向)
3、(1)电解时离子放电顺序:阳极——失电子顺序:
阴极——得电子顺序:
(2)惰性电极电解下列物质的溶液,写出电极反应式、电解化学方程式(或离子方程式)、
溶液PH变化、电解后加入什么物质电解质溶液恢复原浓度
HCl CuCl2 NaCl CuSO4 AgNO3 H2SO4 Na2SO4 NaOH
4、根据下列条件画出电化学装置图并写出电极反应式(要求:注明电极材料、电极名称、
电解质溶液)
(1)电解精炼铜 (2)铁棒上镀铜 (3)Cu+2H2O==Cu(OH)2+H2↑
(4)Zn+ H2SO4===ZnSO4+ H2↑ (5)Cu+2Fe3+===Cu2++2Fe
2+
5、(1)铅蓄电池的电池反应为:Pb+PbO2+2H2SO4 2PbSO4+2H2O
写出电极反应式:放电:
充电:
(2)燃料电池正极通什么物质?负极通什么物质?
写出氢氧燃料电池的电池反应: 写出CH3OH燃料电池在碱性溶液电池反应:
电极反应式 ①电解质溶液为稀硫酸 电极反应式:
②电解质溶液为氢氧化钠溶液
6、(1)金属腐蚀的实质是什么?分哪几类?(化学腐蚀和电化学腐蚀)
电化学腐蚀又分为几类?(析氢腐蚀和吸氧腐蚀)根据什么条件划分的?(水膜的酸性强弱)
分别写出钢铁的电化学腐蚀(析氢、吸氧)电极反应式
(2)金属腐蚀快慢的顺序?(电解池阳极﹥原电池负极﹥正常的﹥原电池正极﹥电解池阴极)
(3)金属的防护主要有哪些方法?电化学保护的两种方法分别叫什么?(原电池原理,保
护的金属做正极,连一更活泼的金属做负极-----牺牲阳极的阴极保护法;电解原理,保护的
金属做阴极-----阴极保护法)
