重要有机化合物的紫外吸收光谱
有机化合物光谱和波谱分析-2.2

1.价电子类型
有机化合物的紫外—可见吸收光谱是三种电子跃迁的结果: σ键电子(单键)
有机分子 价电子类型
π键电子(不饱和键)
未成键n电子(或称非键电子, 如氧,氮,硫,卤素等)
s
H
C H
O
p
n
2.电子跃迁类型
分子轨道理论:成键轨道—反键轨道。
s*
E
K E,B
R
p*
n
p
s
当外层电子吸收紫外或可见辐射后,就从基态向激发态(反 键轨道)跃迁。主要有四种跃迁所需能量Δ Ε 大小顺序为:
溶剂极性↑ π→π*跃迁的吸 收谱带发生红移
基发态 基态
例如: 环己烷改
乙极性对n→π*跃迁谱带的影响
溶剂极性↑ n→π*跃迁的吸收 谱带发生蓝移 例如: 环己烷改 乙醇: 蓝移7nm, 水: 蓝移8nm
异亚丙基丙酮CH3COCH=C(CH3)2吸收带与溶剂极性的关系
(1) 远紫外光区: 100-200nm
(2) 近紫外光区: 200-400nm
(3)可见光区:400-800nm 可用于结构鉴定和定量分析。 电子跃迁的同时,伴随着振动转 动能级的跃迁;带状光谱。
4. 电磁波与辐射能
光: 是一种电磁波, 具有波动性和粒子性.
波动性 – 传播运动过程中突出, 表现在光的偏振, 干涉, 衍射 粒子性 – 与物质相互作用时突出, 表现在光电效 应, 光的吸收和散射
c ν= λ
ν : Hz c 8 c : 光速 (3×10 m/s) E = hν =h λ λ : m
= hcν
※ 频率与波长成反比, 即波长越长, 频率越低, 波数越小 ※ 光量子的能量(E)与波长成反比, 而与频率及波数成正比.
孔雀石绿的紫外吸收光谱

孔雀石绿的紫外吸收光谱(UV-Vis Spectrum of Malachite Green)
孔雀石绿是一种亲环境激素类化合物,在水环境中会被吸附在有机物或胶体表面从而影响水环境质量。
为了更好地检测孔雀石绿的存在,我们可以通过紫外吸收光谱分析的方法进行鉴定。
在紫外吸收光谱中,孔雀石绿的最大吸收波长为618 nm,吸光度范围为0.1至0.8左右,一般以0.2 mol/L 的盐酸为溶液进行测试,测试结果具有稳定性和灵敏性。
此外,对于孔雀石绿的检测还可以采用高效液相色谱(HPLC)等方法,但紫外吸收光谱分析仍是一种应用较为广泛的方法。
总的来说,孔雀石绿的紫外吸收光谱分析是一种简单、稳定、灵敏的检测方法,可以有效检测水环境中孔雀石绿的存在,为水环境治值得注意的是,孔雀石绿的紫外吸收光谱常常会受到水中其他成分的影响而出现干扰信号,因此在测试过程中需要进行适当的前处理和样品预处理,以提高测试结果的准确性和可靠性。
同时,在实际应用中,我们还可以根据孔雀石绿的吸收特征,结合其他技术手段进行检测和监测。
例如,可以使用基于表面增强拉曼光谱(SERS)的方法,利用金属纳米颗粒等纳米材料的特异性增强效应,提高孔雀石绿的检测灵敏度和准确性。
此外,还可以结合气相色谱(GC)或液相色谱(LC)等技术,实现对孔雀石绿的快速检测与定量分析。
总的来说,孔雀石绿的紫外吸收光谱是一种较为简便和常用的检测方法,该方法依靠孔雀石绿的吸收特性对其进行鉴定和定量分析,具有灵敏、快速、可靠等特点,在水环境监测和保护方面具有重要的应用价值。
理和保护提供重要参考依据。
(完整版)图吸收光谱曲线

(8) B带
➢ 由芳香族化合物的π →π*跃迁而产生的精 细结构吸收带。
例如: 苯的B带: 摩尔吸光系数:200 L ·mol-1 ·cm-1 吸收峰的位置:230~270nm之间
(9) E带
➢ 芳香族化合物的π →π*跃迁所产生的吸收带, 也是芳香族的特征吸收峰。
苯的紫外吸收光谱
4、影响紫外-可见吸收光谱的因素
(2) 助色团
➢ 助色团是指本身不产生吸收峰,但与生色团 相连时,能使生色团的吸收峰向长波方向移动, 并使其吸收强度增强的基团。
例如:
—NH2 、—OH 、—OR 、—SH 、—SR 、—Cl 、—Br等
(3) 红移和蓝移
➢ 在有机化合物中,常常因取代基的变更或溶 剂的改变,使其吸收带的最大吸收波长max发生 移动。
例如:含有杂原子的不饱和基团:
(4) 电荷转移跃迁:
➢ 某些分子同时具有电子给予体和电子接受体, 它们在外来辐射照射下会强烈吸收紫外光或可 见光,使电子从给予体轨道向接受体轨道跃迁, 这种跃迁称为电荷转移跃迁,其相应的吸收光 谱称为电荷转移吸收光谱。
➢ 电荷转移跃迁实质上是一个内氧化还原过程。
例如:某些取代芳烃可产生这种分子内电荷转移 跃迁的吸收带。
➢ n → σ* 跃迁的摩尔吸光系数ε较小
(2) π→ π*跃迁:
➢ 吸收峰处于近紫外光区,在200nm左右,摩
ε 尔吸收系数 max > 104 L ·mol-1 ·cm-1 ,为强吸收带。
例如:含有π电子的基团:
(3) n → π*跃迁:
➢ 近紫外-可见光区,ε<100 L ·mol-1 ·cm-1
3、常用术语 (1) 生色团
➢ 生色团是指分子中能吸收紫外或可见光的 基团,它实际上是一些具有不饱和键和含有 孤对电子的基团。
紫外吸收光谱

紫外吸收光谱紫外吸收光谱有关术语1. 发⾊团——指分⼦中能吸收紫外或可见光的基团,含有π键的不饱和基团,如NO2、C=O、COOH、COOR、NO2、N=N、芳基。
若在饱和碳氢化合物中引⼊这种基团,将使这⼀化合物的最⼤吸收峰波长移⾄紫外及可见范围内由于这些基团产⽣π→π* 、n→π*及nσ→* 跃迁吸收能量较低,吸收峰出现在紫外、可见光区2. 助⾊团——指本⾝不产⽣紫外及可见光吸收的基团,但与⽣⾊团相连时,使⽣⾊团的吸收向长波⽅向移动,且吸收强度增⼤OH、OR、X、NH2、NO2、SH等含有n电紫外吸收光谱的产⽣吸光物质分⼦中价电⼦吸收特定能量(波长)的电磁波(紫外光)产⽣分⼦的电⼦能级跃迁。
是研究物质在远紫外区(10-200nm)和近紫外区(200-400nm)的分⼦吸收光谱法。
真空紫外区(<160nm的紫外光会被空⽓中氧所吸收→真空/⽆氧条件下测定)吸收光谱的特征及其表⽰⽅法1、吸收光谱(吸收曲线)a吸收峰;b肩峰;c吸收⾕;d末端吸收:在短波长处(200nm左右),只呈现强吸收,⽽不形成峰的部分2、吸收曲线的横坐标,⼀般⽤波长表⽰。
3、吸收曲线的纵坐标①透光率T(%),(透射⽐)②吸光度ATTIIA lg1lglg0-===③吸收率A(%) A(%)=1-T(%)④吸光系数A=abc摩尔吸光系数ε)(11--?=cmmolLbcAε⼀般认为:ε>104为强吸收,ε.103~104为较强吸收ε.102~103为较弱吸收,ε<102为弱吸收电⼦跃迁(transition)类型各种跃迁所需要能量顺序:σ→σ*> n→σ* >π→π*>n→π*A在紫外和可见光谱区范围内,有机化合物的吸收带主要由σ→σ*、π→π*、n→σ*、n→π*及电荷迁移跃迁产⽣。
B⽆机化合物的吸收带主要由电荷迁移和配位场跃迁(即d—d跃迁和f—f跃迁)产⽣(可见光区)。
(1)σ~σ*跃迁:由饱和键产⽣,能级差⼤,吸收光波波长短,吸收峰多处于真空紫外区。
紫外可见吸收光谱基本原理
n→π* < π→π* < n→σ* < σ→σ*
11:51:47
2
σ→σ*跃迁
所需能量最大;σ电子只有吸收远紫外光的能量
才能发生跃迁;
饱和烷烃的分子吸收光谱出现在远紫外区; 吸收波长λ <200 nm; 例:甲烷的λ max为125nm , 乙烷λ max为135nm 。 只能被真空紫外分光光度计检测到; 作为溶剂使用;
max(甲醇) max(水) max(氯仿)
n → p*跃迁:蓝移; ;
max(正己烷)
p → p* n → p*
230 329
11:51:47
238 315
237 309
243 305
溶剂的影响
苯 酰 丙 酮 1 1:乙醚 2:水
2
250
300
极性溶剂使精细结构 消失;
11:51:47
11:51:47
11:51:47
精品课件!
11:51:47
精品课件!
11:51:47
(三) 金属离子影响下的配位体内π→π*跃迁 金属离子的微扰,将引起配位体吸收波长和 强度的变化。变化与成键性质有关,若共价 键和配位键结合,则变化非常明显。 茜素磺酸钠: 弱酸性介质:黄色(λ max=420nm) 弱碱性介质:紫红色(λ max=560nm )
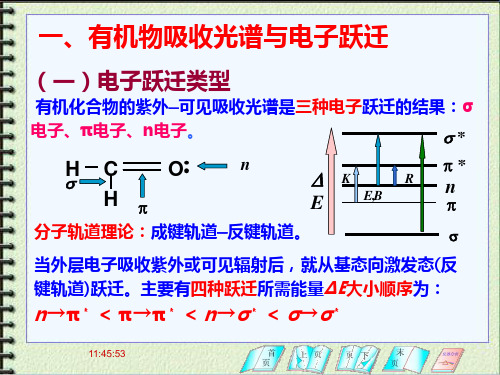
一、有机物吸收光谱与电子跃迁
(一)电子跃迁类型
有机化合物的紫外—可见吸收光谱是三种电子跃迁的结果: σ电子、π电子、n电子。 s*
E p 分子轨道理论:成键轨道—反键轨道。
s
H
C H
OnKR Nhomakorabeap*
E,B
n
p
s
当外层电子吸收紫外或可见辐射后,就从基态向激发态(反 键轨道)跃迁。主要有四种跃迁所需能量ΔΕ大小顺序为:
第八章 紫外吸收光谱分析

i.单取代苯
苯环上有一元取代基时,一般引起B带的精细结
构消失,并且各谱带的λmax发生红移,εmax值通常增大 (表2-14)。当苯环引入烷基时,由于烷基的C-H与 苯环产生超共轭效应,使苯环的吸收带红移,吸收强度 增大。对于二甲苯来说,取代基的位置不同,红移和吸 收增强效应不同,通常顺序为:对位>间位>邻位。
2.3.3 分子结构与紫外吸收光谱
1 有机化合物的紫外吸收光谱
(1) 饱和烃化合物
饱和烃类化合物只含有单键(σ 键),只能产生 σ →σ * 跃迁,由于电子由σ 被跃迁至σ *反键所 需的能量高,吸收带位于真空紫外区,如甲烷和乙 烷的吸收带分别在125nm和135nm。
(2)简单的不饱和化合物
不饱和化合物由于含有π键而具有π→π* 跃迁, π→π* 跃迁能量比σ→σ*小,但对于非共轭的简单不 饱和化合物跃迁能量仍然较高,位于真空紫外区。最 简单的乙烯化合物,在165nm处有一个强的吸收带。 当烯烃双键上引入助色基团时,π→π* 吸收将 发生红移,甚至移到紫外光区。原因是助色基团中的 n电子可以产生p-π共轭,使π→π* 跃迁能量降低, 烷基可产生超共轭效应,也可使吸收红移,不过这种 助色作用很弱。
共轭多烯的紫外吸收计算
共轭多烯的K带吸收位置λmax ,可利用伍德沃德 (Woodward)规则来进行推测,这个定则以丁二烯的作为 基本数据。 (i) 共轭双烯基本值 217 4个环残基取代 +5×4 计算值 237nm(238nm) (ii) 非骈环双烯基本值 4个环残基或烷基取代 环外双键 计算值 217 +5×4 +5 242nm(243nm)
2 一些基本概念
(1)发色团 分子中能吸收紫外光或可见光的结构系 统叫做发色团或生色团。象C=C、C=O、C≡C等 都是发色团。发色团的结构不同,电子跃迁类型也 不同。
第五章 紫外-可见吸收光谱法
甲醇 n→σ*跃迁: λmax 183nm
π→π*跃迁:
所需能量较小,λ一般>200nm,εmax > 104。 不饱和基团(乙烯基、乙炔基) 不饱和烃、共轭烯烃和芳香烃类可发生此类跃迁。 乙烯 π→π*跃迁: λmax 165nm
丁二烯 π→π*跃迁: λmax 217nm
n→π*跃迁:
所需能量最小, λ >200nm, -C=N-
色——蓝色。
我们通常见到的有色物质,都是由于他们吸收了可见光的 部分光,呈现出吸收光颜色的互补色。
二、分子吸收光谱的产生
分子吸收光谱的形成是由于电子在能级之间的跃迁所引
起的。
分子内部具有电子能级、振动能级和转动能级。所以分
子的能量 E分子=E电+E振+E转 。
这些能量是量子化的,只有光辐射的能量恰好等于两能 级之间的能量差时,才能被吸收。
苯环本身分子振动、转动能级跃迁而产生的吸 收带,转动能级消失,谱带较宽。 • 芳香物的主要特征吸收带 • Λ= 230~270 nm, 具有精细结构 • ε~200
• 极性溶剂中,或苯环连有取代基
时,其精细结构消失
三、紫外-可见光谱中的常见吸收带
4、E带: (乙烯型ethylenic band) 由苯环环形封闭共轭体系的π→ π*跃迁产生 • 芳香族化合物的特征吸收带
三、紫外-可见光谱中的常见吸收带
2、K带:(共轭作用konjugation))) 由共轭双键的π→ π*跃迁产生 (—CH=CH—)n, —CH=C—CO— 特点:λmax>200nm,强ε>104 共轭体系增长, ε↑, λ↑(红移)
三、紫外-可见光谱中的常见吸收带
3、B带:(苯benzenoid)
紫外光谱(UV)
→ *跃迁:红移; ;
h
21
轨道极性: n >π* >π
π*
π*
Δ En π
Δ Ep
Δ En n
非极性溶剂
Δ Ep
非极性溶剂
极性溶剂
极性溶剂
极性增大使π—π*红移,n—π*跃迁蓝移,精细结构消失,吸收峰减少,并使吸收 曲线趋于平滑。
h
22
溶剂效应对丙酮紫外吸收的影响
n—π*跃迁蓝移
1-己烷 2-95%乙醇 3-水
紫外光谱
学习要求 概述 紫外吸收光谱的基本原理 影响紫外吸收光谱的主要因素 各类有机化合物的紫外光谱 紫外分光光度计结构与实验技术 紫外吸收光谱的应用
h
1
学习要求: 1.了解用价键和分子轨道理论描述有机分子中电 子激发的一般过程。区别π-π*和n-π*的跃迁。 2、了解紫外吸收光谱基本原理 。 3、理解K带、B带、R带、红移、蓝移等术语。 4、熟悉各类化合物的紫外光谱吸收特征。 5、初步掌握紫外光谱在有机化合物结构鉴定中 的应用。 重点:紫外光谱在有机化合物结构鉴定中的应用 难点:电子跃迁的类型及其吸收带与分子结构之间关系
Io g ε= 4 .0 9
一般 ε> 5000为强吸收 为强带 = 1000~5000为中吸收 < 1000为弱吸收 为弱带
h
14
影响摩尔吸光系数ε的因素: 分子偶极矩变化、跃迁几率。电子跃迁类型
n* 跃迁,吸收强度很弱: < 100 。禁阻跃迁。
n 轨道与 轨道在空间取向不同。由于 n 轨道的电子与 π 电
h
SR 45 85
C l 5 20
29
2、 使n—π*最大吸收向短波位移(蓝移)。
第三章 紫外可见吸收光谱法
3.金属离子影响下配体的 p → p* 跃迁 显色剂大多含有生色团和助色团,与金属离子 配位时,其共轭结构发生变化导致吸收光谱发生红 移或蓝移。 例:茜素磺酸钠 弱酸性-黄色- λmax=420nm 弱碱性-紫红色- λmax=560nm
pH为4~5时与Al3+配位后,为红色,λmax=475nm,相对于 酸性茜素磺酸钠吸收峰红移,相对于碱性茜素磺酸钠吸收峰 蓝移。
480-490
490-500 500-560 560-580 580-610 610-650 650-780
绿蓝
蓝绿 绿 黄绿 黄
橙
红 红紫 紫 蓝
橙
红
绿蓝
蓝绿
3.特点:
(1) 灵敏度较高,可达10-4~10-7g/mL; (2) 准确度较高,一般为1% ~5%; (3) 仪器价格较低,操作简便、快速; (4)应用范围广。既能进行定量分析,又可进行 定性分析和结构分析;既可用于无机物化合 物分析,也可用于有机物化合物分析;还可 用于络合物组成、酸碱解离常数的测定等。
标准谱图库:46000种化合物紫外光谱的标准谱图 有一定局限性,需与红外、核磁、质谱等法相结合 进行准确鉴定。
(二)结构分析
紫外—可见吸收光谱中有机物发色体系信息分析的一般规律: (1)若在220~280nm内无吸收峰,可推断化合物不含苯环、共轭 双键、醛基、酮基、溴和碘(饱和脂肪族溴化物在200-210nm有 吸收)。
必须在配体的配位场作用下才可能产生;
一般的规律:轨道分裂能随场强增加而增加,吸 收峰波长则发生紫移。 例如:水合铜离子(Ⅱ)是浅蓝色的λmax=794nm ,而 它的氨络合物却是深蓝色的λmax=663nm 。
摩尔吸收系数ε很小,对定量分析意义不大。但可 用于络合物的结构及无机络合物的键合理论研究。
紫外吸收光谱1
第九章紫外吸收光谱1. 试简述产生吸收光谱的原因.基本要点:1. 分子吸收光谱;2. 有机化合物的紫外吸收光谱;3. 无机化合物的紫外吸收光谱;4. 溶剂对紫外吸收光谱的影响 ;5. 紫外吸收光谱的应用等 .利用紫外吸收光谱进行定量分析的由来已久,公元60年古希腊已知道利用五味子浸液来估计醋中铁的含量。
这一古老的方法由于最初是运用人的眼睛来进行检测,所以叫比色法。
20世纪30年代产生了第一台光电比色计,40年代出现的BakmanUV 分光光度计, 促进了新的分光光度计的发展。
随着计算机的发展,紫外分光光度计已向着微型化﹑自动化﹑在线和多组分同时测定等方向发展。
第一节分子吸收光谱Molecular Absorption Spectroscopy一、分子内部的运动及分子能级前面讲的AAS和AES都属与原子光谱,是由原子中电子能级跃迁所产生的。
原子光谱是由一条一条的彼此分离的谱线组成的线状光谱。
分子光谱比原子光谱要复杂得多。
这是由于在分子中,除了有电子相对于原子核的运动外,还有组成分子的各原子在其平衡位置附近的振动,以及分子本身绕其重心的转动。
如果考虑三种运动形式之间的相互作用,则分子总的能量可以认为是这三种运动能量之和。
即E=E e+ E v+ E r式中E e为电子能量,E v为振动能量,E r转动能量。
这三种不同形式的运动都对应一定的能级,即:分子中除了电子能级外,还有振动能级和转动能级这三种能级都是量子化的、不连续的。
正如原子有能级图一样,分子也有其特征的能级图。
简单双原子分子的能级图如图9-1所示。
A和B表示电子能级,间距最大;每个电子能级上又有许许多多的振动能级,用V'=0,1,2,……等表示A能级上个振动能级,V"=0,1,2,……等表示B能级上各振动能级;每个振动能级上又有许许多多的转动能级,用j'=0,1,2,……等表示A能级上V'=0各转动能级,j"= 0,1,2,……等表示A能级上V'=1各振动能级等等。
