PCR实验记录表
实用pcr流程表知识讲解

实用p c r流程表临床PCR检验流程记录表检验日期:检验项目: HBV-DNA 扩增仪中保存文件名使用说明:①严格按单一流向进行实验,即试剂准备区→标本制备区→扩增区,严禁逆向移动。
本记录表的流向亦遵循此流程;②各项工作执行后在相应项目前的方框内打“√”;③本记录表最后归档保存在PCR实验室扩增区的专用文件夹中,以备查找。
检验日期:检验项目: HBV-DNA检验日期:检验项目: HBV-DNA1. 操作步骤:1.2.1取n个1.5ml的灭菌离心管,作好标记。
(n=样本数+1管HCV阴性对照+1管HCV强阳性对照+1管HCV临界阳性对照)1.2.2向上述离心管中分别加入25ul蛋白酶溶液。
1.2.3分别加入待测样本、HCV阴性对照、HCV临界阳性对照和HCV强阳性对照各200ul.1.2.4加入200ul新鲜配制的裂解液工作液,盖上盖子,振荡15秒,充分混匀。
(注意:不要把蛋白酶溶液直接加入裂解液工作液中)。
1.2.556摄氏度温浴15分钟。
瞬时离心,以去除管盖上的滴液。
1.2.6加入250ul无水乙醇,盖上盖子,彻底混匀(振荡15秒)。
在室温下静置5分钟(15-25摄氏度)。
注意:如果环境温度超过25摄氏度,无水乙醇需预冷。
瞬时离心,以去除管盖上的滴液。
1.2.7将n个核酸提取柱放入收集管中,小心地将步骤1.2.6中的液体移入核酸提取柱中。
盖上盖子,6000*g离心1分钟。
倒掉收集管中的废液,将提取柱重新放入收集管中。
(如果离心后核酸提取柱中仍有部分液体,以更高的速度再次离心,确保提取柱中无残余的液体)1.2.8小心的打开核酸提取柱的盖子,加入500ul洗液1,盖上盖子,6000*g离心1分钟,倒掉收集管中的废液,将提取柱重新放入收集管中。
1.2.9小心的打开核酸提取柱的盖子,加入500ul洗液2,盖上盖子,6000*g离心1分钟,倒掉收集管中的废液,将提取柱重新放入收集管中。
1.2.10小心的打开核酸提取柱的盖子,加入500ul无水乙醇,盖上盖子,6000*g离心1分钟,丢弃收集管,将提取柱放入新的收集管中。
临床PCR实验室记录及记录表格的设计

临床PCR实验室记录及 记录表格的设计
卫生部临床检验中心 李金明
临床实验室记录的类型
l外界推动型(患者、检查、 认可、验收等)
l内在需求型
实验记录及其管理程序存在的问题
l ①对日常检验中工作人员应记录的基本内容没 有规定或规定不详细。
l ②没有规定实验记录者的签名方式,即是否要 手签、是否要签全名等。
•男 •女
以上标本编号从
至
以上标本编号从
至
以上标本编号从
至
月日时
月日时
•全血 •
, 送检人(签字): , 送检人(签字): , 送检人(签字):
接收人(签字) 接收人(签字) 接收人(签字)
标本状态 •正常 • •正常 • •正常 • •正常 • •正常 • •正常 •
•正常 •
临床PCR实验室标本拒收记录
l 实验室要想很快追溯到某一份《室内质量控制 记录》及《室内质控图》,则需对这些《室内 质量控制记录》及《室内质控图》进行区分, 为追溯和区分的方便,可给每一份《室内质量 控制记录》及《室内质控图》一个惟一性“编 号”,该惟一性编号可含有记录发生的年月日 的信息 ,如2008年12月9日发生的一份《室内 质量控制记录》,其编号可为“08-12-9”。
实验前准备
ÿ 试剂在有效期内
ÿ 扩增仪、加样器和温度计在校准的有效期内
ÿ 生物安全柜的滤膜在使用有效期内 ÿ 消毒溶液在有效期内
ÿ 洗眼器内无菌生理盐水在有效期内 ÿ 离心管、带滤芯吸头已经过质检合格
操作者:
试剂准备区(1区)
实验前 : ÿ 打开通风设备 ÿ 实验台面清洁(水或70%酒精擦拭)
ÿ 冰箱温度:冷藏室(2~8℃) ℃; 冷冻室(-18℃±2℃) ℃
新冠PCR实验室标本保存及处置记录表

高压灭菌后统一处理
E区
高压灭菌后统一处理
E区
高压灭菌后统一处理
E区
高压灭菌后统一处理
E区
高压灭菌后统一处理
E区
高压灭菌后统一处理
E区
高压灭菌后统一处理
E区
高压灭菌后统一处理
注:1、标本做完后先存放于E区-20℃冰箱,每周一和周四,把存放于E区-20℃标本转移到-70℃冰箱。2、标本存放在-20℃冰箱存放期限为7天,-70℃冰箱存放期限为半个月。
2020年度新冠标本处置信息
存放
日期
标本起止号
数量
存放
位置
存放者
监管者
转移
பைடு நூலகம்日期
转移
位置
转移者
监管者
处置
日期
处置方式
处置者
监管者
E区
高压灭菌后统一处理
E区
高压灭菌后统一处理
E区
高压灭菌后统一处理
E区
高压灭菌后统一处理
E区
高压灭菌后统一处理
E区
高压灭菌后统一处理
E区
高压灭菌后统一处理
E区
高压灭菌后统一处理
pcr009次修订xxxxxxxxx医院pcr实验室新冠核酸标本保存及处置记录表2020年度新冠标本存放信息2020年度新冠标本处置信息存放日期标本起止号数量存放位置存放者监管者转移日期转移位置转移者监管者处置日期处置方式处置者监管者高压灭菌后统一处理注
XXXXXXXXX
2020年度新冠标本存放信息
实用pcr流程表样本

临床PCR检验流程记录表检验日期: 检验项目: HBV-DNA 扩增仪中保存文件名使用说明: ①严格按单一流向进行实验, 即试剂准备区→标本制备区→扩增区, 严禁逆向移动。
本记录表的流向亦遵循此流程; ②各项工作执行后在相应项当前的方框内打”√”; ③本记录表最后归档保存在PCR实验室扩增区的专用文件夹中, 以备查找。
检验日期: 检验项目: HBV-DNA检验日期: 检验项目: HBV-DNA1. 操作步骤:1.2.1取n个1.5ml的灭菌离心管, 作好标记。
( n=样本数+1管HCV阴性对照+1管HCV强阳性对照+1管HCV临界阳性对照)1.2.2向上述离心管中分别加入25ul蛋白酶溶液。
1.2.3分别加入待测样本、 HCV阴性对照、 HCV临界阳性对照和HCV强阳性对照各200ul.1.2.4加入200ul新鲜配制的裂解液工作液, 盖上盖子, 振荡15秒, 充分混匀。
( 注意: 不要把蛋白酶溶液直接加入裂解液工作液中) 。
1.2.556摄氏度温浴15分钟。
瞬时离心, 以去除管盖上的滴液。
1.2.6加入250ul无水乙醇, 盖上盖子, 彻底混匀( 振荡15秒) 。
在室温下静置5分钟( 15-25摄氏度) 。
注意: 如果环境温度超过25摄氏度, 无水乙醇需预冷。
瞬时离心, 以去除管盖上的滴液。
1.2.7将n个核酸提取柱放入收集管中, 小心地将步骤1.2.6中的液体移入核酸提取柱中。
盖上盖子, 6000*g离心1分钟。
倒掉收集管中的废液, 将提取柱重新放入收集管中。
( 如果离心后核酸提取柱中仍有部分液体, 以更高的速度再次离心, 确保提取柱中无残余的液体)1.2.8小心的打开核酸提取柱的盖子, 加入500ul洗液1, 盖上盖子, 6000*g离心1分钟, 倒掉收集管中的废液, 将提取柱重新放入收集管中。
1.2.9小心的打开核酸提取柱的盖子, 加入500ul洗液2, 盖上盖子, 6000*g离心1分钟, 倒掉收集管中的废液, 将提取柱重新放入收集管中。
PCR实验室仪器设备档案记录表7
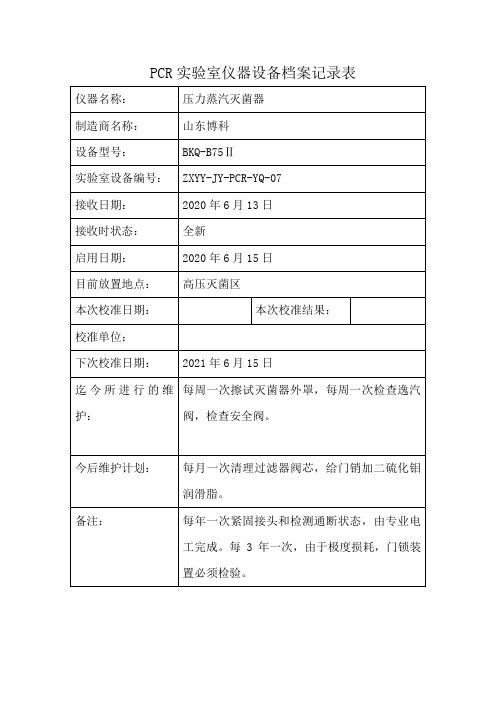
迄今所进行的维护:
每周一次擦试灭菌器外罩,每周一次检查逸汽阀,检查安全阀。
今后维护计划:
每月一次清理过滤器阀芯,给门销加二硫化钼润滑脂。
备注:
每年一次紧固接头和检测通断状态,由专业电工完成。每3年一次,由于极度损耗,门锁装置必须检验。
PCR实验室仪器设备档案记录表
仪器名称:
压力蒸汽灭菌器
制造商名称:
山东博科
设备型号:
BKQ-B75Ⅱ
实验室设备编号:
ZXYY-JY-PCR-YQ-07
接收日期:
2020年6月13日
接收时状态:
全新ห้องสมุดไป่ตู้
启用日期:
2020年6月15日
目前放置地点:
高压灭菌区
本次校准日期:
本次校准结果:
校准单位:
下次校准日期:
荧光定量PCR实验报告

荧光定量PCR实验报告一、实验目的1、掌握荧光定量PCR技术2、学习如何制备PCR反应体系3、了解实时荧光PCR数据分析4、检测DNA含量二、实验原理荧光定量PCR技术是一种基于PCR扩增原理的DNA分析方法,可定量检测DNA的含量,广泛应用于生物学、医学等领域。
该技术主要依靠荧光标记物,结合荧光信号强度进行定量分析。
PCR反应过程中,引物与模板DNA结合后在酶的催化下形成新的DNA链,每个PCR循环会翻倍模板量。
PCR扩增的温度曲线显示,PCR反应初期呈指数上升阶段,后期呈平台期,最后呈线性上升期。
荧光定量PCR技术基于PCR反应的初期、指数上升阶段的振幅与CT值(Crossing Threshold,荧光信号的阈值值点)之间的关系,对样品中靶序列的含量进行定量分析。
三、实验步骤以10μL体积计算,将荧光定量PCR反应体系制备如下表:试剂名称一次浓度最终浓度10μL体积SYBR Green 1x 1x 1μLdNTPs 10mM 0.2mM 0.2μLMgCl2 25mM 3mM 0.3μLTaq DNA Polymerase 5u/μL 0.04u/μL 0.04μLForward Primer - 0.2μM 0.2μLReverse Primer - 0.2μM 0.2μLTemplate DNA - 1ng-100ng 1μLddH2O - - 7.24μL2、装载PCR板将PCR反应体系均匀装到PCR板中,按照如下步骤进行:① 每组实验会使用96孔PCR板;② 取出PCR板后,先用蒸馏水清洗;③ 按照实验设计,合理地将合适的试剂组合均匀装出到每个孔中;④ 采用专用移液器,能够准确的移液。
3、进行PCR扩增反应在PCR扩增反应期间,我们将执行以下操作:② 进行荧光定量PCR反应;③ 在PCR反应过程中,分别记录下样品的CT值和所测基因的拷贝数;4、数据分析① 利用荧光定量PCR仪进行CT值分析,记录下每个样品的CT值;② 利用以下公式,将CT值成功转化成所测基因的拷贝数:DNA含量(ng)=拷贝数 X DNA分子量/ 6.02 X 10^23;③ 分别计算出每个样品的DNA含量;④ 利用所得数据,绘制出荧光定量PCR的结果图,并进行结果的解释。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
PCR 实验室检验流程表
检验日期:
检验项目:
实验前准备
试剂在有效期内
扩增仪、加样器和温度计在校准的有效期内 □生物安全柜的滤膜在使用有效期内 消毒溶液在有效期内
离心管、带滤芯吸头已经经过质检合格 操作者:
试剂准备区(1区)
实验前:
实验后: 清洁实验室台面、地面、加样器,并进行紫外线照射30分钟以上。
处理实验废弃物。
操作者:
打开通风设备
实验台面清洁(水或70%酒精擦拭) 冰箱温度:冷藏室(2~8℃): ℃ 冷冻室(-18℃±2℃): ℃
实验室温度: ℃(允许范围:10~30℃) 相对湿度: (允许范围:30%~70%) PCR 试剂来源: 批号:
检验项目:
本次试验用量: 人份
剩余量: 人份
标本制备区(2区)
检验日期:
检验项目:
实验前:
核酸提取及加样过程:按sop 进行
仪器设备使用:生物安全柜: 正常 不正常 恒温仪温度校准: 正常 不正常 离心机: 正常 不正常 振荡器: 正常 不正常 试验后: 清洁实验室台面、地面及仪器设备。
处理实验室废弃物。
操作者:
打开通风设备 实验台面清洁(水或70%酒精擦拭) 冰箱温度:冷藏室(2~8℃): ℃ 冷冻室(-18℃±2℃): ℃ 实验室温度: ℃(允许范围:10~30℃) 相对湿度: (允许范围:30%~70%) 阳性室内质控物来源: 浓度及批号: 扩增位置:
阴性室内质控物来源: 批号 扩憎位置:
扩增及产物分析区(3区) 检验日期: 检验项目:
扩增仪保存文件名:
实验前:
失控原因及分析:(失控判断标准及原因分析)
实验结果:
实验后: 清洁实验室台面、地面及仪器设备。
处理实验废弃物。
操作者:
打开通风设备
实验台面清洁(水或70%酒精擦拭) 实验室温度: ℃(允许范围:10~30℃) 相对湿度: (允许范围:30%~70%) 扩增仪操作: 开机自检及运行正常 进行编程、参数设定
室内质控结果:结果:
是否失控: 否 是。
