实验室滴定液配制及标定记录表
常见标准滴定液的配置及标定

1氢氧化钠标准滴定溶液1.1配制称取110 g氢氧化钠, 溶于100 ml无二氧化碳的水中,摇匀,注入聚乙烯容器中,密闭放置至溶液。
按表1的规定,用塑料管量取上层清液,用无二氧化碳的水稀释至1000ml,摇匀表11.2 标定按表 2 的规定称取于 105℃~110℃电烘箱中干燥至恒重的工作基准试剂邻苯二甲酸氢钾,加无二氧化碳的水溶解,加2滴酚酞指示液(10 g/L),用配制好的氢氧化钠溶液滴定至溶液呈粉红色,并保持30 s。
同时做空白试验。
表2氢氧化钠标准滴定溶液的浓度〔c(NaOH)],数值以摩尔每升(mol/ L)表示,按以下公式计算:c(NaOH)=m×1000/(V1-V2)M式中 :m —邻苯二甲酸氢钾的质量的准确数值,单位为克(g)V1—氢氧化钠溶液的体积的数值,单位为毫升(ml)V2一空白试验氢氧化钠溶液的体积的数值,单位为毫升(ml)M 一邻苯二甲酸氢钾的摩尔质量的数值,单位为克每摩尔(g/mol)=204.222 盐酸标准滴定溶液2.1 配制按表3的规定量取盐酸,注入1000ml水中,摇匀表32.2 标定按表4的规定称取于270℃~300℃高温炉中灼烧至恒重的工作基准试剂无水碳酸钠,溶于50ml水中,加10滴溴甲酚绿一甲基红指示液,用配制好的盐酸溶液滴定至溶液由绿色变为暗红色,煮沸2 min,冷却后继续滴定至溶液再呈暗红色。
同时做空白试验。
表4盐酸标准滴定溶液的浓度c(HCI)].数值以摩尔每升表示按以下公式计算C(HCl)=m ×1000/(V1-V2)M 式 中 :m 一 无水碳酸钠的质量的准确数值,单位为克(g) V1一盐酸溶液的体积的数值,单位为毫升(ml)V2一 空白试验盐酸溶液的体积的数值,单位为毫升(ml) M 一 无水碳酸钠的摩尔质量的数值,单位为克每摩尔=52.9943.重铬酸钾标准滴定溶液C(61K 2Cr 2O 7)=0.1mol/L3. 1 方法一 3. 1. 1 配制称取5g 重铬酸钾,溶于1000ml 水中,摇匀。
滴定液标定记录

=
=
3
3
RSD%=
︳F4- F复均︳+ ︳F5- F复均︳+ ︳F6- F复均︳
×100%
3×F复均
RSD%=
×100%=%0.1%
3
误差限度:
RSD%=
︳F均- F复均︳
×100%
F均+F复均
RSD%=
×100%=%0.1%
结果计算:
F=
F均+F复均
=
=
2
2
复标人:
结论:本标准溶液浓度为
滴定液配制及标化记录
R–AⅡ02003–01
滴定液名称
盐酸(0.02mol/L)
配制数量
1000ml
基准试剂名称
基准无水碳酸钠
配制日期
年 月 日
指示剂名称
甲基红-溴甲酚绿
使用期限
三个月
标化温度
标化日期
年 月 日
复标温度
复标日期
年 月 日
配制方法:
取盐酸ml(1.8ml)加水适量使成1000ml。
配制人:
V1=ml V2=ml V3=ml
V控1=mlV空2=mlV空3=ml
计算:
F=
W基×1000
V×1.06
F1=
W基1×1000
=
×1000
=
V1×1.06
×1.06
F2=
W基2×1000
=
×1000
=
V2×1.06
×1.06
F3=
W基3×1000
=
×1000
=
V3×1.06
×1.06
常见标准滴定液的配置及标定

1氢氧化钠标准滴定溶液1.1配制称取110 g氢氧化钠, 溶于100 ml无二氧化碳的水中,摇匀,注入聚乙烯容器中,密闭放置至溶液。
按表1的规定,用塑料管量取上层清液,用无二氧化碳的水稀释至1000ml,摇匀表1氢氧化钠标准滴定溶液的浓度氢氧化钠溶液的体积V/ml[c(NaOH)]/ mol/L)1 540.5 270.1 5.41.2 标定按表 2 的规定称取于 105℃~110℃电烘箱中干燥至恒重的工作基准试剂邻苯二甲酸氢钾,加无二氧化碳的水溶解,加2滴酚酞指示液(10 g/L),用配制好的氢氧化钠溶液滴定至溶液呈粉红色,并保持30 s。
同时做空白试验。
表2标准[c(NaOH)]/(mol/L) 邻苯二甲酸氢钾的质量m/g 无二氧化碳水的体积V/L1 7.5 800.5 3.6 800.1 0.75 50氢氧化钠标准滴定溶液的浓度〔c(NaOH)],数值以摩尔每升(mol/ L)表示,按以下公式计算:c(NaOH)=m×1000/(V1-V2)M式中 :m —邻苯二甲酸氢钾的质量的准确数值,单位为克(g)V1—氢氧化钠溶液的体积的数值,单位为毫升(ml)V2一空白试验氢氧化钠溶液的体积的数值,单位为毫升(ml)M 一邻苯二甲酸氢钾的摩尔质量的数值,单位为克每摩尔(g/mol)=204.222 盐酸标准滴定溶液2.1 配制按表3的规定量取盐酸,注入1000ml水中,摇匀表3盐酸标准滴定溶液的浓度[c(HCI)]/(mol/I) 盐酸的体积V/ml.1 900.5 450.1 92.2 标定按表4的规定称取于270℃~300℃高温炉中灼烧至恒重的工作基准试剂无水碳酸钠,溶于50ml水中,加10滴溴甲酚绿一甲基红指示液,用配制好的盐酸溶液滴定至溶液由绿色变为暗红色,煮沸2 min,冷却后继续滴定至溶液再呈暗红色。
同时做空白试验。
表4盐酸标准滴定溶液的浓度c(HCI)/(mol/L)工作基准试剂无水碳酸钠的质量m/g1 1.9 0.5 0.95 0.10.2盐酸标准滴定溶液的浓度c(HCI)].数值以摩尔每升表示按以下公式计算C(HCl)=m ×1000/(V1-V2)M 式 中 :m 一 无水碳酸钠的质量的准确数值,单位为克(g) V1一盐酸溶液的体积的数值,单位为毫升(ml)V2一 空白试验盐酸溶液的体积的数值,单位为毫升(ml) M 一 无水碳酸钠的摩尔质量的数值,单位为克每摩尔=52.9943.重铬酸钾标准滴定溶液C(61K 2Cr 2O 7)=0.1mol/L3. 1 方法一 3. 1. 1 配制称取5g 重铬酸钾,溶于1000ml 水中,摇匀。
标准溶液滴定液管理规程(含表格)

文件制修订记录1.目的:建立标准溶液(滴定液)的标定、贮存、发放和使用管理规程,加强对标准溶液(滴定液)的管理,保证分析结果的准确性。
2.适用范围:适用于标准溶液(滴定液)的管理。
3.职责:标准溶液(滴定液)配制人、复标人、质量管理部对本规程的实施负责。
4.控制要求:4.1标准溶液(滴定液)的配制4.1.1标准溶液(滴定液)实验室要求:4.1.1.1应设在避光房间,室内阴凉、干燥、通风良好。
4.1.1.2室内须有空调设施,温湿度保持相对恒定,一般控制在温度20±5℃,相对湿度50%~75%。
4.1.2配制前准备工作:4.1.2.1所有品种均有批准的试剂配制操作规程。
4.1.2.2严格执行标准操作规程。
4.1.2.3配制前:首先检查所领试剂瓶签完好、包装完整、封口严密、无污染,在规定的使用期内,符合其规格要求。
4.1.2.4试剂恒重。
为防止基准试剂在存放后可能吸湿,配制前必须严格执行恒重的相关规定。
4.1.3称重:4.1.3.1称重是决定所需试剂准确性的关键步骤,必须准确无误。
4.1.3.2称量基准试剂所用天平应为灵敏度在万分之一的专用分析天平,且计量合格证在有效期内。
4.1.3.3称量样品所放的容器及所有操作过程所用容器均须洁净、无痕迹、无残留物。
4.1.4配制:4.1.4.1所有使用的玻璃量器,如容量瓶、滴定管、移液管均选用一等(A级)品,并经过校正,有校正合格证或附有校正值。
4.1.4.2严格按配制方法进行操作,实验操作规范,符合要求。
室内温度不符合要求时不得进行标定和复标。
4.1.4.3配好的标准溶液(滴定液)须放在与溶液性质相适应的洁净试剂瓶中,贴好标签。
4.1.4.4按规定程序进行标定,相对偏差应≤0.1%;由第二人进行复标,其相对偏差应≤0.1% 。
标定的份数和复标的份数均不得少于3份,二者的相对偏差≤0.1%,否则重标。
4.1.4.5标定结果按初、复标的平均值计算,取4位有效数字。
乙二胺四醋酸二钠滴定液 (0.05mol/L)配制、标定及复标记录

滴定液配制、标定及复标记录R-QC-907-00滴定液名称:乙二胺四醋酸二钠滴定液(0.05mol/L)浓度校正因子F:配制日期:年月日有效期:基准试剂名称:氧化锌含量:生产厂家:批号:指示剂名称:铬黑T指示剂配制方法:取乙二胺四醋酸二钠19g,加水适量使溶解成1000ml,摇匀。
标定:取于约800℃干燥至恒重的基准氧化锌0.12g,精密称定,加稀盐酸3ml使溶解,加水25ml,加0.025%甲基红的乙醇溶液1滴,滴加氨试液至溶液显微黄色,加水25ml与氨-氯化铵缓冲液(pH10.0)10ml,再加铬黑T指示剂少量,用本液滴定至溶液由紫色变为纯蓝色,并将滴定结果用空白试验校正,每1ml乙二胺四醋酸二钠滴定液(0.05mol/L)相当于4.069mg 的氧化锌。
根据本液的消耗量与氧化锌的取用量,算出本液的浓度。
即得。
贮藏:置玻璃塞瓶中,避免与橡皮塞、橡皮管等接触。
配制人:配制量:ml 计算公式:069.4)(m21⨯-=VVF式中:m为基准氧化锌的称取量(mg);V1为滴定中本滴定液的用量(ml);V2为空白试验中本滴定液的用量(ml);4.069为与每1ml的乙二胺四醋酸二钠滴定液(0.05mol/L)相当以毫克表示的氧化锌的质量。
上式中如将F改以浓度C (mol/L)计,则式中的“4.069”应该为“81.38”。
标定方法依据:《中国兽药典》2010年版一部附录滴定液标定记录基准试剂恒重温度: ℃恒重时间: h 室温: ℃湿度:% 天平编号:滴定管编号:滴定管初读数:ml 滴定管的末读数:mlT:4.068 mg/ml V0= ml(1)W1= g V1= ml C1= mol/L(2)W2= g V2= ml C2= mol/L(3)W3= g V3= ml C3= mol/L平均值:C= mol/L 相对偏差:D=滴定液复标记录基准试剂恒重温度:℃恒重时间:h 室温:℃湿度:% 天平编号:滴定管编号:滴定管初读数:ml 滴定管的末读数:mlT:4.068mg/ml V0= ml(1)W1= g V1= ml C1= mol/L(2)W2= g V2= ml C2= mol/L(3)W3= g V3= ml C3= mol/L平均值:C= mol/L 相对偏差:D=两人相对偏差:D= 两人平均值:C= mol/L浓度校正因子F=标定人:复核人:标定日期:年月日复标人:复核人:复标日期:年月日。
标准溶液配制标定及复标记录
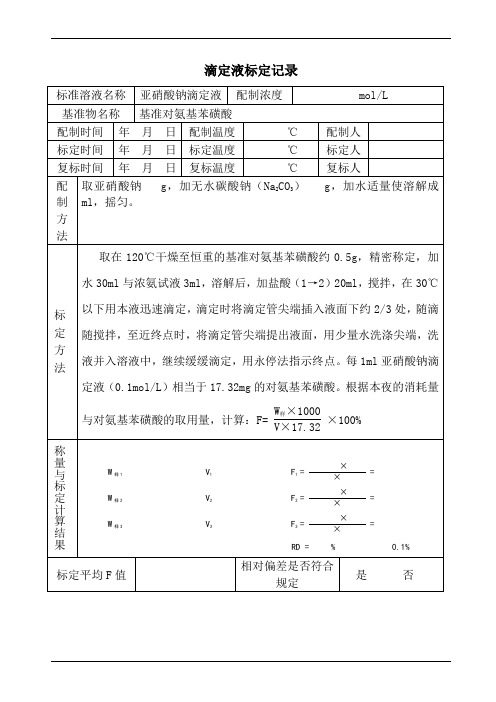
称量计算
标定平均F值
相对偏差是否符合规定
是否
称
量
复
标
计
算
结
果
称量计算
复标平均F值
相对偏差是否符合规定
是否
标准溶液F值
二次相对偏差
是否符合规定
是否
有效期至
年月日
备注
标准溶液的配制、标定及复标记录
标准溶液名称
硫酸铈滴定液
浓度
0.1mol/L
数量
标定用基准物名称
基准草酸钠
级别
配制时间
年月日
标定方法
取在105℃干燥至恒重的基准邻苯二甲酸氢钾约0.16g,精密称定,加无水冰醋酸20ml使溶解,加结晶紫指示液1滴,用本液缓缓滴定至蓝色,并将滴定结果用空白试验校正。每1ml高氯酸滴定液(0.1mol/L)相当于20.42mg的邻苯二甲酸氢钾。根据本液的消耗量与邻苯二甲酸氢钾的取用量,算出本液的浓度,即得。
根据硫代硫酸钠滴定液(0.1mol/L)的消耗量,算出本液浓度,即得。
初标
标定平均F值
相对平均偏差(不得大于0.1%)
复标
标定平均F值
相对平均偏差(不得大于0.1%)
标准溶液F值
二次相对偏差
(不得大于0.1%)
有效期至
年月日
备注
标准溶液的配制、标定及复标记录
标准溶液名称
氢氧化钠滴定液
浓度
数量
标定用基准物名称
年月日
标定人
复标时间
年月日
复标人
配制方法
取碘g,加碘化钾g与水ml溶解后,加盐酸滴与水适量使成ml,摇匀,滤过。
标定方法
精密量取本液25ml,置碘量瓶中,加水100ml与盐酸溶液(9→100)1ml,轻摇混匀,用硫代硫酸钠滴定液(0.1mol/L)滴定至近终点时,加淀粉指示液2ml,继续滴定至蓝色消失。
(完整word版)高氯酸滴定液(0.1mol/L)配制、标定及复标记录(word文档良心出品)
滴定液配制、标定及复标记录R-QC-912-00滴定液名称:高氯酸滴定液(0.1mol/L)浓度校正因子F:配制日期:年月日有效期:基准试剂名称:邻苯二甲酸氢钾含量:生产厂家:批号:指示剂名称:结晶紫滴定液配制方法:取无水冰醋酸(按含水量计,每1g水加醋酐5.22ml)750ml,加入高氯酸(70%~72%)8.5ml,摇匀,在室温下缓缓滴加醋酐23ml,边加边摇,加完后再振摇均匀,放冷,加无水冰醋酸适量使成1000ml,摇匀,放置24小时。
标定:取在105℃干燥至恒重的基准邻苯二甲酸氢钾约0.16g,精密称定,加无水冰醋酸20ml使溶解,加结晶紫指示剂1滴,用本液滴定至蓝色,滴定的结果用空白试验校正,每1ml高氯酸滴定液(0.1mol/L)相当于20.42mg邻苯二甲酸氢钾。
根据本液的消耗量与邻苯二甲酸氢钾的取用量,算出本液的浓度。
即得。
如需用高氯酸钠滴定液(0.05mol/L)或(0.02mol/L)时,可取高氯酸滴定液(0.1mol/L)加无水冰醋酸稀释制成。
配制人:配制量:ml 计算公式:TVVCWC⨯-⨯=)(理理实CCF=标定方法依据:《中国兽药典》2010年版一部附录滴定液标定记录基准试剂恒重温度: ℃恒重时间: h 室温: ℃湿度:% 天平编号:滴定管编号:滴定管初读数:ml 滴定管的末读数:mlT:20.42mg/ml V0= ml(1)W1= g V1= ml C1= mol/L(2)W2= g V2= ml C2= mol/L(3)W3= g V3= ml C3= mol/L平均值:C= mol/L 相对偏差:D=滴定液复标记录基准试剂恒重温度:℃恒重时间:h 室温:℃湿度:% 天平编号:滴定管编号:滴定管初读数:ml 滴定管的末读数:mlT:20.42mg/ml V0= ml(1)W1= g V1= ml C1= mol/L(2)W2= g V2= ml C2= mol/L(3)W3= g V3= ml C3= mol/L平均值:C= mol/L 相对偏差:D=两人相对偏差:D= 两人平均值:C= mol/L浓度校正因子F=标定人:复核人:标定日期:年月日复标人:复核人:复标日期:年月日。
标准滴定溶液的配制与标定
(1)、氢氧化钠标准滴定溶液配制按表1规定的体积用塑料管虹吸上层清液于聚乙烯容器中,注入1000mL无二氧化碳的水中摇匀。
表1(2)、标定a、测定方法按表1规定称取于105℃~110℃电热恒温干燥箱中干燥至质量恒定的基准邻苯二甲酸氢钾,精确至0.0001g,溶于规定体积的无二氧化碳的水中,加2滴酚酞指示液(10g/L),用配制好的氢氧化钠标准滴定溶液滴定至溶液呈粉红色。
同时作空白试验。
b、结果计算氢氧化钠标准滴定溶液的浓度[c(NaOH)],数值以摩尔每升(mol/L)表示,按下式计算:式中:V1-滴定时所消耗的氢氧化钠标准滴定溶液的体积的数值,单位为毫升(mL);V2-空白试验所消耗的氢氧化钠标准滴定溶液的体积的数值,单位为毫升(mL);m -称取的基准邻苯二甲酸氢钾质量的数值,单位为克(g);M-邻苯二甲酸氢钾(KHC8H4O4)的摩尔质量的数值,单位为克每摩尔(g/mol)(M=204.2)。
(1)配制按表2移取规定体积的盐酸,注入1 000mL水中,摇匀。
表2(2)标定a、测定方法按表2称取规定量的于270℃~300℃高温炉中灼烧至质量恒定的基准无水碳酸钠,精确至0.0001g,溶于50mL水中,加10滴澳甲酚绿一甲基红混合指示液,用配制好的盐酸标准滴定溶液滴定至溶液由绿色变为暗红色,煮沸2min,冷却后继续滴定至溶液再呈暗红色。
同时作空白试验。
b、计算盐酸标准滴定溶液浓度[c(HCl)],数值以摩尔每升(mol/L)表示,按下式计算:式中:V1一滴定时所消耗的盐酸标准滴定溶液的体积的数值,单位为毫升(mL);V2—空白试验所消耗的盐酸标准滴定溶液的体积的数值,单位为毫升(mL);m—称取的基准无水碳酸钠质量的数值,单位为克(g);M一无水碳酸钠(1/2Na2CO3)的摩尔质量的数值,单位为克每摩尔(g/mol)(M=52.99)。
3、重铬酸钾标准滴定溶液[c(1/6K 2Cr 207]≈0.1mol/L(1)方法一 a 、配制称取5 g 重铬酸钾,溶于1 000mL 水中,摇匀。
滴定液配制及标化记录2--锌
相对偏差1= ——————————— = %
相对偏差2= ——————————— = %
相对偏差3= ——————————— = %
相对偏差4= ——————————— = %
数
据
处
理
标准滴定液平均浓度:
CZnSO4= ——————————————————————
= mol/L
C标平均- CZnSO4
相对偏差2= ——————————— = %
相对偏差3= ——————————— = %
相对偏差4= ——————————— = %
复
标
记
录
复
标
记
录
标准滴定液浓度C1:标准溶液滴定管编号:被测液滴定管编号:
次数
项目
1
2
3
4
被测溶液体积(ml)
量取体积
滴定管校正
温度校正
实际体积(V)
标准滴定液体积(ml)
标定浓度计算
CZnSO4= C1V1/V
C1=
= mol/LC2== Nhomakorabeaol/L
C3=
= mol/L
C4=
= mol/L
标定平均浓度:C标平均= —————————————= mol/L
标定结果相对偏差
X-X平均
相对偏差= ————————×100%
X平均
相对偏差1= ——————————— = %
标定相对误差= ————————×100% =———————×100% = %
CZnSO4
C标平均- CZnSO4
复标相对误差= ————————×100% =———————×100% = %
高锰酸钾滴定液(0.02mol/L)配制及标定记录
高锰酸钾滴定液(0.02mol/L)配制及标定记录
基准草酸钠 配制数量
标定日期
文件编号: 标定温度
指示剂
________
配制日期
复标日期
复标温度
方法依据 《中国药典》2010 年版二部
批号
有效期至
滴定液配制: 取高锰酸钾
g,加水
ml,煮沸 分钟,密塞,静置 日,用垂熔玻璃滤器滤过,摇匀。
配制人:
滴定液(0.02mol/L)相当于 6.70 ㎎的草酸钠。根据本液的消耗量与草酸钠的取用量,算出本液的浓度,
即得。
取公式:C 2W 1000 5M V
C-高锰酸钾的浓度,mol/L
W-基准草酸钠的取用量,g
V-消耗本液的体积,ml
M-基准草酸钠的摩尔质量,134.00g/mol
标定记录: 基准草酸钠 的取用量(g)
F 值:初标与复标的硫酸浓度平均值(mol/L)/0.1(mol/L)=
l
复标记录:
基准无水碳酸钠 的取用量(g)
消耗本滴定 液的体积(ml)
1
2
3
实测硫酸浓度平均值(mol/L):________________
相对平均偏差:________________________________
实测得硫酸 浓度(mol/L)
复标人:
复核人:
结论: 初标与复标的硫酸浓度平均值(mol/L): 初标与复标的相对偏差:
复核人:
标定方法:
取在 105℃干燥至恒重的基准草酸钠约 0.2g,精密称定,加新沸过的冷水 250 ml 与硫酸 10 ml,搅拌
使溶解,自滴定管中迅速加入本液约 25 ml(变加边振摇,以免产生沉淀),待褪色后,加至 65℃,继
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
滴定液配制及标定记录
配制记录
滴定液名称配制批号
配制日期配制数量
标定日期标定温度
复标日期复标温度
有效期配置人
配制方法:
标定记录
基准试剂(名称:,批号:)恒重记录操作人/日期:
仪器:□干燥箱,编号:□天平,编号:□其他,名称/编号:干燥温度(℃)干燥时间(min)
□空坩埚□空称量瓶重量(g)□空坩埚□空称量瓶+基准试剂重量(g)
恒重一次重量(g)恒重二次重量(g)
标定步骤:
基准物质称样量(g)滴定液消耗量V(ml)C(mol/L)相对偏差(≤0.1%)
1 2 3 1 2 3 空白C1 C2 C3 均值 1 2 3
(第一行为初始读数,称量天平编号:)标定人/日期:
基准物质称样量(g)滴定液消耗量V(ml)C(mol/L)相对偏差(≤0.1%)
1 2 3 1 2 3 空白C1 C2 C3 均值 1 2 3
(第一行为初始读数,称量天平编号:)复标人/日期:
结论:
间接配置法配制的滴定液F值在0.95-1.05之间,标定与复标浓度均值为: mol/L,两者相对偏差(规定值为≤0.1%)为: %,故本滴定液校正浓度为: mol/L,F值为:。
