DNA制片过程
DNA制片过程

DNA制片过程制片过程1.固定(宫颈标本)医生用宫颈刷刷取标本后,将宫颈刷头取下放入固定液中,使取得的宫颈细胞标本得到及时的固定保存。
2.消化将固定液瓶放于振荡器上振荡半小时,直至粘液被完全消化,标本呈细颗粒状——细胞分散成细胞悬液止。
3.离心宫颈刷取物标本或痰标本消化好的标本液使其细胞均匀分布,另取一支7ml试管,倒入标本液4~5ml,放入离心机中以2500转/分转速离心4分钟。
从离心机中取出后,倒去上清夜。
根据沉淀的标本量加入适量固定液,再用一次性吸管反复抽吸使其混合均匀备用。
浆膜腔积液1)将标本先摇匀,将浆膜腔积液标本倒入一支50ml或15ml刻度离心管,放入离心机中以3000转/分转速离心5分钟。
2)从离心机中取出后,倒入上清液。
(或用一次性滴管吸除上清液,具体操作可视沉淀物性状而定)4.制片宫颈刷取物制片将转头置入离心涂片机(兰丁高科公司)中备好,吸取混匀的标本液加入转头孔中,以1500转/分的速度离心涂片4分钟,制成薄层细胞片1-2张。
细胞片经充分干燥后,经Feulgen-THionin染色,用DNA细胞自动检测分析仪扫描。
浆膜腔积液根据标本的性质,合理选择使用离心涂片机制片或者推片。
染色过程1)将制好的标本片干燥。
2)固定:将标本片置入无水乙醇中固定30分钟,回收无水乙醇。
3)B.S液固定60分钟,回收B.S液。
4)水洗3到5次,尽量控干水分。
5)酸化水解:5N HCL 25摄氏度酸解60分钟。
6)水洗3到5次。
7)DNA染液67分钟(25摄氏度)。
8)水洗6到8次。
9)用漂洗液漂洗3次,第1次1分钟、第2次3分钟、第3次4分钟。
10)水洗3到5次。
11)脱水:分别经95%乙醇、95%乙醇、无水乙醇、无水乙醇各2分钟。
12)吹干、贴条形码,中性树胶封片。
实验:观察DNA和RNA在细胞中的分布

实验:观察DNA和RNA在细胞中的分布(1)实验原理:甲基绿和吡罗红两种染色剂对DNA和RNA的亲和力不同,甲基绿使DNA呈绿色,吡罗红使RNA呈红色。
(2)实验材料:人的口腔上皮细胞或洋葱鳞片叶内表皮细胞(3)实验步骤是:制片—水解—冲洗涂片—染色—观察(4)载玻片上滴0.9%的NaCl溶液的作用:是保持口腔上皮细胞的正常形态;(5)水解时用到8%的盐酸的作用:①盐酸能改变细胞膜的通透性,加速染色剂进入细胞,②同时使染色体中 DNA与蛋白质分离,有利于DNA与染色剂结合;(6)用蒸馏水的缓水流冲洗载玻片:是为了防止细胞被水流冲走;(7)实验结果:绿色明显集中且接近细胞中央,绿色周围的红色范围较广;说明DNA主要分布于细胞核中,RNA主要分布于细胞质。
实验:观察DNA和RNA在细胞中的分布(1)实验原理:甲基绿和吡罗红两种染色剂对DNA和RNA的亲和力不同,甲基绿使DNA呈绿色,吡罗红使RNA呈红色。
(2)实验材料:人的口腔上皮细胞或洋葱鳞片叶内表皮细胞(3)实验步骤是:制片—水解—冲洗涂片—染色—观察(4)载玻片上滴0.9%的NaCl溶液的作用:是保持口腔上皮细胞的正常形态;(5)水解时用到8%的盐酸的作用:①盐酸能改变细胞膜的通透性,加速染色剂进入细胞,②同时使染色体中 DNA与蛋白质分离,有利于DNA与染色剂结合;(6)用蒸馏水的缓水流冲洗载玻片:是为了防止细胞被水流冲走;(7)实验结果:绿色明显集中且接近细胞中央,绿色周围的红色范围较广;说明DNA主要分布于细胞核中,RNA主要分布于细胞质。
实验:观察DNA和RNA在细胞中的分布(1)实验原理:甲基绿和吡罗红两种染色剂对DNA和RNA的亲和力不同,甲基绿使DNA呈绿色,吡罗红使RNA呈红色。
(2)实验材料:人的口腔上皮细胞或洋葱鳞片叶内表皮细胞(3)实验步骤是:制片—水解—冲洗涂片—染色—观察(4)载玻片上滴0.9%的NaCl溶液的作用:是保持口腔上皮细胞的正常形态;(5)水解时用到8%的盐酸的作用:①盐酸能改变细胞膜的通透性,加速染色剂进入细胞,②同时使染色体中 DNA与蛋白质分离,有利于DNA与染色剂结合;(6)用蒸馏水的缓水流冲洗载玻片:是为了防止细胞被水流冲走;(7)实验结果:绿色明显集中且接近细胞中央,绿色周围的红色范围较广;说明DNA主要分布于细胞核中,RNA主要分布于细胞质。
动物细胞有丝分裂过程图
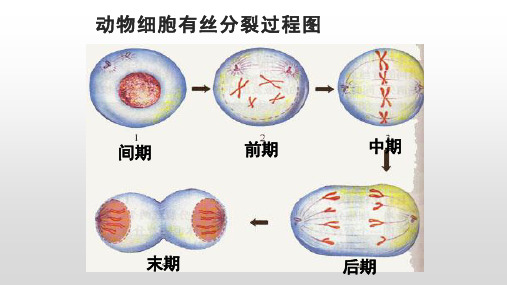
分裂间期
分裂前期
分裂中期
讨论: 1.你视野中哪一期细胞最多?为什么? 2.如何比较细胞周期不同时期的时间长短? 3.怎么确定分生区的细胞? 4.首先找出哪个时期的细胞?
如图是具有四条染色体的植物细胞有丝分裂图,据图分析回答下列问题:
(1)C图所示分裂的时期是___前_期___,判断的理由是__核_仁__逐_渐__消_失__,_出__现_染__色_体__和_纺__锤_体。. (2)一个细胞中,DNA分子数与染色体数相同的是___A_D_图。这些细胞在染色体结构 上的共同点是___没__有__染__色_单__体_____________。 (3)染色体数目加倍发生在___A____图. (4)若组成染色体的蛋白质中含有放射性元素,则A、B、C、D四图代表的细胞的放 射性强度相同吗?____相_同_____
3、举例 蛙的红细胞
观察根尖分生组织细胞的有丝分裂
实验原理:
➢ 在高等植物体内,有丝分裂常见于根尖、芽尖等分生区,茎形成 层细胞。
➢ 由于各个细胞的分裂是独立进行的,因此,当染色体被碱性染料
着色后,通过在
高倍镜
下观察,同一组织中可以看
到不同 时期 细胞内 染色体 的存在状态。从而判断细
胞各处于有丝分裂的哪个时期。
过程 解离
漂洗 染色 制片
方法 根尖2-3mm,盐酸和酒精混 合液(1∶1) 根尖酥软,清水
龙胆紫或醋酸洋红液
根尖弄碎,盖上盖玻片,再 加一片载玻片,用拇指轻压 载玻片
时间 3-5min
10 min 3-5 min
目的 使组织中的细胞相互分离开来; 杀死细胞 洗去药液,防止解离过度使染色体色使细胞分散开,有利于观察
b. 分裂期实现染色体平均分配到两个子细胞中去
病理组织切片制作技术

病理组织切片制作技术病理组织切片制作技术病理组织切片常用的制作方法有三种。
即石蜡切片法,冰冻切片法和火棉胶切片法。
以石蜡切片法为代表,切片的基本制作过程是:组织取材→固定→冲洗→脱水→透明→浸蜡→组织包埋→组织切片→展片附贴→切片脱蜡→染色→脱水→染片透明→封固。
以上基本过程是互相联系的,任何一环节出现问题,都将使整个切片制作归于失败。
因此应细致、耐心、认真负责,并事先做好计划安排。
一、取材采取病料,要刀剪锐利,剪切时不可挤压,扯拉病料,以防人为损伤。
切取的工具要清洁。
采取病料越新鲜越好,一般不超过死后24小时。
应选择病变部与可疑病变部切取,切取时要由表及里,有浅入深并包括周围正常组织一部分。
特殊病料应根据器官的结构特点切取。
管状,囊状和皮肤组织应注意垂直切取(横切)。
带有薄膜的组织,要防止切时薄膜分离和脱落。
切取组织块大小,以1.5×1.5×0.3厘米为宜,最厚不宜超过0.5厘米。
组织块病变一面应平整光滑,另一面可不平整,以便包埋时辨认。
切取后,放入事先准备好的装有固定液的磨口玻璃广口瓶中,并做好标记。
二、固定固定的目的是迅速将组织细胞杀死,使细胞中的蛋白质,糖,脂肪等凝固,从而保持与活组织相似的结构状态。
材料取下后,应迅速固定。
固定液数量应为病理组织块的5到20倍。
由于一般把组织块浸入固定液后数小时,固定液渗入组织液的深度只达2到3厘米。
因此,可以放置冰箱内固定,使组织内酶失去作用,细菌也能停止滋生。
最常用的固定液是10%的福尔马林溶液:使用时,用40%的甲醛饱和水溶液10毫升,加水90毫升配成。
三、冲洗固定后的组织块,应将固定液洗去。
一般均用流水(自来水)冲洗12到24小时左右。
及时冲洗尚有停止固定的作用,防止固定过度,有利于制片染色。
冲洗时如不方便用流水冲洗,也可用较大容器盛装水浸洗,每隔相当时间换水一次。
整个浸洗时间比流水冲洗应稍长一些。
酒精固定的组织材料不需冲洗。
DNA的原位显示—Feulgen染色法

Carnoy固定液:3份95%酒精加入1份冰醋酸。固定显 示DNA、RNA的效果好
,否则会使染色剂浓度降低。
• 漂洗时,所用的亚硫酸水,最好在每次实验前
临时配制,以便保持较浓的SO2。
• 加盖玻片时,切勿用力过大。
『其他固定液』
Flemming固定液:1%铬酸水溶液 25ml,1%冰醋酸 (用前加入)10ml,蒸馏水 60ml
Champy固定液:3%重铬酸钾 70ml,1%铬酸 70ml,2% 锇酸 40ml
『实验原理』 DNAຫໍສະໝຸດ 弱酸(1M的HCL)水解,其上的嘌呤碱和脱氧
核糖之间的键打开,使脱氧核糖的一端形成游离的醛 基,这些醛基在原位与Schiff试剂(无色品红亚硫酸 溶液)反应,形成紫红色的化合物,使细胞内含有DNA 的部位呈紫红色阳性反应。紫红色的产生是因为反应 产物的分子内含有醌基,醌基是一个发色团,所以具
『思考题』
欲得到一张好的Feulgen反应制片,制片过程 中应注意些什么?
• 水解是本实验成败关键之一。水解时间和温度
一定要合适,如果温度过高或时间过长,造成 水解过度,醣与醛基之间的键被破坏,醛基流 失到水解液中,反之,不能出现潜在的醛基, 都不能呈现颜色反应。
• 用Schiff试剂染色前,蒸馏水的残留不宜过多
4、Schiff液黑暗条件下染色30-50min(避光: 因为生成不稳定的物质,见光很容易分 解)。
5、用新配制的亚硫酸氢钠溶液洗3次,每次 约5min。(洗去无色品红,在自然条件下 易还原为碱性品红)
6、用清水洗2次,每次2min。 7、取一根尖置于载玻片上,切下生长区部位
DNA提取方法范文

DNA提取方法范文
材料和仪器:
1.细胞样品(例如细菌、动植物组织)
2. lysis缓冲液(含有蛋白酶、盐、缓冲液等成分)
3.蛋白酶K
4.乙酸混合酚
5.氯仿-异戊醇
6. 同济 Pharmacia GenePure Kit
7.离心管及离心机
8.PCR反应管
9.热水浴
步骤:
1. 取细胞样品加入适量的l 管内,混匀后用200L蛋白酶K
(10mg/Lysis)进行蛋白酶作用,37℃恒温2小时,期间翻转混匀。
2. 加入200L 10mg/ml 乙醚/酚搅匀,室温6分钟。
4.在热水浴中加入异戊醇至70°,10分钟,室温离心后去异戊醇。
5.加入75%乙醇冷冻纯化。
6.给乙醇沫体V100V1/50V离心处理梦泪水,禾端。
7. 加入便直完成cent and Over night 28°。
本方法主要通过蛋白酶作用和有机溶剂的使用来破坏细胞膜和蛋白质,最终得到DNA。
蛋白酶K能够将蛋白质降解,使得DNA得以释放出来。
乙
醚/酚和氯仿-异戊醇的使用则有助于分离DNA、RNA和蛋白质,最终得到
高纯度的DNA。
在DNA提取的过程中,要注意避免DNA受到外界污染,可以在操作台
上使用紫外灯杀菌消毒,同时使用无菌技术进行操作。
此外,选用高质量
的试剂和耗材也是保证实验成功的重要因素。
高中生物实验原理步骤总结

高中生物实验原理步骤总结一、用显微镜观察多种多样的细胞1.实验原理(1)放大倍数的计算,显微镜的放大倍数等于目镜放大倍数与物镜放大倍数的乘积。
(2)放大倍数的实质:放大倍数是指放大的长度或宽度,不是指面积或体积。
(3)高倍显微镜的作用:可以将细胞放大,更清晰地观察到细胞的形态、结构,有利于区别不同的细胞。
2.操作步骤【深度思考】(1)如何区分目镜与物镜,其长短与放大倍数之间存在怎样的关系?提示:目镜无螺纹,物镜有螺纹。
物镜越长,放大倍数越大;目镜越长,放大倍数越小。
(2)为什么要先用低倍镜观察清楚后,把要放大观察的物像移至视野中央,再换高倍物镜观察?提示:低倍镜下视野范围大,而高倍镜下视野范围小,如果直接用高倍物镜观察,往往由于观察的物像不在视野范围内而找不到。
因此,需要先用低倍镜观察清楚,并把要放大观察的物像移至视野中央,再换高倍物镜观察。
(3)如何把物像移到视野中央?提示:物像在视野中偏向哪个方向,装片就向哪个方向移动,简称“偏哪移哪”。
(4)若视野中出现一半亮一半暗;观察花生切片标本材料一半清晰一半模糊不清,出现上述两种情况的可能原因分别是什么?提示:前者可能是反光镜的调节角度不对;后者可能是由花生切片厚薄不均匀造成的。
(5)若所观察视野中有“污物”,应如何判断“污物”位置?提示:[方法技巧]1.关注显微镜使用的“4”个易错点(1)必须先用低倍物镜观察,找到要观察的物像,移到视野中央,然后再换用高倍物镜。
(2)换用高倍物镜后,不能再转动粗准焦螺旋,只能用细准焦螺旋来调节。
(3)换用高倍物镜后,若视野太暗,应先调节遮光器(换大光圈)或反光镜(用凹面反光镜)使视野明亮,再调节细准焦螺旋。
(4)观察颜色深的材料,视野应适当调亮,反之则应适当调暗。
2.显微镜下细胞数目的两种计算方法若视野中的细胞为单行,计算时只考虑长度和宽度;若视野中充满细胞,计算时则要考虑面积的变化。
(1)若视野中为一行细胞,高倍镜下细胞数量与低倍镜下细胞数量之比等于其放大倍数之比的倒数。
实验DNA的细胞化学——Feulgen反应

实验 DNA的细胞化学——Feulgen反应【实验目的】了解Feulgen反应的原理,掌握有关的操作方法。
【实验原理】DNA是由许多单核苷酸聚合成的多核苷酸,每个单核苷酸又由磷酸、脱氧核糖和碱基构成。
DNA经1N盐酸水解,其上的嘌呤碱和脱氧核糖之间的键打开,使脱氧核糖的第一碳原子上形成游离的醛基,这些醛基与Schiff试剂反应。
Schiff试剂是由碱性品红和偏重亚硫酸钠相作用,形成无色的品红液,当无色品红与醛基结合形成紫红色的化合物。
因此凡有DNA的地方,都能显示紫红色。
紫红色的产生,是由于反应产物的分子内含有醌基,醌基是一个发色基团,所以具有颜色。
材料不经过水解或预先用热的三氯醋酸或DNA酶处理,得到的反应是阴性的,从而证明了Feulgen反应的专一性。
【实验仪器、材料和试剂】(一) 仪器、用具显微镜、恒温水浴箱、温度计、解剖针、酒精灯、试管、烧杯、载玻片、盖玻片、吸水纸。
(二 )材料洋葱鳞茎(见图2,1)或根尖(见图2,2)(三)试剂1(1MHCl的配制取82.5ml比重1.19的浓HCl加蒸馏水至1000ml 。
2(Schiff试剂的配制及保存称取0.5g碱性品红加入到100ml煮沸的蒸馏水中(用三角烧瓶),时时振荡,继续煮 5分钟(勿使之沸腾),使之充分溶解。
然后冷却至50?时用滤纸过滤,滤液中加入10ml 1MHCl,冷却至25?时,加入0.5g Na2S2O5(偏重亚硫酸钠或钾),充分振荡后,塞紧瓶塞,在室温暗处静置至少24小时(有时需2,3天),使其颜色退至淡黄色,然后加入0.5g活性炭,用力振荡1分钟,最后用粗滤纸过滤于棕色瓶中,封严瓶塞,外包黑纸。
滤液应为无色也无沉淀,贮于4?冰箱中备用。
如有白色沉淀,就不能再使用,如颜色变红,可加入少许偏重亚硫酸钠或钾,使之再转变为无色时,仍可再用。
3(亚硫酸水取200ml自来水,加10ml 10%偏重亚硫酸钠(或偏重亚硫酸钾)水溶液和10ml 1M HCl,三者于使用前混匀。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
制片过程
1.固定(宫颈标本)
医生用宫颈刷刷取标本后,将宫颈刷头取下放入固定液中,使取得的宫颈细胞标本得到及时的固定保存。
2.消化
将固定液瓶放于振荡器上振荡半小时,直至粘液被完全消化,标本呈细颗粒状——细胞分散成细胞悬液止。
3.离心
宫颈刷取物标本或痰标本
消化好的标本液使其细胞均匀分布,另取一支7ml试管,倒入标本液4~5ml,放入离心机中以2500转/分转速离心4分钟。
从离心机中取出后,倒去上清夜。
根据沉淀的标本量加入适量固定液,再用一次性吸管反复抽吸使其混合均匀备用。
浆膜腔积液
1)将标本先摇匀,将浆膜腔积液标本倒入一支50ml或15ml刻度离心管,放入离心机中以3000转/分转速离心5分钟。
2)从离心机中取出后,倒入上清液。
(或用一次性滴管吸除上清液,具体操作可视沉淀物性状而定)
4.制片
宫颈刷取物制片
将转头置入离心涂片机(兰丁高科公司)中备好,吸取混匀的标本液加入转头孔中,以1500转/分的速度离心涂片4分钟,制成薄层细胞片1-2张。
细胞片经充分干燥后,经Feulgen-THionin染色,用DNA细胞自动检测分析仪扫描。
浆膜腔积液
根据标本的性质,合理选择使用离心涂片机制片或者推片。
染色过程
1)将制好的标本片干燥。
2)固定:将标本片置入无水乙醇中固定30分钟,回收无水乙醇。
3)B.S液固定60分钟,回收B.S液。
4)水洗3到5次,尽量控干水分。
5)酸化水解:5N HCL 25摄氏度酸解60分钟。
6)水洗3到5次。
7)DNA染液67分钟(25摄氏度)。
8)水洗6到8次。
9)用漂洗液漂洗3次,第1次1分钟、第2次3分钟、第3次4分钟。
10)水洗3到5次。
11)脱水:分别经95%乙醇、95%乙醇、无水乙醇、无水乙醇各2分钟。
12)吹干、贴条形码,中性树胶封片。
