2020届高考化学二轮复习专题五化学能与热能(5)专项测试(含解析)
2020届高考化学二轮复习专题十五化学能与热能(含解析)

专题十五化学能与热能1、在研究物质变化时,人们可以从不同的角度、不同的层面来认识物质变化所引起的化学键及能量的变化,据此判断以下叙述错误的是( )A.化学反应中物质变化的实质是旧化学键断裂和新化学键生成B.物质的燃烧过程可看成“储存”在物质内部的能量(化学能)转化为热能释放出来的过程C.在化学反应中,破坏旧化学键吸收的能量大于形成新化学键释放的能量时,该反应是吸热反应D.需要在高温条件下才能发生的反应一定是吸收能量的反应2、2016年诺贝尔化学奖授予在合成分子机器领域做出贡献的三位科学家。
分子机器是一种特殊的超分子体系,当体系受到外在刺激(如pH 变化、吸收光子、电子得失等)时,分子组分间原有作用被破坏,各组分间发生类似于机械运动的某种热运动。
下列说法不正确...的是( )A.驱动分子机器时,需要对体系输入一定的能量B.分子状态的改变会伴随能量变化,属于化学变化C.氧化还原反应有可能是刺激分子机器体系的因素之一D.光照有可能使分子产生类似于机械运动的某种热运动3、化学与社会、科学、技术、环境密切相关。
下列说法不正确的是( )A.T-碳是一种新型三维碳结构晶体,与C60互为同素异形体B.推广利用CO2合成聚碳酸酯可降解塑料符合低碳经济理念C.将金属钛、铝混合后在空气中熔化可制得强度较大的钛合金材料D.为汽车安装尾气催化转化装置,可将尾气中的部分CO和NO转化为无毒气体4、下列说法正确的是( )A.凡是放热反应都是自发的,因为吸热反应都是非自发的B.自发反应的熵一定增大,非自发反应的熵一定减小C.常温下,反应C(s)+CO2(g)2CO(g)不能自发进行, 则该反应的ΔΗ>0D.反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的ΔΗ>05、H2与ICl的反应分①、②两步进行,其能量曲线如下图所示,下列有关说法不正确的是()A.反应② 比① 要容易发生是因为反应② 活化能大B.反应① 和② 均为放热反应C.H2(g)+2ICl(g)= I2(g)+2HCl(g) ∆H= -218 kJ·molˉ1D.反应① 和② 均为氧化还原反应6、甲烷与氯气光照条件下取代反应的部分反应历程和能量变化如下:第一步:Cl2(g) 2C1•(g) △H1 = +242.7 kJ • mol-1第二步:CH4(g) + Cl • (g) CH3• (g) + HCl(g) △H2 = + 7.4 kJ • mol-1第三步:CH3• (g)+Cl2(g) CH3Cl(g)+Cl • (g) △H3 = -112. 9 kJ • mol-1……中(其中Cl •表示氯原子,CH3 •表示甲基)下列说法不正确的是( )A.由题可知,甲烷和氯气在室温暗处较难反应B. CH4(g)+Cl2(g)CH3Cl(g) + HCl(g) △H=–105.4 kJ • mol-1C.形成1 mol CH3Cl中C—Cl键放出的能量比拆开1 mol Cl2中化学键吸收的能量多D.若是甲烷与Br2发生取代反应,则第二步反应△H < + 7.4 kJ • mol-17、已知:① S(g)+O2(g)=SO2(g) ΔH1;② S(s)+O2(g)=SO2(g) ΔH2;③ 2H2S(g)+O2(g)=2S(s)+2H2O(l) ΔH3;④ 2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH4;⑤ SO2(g)+2H2S(g)=3S(s)+2H2O(l) ΔH5下列关于上述反应焓变的判断不正确的是()A.ΔH1<ΔH2B.ΔH3<ΔH4C.ΔH5=ΔH3-ΔH2D.2ΔH5=3ΔH3-ΔH48、中国研究人员研制一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,主要过程如下图所示下列说法不正确的是( )A.整个过程实现了光能向化学能的转化B.过程Ⅱ放出能量并生成了O-O 键C.总反应2H 2O2H 2+O 2D.过程Ⅲ属于分解反应也是吸热反应9、已知化学反应22A (g)+B (g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是(2A 和2B 的结构式分别为A-A 、B-B)( )A.每生成2分子AB 吸收b kJ 热量B.该反应的反应热-1()kJ mol H a b ∆=+-⋅C.该反应中反应物的总能量高于生成物的总能量D.断裂1mol A —A 键和1mol B —B 键,放出a kJ 能量10、研究表明CO 与N 2O 在Fe 作用下发生反应的能量变化及反应历程如图所示,两步反应分別为: ①②N 2O+Fe +=N 2+FeO +(慢):②FeO ++CO=CO 2+Fe +(快)。
2020届高考化学二轮复习专项测试:专题五 热化学方程式 盖斯定律及其应用 (3)含解析

2020届高考化学二轮复习专项测试专题五热化学方程式盖斯定律及其应用(3)1、已知3.0g乙烷完全燃烧在常温下放出的热量为155.98kJ,则下列关于乙烷燃烧热的热化学方程式书写正确的是( )A.2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g) ΔH=-3119.6kJ/molB.C2H6(g)+5/2O2(g)=2CO(g)+3H2O(g) ΔH=-1559.8kJ/molC.C2H6(g)+7/2O2(g)=2CO2(g)+3H2O(g) ΔH=-1559.8kJ/molD.C2H6(g)+7/2O2(g)=2CO2(g)+3H2O(l) ΔH=-1559.8kJ/mol2、1g碳与适量水蒸气反应生成CO和H2,需吸收10.94kJ热量,此反应的热化学方程式为( )A.C+H2O CO+H2ΔH=+131.3kJ·mol-1B.C(s)+H2O(g)CO(g)+H2(g) ΔH=+10.94kJ·mol-1C.C(s)+H2O(l)CO(g)+H2(g) ΔH=+131.3kJ·mol-1D.C(s)+ H2O(g)CO(g)+H2(g) ΔH=+131.3kJ·mol-13、下列依据热化学方程式得出的结论正确的是( )A.已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1,则氢气燃烧热为241.8kJ·mol-1B.已知C(s)+O2(g)=CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2,则2ΔH1<ΔH2C.已知2SO2(g)+O2(g)2SO3(g) ΔH=-Q kJ·mol-1(Q>0),则将16g SO2(g)和足量O2置于一密闭容器中,充分反应后放出0.25Q kJ的热量D.已知:C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨4、常温下,1mol化学键分解成气态原子所需要的能量用E表示,结合表中信息判断下列说法不正确的是( )A.432kJ·mol-1>E(H-Br)>298kJ·mol-1B.表中最稳定的共价键是H-F键C.H2(g)→2H(g) ΔH=+436kJ·mol-1D.H2(g)+F2(g)=2HF(g) ΔH=-25kJ·mol-15、已知反应:①101kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221kJ·mol-1②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1下列结论正确的是( )A.碳的燃烧热大于110.5kJ·mol-1B.反应①的反应热为221kJ·mol-1C.98%的浓硫酸与稀氢氧化钠溶液反应生成1mol水的中和热为-57.3kJ·mol-1D.稀醋酸与稀氢氧化钠溶液反应生成1mol水时放出57.3kJ的热量6、下列关于反应过程中能量变化的说法正确的是()A.图中a、b曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g) ΔH<0使用和未使用催化剂时,反应过程中的能量变化B.己知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2。
2020届高考化学二轮复习专项测试:专题五 化学能与热能 (4)含解析

2020届高考化学二轮复习专项测试专题五化学能与热能(4)1、已知:H 2O(g)H 2O(l) ΔH 1=-Q 1kJ·mol -1;C 2H 5OH(g)C 2H 5OH(l) ΔH 2=-Q 2kJ·mol -1;C 2H 5OH(g)+3O 2(g)2CO 2(g)+3H 2O(g) ΔH=-Q 3kJ·mol -1。
若23g 液体酒精完全燃烧,最后恢复到室温,则放出的热量为( ) A.Q 1+Q 2+Q 3 B.1.5Q 1-0.5Q 2+0.5Q 3C.0.5Q 1-0.5Q 2+0.5Q 3D.0.5(Q 1+Q 2+Q 3) 2、有关键能的数据如下表 :已知晶体硅在氧气中燃烧的热化学方程式为:Si(s)+O 2(g)=SiO 2(s) 1989.2H kJ mol -∆=-⋅;则x 的值为( )。
A.460 B.920 C.1165.2 D.423.33、最近意大利罗马大学的FuNvio Cacace 等人获得了极具理论研究意义的N 4分子。
N 4分子结构如下图所示,已知断裂1mol N __N 键吸收193 kJ 热量,生成1mol N N 键放出946 kJ 热量。
根据以上信息和数据判断,下列说法正确的是( )A.N 4属于一种新型的化合物B.14N 原子核内的中子数为7 C.N 4的沸点比P 4(白磷)的高D.1mol N 4气体转变为N 2吸收734 kJ 热量4、已知N 2(g)+3H 2(g)2NH 3(g)+Q 1反应历程的能量变化如曲线Ⅰ,说法正确的是( )A.1molN≡N 键能与3molH-H 键能之和大于6molN-H 键能,所以反应为放热B.N 2(g)+3H 2(g)2NH 3(l)+Q 2反应历程的能量变化如曲线Ⅱ,则Q 2>Q 1C.选择合适的催化剂,可以降低反应所需温度,Q 1值也相应减少D.2mol 氨气的能量高于1mol 氮气和3mol 氢气的能量之和,所以反应需要高温 5、如图是2CO 生产甲醇的能量变化示意图.下列说法正确的是( )A. 21E E -是该反应的热效应B. 31E E -是该反应的热效应C.该反应放热,在常温常压下就能进行D.实现变废为宝,且有效控制温室效应6、一定条件下,在密闭容器内,SO 2氧化成SO 3的热化学方程式为:2SO 2(g)+O 2(g)2SO 3(g);△H -akJ·mo1-1在相同条件下要想得到2akJ 热量,加入各物质的物质的量可能是( )A.4mo1SO 2和2mol O 2B.4mol SO 2、2mo1 O 2和2mol SO 3C.4mol SO 2和4 mo1 O 2D.6mo1 SO 2和4 mo1 O 27、下列关于热化学反应的描述中正确的是 ( )A. ()CO g 的燃烧热是283.01mol kJ -⋅,则222()2()()CO g CO g O g +反应的12283.0H kJ mol -∆=+⨯⋅B.盐酸和NaOH 反应的中和热157.3H kJ mol -∆=-⋅, 则24H SO 和()2Ca OH 反应的中和热12(57.3)H kJ mol -∆=⨯-⋅C.用等体积的0.501mol L -⋅盐酸、0.551mol L -⋅ NaOH 溶液进行中和热测定的实验,会使测得的值偏大D.1mol 甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 8、已知:①()()222H g O g +()22?H O l 1571.6mol H kJ -∆=-⋅②()()3223CH OH l O g +()()2224CO g H O l + 11452H kJ mol -∆=-⋅③()()Haq OH aq +-+()2H O l 157.3H kJ mol -∆=-⋅下列说法正确的是( )A. ()2H g 的燃烧热为571.6 1mol kJ -⋅B. ()()()242H SO aq Ba OH aq +()()42 2BaSO s H O l + 1114.6H kJ mol -∆=-⋅C.同质量的()2H g 和()3CH OH l 完全燃烧, ()2H g 放出的热量多D. ()()223H g CO g +()()32CH OH l H O l + 1135.9H kJ mol -∆=+⋅9、一定条件下在2L 的密闭容器中,充入2mol 2SO 和1mol 2O 发生反应:()()222SO g O g +()32SO g 1196H kJ mol -∆=-⋅,当气体的总物质的量减少0.8mol 时反应达到平衡,下列有关叙述不正确的是( )A.保持温度不变,向平衡后的容器中再充入1mol 2SO 和0.5mol 2O 时,B.相同温度下,起始时向容器中充入2mol 3SO ,达平衡时3SO 的转化率为20%C.平衡混合气体中2SO 的物质的量为1.2molD.保持其他条件不变,若起始时向容器中充入2mol 3SO ,达平衡时吸收39.2kJ 的热量10、强酸与强碱的稀溶液发生中和反应的热效应:()()H aq OH aq +-+()2H O l ;157.3H kJ mol -∆=-⋅,向1L 0.51mol L -⋅的NaOH 溶液中加入下列物质:①稀醋酸;②浓24H SO ;③稀硝酸,恰好完全反应的热效应1H ∆、2H ∆、3H ∆的关系正确的是( ) A. 123H H H ∆>∆>∆ B. 132H H H ∆<∆<∆ C. 132H H H ∆=∆>∆ D. 132H H H ∆>∆>∆11、在同温同压下,下列各组热化学方程式中b a >的是( ) A.()()()222;?H g Cl g HCl g H a +=∆=-()()()2211;22H g Cl g HCl g H b +=∆=- B.()()()21;?2C s O g CO g H a +=∆=- ()()()22 ;C s O g CO g H b +=∆=-C.()()()22222;?H g O g H O l H a +=∆=- ()()()22222;H g O g H O g H b +=∆=-D.()()()22 ;S g O g SO g H a +=∆=- ()()()22 ;S s O g SO g H b +=∆=-12、氢气是一种清洁能源,其来源可以是: 途径1.用太阳能分解水生成氢气途径2.用聚焦太阳能反应器发生以下反应:CH4(g)+H2O(g)CO(g)+3H2(g) ΔH=+206kJ·mol-1已知:在25℃、101kPa时2CO(g)+O2(g)2CO2(g) ΔH=-566.0 kJ·mol-11.在25℃、101kPa时,1克H2完全燃烧生成气态水时放热120.9kJ热量。
2020年高考课标版高考化学 5_专题五 化学能与热能
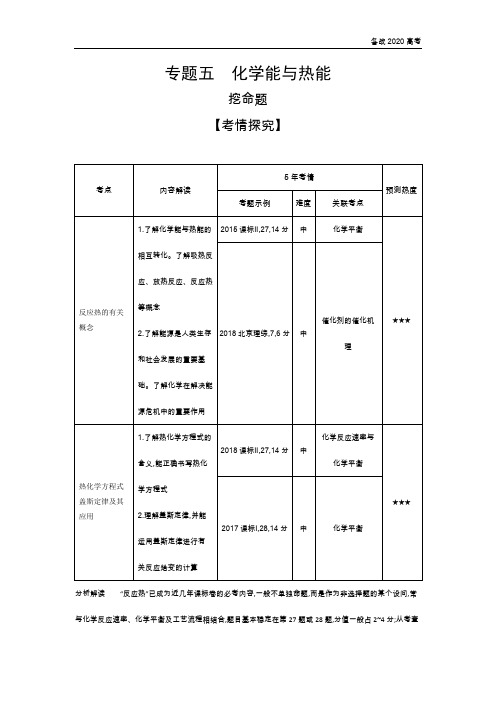
专题五化学能与热能挖命题【考情探究】分析解读“反应热”已成为近几年课标卷的必考内容,一般不单独命题,而是作为非选择题的某个设问,常与化学反应速率、化学平衡及工艺流程相结合,题目基本稳定在第27题或28题,分值一般占2~4分;从考查的内容上看,均与盖斯定律有关,试题整体难度虽然较大,但涉及本专题的内容都比较容易。
随着能源问题的日益突出,对本专题的考查仍将维持较高的热度。
【真题典例】破考点【考点集训】考点一反应热的有关概念1.(2018北京石景山一模,6)2017年3月,中国成功开采可燃冰(主要成分为甲烷)。
直接从自然界得到的能源为一次能源,下列不属于一次能源的是( )A.石油B.氢能C.太阳能D.煤答案B2.(2019届河南焦作定位考试,12)下列说法正确的是( )A.已知C(石墨,s)C(金刚石,s) ΔH>0,则金刚石比石墨稳定B.已知H+(aq)+OH-(aq)H2O(l) ΔH=-57.3 kJ·mol-1,则稀硫酸溶液和稀Ba(OH)2溶液反应的反应热ΔH=-114.6 kJ·mol-1C.常温下,反应C(s)+CO2(g)2CO(g)不能自发进行,则该反应的ΔH<0D.已知H2(g)+Cl2(g)2HCl(g) ΔH1=-a kJ·mol-1,H2(g)+Cl2(g)2HCl(l) ΔH2=-b kJ·mol-1,则a<b答案D3.(2019届四川成都摸底,14)下列说法正确的是( )A.锂电池使用时,能量只存在由化学能到电能的转化B.已知P4(白磷,s)4P(红磷,s) ΔH=-18.4 kJ·mol-1,故白磷比红磷稳定C.H2在Cl2中燃烧:H2(g)+Cl2(g)2HCl(g) ΔH=-184.6 kJ·mol-1,则H2的燃烧热ΔH=-184.6 kJ·mol-1D.测定中和反应的反应热时,其他不变,用醋酸代替盐酸测得的反应热ΔH偏大答案D4.(2017河南中原名校联盟三联,13)已知:C(s)+H2O(g)CO(g)+H2(g) ΔH=+130 kJ·mol-1;2C(s)+O2(g)2CO(g) ΔH=-220 kJ·mol-1。
2020年高三化学第二轮复习《化学能与热能》能力提升24题(含答案和解析)

2020年高三化学第二轮复习《化学能与热能》能力提升24题一、单选题(本大题共20小题,共40分)1、炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。
活化过程的能量变化模拟计算结果如图所示。
活化氧可以快速氧化二氧化硫。
下列说法不正确的是()A. 每活化一个氧分子放出的能量B. 水可使氧分子活化反应的活化能降低C. 该过程反应速率主要取决于第一步D. 炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂2、已知反应:,其反应机理如下:快慢下列有关该反应的说法正确的是()A. 该反应的速率主要取决于的快慢B. 是该反应的催化剂C. 正反应的活化能比逆反应的活化能小D. 增大浓度能增大单位体积内活化分子百分数,加快反应速率3、下列热化学方程式及有关应用的叙述中,正确的是()A. 甲烷的燃烧热为,则甲烷燃烧的热化学方程式可表示为:B. 取和进行中和热的测定实验,用温度计测定起始温度后,直接测定的温度,会使中和热偏小C. 、30MPa下,将和置于密闭的容器中充分反应生成,放热,其热化学方程式为:D. 已知、101KPa条件下:,,则比稳定4、和的能量关系如图所示、:下列说法正确的是()A.B.C.D. 对于和,5、下列图示与对应叙述相符的是()A. 图1表示向氯水中逐滴加入醋酸溶液,溶液导电性随加入酸溶液体积的变化B. 图2表示酸性介质原电池反应过程中的电流强度的变化,T时可能加入了C. 图3表示与反应过程中的能量变化,其中D. 图4表示在饱和溶液中逐步加固体后,溶液中的浓度变化6、下列说法正确的是()A. 中和热测定实验中需要的玻璃仪器有:烧杯、量筒、温度计、环形玻璃搅拌棒B. 乙烯的燃烧热为,则乙烯燃烧的热化学方程式为:C. 用石墨电极电解溶液,若反应产生,则向原溶液中加入能恢复至原浓度D. 用pH试纸分别测定氯水和盐酸的pH,比较两溶液的酸性强弱7、下列有关热化学方程式的叙述中,正确的是()A. 已知,,则B. 已知石墨,金刚石,,则金刚石比石墨稳定C. 已知,则的燃烧热为D. 含的稀溶液与稀盐酸完全中和,放出的热量,则表示该反应中和热的热化学方程式为8、已知:下列说法正确的是()A.B. HCl和HBr的键能差可以表示为C.D. 升温时,丙烷与反应速率加快,与反应速率降低9、下列热化学方程式及有关应用的叙述中,正确的是()A. 甲烷的燃烧热为,则甲烷燃烧的热化学方程式可表示为:B. 取和进行中和热的测定实验,用温度计测定起始温度后,直接测定的温度,会使中和热偏小C. 、30MPa下,将和置于密闭的容器中充分反应生成,放热,其热化学方程式为:D. 已知、101KPa条件下:,O,则O比O稳定10、下列说法不正确的是()【电离度a是指达电离平衡时以电离的电解质分子数占原来总分子数的百分比】A. 甲烷的标准燃烧热为,则甲烷燃烧的热化学方程式可表示为:B. 已知冰的熔化热为,冰中氢键键能为,假设1mol冰中有2mol氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中的氢键C. 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为a,电离常数。
2025届高考化学二轮复习专题五化学能与热能2专项测试含解析

化学能与热能(2)1、25℃、101kPa 、2g 氢气燃烧生成液态水,放出285.8kJ 的热量,下列表示该反应的热化学方程式正确的是( ) A. 222(g)(g)H O +22()H O l 1571.6mol H kJ -∆=-⋅ B. 222(g)(g)H O +22()H O l 1571.6?H kJ mol -∆=+⋅C. 222(g)(g)H O +22(g)H O 1571.6mol H kJ -∆=-⋅D. 2212(g)(g)2H O +22(g)H O 1285.8H kJ mol -∆=-⋅2、已知:①1 molH 2分子中化学键断裂时须要汲取436 kJ 的能量,②1 mol I 2蒸气中化学键断裂时须要汲取151kJ 的能量,③由H 原子和I 原子形成1 mol HI 分子时释放299 kJ 的能量。
下列推断错误的是( ) A.I 2(g)分子比H 2分子稳定B.2 mol HI(g)发生分解反应汲取11 kJ 热量C.HI 与NaOH 反应属于放热反应D.0. 5 mol H 2 (g)与 0.5 mol I 2 (g)完全反应释放出5.5 kJ 热量 3、已知反应:①101kPa 时,2C(s)+O 2(g)=2CO(g) △H=-221kJ/mol ②稀溶液中,H +(aq)+OH -(aq)=H 2O(1) △H=-57.3kJ/mol 下列结论正确的是( )A.稀醋酸与稀NaOH 溶液反应生成1mol 水,放出57.3kJ 热量B.①的反应热为221kJ/molC.通过浓硫酸与稀NaOH 溶液反应测得的中和热为57.3kJ/molD.碳的燃烧热的数值大于110.5kJ/mol4、下列依据热化学方程式得出的结论正确的是( )A.已知()()()2222?2H g O g H O g + 1483.6?H kJ mol -∆=-⋅,则氢气的燃烧热为241.8 1mol kJ -⋅B.已知()()()()2 NaOH aq HCl aq NaCl aq H O l ++ 157.3H kJ mol -∆=-⋅,则含40.0 g NaOH 的稀溶液与稀醋酸完全中和,放出57.3 kJ 的热量 C.已知()()()22 222C s O g CO g + a?H ∆=;()()()222C s O g CO g + H b ∆=,则a b >D.已知C (石墨, s )C (金刚石, s ) 0H ∆>,则石墨比金刚石稳定5、已知()()2212H g O g +()2H O g 1241.8?.?H kJ mol -∆=-.下列说法中不正确的是( )A. 2H 燃烧放出的热量为241.8kJB. ()()222H g O g +()22H O g 1483.6?H kJ mol -∆=-⋅C.1mol2H 完全燃烧生成液态水放出的热量小于241.8kJD.断开1mol 2H O 的化学键汲取的总能量大于断裂1mol 2H 和0.5mol 2O 的化学键所汲取的总能量6、今有如下3个热化学方程式:① ②③关于它们在下列表述中缘由和结论都正确的是 ( ) A.缘由:燃烧是放热反应;结论:。
全品高考化学二轮:专题(5)化学能与热能

专题限时集训(五) [专题五化学能与热能](时间:40分钟)1.下列说法或表示方法不正确的是( )A.盖斯定律实质上是能量守恒定律的体现B.在稀溶液中:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol。
若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJC.由C(石墨)→C(金刚石) ΔH=+73 kJ/mol,可知石墨比金刚石稳定D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ/mol2.下列表示化学反应2H2(g)+O2(g)===2H2O(g)过程能量变化的示意图中,合理的是( )图Z513.下列热化学方程式书写正确的是( )A.2SO2+O2===2SO3ΔH=-196.6 kJ·mol-1B.H2(g)+12O2(g)===H2O(l)ΔH=-285.8 kJ·mol-1C.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJD.C(s)+O2(g)===CO2(g) ΔH=+393.5 kJ·mol-14.反应A(g)+B(g)→C(g)ΔH分两步进行:①A(g)+B(g)→X(g) ΔH1;②X(g)→C(g)ΔH2。
反应过程中能量变化如图Z52所示,E1表示A+B→X的活化能,下列说法正确的是( )A.ΔH1=ΔH-ΔH2>0B.X是反应A(g)+B(g)→C(g)的催化剂C.E2是反应②的活化能D.ΔH=E1-E2图Z535.图Z53为反应2H2(g)+O2(g)===2H2O(g)的能量变化示意图。
下列说法正确的是( )A.将2 mol H2(g)和1 mol O2(g)中的化学键拆开得H、O原子,共放出1368 kJ能量B .由H 、O 原子形成2 mol H 2O(g),共吸收1852 kJ 能量C .2 mol H 2(g)和1 mol O 2(g)反应生成2 mol H 2O(l),共吸收484 kJ 能量D .2 mol H 2(g)和1 mol O 2(g)反应生成2 mol H 2O(g),共放出484 kJ 能量6.已知下列热化学反应方程式:Fe 2O 3(s)+3CO(g)===2Fe(s)+3CO 2(g)ΔH =-24.8 kJ/molFe 2O 3(s)+13CO(g)===23Fe 3O 4(s)+13CO 2(g) ΔH =-15.73 kJ/molFe 3O 4(s)+CO(g)===3FeO(s)+CO 2(g)ΔH =+640.4 kJ/mol则14 g CO 气体还原足量FeO 固体得到Fe 固体和CO 2气体时对应的ΔH 约为( )A .-218 kJ/molB .-109 kJ/molC .+218 kJ/molD .+109 kJ/mol7.已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(a 、b 均为正值):①H 2(g)+Cl 2(g)===2HCl(g) ΔH =-a kJ ·mol -1,②H 2(g)+Br 2(g)===2HBr(g) ΔH =-b kJ ·mol -1。
2020年高中会考化学专题训练:化学能与热能

2020年高中会考化学专题训练:化学能与热能考标:1.知道化学键的断裂和形成是化学反应中能量变化的主要原因2.通过实例了解化学能与热能的转化3.举例说明化学能与电能的转化关系及其应用一.能量总述:1.从宏观的角度看,任何物质都储存有一定的能量,不同的物质所储存的能不同。
2.化学反应的特点是有新物质生成,新物质和反应物总能量不同,而反应中能量守恒,所以一个确定的化学反应在发生过程中是吸收能量还是放出能量,取决于。
(1)反应物总能量生成物总能量,则化学反应为吸收能量;(2)反应物总能量生成物总能量,则化学反应为放出能量;3.化学反应从微观的角度即从化学键的角度分析,化学反应的本质是过程。
断键和成键都伴随着能量的变化:断键——能量;成键——能量,所以是化学反应中能量变化的主要原因。
二.化学能与热能(关键熟记哪些类型的反应吸热或放热)1.任何化学反应都伴随着能量的变化,化学反应能量变化主要以能表现出来即吸热或者放热。
2.常见的放热反应:①②③;④⑤。
3.常见的吸热反应:①②③;④⑤。
注意:有热量放出的过程一定是化学反应吗?未必是放热反应,放热反应和吸热反应必须是化学变化。
某些常见的热效应:a、放热:①浓硫酸溶于水②NaOH溶于水③CaO溶于水,其中属于放热反应的是b、吸热:铵盐溶于水反应条件与热量变化没有必然的关系,既需要点燃或加热的反应是吸热反应。
4、中和热:。
5、能源的分类:[思考]一般说来,大多数化合反应是放热反应,大多数分解反应是吸热反应,放热反应都不需要加热,吸热反应都需要加热,这种说法对吗?试举例说明。
例1:下列说法正确的是()A. 物质发生化学反应都伴随着能量变化 B.伴有能量变化的物质变化都是化学变化C.在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量D. 放热反应的发生无需任何条件例2:下列反应中,即属于氧化还原反应同时又是吸热反应的是()A. Ba(OH)2.8H2O与NH4Cl反应B. 铝与稀盐酸C. 灼热的炭与CO2反应D. 甲烷与O2的燃烧反应例3:燃烧相同质量的氢气,生成液态水放出热量Q1,生成气体水放出热量为Q2,则Q1和Q2的关系是()A. 相等B. 大于C. 小于D. 无法确定例4:在H2燃烧的反应中,破坏1mol H2的化学键消耗的能量为Q1kJ, 破坏1mol O2的化学键消耗的能量为Q2kJ,形成1mol H2O的化学键释放的能量为Q3kJ,下列关系式正确的是A.Q1+Q2>Q3 B.2Q1+Q2>4Q3C.Q1+Q2<Q3D.2Q1+Q2<4Q3。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学能与热能(5)1、已知:()()22C s O g +()2CO g 1 -=-⋅ΔH 217kJ mol ()()2C s H O g +()()+CO g Hg 2 1 H bkJ mol -∆=⋅H H -、O H -和O O =键的键能分别为436、462和4951mol kJ -⋅,则b 为( )A.+352B.+132C.-120D.-330 2、已知: C (s ,石墨) C (s ,金刚石) 11.9H kJ mol -∆=+⋅。
下列有关说法正确的是( )A.相同条件下,1mol 石墨比1mol 金刚石能量高B.断裂1mol 石墨中的化学键吸收的能量比断裂1mol 金刚石中的化学键吸收的能量少C.若: C (s ,石墨) 1221()()393.5O g CO g H kJ mol -+∆=-⋅则有: C (s ,金刚石) 1222()()395.4O g CO g H kJ mol -+∆=-⋅D.其他条件不变时,加入合适的催化剂,可实现该反应的反应热转变为0H ∆<3、含有的稀溶液与的溶液反应,放出的热量,表示该反应中和热的热化学方程式为( )。
A.B.C.D.4、下列图示与对应的叙述相符的是( )A.图甲表示某可逆反应物质的浓度随时间的变化,且在t 时刻达到平衡状态B.图乙表示向0.11mol L -⋅的氨水溶液中逐渐加水时溶液的导电性变化 C.图丙表示某放热反应分别在有、无催化剂的情况下,反应过程中的能量变化 D.图丁表示向3CH COOH 溶液中逐渐加入3CH COONa 固体后,溶液pH 的变化 5、通过以下反应均可获取2H 。
下列有关说法正确的是( ) ①太阳光催化分解水制氢:()22?H O l ()()222?H g O g + 11571.6H kJ mol -∆=+⋅ ②焦炭与水反应制氢:()()2C s H O g +()()2CO g H g + 12131.3H kJ mol -∆=+⋅ ③甲烷与水反应制氢:()()42CH g H O g +()()23CO g H g + 13206.1H kJ mol -∆=+⋅A.反应①中太阳能转化为化学能B.反应②为放热反应C.反应③使用催化剂, 3H ∆减小D.反应()4CH g ()()22C s H g +的1374.8H kJ mol -∆=-⋅6、对于反应: ()24C H g ()()()2224,2C H g H g CH g +()()2422C H g H g +,当升高温度时都向右移动。
①()()22C s H g +()4CH g1H ∆;②()()22C s H g +()22C H g 2H ∆;③()()222C s H g +()24C H g3H ∆。
则①②③中1H ∆、2H ∆、3H ∆的大小顺序排列正确的是( )A. 123?H H H ∆>∆>∆B. 231 H H H ∆>∆>∆C. 213 H H H ∆>∆>∆D. 321H H H ∆>∆>∆7、常温下,1mol 化学键分解成气态原子所需要的能量用E 表示。
根据表中信息判断下列说法不正确的是( )A. 11432()298kJ mol E H Br kJ mol --⋅>->⋅B.表中最稳定的共价键是H —F 键C. ()2H g ()12?436?H g H kJ mol -∆=+⋅D. ()()()1222?25?H g F g HF g H kJ mol -+∆=-⋅8、已知()()3245?NH g O g +()()246?NO g H O l +;/H xkJ mol ∆=-,蒸发1mol ()2H O l 需要吸收的能量为44kJ ,其它相关数据如下表:则表中z (用x、a 、b 、d 表示)的大小为( )A.4B. (12512264)4x a b d ++--C.(45644)4x a b d ++--D. (1251244)4x a b d ++--9、下列图示与对应的叙述相符的是( )A.图I 表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化B.图II 表示常温下,0.1000mol/LNaOH 溶液滴定20.00mL 、0.0100mol/LHCl 溶液所得到的滴定曲线C.图III 表示一定质量的冰醋酸加水稀释过程中,醋酸溶液电离程度:c<a<bD.图Ⅳ表示反应4CO(g)+2NO 2(g)N 2(g)+4CO 2(g),在其他条件不变的情况下改变10、已知在一定条件下,存在下列反应:()()22 H g Cl g +()2HCl g ()111 /0H Q kJ mol Q ∆=->()()22H g Cl g +()2?HCl l ()222 /0H Q kJ mol Q ∆=->1. 1Q 和2Q 的大小关系为: 1Q __________2Q (填“大于”、“小于”或“等于”);2.相同条件下,2mol 氢原子所具有的能量__________1mol 氢分子所具有的能量(填“大于”、“小于”或“等于”);3.相同条件下,1mol 氢气和1mol 氯气所具有的总能量__________2mol 氯化氢气体所具有的总能量(填“大于”、“小于”或“等于”)4.若1185/?H kJ mol ∆=-,已知H —H 键的键能为436/kJ mol ,Cl —Cl 键的键能为247/kJ mol ,则H —Cl 键的键能为__________/kJ mol 。
11、2SO 2(g)+O 2(g)2SO 3(g),反应过程的能量变化如图所示.已知1mol SO 2(g)氧化为1molSO 3(g)的△H=-99kJ/mol. 请回答下列问题:1.E的大小对该反应的反应热__________影响?(填“有或无”). 该反应通常用V2O5作催化剂,加V2O5会使图中B点__________(填“升高或降低”);2.图中△H=__________kJ/mol;3.如果反应速率υ(SO2)为0.05mol/(L·min),则υ(O2)=__________mol/(L·min);4.1mol SO2(g)氧化为1mol SO3(g)的反应热△H1__________1mol SO3(g)还原为1mol SO2(g)的反应热△H2(填“>、<或=”)5.已知单质硫的燃烧热为296kJ/mol,计算由S(s)生成3mol SO3(l)的△H=__________12、工业上制二甲醚是在一定温度(230 ~ 280 ℃)、压强(2.0~10.0 MPa)和催化剂作用下进行的,反应器中发生了下列反应: ①②③1.反应器中的总反应可表示为,则该反应∆=_________。
在密闭容器中,开始投入3 mol CO和3 mol H2并在一定条件下达到平的H衡,该反应放出的热量为__________,简述理由:_________________________。
2.二氧化碳是大气中含量最高的一种温室气体,控制和治理二氧化碳是解决温室效应的有效途径。
目前,由二氧化碳合成二甲醚已取得了较大的进展,化学反应与能量关系如图所示。
写出该反应的热化学方程式:__________。
3.二甲醚气体的燃烧热H ∆= -1455 kJ · mol -1。
二甲醚燃烧热的热化学方程表示为是否正确?_________。
若不正确,请写出正确的热化学方程式:_____________(若正确,该问不答)。
4.CO 与H 2以体积比1:2组成合成气。
在相同条件下,等体积合成气提供能量有两种途径:一是直接完全燃烧,放出的热量为Q 1kJ;二是先完全合成甲醇,然后再完全燃烧甲醇,两个过程一共放出的热量为Q 2kJ 。
Q 1与Q 2的关系是_______。
理由是__________________。
答案以及解析1答案及解析: 答案:B 解析:2答案及解析: 答案:C解析:A 、从题设条件中的化学方程式可以看出,在相同的条件下,1mol 石墨转化为金刚石,要吸收1.9kJ 的能量,说明石墨的能量低于金刚石的能量,石墨更稳定,金刚石的能量高,错误;B 、石墨的键能比金刚石的键能高,因此,断裂1mol 石墨中的化学键吸收的能量比断裂1mol 金刚石中的化学键吸收的能量要多,错误;C 、从题意来看,1mol C (s ,金刚石)自身具有的能量比1mol C (s ,石墨)自身具有的能量要高1.91mol kJ -⋅,燃烧时,1mol C (s ,金刚石)放出的热量要比1mol C (s ,石墨)要多1.9kJ ,正确;D 、对于一个确定的化学反应,化学反应的焓变(H ∆)是确定的,不随着外界条件的改变而改变,错误。
3答案及解析: 答案:D解析:由,,则二者恰好反应生成,则生成时放热为:4答案及解析: 答案:B 解析:5答案及解析: 答案:A 解析:6答案及解析: 答案:B解析:由反应②-③得()24C H g ()()22223 C H g H g H H +∆-∆,由反应③-2×①得()42CH g ()()242312?2C H g H g H H +∆-∆,当升高温度时两反应都向右移动,所以两反应均为吸热反应,即23310,20H H H H ∆-∆>∆-∆>,可得231 H H H ∆>∆>∆,故选B 。
7答案及解析: 答案:D解析:H —Br 键的键能应介于H —I 键的键能和H —Cl 键的键能之间,即11298()432kJ mol E H Br kJ mol --⋅<-<⋅,A 项正确;由表中数据可知, H —F 键的键能最大,故H —F 键最稳定,B 项正确; ()2H g ()2H g ,吸收能量,故1()436H E H H kJ mol -∆=-=+⋅,C 项正确;()()()222H g F g HF g +()()2()H E H H E F F E H F ∆=-+---=11(4361572568)543kJ mol kJ mol --+-⨯⋅=-⋅,D 项错误。
8答案及解析: 答案:A解析:反应热就是断裂反应物中化学键吸收的热量与形成生成物的化学键所释放的能量的差。
则根据表格提供的数据可知412446125z d a b x ++⨯--=,解得()12512264/4z x a b d =++--,故答案是选项B 。
考点:考查反应热与键能、物质的存在状态的关系的知识。
9答案及解析: 答案:D解析:图I 中反应物的能量高于生成物的能量,故表示的是放热反应。
