物理化学第一章-2016-3-8上课内容
物理化学第一章_热力学第一定律

J=1°50′
W=8° t =-20℃
东经J1 =118°75 ′
北纬 W1 = 32°00 ′ 某时气温 t1 = 30℃
上页 0000--77-2-828
下页
回主目录
返回 2200
标准态
➢规定标准态的必要性:
• 体系的状态函数强烈地依赖于物质所处的状态. • 有关状态函数的计算强烈地依赖于基础的实验数据. • 建立通用的基础热力学数据需要确立公认的物质标
下页
回主目录
返回 1133
由经验可知,一般来说,质量一定的单组分气相 体系,只需要指定两个状态函数就能确定它的状态。 另一个通过近似PV=nRT的关系也就随之而定了,从 而体系的状态也就确定了。
上页 0000--77-2-828
下页
回主目录
返回 1144
状态函数共同性质
(1) 体系的状态一定,状态函数有确定值。
上页 0000--77-2-828
下页
回主目录
返回 1122
四、状态函数与状态性质
1、状态和状态函数
物理性质和化学性质的综合表现就称体系的状态。
描述物质状态的性质叫做状态函数(state function)。
状态函数是相互联系,相互制约,一个状态函 数的改变,也会引起另一个状态函数的改变 。
上页 0000--77-2-828
四、状态函数与状态性质
⑴ 状态函数的数学表达
体系由A态变到B态,Z值改变量
Z ZB ZA
ZB dZ
ZA
对于循环过程 dZ 0
状态函数的微小改变量可以表示为全微分,即偏微分之和
dZ
物理化学全套课件 完整版

Physical Chemistry
1
绪论
Preface
2
一、什么是物理化学?
无机化学
分析化学
有机化学 化学 物理化学
生物化学
高分子化学
物理化学是化学学科的一个分支 3
温度变化 压力变化 体积变化 状态变化
热
电
化学反应
原子、分子间的分离与组合
化学
密 不 可 分
物理学
光
磁
热学、电学、光学、磁学是物理学的重要分支
М В Ломоносов 8
十九世纪中叶形成:
1887年俄国科学家W.Ostwald(1853~1932)和荷兰科学家 J.H.van’t Hoff (1852~1911)合办了第一本“物理化学杂志” 。
W. Ostwald
J. H. van’t Hoff
(1853~1932)
(1852~1911)
理想气体定义: 服从 pV=nRT 的气体为理想气体 或服从理想气体模型的气体为理想气体
(低压气体)p0 理想气体
20
3. 摩尔气体常数 R mole gas constant R
R 是通过实验测定确定出来的
例:测300 K时,N2、He、 CH4 pVm ~ p 关系,作图
p0时:
5000
(1)分子间力
吸引力 分子相距较远时,有范德华力;
排斥力 分子相距较近时,电子云及核产生排斥作用。
E吸引 -1/r 6
E排斥 1/r n
Lennard-Jones理论:n = 12
E总
E吸
引+E排
斥=
-A r6
B r 12
式中:A-吸引常数;B-排斥常数
物理化学电子教案第一章(1).ppt

上一内容 下一内容 回主目录
返回
2020/11/23
(1) 混合物的组成
a 摩尔分数x或y:
xB 或yB
nB nA
显然 xB 1 或 yB 1
A
B
B
b 质量分数
wB
mB mA
A
wB 1
B
c 体积分数
B
xB Vm,B xA Vm, A
A
B 1
B
上一内容 下一内容 回主目录
上一内容 下一内容 回主目录
返回
2020/11/23
§1.1 气体分子动理论
一 气体分子动理论的基本公式 二 理想气体状态方程 三 理想气体模型 四 理想气体混合物 五 分子平均平动能与温度的关系
上一内容 下一内容 回主目录
返回
2020/11/23
1 气体分子动理论的基本公式
气体分子运动的微观模型
返回
2020/11/23
(2) 理想气体混合物状态方程
• 理想气体混合物状态方程为:
pV n总RT nB RT B
pV m RT M mix
上一内容 下一内容 回主目录
返回
2020/11/23
(3) 道尔顿定律与分压力
⑴ 道尔顿定律:
混合气体的总压力等于各组分单独存在于混 合气体的温度、体积条件下所产生压力的总和。
u ( niui2 ) / n
i
n为单位体积内的分子数。
上一内容 下一内容 回主目录
返回
2020/11/23
2 理想气体状态方程
• 17~19世纪三个著名的低压气体经验定律:
• 波义尔定律(R.Boyle,1662):
pV = 常数
《物理化学》教学大纲

《物理化学》课程教学大纲课程编号:课程性质:通识选修课课程组长:总学分值:总学分:2学分,其中理论2学分,实验实践0学分。
总学时数:总学时:32学时,其中理论学时32,实验实践0学时。
适用专业:酿酒工程先修课程:分析化学、有机化学后续课程:食品生物化学、食品营养学、食品微生物学一、课程简介1、课程性质与定位:物理化学是化学科学的一个重要分支,是一门理论性和实践性并重的课程。
物理化学课程是高等学校化学,食品,生物,农林,材料等各专业教学计划中一门必修的基础课程,通过本课程的学习,可以为本学科的后续课程学习和发展能力打下坚实的基础。
2、教学目的与要求:通过学习化学热力学、动力学、电化学、表面化学、胶体化学的基本理论与研究方法,使学生掌握物理化学的基本原理、基础知识、基本方法,从物理变化和化学变化入手,探求化学变化的基本规律,提高对物理化学的分析能力和计算能力,为学生学习后继课程奠定必要的基础。
在授课的过程中,坚持物理化学理论与食品学科知识相结合、理论教学与实验教学相结合的原则。
同时要求学生关注物理化学在食品中应用的最新动态,引导学生用书本上的理论去分析解决食品生产和检测中的实际问题。
3、教学重点与难点:(字数原则上控制在260字左右)二、课程教学内容、要求与学时分配(一)理论教学内容:第一章绪论(1学时)(1)了解《物理化学》的基本教学内容,学时分配,以及教学安排。
(2)理解《物理化学》课程的性质、地位,和学好本课程对未来专业课学习的重要性。
(3)掌握本课程学习的方法,以及利用课下其他资源扩展专业知识能力。
通过本节课使学生对物理化学有初步的了解,为以后学习好物理化学打好基础。
教学内容1、物理化学的内容、目的和任务。
2、物理化学的研究方法及其发展。
3、物理化学在食品科学、生物工程等领域的作用。
4、物理化学课程的学习方法。
教学重点:物理化学研究的内容与方法。
教学难点:物理化学的内容、目的和任务。
第二章热力学第一定律及应用(3学时)教学要求:(1)掌握热力学平衡态、状态函数、可逆过程、热力学能、热容等基本概念;了解状态函数的全微分性质。
物理化学第一章1【精选】
2019/9/27
上一内容 下一内容 回主目录
返回
热力学的重要意义
在设计新的反应路线或试制新的化学产品时,变 化的方向和限度问题,显然是十分重要的。只有确 知存在反应的可能性的前提下,再去考虑反应的 速率问题,否则将徒劳无功:
如在19世纪末进行了从石墨制造金刚石的尝 试,所有的实验都以失败告终。以后通过热力学 计算知道,只有当压力超过大气压15000倍时, 石墨才有可能转变成金刚石。现在已经成功地实 现了这个转变过程。
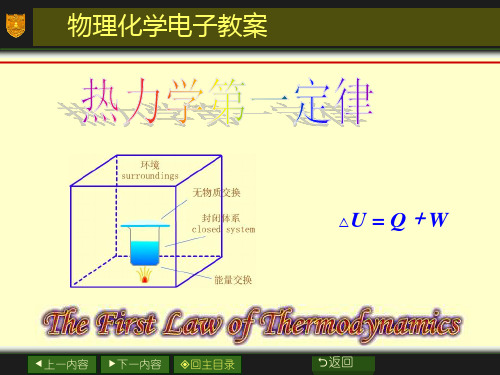
1. 系统(System)与环境(Surroundings)
系统: 在科学研究时必须先 确定研究对象,把一部分物质与 其余分开,这种分离可以是实际 的,也可以是想象的。这种被划 定的研究对象称为系统,亦称为 体系。
环境: 与系统密切相关、有 相互作用或影响所能及的部分称 为环境。
2019/9/27
上一内容 下一内容 回主目录
上一内容 下一内容 回主目录
返回
4
热力学的方法特点:
(3)在热力学研究中无时间概念
即不管(反应)变化速率。 例如根据热力学计算,金刚石可自发地变成石墨
,但这个过程需用多少时间?发生变化的根本原因和 机理?热力学中无法知道。
这些特点既是热力学方法的优点,也是它的局 限性。
上一内容 下一内容 回主目录
物理化学电子教案
△U = Q + W
上一内容 下一内容 回主目录
返回
热力学的基本内容
热力学:研究不同形式能量转化的科学
化学热力学与物理中的热力学不同,本课程主要讲与化学变化相 关的热力学(Chemical Thermodynamics)
1. 第一定律:能量守恒,解决过程的能量衡算问题 (功、热、热力学能等) 2. 第二定律:过程进行的方向判据 3. 第三定律:解决物质熵的计算
物理化学第一章

四、 热力学平衡状态
1 力学平衡(mechanical eauilibrium) 界面不发生移动 2 热平衡(thermal equilibrium) 温度相等,没有热量传递 3 物质平衡(material equilibrium) 没有物质传递、没有化学反应、没有相变 化 -----------化学平衡和相平衡
焓的特点
(1)焓是状态函数,焓具有能量的单位
*焓是不是能量?
(2)焓遵守能量守恒定律么?(即孤立体系焓变为零么?) *为什么?
(3) 焓有没有绝对值?
*为什么?
(4)只做体积功的封闭体系在定压过程中,△H=Qp
其他过程△H =△U +△(pV)
问题
为什么要定义焓? 为了使用方便,因为在等压、不作非膨胀功的条 件下,焓变等于等压热效应Qp。Qp容易测定, 从而可求其它热力学函数的变化值。
恒压热容 Cp =δQp /dT
则dU = CvdT
则 dH = Cp dT
H
T2
U
T2
适用于封闭体系不做其它功简单状态变化的任何过程
T1
C v dT
T1
C p dT
热容与温度的关系
物质的热容与温度有关
Cp,m a bT cT
2
Cp,m a bT cT
'
二、 恒压热Qp与焓H
不做其他功的体系定压下发生变化, △U = Q + W = Q - pe△V Qp =△U + pe△V =(U2-U1) + p(V2 -V1) = ( U2 + p2V2) - (U1 + p1V1)
第一课物化 第一章

(2)应用式( 1-3)计算可逆过程的体积功时,须先 求出体系的 p~V 关系式,然后代入式( 1-3)积分。
例:对理想气体定温可逆过程
p nRT
V
W V2 nRT dV nRT V2dV nRTln V2
V V1
V V1
W nRTln V2 nRTln p1
上一内容 下一内容 回主目录
返回
2019/12/10
1.基本概念
热和功
热和功是热力学过程中的能量交换形式。
热 (heat) Q:体系与环境间因温差引起的能量交换
功 (work) W:除 Q 以外的其他形式交换的能量
讨论: (1)Q 和 W 均非状态函数,只有变化过程,方
可能有 Q 、 W ,故 Q 和 W 均为过程量;过程量与状态
(3)化学变化过程: 化学反应
上一内容 下一内容 回主目录
返回
2019/12/10
1.基本概念
过程与途径
根据过程中物理量的变化情况,又可分为以下过程:
①定温过程: T1=T2= Te ②定压过程: p 1=p 2= pe ③定容过程: V1=V2 ④绝热过程: Q=0
⑤循环过程:始态与终态相同
1.体积功的计算
功W WV:体积功—因体系体积变化而产生的功交换 W′:非体积功—除WV之外的其他功,如电功、表 面功等。
若系统反抗外压 pe,体积改变了 dV, 则体积功为 δ WV= - pedV
WV
V2 V1
pedV
(1-2)
式( 1-2)为 WV 的基本计算公式 pe—反抗的外界压力
(2)强度性质( intensive properties ):其数值取决 于体系自身的特点,与体系中物质的数量无关,不具有 加和性,如 T、p 等。它在数学上是零次齐函数。
物理 化学 第一章 课件

(3) 量的数值
特定单位表示的数值,量与单位的比值。{A}= A/[A]。在图、表中常用到。 如 T/K =300。图中横坐标表示为x/[x], 如 T/K; 纵坐标 y/[y], 如 p/kPa。
20
图1.1.2 300 K下N2, He, CH4的 pVm-p 等温线
21
0.2.2 对数中的物理量 lnA 或 logA
0 绪 论
0.1 课程简介
0.1.1 什么是物理化学
化学:无机化学 有机化学 物理化学 分析化学 (高分子化学)
物理化学是化学的理论基础,是用物理的原理和方法来 研究化学中最基本的规律和理论,所研究的是普遍适用于各 个化学分支的理论问题——理论化学(化学中的哲学)。 研究化学变化中的普遍规律,不管是有机还是无机,化 学变化及相关的物理变化都是物理化学研究的对象。
作业/考题中若有 1 mol, 25℃,常数如π,e,二分之一等..., 约 定有效数字位数为无限多位。
24
第1章 气体的pVT关系
• 物质的聚集状态 气体、液体、固体。
宏观性质:p, V, T,ρ, U…
p, V, T 物理意义明确,易于测量
状态方程 联系 p, V, T 之间关系的方程。
液体和固体,其体积随压力和温度的变化很小,常 忽略不计;气体在改变压力和温度时,其体积会发生较 大变化,通常只讨论气体的状态方程。
物理化学
溶 液 化 学
9
0.1.3 本课程 物理化学B 的主要内容
绪论 气体的 pVT 关系 热力学第一定律 热力学第二定律 多组分系统热力学 化学平衡 相平衡 电化学 界面现象 化学动力学
胶体化学
10
0.1.4 关于本课程
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
热力学第一定律
1.4.2 Cp,m与 CV,m 的关系 对理想气体: Cp,m - CV,m= R 对凝聚态:
Cp,m - CV,m≈0
Remember!
9
热力学第一定律
1.4.3 DU 和DH 的计算
恒容: dU=QV=nCV,mdT , DU=QV=∫nCV,mdT
恒压: dH=Qp=nCp,mdT,
(3) 特点:无限接近平衡条件下进行的过程
一种非常理想化的过程 无摩擦力的准静态过程
20
热力学第一定律
恒温准静态膨胀(压缩)过程 活塞与汽缸间无摩擦时,压力差dp 无
限小,系统内部和环境之间变化无限
慢,在接近平衡时发生,称为准静态
过程。
21
热力学第一定律
p p1
p1
p1 V1
T
p2
p2
V1 V2
p1 p p p V T p V p p2 p V1 V' V'' V2
V
p2
假如将活塞上的砝码分3次逐一增加
T
p2 V2
W=?
T
23
热力学第一定律
p
p1 p1
p1 V1 T
p2
p2 V1
p2 V2
V2
V
T
(c)将活塞上的4个砝码中的3个砝码用等质量的无 限小砂粒更换
W
适用条件:
DH=Qp=∫nCp,mdT
(1) 气体,pVT变化时的恒容或恒压。 (2) 凝聚态(液或固),无须恒容或恒压(因为Cp,m=Cv,m)。
CV,m,Cp,m 为常数时:
DU = n CV,m ( T2- T1 ) DH = n Cp,m ( T2 - T1 )
10
热力学第一定律
1.4.4 过程热的计算
400K =[300K n(26.75 + 42.258×10-3(T/K)-14.25×10-6(T/K)2) dT ] J
= [26.75(400-300)+ 0.5×42.258×10-3(4002-3002) -(1/3)×14.25×10-6(4003-3003)] J = 3978J DU1=Q1 +W1=(3978 - 831.5)J=3147 J 17
热力学第一定律
(2) 热容(heat capacity)及质量热容c
热 容:
C=Q/dT
恒容热容:
恒压热容:
CV =QV/dT =(U/T)V
Cp= Qp/dT = (H/T)p
意义: C(或CV、Cp)是指系统(或恒容、恒压) 无相变化和化学变化,非体积功为零时, 温度升高 1K 所吸收的热 摩尔热容: Cm= C/n
单位: J· K-1· mol-1
2
热力学第一定律
(1) 物理量定义式的意义
定义式:
CV ,m
Q U ndT V nT V
分母各量为1个单位时的分子中的物理量值, 下标V表示恒容,即恒容时 n=1 mol , dT = 1 K 时 数值有: CV,m = QV 或 CV,m = dUV 3
恒压膨胀功
(2) 恒温可逆压缩过程环境做
功最小。
V 可逆过程状态变化图 26
O
热力学第一定律
2. 热力学可逆过程的特征
(1) 推动力无限小。
系统内部和环境在任何瞬间都无限接近平衡态
(2) 系统与环境能沿原来相反途径同时复原。 (3) 膨胀过程对环境做最大功, 压缩过程环境对系统做最小功。
实际过程均为不可逆过程!
27
热力学第一定律
实际过程可近似为可逆过程的情况
(1) 平衡相变(液体在其饱和蒸气中蒸发等): 100℃, 101325Pa
H2O(l)
H2O(g)
(2) 化学平衡: 2Ag2O(s) = 4Ag(s) + O2(g)
473K 时反应的压力为分解压 137802Pa 时
Qp n(T2 T1 )
n mol 物质恒压下 T1 →T2 的热Qp
Qp 与Cp,m 关系: Qp 温度T1→T2 范围内物 质的Cp,m 与Cp,m 的 关系:
T2
T1
nCp,m dT
C p,m
T2
T1
C p,mdT
(T2 T1 )
7
热力学第一定律
例1.4.1 已知 CO2 的 Cp,m = [ 26.75 + 42.258×10-3
对于问题(2),是否有更简单方法?
理想气体的热力学能、焓仅是温度的函数 DU1=DU2,DH1=DH2
18
热力学第一定律
1.5 可逆过程与理想气体的绝热可逆过程
When Wmax= ? 1.5.1 可逆过程 1.5.2 可逆过程的体积功 1.5.3 理想气体的绝热可逆过程
19
Q=0 Reversible!
A(p1, V1 )
B(p2, V2 )
W=0, Q=0
系统与环境均未变化 V 可逆过程状态变化图 25
O
热力学第一定律
从图中可知:
(1) 可逆膨胀功大于恒压 (p2) 过程功 (2) 可逆压缩功小于恒压 (p1) 过程功 可进一步证明: (1) 恒温可逆膨胀过程系统做 功最大。 p A(p1, V1 ) 恒压 压缩功 B(p2, V2 )
V
问题: W=?
p2 V2
T
(a)将活塞上的砝码同时取走3个,外压由p1突然降到p2
W = - p环(V2 – V1)= - p2(V2 – V1)
22
热力学第一定律
(b)将活塞上的砝码分3次逐一取走
p1
p1 V1
T
W p (V V1 ) p ( V V ) p 2 (V2 V ) p
W,DU,DH。
(1) 恒容加热到 600 K。 (2) 恒压膨胀至原来体积的两倍。
解题步骤:先写框图,再分析过程特征
5mol,V1 ,T1=400K p1=200kPa 5mol,V2 T2 ,p2 12
热力学第一定律
解: (1) 理想气体恒容(dV=0,W'=0)
5mol,V1, T1=400K, 5mol,V2
p1=200kPa
T2=600K, p2=(p1/T1)T2 W1=0 (∵ dV=0,p环dV=0)
T2 ,p2
Q1=DU1=∫nCV,mdT=nCV,m(T2- T1)=n(Cp,mR)(T2T1) ={5×(29.10-8.315)×(600400)}J
=20.79 kJ D H1 =∫nCp,mdT= nCp,m(T2- T1)
5
热力学第一定律
3. 摩尔热容与温度的关系
经验式:
或
Cp,m= a + bT + c T 2 Cp, m= a + bT + c' T -2
a、b、…与物质有关,可查表
理想气体:
CV, m = Cp, m- R
可用经典的能量均分原理估值 6
热力学第一定律
4. 平均定压摩尔热容 Cp,m
定义:
C p, m
= -5mol×8.315J· K-1· mol-1×400K= -16.63kJ
15
热力学第一定律
例1.4.3
在101325Pa下把 1mol CO2(g )由 300K
加热到 400K。分别计算 (1) 恒压过程;(2) 恒容过程 的W、Q、DU 和 DH。设 CO2 为理想气体,已知在 300~1500K 范围CO2 的Cp,m 与T 的关系式:
热力学第一定律
1.4 单纯pVT 变化的过程热
pVT 变化: 组成不变(无相变化、无化学变化) 的均相封闭系统的变化
1.4.1 热容与摩尔热容 1.4.2 Cp,m与CV,m的关系 1.4.3 DU与DH的计算
1.4.4 过程热的计算
1
热力学第一定律
1.4.1 热容与摩尔热容
1. 摩尔热容(molar heat capacity)
CV ,m
Q U ndT V nT V
角标“m” : 摩尔量
C p,m
Q H ndT p nT p
意义: CV,m(或Cp,m)是指 1mol 物质在恒容(或恒压) 且无相变化和化学变化,非体积功为零时, 温度升高 1K 所吸收的热或热力学能变
= 41.57kJ
DH =nCp,m(T2- T1)
= 5mol×29.10J· K-1· mol-1×(800-400)K= 58.20 kJ
14
热力学第一定律
恒压,W' = 0 则 Q = DH = 58.20 kJ W = -∫p环dV = -∫p1dV = -p1(V2-V1)
= -p1(2V1-V1) = -p1V1= -nRT1
1mol,V1 ,T1=300K p1=101325Pa
V2 V1
1mol,V2 T2 =400K ,p2 = p1
W1 = p环 dV = -p(V2-V1) =-nR(T2-T1) = -[1×8.315×(400-300)]J =-831.5 J
400K Q1= D H1 = 300K nCp,mdT
V2 V1
p环 dV
V2
V1
( p dp)dV
V2
V1
pdV
24
热力学第一定律
可逆膨胀或压缩过程状态变化的 p - V 关系见图: A→B 可逆膨胀功,p - V曲线下所对应的面积 B→A 可逆压缩功,p - V曲线下所对应的面积
故 可逆膨胀功= -可逆压缩功 整个循环过程: p
