电导法测定CTAB的临界胶束浓度及乙醇
CTAB临界胶束浓度的测定的设计报告

十六烷基三甲基溴化铵表面活性剂的临界胶束浓度的测定摘要:凡能显著改变表面(或界面)性质的物质都称为表面活性剂。
表面活性剂的临界胶束浓度(CMC)作为表面活性剂的表面活性的一种量度,是表面活性溶液性质的重要表征之一。
表面活性剂的一些理化性质,如表面张力, 摩尔电导率, 渗透压、浊度、光学性质等在临界胶束浓度时都有显著的变化,所以通过测定发生这些显著变化时的转变点,就可以得知。
本文采用紫外法,比色法来探究盐对CMC的影响。
关键词:十六烷基三甲基溴化铵;CMC;NaCl;紫外分光光度法;比色法;曙红;荧光黄。
引言:凡能显著改变表面(或界面)性质的物质都称为表面活性剂。
分子既含有亲油的足够长的(大于10个碳原子)烷基,又含有亲水的极性基团若按离子的类型分类,可分为三大类:①阴离子型表面活性剂;②阳离子型表面活性剂;③非离子型表面活性剂。
表面活性剂进入水中,在低浓度时呈分子状态,并且三三两两地把亲油基团靠拢而分散在水中。
当溶液浓度加大到一定程度时,许多表面活性物质的分子立刻结合成很大的集团,形成”胶束”。
以胶束形式存在于水中的表面活性物质是比较稳定的。
表面活性物质在水中形成胶束所需的最低浓度称为临界胶束浓度CMC。
CMC可看作是表面活性对溶液的表面活性的一种量度。
因为CMC越小,则表示此种表面活性剂形成胶束所需浓度越低,达到表面饱和吸附的浓度越低。
也就是说只要很少的表面活性剂就可起到润湿、乳化、加溶、起泡等作用。
在CMC点上,由于溶液的结构改变导致其物理及化学性质(如表面张力,电导,渗透压,浊度,光学性质等)同浓度的关系曲线出现明显的转折,因此,通过测定溶液的某些物理性质的变化,可以测定CMC。
测定溶液临界胶束浓度的方法有多种,如表面张力法、光散射法、比色法、浊度法、电导率法等,本实验采用比色法、紫外分光光度法。
CMC影响因素【3】: CMC是表面活性剂表面活性大小的重要参数一般主要受分子结构亲水基和疏水基的大小与性质添加物和温度的影响。
实验三 电导法测定临界胶团浓度

实验三 电导法测定临界胶团浓度一、 实验目的1、熟悉表面活性剂溶液临界胶团浓度的意义。
2、掌握电导法测定离子型表面活性剂临界胶团浓度的方法,熟悉电导仪的使用方法。
3、了解测定表面活性剂临界胶团浓度的几种方法。
二、 实验原理在含有表面活性剂的溶液中,当表面活性剂的浓度较低时,表面活性剂在溶液的表面定向排列,在溶液中的浓度相对较低;当表面被表面活性剂分子占满后,即表面活性剂的浓度超过一定值时,表面活性剂离子或分子将会在溶液中发生缔合,形成胶团。
对于指定的表面活性剂,其在溶液中开始形成胶团的最小浓度称为该表面活性剂的临界胶团浓度(crtical micelle concentration ,CMC )。
在临界胶团浓度时,表面活性剂溶液的许多物理化学性质均发生突变,降低表面张力的性质或作用发生在CMC 之前,而电导、去污力、增溶作用则在CMC 后更为明显。
电导、去污力、增溶作用只有在浓度稍高于CMC 时,才能充分体现。
因此,CMC 是表面活性剂的物理化学性质中至关重要的。
一般来说,表面活性剂随浓度变化的物理化学性质皆可用来测定CMC ,常用的方法有表面张力法、电导法、染料法等。
本实验通过测定阴离子表面活性剂溶液的电导率确定CMC 值。
对于电解质溶液,其导电能力的大小由电导L 衡量。
1/---=m l Am S lAL 电导电极常数,溶液电导率,κκ一定温度下,强电解质稀溶液的电导率与其摩尔电导率的关系为:312/m mol C mol m S Cm m 电解质溶液的浓度,率,电解质溶液的摩尔电导-∙∙-Λ=Λ-κ一定温度下,电解质溶液的摩尔电导随其浓度而变。
在极稀的浓度范围内,强电解质溶液的摩尔电导率与其溶液浓度的C 成线性关系:常数电导率无限稀释时溶液的摩尔--Λ-Λ=Λ∞∞A CA m mm 三、 仪器和试剂电导率仪1台,铂黑电导电极1 支,磁力加热搅拌器1台,烧杯(100ml ,干燥)2个,移液管(50ml )2支,滴定管(25ml ,酸式)1支。
临界胶束的测定方法

临界胶束的测定方法一、表面张力法。
这可是个挺经典的法子呢。
就像你看水面上有一些小变化一样。
当表面活性剂的浓度慢慢增加的时候呀,溶液的表面张力会开始降低哦。
一开始降得还挺明显的呢,但是到了临界胶束浓度(CMC)的时候,这个表面张力就不怎么变啦。
就好像它突然变得很淡定了。
我们就可以通过测量不同浓度下的表面张力,然后找到那个转折点,这个转折点对应的浓度呀,大概率就是临界胶束浓度啦。
二、电导法。
这个方法也挺有趣的哦。
对于离子型的表面活性剂来说,在浓度比较低的时候,它的电导率是随着浓度增加而直线上升的。
为啥呢?因为离子多了嘛。
但是呀,一旦到了临界胶束浓度的时候,这个电导率的增加就变得很缓慢啦。
就像是跑步的时候,本来一路狂奔,突然就慢下来了。
我们通过测量不同浓度下溶液的电导率,然后看看这个变化趋势,就能找到临界胶束浓度在哪里啦。
三、增溶作用法。
想象一下,有些东西本来在溶液里不太能溶解的,但是有了表面活性剂就不一样啦。
在临界胶束浓度之前呢,表面活性剂对一些难溶物质的增溶能力比较弱。
可是到了临界胶束浓度之后呀,这个增溶能力就突然变强了。
我们可以通过观察这种增溶能力的突变,来确定临界胶束浓度。
就像是一个小魔法一样,到了某个点,突然就有了大变化。
四、染料法。
这就像是给溶液做个小标记一样。
有一些染料在水中和在胶束中的颜色或者荧光是不一样的呢。
当表面活性剂的浓度达到临界胶束浓度的时候,这个染料的性质就会发生改变。
比如说颜色变了呀,或者荧光强度变了之类的。
我们就可以根据这个变化来判断临界胶束浓度。
是不是很神奇呀,就像溶液在给我们偷偷发信号一样。
总之呢,这些测定临界胶束浓度的方法都各有各的妙处,就看在具体的情况下,哪种方法更适合啦。
宝子,你现在是不是对临界胶束的测定有点感觉了呢?。
电导率法测定SDS、CTAB的临界胶束浓度

电导率法测定SDS、CTAB 的临界胶束浓度叶齐全2009012230周毅聪2009012232刘曦阳20090122331. 实验目的1) 通过对胶体溶液的电导率变化规律的测定,学习胶体相关知识; 2) 了解阴离子型,阳离子型的表面活性剂的特点及性质; 3) 掌握电导率测定的原理和方法 4) 尝试自己建立模型解释实验现象 2. 实验原理表面活性剂科学是胶体与界面科学中的一个重要领域,简单的表面活性剂分子通过其特殊的两亲分子结构,可以显著改变体系的界面状态,从而产生一系列特殊的性能,因此广泛应用于工业、农业以及日常生活中,所以其相关参数的实验测量就显得非常重要。
在表面活性剂溶液浓度很稀时,当浓度增大到一定值时,表面活性剂离子或分子将发生缔合,形成胶束(或称胶团)。
对于某表面活性剂,其溶液开始形成胶束的浓度称为该表面活性剂的临界胶束浓度(critical micelle concentration ),简称CMC 。
其中,临界胶束浓度C mc 是表面活性剂的一个非常重要的参数,C mc 越低,表示表面活性剂形成胶束所需之浓度越低,因而起到表面活性作用的浓度也越低。
在C mc 附近,溶液的许多物理化学性质如电导率、渗透压、蒸气压、光学性质、乳化能力及增溶性等均产生明显的变化。
本实验计划针对两种表面活性剂的临界胶束浓度C mc 及温度对临界胶束浓度C mc 的影响展开研究,两种表面活性剂分别为:SDS (十二烷基硫酸钠)和CTAB (十六烷基三甲基溴化铵),两种物质的结构如下:H 3CCH 2O 10SOOO Na H 3C CH214Br图1 SDS 图2 CTAB电导法测定离子表面活性剂的C mc 相当方便,在溶液中对电导有贡献的主要是带长链烷基的表面活性剂离子和相应的反离子,而胶束的贡献则极为微小。
从离子贡献大小来考虑,反离子大于表面活性剂离子。
当溶液浓度达C mc 时,由于表面活性剂离子缔合成胶束,反离子固定于胶束的表面,它们对电导的贡献明显下降,同时由于胶束的电荷被反离子部分中和,这种电荷量小,体积大的胶束对电导的贡献非常小,所以电导急剧下降。
ctab的临界胶束浓度

ctab的临界胶束浓度
CTAB(十六烷基三甲基溴化铵),是一种阳离子表面活性剂,常用于分子生物学实验,如核酸的提取和纯化,因为它能够破坏膜脂并沉淀脱氧核糖核酸。
CTAB的一个重要性质是它能在溶液中形成胶束。
胶束形成时所对应的表面活性剂浓度称为临界胶束浓度(Critical Micelle Concentration,CMC)。
CTAB的CMC会受到溶液中的其他成分(如盐类或有机溶剂)、温度和压力等因素的影响。
在纯水中,CTAB的CMC一般在0.9至1.0 mM(毫摩尔每升)范围内,但这个值在不同的条件下会有所变化。
例如,增加溶液的盐浓度通常会降低CTAB的CMC,因为盐类增加了水溶液中的离子强度,从而减少了CTAB分子间的静电排斥力,使得胶束更容易形成。
实验室中确定CTAB的CMC通常可以通过各种方法,包括:
电导率测定:随着表面活性剂浓度的增加,溶液的电导率会发生变化。
在CMC点,胶束的形成导致电导率变化的趋势发生突变。
表面张力测量:表面活性剂的增加会降低溶液的表面张力,达到CMC时,表面张力的下降会停止或显著放缓。
光散射:胶束形成会导致光散射的变化,通过测量散射光强度的
变化可以确定CMC。
荧光探针法:某些荧光染料的荧光特性会因为表面活性剂胶束的形成而改变,通过监测这些变化可以估计CMC。
在应用CTAB时,了解其CMC对于实验的设计和理解结果是非常重要的,特别是在需要利用其胶束形成性质的应用中。
在CTAB作用于生物大分子时,通常希望其浓度超过CMC,以确保形成胶束并有效地与目标分子相互作用。
电导法测定表面活性剂的临界胶束浓度教案
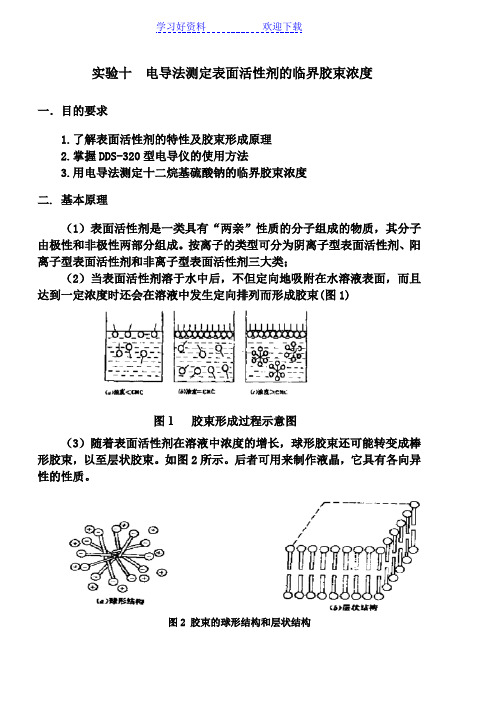
实验十电导法测定表面活性剂的临界胶束浓度一.目的要求1.了解表面活性剂的特性及胶束形成原理2.掌握DDS-320型电导仪的使用方法3.用电导法测定十二烷基硫酸钠的临界胶束浓度二. 基本原理(1)表面活性剂是一类具有“两亲”性质的分子组成的物质,其分子由极性和非极性两部分组成。
按离子的类型可分为阴离子型表面活性剂、阳离子型表面活性剂和非离子型表面活性剂三大类;(2)当表面活性剂溶于水中后,不但定向地吸附在水溶液表面,而且达到一定浓度时还会在溶液中发生定向排列而形成胶束(图1)图1 胶束形成过程示意图(3)随着表面活性剂在溶液中浓度的增长,球形胶束还可能转变成棒形胶束,以至层状胶束。
如图2所示。
后者可用来制作液晶,它具有各向异性的性质。
图2 胶束的球形结构和层状结构4.表面活性物质在水中形成胶束所需的最低浓度称为临界胶束浓度,以CMC表示。
在CMC点上,由于溶液的结构改变导致其物理及化学性质与浓度的关系曲线出现明显转折,如下图所示。
图3 25℃时十二烷基硫酸钠水溶液的物理性质和浓度关系本实验通过测定不同浓度的十二烷基硫酸钠水溶液的电导值,作电导率-浓度关系图,由图中的转折点即可求出十二烷基硫酸钠水溶液在该温度下的临界胶束浓度。
三.仪器和试剂1.DDS-320型电导率仪 1 台2. DJS-1C型铂黑电极 1 支3.容量瓶(1000mL) 1 只4.容量瓶(250mL) 12只5.十二烷基硫酸钠(分析纯)6.电导水四.实验步骤1.取十二烷基硫酸钠在80℃烘干3小时,用电导水或重蒸馏水0.2 mol·dm-3准确配制0.002,0.006,0.007,0.008,0.009,0.010,0.012,0.014,0.018,0.020 mol·dm-3的十二烷基硫酸钠溶液各50mL.2.调节电导池常数。
3.用DDS-320A型电导率仪从稀到浓分别测定上述各溶液的电导率值。
用后一个溶液荡洗前一个溶液的电导池三次以上,每个溶液的电导率读数三次,取平均值。
电导法测定CTAB地临界胶束浓度及乙醇
电导法测定CTAB的临界胶束浓度及乙醇对它的影响南昌航空大学13229216宋熠1 前言1.1表面活性剂【1】表面活性剂是指具有固定的亲水亲油基团,在溶液的表面能定向排列,并能使表面张力显著下降的物质。
由于表面活性剂分子中具有非极性烃链(8个碳原子以上烃链)以及极性基团(如:羧酸、磺酸、硫酸、氨基或胺基及其盐,也可是羟基、酰胺基和醚键等),使其分子结构具有两亲性。
表活性剂都是由极性和非极性两部分组成的,若按离子的类型来分,可分为以下三类阴离子型表面活性剂如羧酸盐(如肥皂,C17H35COONa)、烷基硫酸盐[如十二烷基硫酸钠,CH3(CH2)11SO4Na]、烷基磺酸盐[十二烷基苯磺酸钠,CH3(CH2)11C6H5SO3Na]等。
阳离子型表面活性剂主要是铵盐,如十六烷基三甲基溴化铵(CTAB)1.2.临界胶束浓度【2】由于表面活性剂具有双亲结构,分子有自水中逃离水相而吸附于界面上的趋势,但当表面吸附达到饱和后,再增加浓度时,表面活性剂分子无法再在表面上进一步吸附,这时为了降低体系能量,活性剂分子会相互聚集,形成胶束,以胶束形式存在于水中的表面活性物质是比较稳定的,表面活性物质在水中开始形成胶束的浓度(或形成胶束所需的最低浓度)称为临界胶束浓度(critical micelle concentration,CMC)。
1.3.电导法【3】电导法是利用表面活性剂水溶液电导率随浓度的变化关系,从电导率(к)对浓度(c)曲线上表现为CMC 前后直线斜率的变化,两条不同斜率的直线的交点所对应的浓度即CMC。
原则上,表面活性剂物理化学性质的突变皆可利用来测定表面活性剂的CMC,目前就报道文献来说,测定表面活性剂CMC如电导法,染料法【4】、增溶作用法【5】、表面张力法【6】和NMR【7】方法等,最常用的是表面张力测定和电导测量。不同方法测定同一表面活性剂的CMC值有一定的差异,也各有特点。本文利用电导法测定了阳离子型CTAB的CMC值,研究了乙醇对CMC值的影响。
电导率测定表面活性剂的临界胶束浓度
电导率测定表面活性剂的临界胶束浓度引言表面活性剂是一类具有显著表面活性的化学物质,广泛应用于日常生活和工业生产中。
表面活性剂在溶液中可以形成胶束结构,其中包括亲水头基团和疏水尾基团。
当表面活性剂浓度达到一定值时,会发生临界胶束浓度效应。
了解和测定表面活性剂的临界胶束浓度对于研究其胶束结构和应用具有重要意义。
本文将介绍电导率法测定表面活性剂的临界胶束浓度的原理和实验方法。
原理电导率法是测定溶液中物质浓度的一种常用方法。
在表面活性剂溶液中,当浓度低于临界胶束浓度时,溶液电导率主要由游离离子贡献,而当浓度超过临界胶束浓度时,由于表面活性剂形成了胶束结构,溶液电导率会显著增加。
因此,通过测量表面活性剂溶液的电导率随浓度变化的曲线,可以确定临界胶束浓度。
实验方法实验仪器和试剂所需实验仪器和试剂如下:•电导仪:用于测量溶液的电导率。
•玻璃容器:用于容纳表面活性剂溶液。
•表面活性剂:选择一种常用表面活性剂,如十二烷基硫酸钠等。
实验步骤1.准备一系列不同浓度的表面活性剂溶液。
可以通过逐步稀释高浓度溶液得到不同浓度的溶液。
每个浓度的溶液至少需要准备3个平行样品。
2.将所需浓度的表面活性剂溶液分别倒入各个玻璃容器中。
3.使用电导仪测量每个溶液的电导率,并记录测量值。
4.根据测量值绘制表面活性剂溶液电导率随浓度变化的曲线。
5.分析曲线,确定电导率发生显著变化的浓度点,该浓度即为表面活性剂的临界胶束浓度。
结果分析通过电导率测定表面活性剂的临界胶束浓度,根据实验数据绘制的电导率曲线可以得到明显的变化点。
该变化点对应的浓度即为表面活性剂的临界胶束浓度。
在实验过程中,可能会发现多个变化点,这是由于表面活性剂胶束结构的变化导致的。
因此,在分析结果时应注意该现象。
应用与展望电导率法测定表面活性剂的临界胶束浓度在实际应用中有着广泛的应用。
了解表面活性剂的临界胶束浓度可以帮助我们确定最佳使用浓度范围,例如在洗涤剂、乳化剂等应用中。
此外,通过调控表面活性剂的临界胶束浓度,还可以改变其溶液性质和应用特性,如增加溶液的稳定性、降低界面张力等。
电导法测定CTAB的临界胶束浓度及乙醇
电导法测定CTAB的临界胶束浓度及乙醇对它的影响南昌航空大学13229216宋熠1前言1.1表面活性剂【1】表面活性剂是指具有固定的亲水亲油基团,在溶液的表面能定向排列,并能使表面张力显著下降的物质。
由于表面活性剂分子中具有非极性烃链(8个碳原子以上烃链)以及极性基团(如:羧酸、磺酸、硫酸、氨基或胺基及其盐,也可是羟基、酰胺基和醚键等),使其分子结构具有两亲性。
表活性剂都是由极性和非极性两部分组成的,若按离子的类型来分,可分为以下三类阴离子型表面活性剂如羧酸盐(如肥皂,C17H35COONa)、烷基硫酸盐[如十二烷基硫酸钠,CH3(CH2)11SO4Na]、烷基磺酸盐[十二烷基苯磺酸钠,CH3(CH2)11C6H5SO3Na]等。
阳离子型表面活性剂主要是铵盐,如十六烷基三甲基溴化铵(CTAB)1.2.临界胶束浓度【2】由于表面活性剂具有双亲结构,分子有自水中逃离水相而吸附于界面上的趋势,但当表面吸附达到饱和后,再增加浓度时,表面活性剂分子无法再在表面上进一步吸附,这时为了降低体系能量,活性剂分子会相互聚集,形成胶束,以胶束形式存在于水中的表面活性物质是比较稳定的,表面活性物质在水中开始形成胶束的浓度(或形成胶束所需的最低浓度)称为临界胶束浓度(critical micelle concentration,CMC)。
1.3.电导法【3】电导法是利用表面活性剂水溶液电导率随浓度的变化关系,从电导率(к)对浓度(c)曲线上表现为CMC 前后直线斜率的变化,两条不同斜率的直线的交点所对应的浓度即CMC。
原则上,表面活性剂物理化学性质的突变皆可利用来测定表面活性剂的CM C,目前就报道文献来说,测定表面活性剂CMC如电导法,染料法【4】、增溶作用法【5】、表面张力法【6】和NMR【7】方法等,最常用的是表面张力测定和电导测量。不同方法测定同一表面活性剂的CMC值有一定的差异,也各有特点。本文利用电导法测定了阳离子型CTAB的CMC值,研究了乙醇对CMC值的影响。
实验四 电导法测定水溶性表面活性剂的临界胶束浓度和表面活性相关性的研究
实验四. 电导法测定水溶性表面活性剂的临界胶束浓度与表面活性相关性的研究一、实验目的:1.学会用电导法测定表面活性剂的临界胶束浓度;3.理解电导法测定表面活性剂的临界胶束浓度的原理;2.了解无机盐和有机添加物对表面活性剂临界胶束浓度的影响。
二、实验原理:表面活性剂是那些具有两亲结构,可明显降低体系的表面(或界面)张力,使体系产生润湿、乳化、分散、气泡、增溶等一系列作用的物质。
在表面活性剂溶液中,当表面活性剂浓度增大到一定值时,表面活性剂离子或分子将发生缔合,形成胶束(或称胶团)。
表面活性剂溶液形成胶束的浓度称为表面活性剂的临界胶束浓度(Critical Micelle Concentration),简称CMC。
由于表面活性剂的某些物理化学性质随着胶束的形成而发现突变(如图1)图1 表面活性剂溶液的一些性质与浓度的关系故将CMC看作表面活性剂的一个重要特征,它是表面活性剂表面活性大小的一个度量。
CMC越小,则表示这种表面活性剂形成胶束所需浓度越低,达到表面(或界面)饱和吸附的浓度越低,因而改变表面性质起润湿、乳化、分散、气泡、增溶等作用所需浓度就越大,而表面活性剂的表面活性就越大。
测定CMC的方法很多,而电导法是测量离子型表面活性剂CMC值的较为经典的方法。
对于一般的电解质溶液,其导电能力由电导G,即电阻的倒数(1/R)来衡量。
若用电极面积为A,电极间距为L的电导管测定电解质溶液电导时,则有G=1/R=κ(A/L) (1)式中κ是指长1m,截面积为1m2的导体的电导,称作比电导或电导率,单位为S·m-1,L/A称作电镀池常数,电导率κ和摩尔电导Λm有如下关系:Λm=κ/c (2)Λm为1mol电解质溶液的导电能力,称为摩尔电导率,c为电解质溶液的摩尔浓度,Λm随电解质溶液浓度而变。
对于离子型表面活性剂溶液,当溶液浓度很稀时,电导的变化规律也和强电解质一样,但当溶液的浓度达到临界胶束浓度时,随着胶束的形成,带相反电荷的离子被强烈地吸附在胶团表面上,它们的部分电荷被中和,电导率发生变化,摩尔电导急剧下降,这就是电导法测定CMC的依据。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电导法测定CTAB的临界胶束浓度及乙醇对它的影响南昌航空大学13229216宋熠1 前言1.1表面活性剂【1】表面活性剂是指具有固定的亲水亲油基团,在溶液的表面能定向排列,并能使表面张力显著下降的物质。
由于表面活性剂分子中具有非极性烃链(8个碳原子以上烃链)以及极性基团(如:羧酸、磺酸、硫酸、氨基或胺基及其盐,也可是羟基、酰胺基和醚键等),使其分子结构具有两亲性。
表活性剂都是由极性和非极性两部分组成的,若按离子的类型来分,可分为以下三类阴离子型表面活性剂如羧酸盐(如肥皂,C17H35COONa)、烷基硫酸盐[如十二烷基硫酸钠,CH3(CH2)11SO4Na]、烷基磺酸盐[十二烷基苯磺酸钠,CH3(CH2)11C6H5SO3Na]等。
阳离子型表面活性剂主要是铵盐,如十六烷基三甲基溴化铵(CTAB)1.2.临界胶束浓度【2】由于表面活性剂具有双亲结构,分子有自水中逃离水相而吸附于界面上的趋势,但当表面吸附达到饱和后,再增加浓度时,表面活性剂分子无法再在表面上进一步吸附,这时为了降低体系能量,活性剂分子会相互聚集,形成胶束,以胶束形式存在于水中的表面活性物质是比较稳定的,表面活性物质在水中开始形成胶束的浓度(或形成胶束所需的最低浓度)称为临界胶束浓度(critical micelle concentration,CMC)。
1.3.电导法【3】电导法是利用表面活性剂水溶液电导率随浓度的变化关系,从电导率(к)对浓度(c)曲线上表现为CMC 前后直线斜率的变化,两条不同斜率的直线的交点所对应的浓度即CMC。
原则上,表面活性剂物理化学性质的突变皆可利用来测定表面活性剂的CMC,目前就报道文献来说,测定表面活性剂CMC如电导法,染料法【4】、增溶作用法【5】、表面张力法【6】和NMR【7】方法等,最常用的是表面张力测定和电导测量。不同方法测定同一表面活性剂的CMC值有一定的差异,也各有特点。本文利用电导法测定了阳离子型CTAB的CMC值,研究了乙醇对CMC值的影响。
2.实验部分2.1仪器和药品:1个150ml小烧杯,一个酸式滴定管,DDS-307电导率仪(上海世义精密仪器有限公司),移液管一只(25ml),电子天平一台分析纯十六烷基三甲基溴化铵,蒸馏水,乙醇2.2实验步骤:1.配制母液(浓度为0.002mol•L– 1)准确称取十六烷基三甲基溴化铵0.7290g,在150ml小烧杯中加入20ml蒸馏水溶解,转入1L容量瓶中,再用少许蒸馏水洗涤烧杯三次,洗涤液也转入容量瓶中。
初步摇匀,再加蒸馏水至刻度,摇匀。
2.测定不同浓度表面活性剂的电导率(1)用移液管准确加入20ml已经配制好的十六烷基三甲基溴化铵溶液于烧杯中,然后用碱式滴定管加入1.1ml的去离子水测定19×10- 4mol•L – 1十六烷基三甲基溴化铵溶液的电导率。
,用滤纸擦干电极,然后插入电导率仪电极,测定该溶液的电导率,从仪器的屏幕上读出该条件下的电导率,并记录下来。
(3)用同样的方法,依次加入去离子水2.5ml、3.1ml、4.1 ml 、5.6ml、8.1ml、12.7ml、9.5ml、6.1 ml 、7.3ml。
分别测定17.2×10 - 4mol•L – 1、15.3×10 - 4 mol•L – 1、13.4×10- 4mol•L – 1、11.5×10 - 4mol•L – 1、9.5×10- 4mol•L – 1、7.4×10 - 4mol•L – 1、6.4×10 - 4 mol•L – 1、5.9×10 - 4 mol•L – 1、5.4×10 - 4mol•L – 1系列浓度十六烷基三甲基溴化铵溶液的电导率。
加乙醇对CMC 值的影响(1)将1%浓度的乙醇溶液加水稀释成0.3%的乙醇溶液,取5ml的0.3%乙醇,加入烧杯再向其中加入20ml的母液(0.002mol/mol)于烧杯中,再向烧杯中分别加入0ml,1.7ml,1.9ml,2.2ml,5.6ml,8.1ml,12.7ml,9.5ml,6.1ml,和7.3ml 的0.06%的乙醇溶液并分别测量其电导率,记录在表格内。
(2)取5ml的1%乙醇,加入烧杯再向其中加入20ml的母液(0.002mol/mol)于烧杯中,再向烧杯中分别加入0ml,1.7ml,1.9ml,2.2ml,5.6ml,8.1ml,12.7ml,9.5ml,6.1ml,和7.3ml的0.2%的乙醇溶液并分别测量其电导率,记录在表格内。
(3)将1%的乙醇稀释成0.2%的乙醇溶液,取5ml的0.2%乙醇,加入烧杯再向其中加入20ml的母液(0.002mol/mol)于烧杯中,再向烧杯中分别加入0ml,1.7ml,1.9ml,2.2ml,5.6ml,8.1ml,12.7ml,9.5ml,6.1ml,和7.3ml的0.04%的乙醇溶液并分别测量其电导率,记录在表格内.(4)将1%的乙醇稀释成0.5%的乙醇溶液,取5ml的0.5%乙醇,加入烧杯再向其中加入20ml的母液(0.002mol/mol)于烧杯,再向烧杯中分别加入0ml,1.7ml,1.9ml,2.2ml,5.6ml,8.1ml,12.7ml,9.5ml,6.1ml,和7.3ml的0.1%的乙醇溶液并分别测量其电导率,记录在表格内.(5)将1%的乙醇稀释成0.4%的乙醇溶液,取5ml的0.4%乙醇,加入烧杯再向其中加入20ml的母液(0.002mol/mol)于烧杯中,再向烧杯中分别加入0ml,1.7ml,1.9ml,2.2ml,5.6ml,8.1ml,12.7ml,9.5ml,6.1ml,和7.3ml的0.08%的乙醇溶液并分别测量其电导率,记录在表格内3 结果的记录与处理3.1,同一温度不同的CTAB 的电导率的测定(已知母液浓度0.002mol•L – 1 取20ml母液)3.12电导率对浓度的函数图象如下图所示;405060708090100BAc/mol/l在温度恒定的情况下,在不考虑影响因素时,所测得的CTAB 的临界胶束浓度(CMC )为9.24×10 - 4mol/l 。
影响因素:与文献值相比较,用电导法测得的临界胶束浓度值与文献值有所差别的原因可能是由于溶液配制不准或配制溶液过程有气泡产生,定容不准,CTAB 部分分解等原因所致;溶液温度低于实际要测得温度。
3.2同一温度,加入同样的量乙醇,以不同量的CTAB 分别测量电导率记录下表如示;3.21数据分析与记录温度25℃时不同浓度的乙醇对CMC的影响405060708090u /m s /c m -1c/mol/L405060708090u /m s /c m -1c/mol/L405060708090u /m s /c m -1C/mol/L405060708090u /m s /c m -1C/mol/L405060708090u /m s .c m -1C/mol/L醇R20.99712 R20.967810.2%的乙醇斜率63200 斜率22823.53 9.2866 截距11.6000 截距49.0961R20.99932 R20.963933.23结论:乙醇的加入对CMC影响:从总体趋势上看,乙醇的加入不利于胶束形成,即增大了CMC。
分析:乙醇的加入对CMC增加的原因:乙醇的极性大,与水的互溶性好,加入乙醇后,溶剂的性质发生了变化,CTAB的憎水尾基与乙醇分子之间的相互作用比较强,使表面活性剂的溶解度增大,从而使CMC上升,也可能是乙醇与水分子发生强烈作用,特别是形成氢键,破坏了水的结构,使溶液的介电常数变小,削弱了表面活性剂的憎水效应和胶束形成能力,不利于胶束作用的形成,使CMC上升。
注MCTAB=364.45其CMC的理论值为9.11×10 - 4mol/l。
4.注意事项:1,电极在冲洗后必须擦干,以保证溶液浓度的准确,电极在使用过程中其极片必须完全浸入到所测溶液中。
2,为避免气泡形成,保证表面活性剂完全溶解,影响浓度的准确性,在配制溶液时尽量减少搅拌,定容时水要沿瓶壁缓缓加入。
参考文献【1】崔德福.药剂学[M] .北京人民卫生出版社,2007:267.【2】孙德志.赵敬中.魏西莲,吸附伏安法测定表面活性剂的临界胶束浓度[J],分析测试学报 1994(03)【3】 Ralston A W,Hoerr CW,Hoffman E J.Studies on high molecular weig ht aliphatic amines and their salts. IV. Electricalc on ductivities of aqueoussolutions of thehy droch lorid esand acetates of dodecyl a nd octade cylamines.J.Am.Chem.Soc.,1942,64(1):97.[4] MutoS, MeguroK. The determination of the C M C of surfactants insome organic solvents .Bull.Chem.Soc.Japan.,1973,46(5):1316.[5] Kitahara A,I shikawa T,Tanimari S. The study on solubilization of fromits vapor press ureovern onionican dionic surfactants olution sinvarious nonpolar solcents. J. ColloidInter. Sci., 1967, 23(2):243.[6] 赵国玺,程玉珍,欧进国等.正离子表面活性剂与负离子表面活性剂在水溶液中的相互作用[J].化学学报,1980,38(05):409.[7] Corno C, Platone E, Ghelli S 13C NMR analysis of po lyoxyethylenated surfactants determinations of criticalm icellar concentration. Collo id and Po lym. Sci , 1984, 262 (8) : 667.[8] SuzukiH. Determination of critical micelleconcentrations of surfactant by ultravio letab sorptions pectra.J.Am.Oil Chem.Soc.,1970,47(8):273.。
