二氧化碳和一氧化碳第二课时
《二氧化碳和一氧化碳》第二课时课件1

高温
C +CO2 == 2CO
点燃
2C + O2 == 2CO
点燃
C + O2 == CO2
空气
•
9、要学生做的事,教职员躬亲共做;要学生学的知识,教职员躬亲共学;要学生守的规则,教职员躬亲共守。21.9.1321.9.13Monday, September 13, 2021
3CO + Fe2O3 高=温= 2Fe + 3CO2
冶金工 业上利用 一氧化碳 的还原性 来炼铁
点燃
2CO + O2 == 2CO2 CO + CuO == Cu + CO2
点燃
2C + O2 == 2CO
高温
C +CO2 == 2CO
CO 高温
C +CO2 == 2CO
2
点燃
C
C + O2 == CO2
第六单元 碳和碳的氧化物 (第二课时)
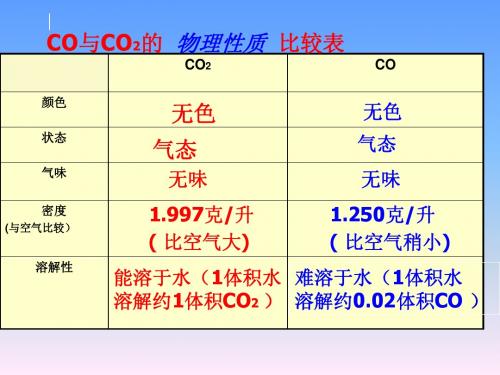
一 、 CO 与 CO2 的 部 分 性 质 比 较
(通常状况下)
色味态
CO2
CO
无色、无味、气体 无色、无味、气体
密度
(与空气比较)
比空气大
比空气稍小
溶解性
能溶于水(1体积水 难溶于水(1体积水
溶解约1体积CO2 ) 溶解约0.02体积CO )
一氧化碳、二氧化碳都是碳的氧化物,为什么
得氧
CO
1.b处燃着的酒精灯的作用是什么?
2.实验开始时,是先点燃a处酒精灯,还是先通入 CO气体?为什么?
3.实验结束时,是先熄灭a处酒精灯,还是先停止通 入CO气体?为什么?
二氧化碳和一氧化碳第二课时教案2.人教版

课题3 二氧化碳和一氧化碳(第2课时)碳的氧化物有一氧化碳和二氧化碳两种。
1个CO2分子比1个CO分子多1个氧原子,这就使得它们的性质有很大的不同。
本节课我们就来探究一氧化碳的性质。
(教师演示,学生观察分析)观察贮气瓶内一氧化碳的颜色和状态,然后在贮气瓶的导管口点火,观察火焰的颜色;把一个内壁附着有澄清石灰水的烧杯罩在火焰上,观察现象并分析。
一氧化碳是无色的气体,一氧化碳可以燃烧,火焰呈蓝色;烧杯氧化碳点燃时生成二氧化碳。
二、一氧化碳1.一氧化碳是一种无色无味的气体。
2.一氧化碳具有可燃性。
燃烧时放出大量的热,火焰呈蓝色。
2CO+O2点燃2CO2煤炉里煤层上方的蓝色火焰,就是一氧化碳在燃烧。
有人用煤火取暖容易发生煤气中毒,你知道中毒的原理吗?在试管中加入新鲜鸡血(加入抗凝血剂),然后通入一氧化碳气体,观察血液颜色的变化。
一氧化碳极易与血液中的血红蛋白结合,从而使血红蛋白不能很好地与氧气结合,造成生物体内缺氧,所以会出现上述现象,严重时会危及生命。
3.一氧化碳有剧毒1.在什么条件下容易发生煤气中毒?2.有人用煤火取暖,又担心煤气中毒,临睡前在煤炉上和地上放两大盆冷水,这样做能预防煤气中毒吗?3.用煤火取暖时,怎样预防煤气中毒?4.煤气厂为什么常在家用煤气(含有一氧化碳)中掺入微量具有难闻气味的气体?如发生煤气泄漏应当怎么办?1.如果煤气泄漏,室内通风不良,或生煤炉火的房间不装烟囱,都有可能导致煤气中毒。
2.水不能预防煤气中毒,因为CO难溶于水。
3.首先室里应装烟囱,其次应注意睡觉时头不要靠墙边,因为CO的密度略小于空气,它会沿着墙壁慢慢地向上飘。
4.因为一氧化碳无色无味,煤气泄露不易被察觉,所以煤气厂常在家用煤气中掺入微量具有难闻气味的气体。
如果发生煤气泄漏,应立即关闭煤气阀门,然后开窗通风。
我们探究了一氧化碳的两大性质,它还会有什么性质呢?在玻璃管中放入氧化铜,通入一氧化碳赶走玻璃管内的空气后,加热。
课题3二氧化碳和一氧化碳(第二课时)
2、CO化学性质
CO 具有还原性
操作:
将纯净的 CO 通过灼热的CuO,再将生成的气体 通入澄清的石灰水中。并对尾气处理。
⑴黑色的CuO粉逐渐变成红色。 现象: ⑵产生的气体使澄清石灰水变浑浊。
结论:
⑴ CO具有还原性;CO + CuO
△
Cu + CO2
⑵ CO2 + Ca(OH)2 CaCO3↓+ H2O ⑶此套装置中增添了尾气处理装置。
CO2
高温
C + 2CuO
2CO
2Cu+CO2
CO
2CO + O2
点燃 2CO2 CO + CuO Cu + CO2
H2
2H2 + O2
点燃
2H2O
H2 + CuO
Cu + H2O
【小复习3】除杂质
CO CO2
CO
怎样除去CO中的CO2
石灰水
CO
怎样除去CO2 中的CO CO 2
CuO
CO2
【练习与思考】
A
B
C
收集CO的方法: 收集 CO只能用排水法。
⒉CO化学性质 操作: ⑴点燃纯净的CO。 ⑵在火焰上方罩一内壁涂有石 灰水的烧杯。 现象:⑴CO燃烧,产生蓝色火焰,放出热量。 ⑵澄清石灰水变浑浊。 点燃 结论:⑴CO具有可燃性。 2CO + O2 2CO2 ⑵CO燃烧的产物是CO2。 CO2 + Ca(OH)2 CaCO3↓+ H2O
物 质 有利的一面(用途) 不利的一面 示例:
H2
可用作高能燃料
使用不当容易引起爆炸
O2
广泛用于支持燃烧; 造成食物的腐烂; 供动植物呼吸 钢铁的锈蚀 可用于民用或工业 燃料 植物的光合作用; 灭火;人工降雨
二氧化碳和一氧化碳第二课时教案新部编本

教师学科教案[ 20 – 20 学年度第__学期]任教学科:_____________任教年级:_____________任教老师:_____________xx市实验学校《二氧化碳和一氧化碳》第二课时教案————一氧化碳教学目标:1:通过观察使同学们了解一氧化碳的物理性质。
2:通过实验了解一氧化碳可燃性、还原性的化学性质,理解并掌握一氧化碳还原氧化铜实验步骤、现象和注意事项。
3:从生活中一氧化碳造成人员伤害使同学们知道一氧化碳的毒性。
知识与技能:1:理论联系实际,要求同学们了解在什么情况下可能造成一氧化碳中毒,从而掌握防护措施。
2:联系中考,要求同学们了解并掌握二氧化碳与一氧化碳的区别和联系。
过程与方法:学会分析、归纳展示或演示的资料。
能认真观察试验现象,并对现象进行分析归纳,总结出重要的知识点。
情感、态度与价值观:学会用发展的眼光看问题、提高学生的科学素质。
教学重点、难点重点:一氧化碳的性质。
难点:一氧化碳还原氧化铜。
教学准备:仪器:硬质试管、试管、铁架台、酒精灯、带导管的橡皮塞、药匙、烧杯、玻璃片和多媒体设备。
药品:一氧化碳、氧化铜粉末、澄清的石灰水、澄清石灰水变浑浊的气体。
用途:气体燃料点燃时必须验纯。
力。
教学流程教师活动学生活动设计意图时间安排媒体展示【展示】视频讲解高炉炼铁原理。
学生通过观看了解高炉炼铁原理及主要化学反应方程式。
并归纳出一氧化碳另外化学性质。
培养学生的观察归纳能力1分钟【板书】3:还原性媒体展示归纳小结【展示】视频讲解一氧化碳还原氧化铜实验【展示】一氧化碳还原氧化铜实验装置【点评归纳】点评学生的阐述实验步骤和实验现象的归纳。
【板书】实验步骤:1:检查装置的气密学生通过观看视频了解一氧化碳还原氧化铜实验,观看实验装培养学生的观察分板书:《二氧化碳和一氧化碳》一氧化碳一:一氧化碳性质物理性质:通常情况下一氧化碳是无色、无味的气体。
化学性质:1:有毒性2:可燃性化学方程式:2CO+O2=点燃=2CO2现象:产生蓝色火焰,并放出热量,生成一种能使澄清石灰水变浑浊的气体。
二氧化碳和一氧化碳(第2课时)教学设计
止“温室效应”进一步加强?4、全面评价二氧化碳的功与过。
三、一氧化碳的性质【问题与情景】我们知道,碳的氧化物有两种:二氧化碳和一氧教学内容及问题情境综合评价(分析功时重点分析碳在自然界的循环中二氧化碳所起作用。
)学生活动维方式的培养。
设计意图化碳。
它们都是由碳、氧两种元素组成的,那么它们的性质是否也相同呢?为什么?究竟哪种说法是对的呢,下面通过实验来证明。
【活动与探究】【实验6--7】一氧化碳的燃烧现象结论小结:一氧化碳是一种没有颜色、没有气味的气体,(补充难溶于水,密度比空气小)它能燃烧,燃烧时放出大量的热,火焰呈蓝色。
【问题与情景】①在煤炉的上方,我们常常看到蓝色火焰出现,请问这是什么气体燃烧的结果?你能写出煤炉中产生该气体的有关化学方程式吗?由此性质可知一氧化碳有什么用途?2C + O22COC + O2CO2;2C + CO22CO②在冬天用煤(或木炭)取暧或用燃气洗澡时,若室内不通风,容易造一氧化碳中毒。
那么为什么一氧化碳能使人中毒呢?阅读教材117-118页相关内容。
【讨论与交流】课本P118页讨论:煤气厂为什么常在家用煤气(含有一氧化碳)中掺入微量具有难闻气味的气体?如发生煤气泄漏应当怎么办?【问题与情景】一氧化碳还有什么化学性质?与碳相似它除了有可燃性之外还有还原性。
【投影展示】木炭还原氧化铜的实验装置【提问】如果还原剂改用一氧化碳装置应如何改变为什么?【播放录像】一氧化碳还原氧化铜实验现象回答:①相同的②不同的。
并说出理由观察现象,填写表格书写化学方程式2CO + O22CO2小结:一氧化碳气体燃烧写出相关化学方程式回答:可作燃料。
交流:一氧化碳的毒性交流讨论观看投影结合一氧化碳状态、性质设计、改装装置。
有助于培养学生独立思维的能力。
培养观察能力表达能力。
利用知识解决实际问题。
体会性质决定用途的学习方法。
提高自学能力。
学生学会用对比法进行学习。
增强分析问题能力。
结论小结:一氧化碳具有还原性。
