中南民族大学研究生酶学第七章多底物酶反应动力学
《酶工程》课后知识题目解析

《酶工程》课后知识题目解析第一章酶工程基础1.名词解释:酶工程、比活力、酶活力、酶活国际单位、酶反应动力学①酶工程:由酶学与化学工程技术、基因工程技术、微生物学技术相结合而产生的一门新技术,是工业上有目的地设计一定的反应器和反应条件,利用酶的催化功能,在常温常压下催化化学反应,生产人类所需产品或服务于其它目的地一门应用技术。
②比活力:指在特定条件下,单位质量的蛋白质或RNA所拥有的酶活力单位数。
③酶活力:也称为酶活性,是指酶催化某一化学反应的能力。
其大小可用在一定条件下,酶催化某一化学反应的速度来表示,酶催化反应速度愈大,酶活力愈高。
④酶活国际单位: 1961年国际酶学会议规定:在特定条件(25℃,其它为最适条件)下,每分钟内能转化1μmol底物或催化1μmol产物形成所需要的酶量为1个酶活力单位,即为国际单位(IU)。
⑤酶反应动力学:指主要研究酶反应速度规律及各种因素对酶反应速度影响的科学。
2.说说酶的研究简史酶的研究简史如下:(1)不清楚的应用:酿酒、造酱、制饴、治病等。
(2)酶学的产生:1777年,意大利物理学家 Spallanzani 的山鹰实验;1822年,美国外科医生Beaumont 研究食物在胃里的消化;19世纪30年代,德国科学家施旺获得胃蛋白酶。
1684年,比利时医生Helment提出ferment—引起酿酒过程中物质变化的因素(酵素);1833年,法国化学家Payen和Person用酒精处理麦芽抽提液,得到淀粉酶;1878年,德国科学家K?hne提出enzyme—从活生物体中分离得到的酶,意思是“在酵母中”(希腊文)。
(3)酶学的迅速发展(理论研究):1926年,美国康乃尔大学的”独臂学者”萨姆纳博士从刀豆中提取出脲酶结晶,并证明具有蛋白质的性质;1930年,美国的生物化学家Northrop分离得到了胃蛋白酶、胰蛋白酶、胰凝乳蛋白酶结晶,确立了酶的化学本质。
3.说说酶工程的发展概况I.酶工程发展如下:①1894年,日本的高峰让吉用米曲霉制备淀粉酶,酶技术走向商业化:②1908年,德国的Rohm用动物胰脏制得胰蛋白酶,皮革软化及洗涤;③1911年,Wallerstein从木瓜中获得木瓜蛋白酶,用于啤酒的澄清;④1949年,用微生物液体深层培养法进行-淀粉酶的发酵生产,揭开了近代酶工业的序幕;⑤1960年,法国科学家Jacob和Monod 提出的操纵子学说,阐明了酶生物合成的调节机制,通过酶的诱导和解除阻遏,可显著提高酶的产量;⑥1971年各国科学家开始使用“酶工程”这一名词。
酶促反应动力学PPT课件

第五节
激活剂对酶反应的 影响
1. 激活剂(activator)
• 激活剂:凡是能提高酶活性的物质。其 中大部分是无机离子或简单有机化合物。
• 金属离子有K+、Na+、Ca2+、Mg2+等离 子,如Mg2+是多数激酶及合成酶的激 活剂,
• 无机阴离子如:Cl—、Br—、I—等都可作 为激活剂。如Cl—是唾液淀粉酶的激活剂
五、Km和Vmax值的测定
• (3) Hanes— Woolf作图法
• 将前式两边均 乘以[S]得:以 [s]/ v~[s]作图, 得一直线,横 轴的截距为 -Km,斜率为 1/ Vmax
第二节 酶的抑制作用
抑制与失活之间的关系
• 失活作用(inactivation) :使酶蛋白变性 而引起酶活力丧失的作用 ,变性剂对酶 的变性作用无选择性.
0.058
• Km值氢随酶测定的底物、反应的温度、pH及离子强度
而改变。各种酶的K苯m值甲相酰差酪很氨大酰,胺大多数酶2的.5Km
胰值凝介乳于蛋10白-6~酶10-1mol/甲L之酰间酪。氨酰胺
12.0
乙酰酪氨酰胺
32.0
三、Km值的意义
• 3. Km值可以判断酶的专一性和天然底物 有的酶可作用于几种底物,因此就有几个 Km值,其中Km值最小的底物称为该酶的 最适底物也就是天然底物。
•
i =1-a
• (4) 抑制百分数; i %=(1-a) x 100%
• 通常所谓抑制率是指抑制分数或抑制百分数。
二、抑制作用的类型
v • 根据抑制作用是否可逆:
• 1.不可逆的抑制作用: 抑 制剂与酶的必需基团以共价 键结合而引起酶活力丧失, 不能用透析、超滤等物理方 法除去抑制剂而使酶复活的 作用.
酶学-3-酶促反应动力学-最新

用稳态学说处理速度方程的推导如下: 对于只有一个结合位点的单底物反应: d [ ES ] 稳态假设:
E + S
dt
k1[ E ][ S ] k 1[ ES ] k 2 [ ES ] 0
k1 k ES 2 E + P k-1
k1[E][S]=k-1[ES]+k2[ES] [E]=[E0]-[ES]
实际上,许多酶的催化常数 很高,即ES分解为产物这个 过程对酶反应速度的影响不 能忽略!
ES
k2
E + P
图6-2 酶反应过程中各种浓度的时间曲线
何谓 “稳态”?
稳态的数学表达式:
d[ES] 0 dt
or:
d[ES] k1[E][S] (k 1 k 2 )[ES] 0 dt
实验证明: ◆ 稳态假设对于大多数酶促反应是合理的。 ◆ 稳态通常在反应初期的数毫秒内建立,然后 维持相当长一段时间。 稳态即反应体系中酶与酶底复合物浓度保持不变 稳态是一种动态平衡状态,亦称恒态。
第六章
酶催化反应动力学
预习思考题
1. 什么是酶促反应动力学? 2. 什么是酶反应初速度? 3. 影响酶作用的主要因素有哪些? 4. 米氏方程推导方法有哪些? 5. 什么是Km?Km的意义是什么? 6. 双底物反应常见类型有哪几种? 7. 抑制类型有哪几种?动力学特征有哪些? 8. 不同抑制条件下的米氏方程是什么?
三、关于米氏方程的讨论
1.米氏方程的数学特征
ax 米氏方程 在数学上属于Y= b x
形式的等轴直角双曲线方程。 酶反应初速度v0与底物浓度[S0] 的关系为一条双曲线。双曲线的 两条渐近线分别为v0=Vm, [S]=-Km ,两条渐近线的交点, 也是二条双曲线对应的中心点 (-Km Vm);实的双曲线可以 经过实验得出。由方程和曲线图 都可以看出,当底物浓度[S0]足 够大时,曲线趋于v0=Vm渐近线。 也就是说Vm是酶被底物充分饱和 时可能达到的最大速度,即为最 大反应初速度。
酶促反应动力学(doc)

2 酶促反应动力学教学基本内容:酶促反应的特点;单底物酶促反应动力学方程(米氏方程)的推导;抑制剂对酶促反应的影响,竞争性抑制和非竞争性抑制酶促反应动力学方程的推导;产物抑制、底物抑制的概念,产物抑制和底物抑制酶促反应动力学方程的推导;多底物酶促反应的机制,双底物酶促反应动力学的推导;固定化酶的概念,常见的酶的固定化方法,固定化对酶性质的影响及固定化对酶促反应的影响,外扩散过程和内扩散过程分析;酶的失活动力学。
2.1 酶促反应动力学的特点2.2 均相酶促反应动力学2.2.1 酶促反应动力学基础2.2.2 单底物酶促反应动力学2.2.3抑制剂对酶促反应速率的影响2.2.4多底物酶促反应动力学2.3 固定化酶促反应动力学2.4 酶的失活动力学授课重点:1. 酶的应用研究与经典酶学研究的联系与区别2. 米氏方程。
3 竞争性抑制酶促反应动力学方程。
4. 非竞争性抑制酶促反应动力学方程。
5. 产物抑制酶促反应动力学方程。
6. 底物抑制酶促反应动力学方程。
7. 双底物酶促反应动力学方程。
8. 外扩散对固定化酶促反应动力学的影响,Da准数的概念。
9. 内扩散对固定化酶促反应动力学的影响,φ准数的概念。
10. 酶的失活动力学。
难点:1. 采用稳态法和快速平衡法建立酶促反应动力学方程。
2. 固定化对酶促反应的影响,五大效应(分子构象的改变、位阻效应、微扰效应、分配效应及扩散效应)的区分。
3. 内扩散过程分析,涉及到对微元单位进行物料衡算和二阶微分方程的求解、无因次变换、解析解与数值解等问题。
4.温度对酶促反应速率和酶的失活速率的双重影响,最适温度的概念。
温度和时间对酶失活的影响。
本章主要教学要求:1. 掌握稳态法和快速平衡法推导酶促反应动力学方程。
2. 了解酶的固定化方法。
理解固定化对酶促反应速率的影响。
掌握Da准数的概念及φ准数的概念,理解外扩散和内扩散对酶促反应速率的影响。
3. 了解酶的一步失活模型与多步失活模型,反应过程中底物对酶稳定性的影响。
酶促反应动力学多底物动力学

k2[B] k-4[Q] k-3[P]
EQ:
k1[A]
k-1
k-1
k2[B] k-4[Q] k3
k-2 k-4[Q] k3
k2[B] k-4[Q] k3
V=k4[EQ] – k-4[E][Q] =(k4∙КEQ – k-4[Q]∙КE) [E0]/∑К
=
num1[A][B] - num2[P][Q]
反应速度:Vf= К12 [E] ; Vr= К21 [EA]
❖ К具有方向性,是一种矢量。其方向与酶形式旳 流向有关
(二)King-Altman 法环节:
(1)首先写出反应历程,然后将反应历程安排成封 闭环形式。环旳角数就是酶存在形式数目,用n表 达。然后在各角之间连线上标出各步反应旳К。
E + A k1 EA k2 EP k3 E + P
3!
=3
(3-1)!(3-3+1)!
King- Altman 图形不包括封闭环形式:
E1
E2
E3
E4
❖ n=4,m=5
n-1线(3线)图数目=
5!
=10个,
(4-1)!(5-4+1)!
❖ 2个封闭环形式无效,应清除。共有8个有效旳 King- Altman 图形
反应历程中有时可能没有逆反应,此时有些 KingAltman 图形不存在。
分为: 非中心复合物:酶未完全被底物饱和 中心复合物: 酶已经完全被底物饱和,
(EAB EPQ); (EA EP)
(二) 反应机制旳分类和命名
(以双底物双产物反应为例):
1. 序列(sequential)反应机制: 酶必需与全部底物都结合之后才有产物放出。对于双
酶催化反应动力学
(2)特点:
① 抑制剂I与底物S在 化学结构上相似,能 与底物S竞争酶E分子 活性中心的结合基团.
例如,丙二酸、苹果酸 及草酰乙酸皆和琥珀酸 的结构相似,是琥珀酸 脱氢酶的竞争性抑制剂。
”
二.抑制程度取决于抑制剂与底 物的浓度比、
〔ES〕和〔EI〕的相对稳定 性;
3. 加大底物浓度,可使抑制作用减 弱甚至消除。
不可逆抑制
根据产生抑制 的机理不同, 可逆抑制分为:
竞争性抑制 反竞争性抑制
非竞争性抑制 混合性抑制
1.竞争性抑制(competitive inhibition) (1)含义和反应式
抑制剂I和底物S结构相似,抑制剂I和底物S对游离酶E的结合有竞争作 用,互相排斥,已结合底物的ES复合体,不能再结合I
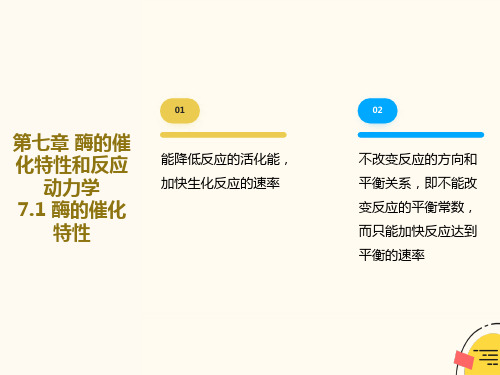
第七章 酶的催 化特性和反应
动力学 7.1 酶的催化
特性
01
能降低反应的活化能, 加快生化反应的速率
02
不改变反应的方向和 平衡关系,即不能改 变反应的平衡常数, 而只能加快反应达到 平衡的速率
目录
CONTENTS
01
1.
较高的催化效率
2.
很强的专一性
3.
具有温和的反应条件
4.
易变性与失活
02
酶的催化特性
移反应
序列反应和乒乓反应的区别
本章重点
01
酶催化的基本特征
03
米氏方程的推导
05
酶反应抑制动力学,几 种抑制的反应式和特点
02
影响酶催化活性的因素
04
米氏常数的意义
反应快速建立平衡:
k1 k1
KM
[E][S] [ES ]
[ES ] [E][S] KM
实验报告酶催化反应的动力学研究

实验报告酶催化反应的动力学研究实验报告:酶催化反应的动力学研究一、实验目的本次实验旨在研究酶催化反应的动力学特性,包括酶促反应速率与底物浓度、酶浓度、温度、pH 值等因素之间的关系,以深入理解酶催化作用的机制,并为相关的生物化学和生物技术应用提供理论基础。
二、实验原理酶是一种具有高度催化活性的生物大分子,能够显著降低化学反应的活化能,从而加速反应的进行。
酶催化反应的速率通常受到多种因素的影响,其中最重要的是底物浓度和酶浓度。
在低底物浓度下,反应速率与底物浓度成正比,这一阶段被称为一级反应;随着底物浓度的增加,反应速率逐渐接近最大值,此时反应速率不再随底物浓度的增加而显著增加,这一阶段被称为零级反应。
米氏方程(MichaelisMenten equation)是描述酶催化反应动力学的经典方程:$V = V_{max} S /(K_m + S)$,其中$V$ 是反应速率,$V_{max}$是最大反应速率,$S$ 是底物浓度,$K_m$ 是米氏常数,其数值等于反应速率达到最大反应速率一半时的底物浓度。
此外,温度和 pH 值也会通过影响酶的活性和构象来影响酶催化反应的速率。
三、实验材料与设备(一)实验材料1、酶:本次实验使用的酶为过氧化氢酶。
2、底物:过氧化氢(H₂O₂)溶液。
3、缓冲液:用于维持反应体系的 pH 值稳定。
(二)实验设备1、分光光度计:用于测定反应体系中产物的生成量或底物的消耗量。
2、恒温水浴锅:用于控制反应温度。
3、移液器:用于准确移取实验所需的溶液体积。
4、离心机:用于离心分离酶和底物。
5、试管、烧杯、量筒等常规实验器具。
四、实验步骤(一)底物浓度对酶促反应速率的影响1、配制一系列不同浓度的过氧化氢溶液,浓度范围从低到高。
2、向每个试管中加入相同量的过氧化氢酶溶液和缓冲液,使反应体系的总体积相同。
3、将试管置于恒温水浴锅中,设定反应温度为37°C,并开始计时。
4、在一定时间间隔内,使用分光光度计测定每个试管中反应体系的吸光度变化,以反映底物的消耗量或产物的生成量。
酶催化反应动力学(共49张PPT)

❖ 中间络合物学说最早是由 Henri和Wurtz两位科学家 提出的。
❖ 在1903年,Henri在用蔗 糖酶水解蔗糖实验研究化 学反响中底物浓度与反响 速度的关系时发现,当酶 浓度不变时,可以测出一 系列不同底物浓度下的化 学反响速度,以该反响速 度对底物浓度作图,可得 到如图3-2所示的曲线。
酶底物中间络合物学说
本质上来说就是酶的修饰抑制
竞争性抑制剂。 ⑴ Vm值降低,Km值不变;
3酶活力测定时需注意:
测定酶活力常用的方法:
❖ 有某些重金属离子如Ag 、Cu 、Hg 、Pb 等 K+、Na+、Ca2+、Mg2+、Zn2+及Fe2+
图3-1 酶促反响的速度曲线 测定酶活力常用的方法:
+
2+
2+
2+
对酶的抑制作用也属于这一类。 3激活剂对酶促反响速度的影响
1 竞争性抑制 2 非竞争性抑制 3 反竞争性抑制
①竞争性抑制(competitive inhibition) :
❖ 是最常见的一种可逆抑制作用。
❖ 大多数竞争性抑制剂与底物的结构相似,能与底
物竞争酶的活性中心,从而阻碍酶底物复合物的形 成,使酶的活性降低。这种抑制作用称为竞争性抑 制作用。 ❖ 其抑制程度取决于底物和抑制剂的相对浓度,可以 通过增加底物浓度的方法来解除这种抑制作用。
竞争性抑制反响模式
❖ 在竞争性抑制中,底物(S)或抑制剂(I)与酶(E)的结合
都是可逆的,因此存在着如下的化学平衡式:
[S]>>[I]:高浓度的底物可解除抑制
图3-5 竞争性抑制曲线
特点:
⑴ Vm值不变,(表观)Km值增大; ⑵ Km随抑制剂浓度[I]的增加而增加; ⑶双倒数作图所得直线相交于纵轴; ⑷抑制作用可以被高浓度的底物减低以致消除。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第七章多底物酶反应动力学
多底物酶占所有酶的一半以上。
见下表:
表酶反应按底物数的分类
A
O
+ B
A + BX
X + Y + ATP
X + Y + ATP
7.1 双底物酶反应机制
7.1.1 顺序机制ordered mechanism
此机制有三元复合物生成,大部分脱氢酶属于顺序机制。
7.1.2 Theorell Chance机制
此机制也属顺序机制,只是没有三元复合物生成。
如肝醇脱氢酶,A为NAD+,B为乙醇,P为乙醛,Q为NADH。
7.1.3 随机机制random mechanism
许多激酶的催化机制属于此类。
7.1.4 乒乓机制ping pong mechanism
转氨酶、转磷酸酶、转酰基酶属于此机制。
7.2 双底物顺序反应动力学 7.2.1 反应模式
7.2.2 速度方程推导
按快速平衡法,如果k 4、k 5 << k -1、k -2,则总反应的限速步骤为EAB 的生成,故可将反应模式简写成:
][]][[EAB B EA K mB =
, ][]
[][EAB B K EA mB ⋅=
]
[]][[EA A E K iA =
, ][]
[][EA A K E iA ⋅=
, ][]
][[][EAB B A K K E mB iA ⋅=
][EAB k V p =, ][][][][0E A B EA E E ++=
]
[][][]][[0EAB EA E E EAB k V p ++=
]
[][]
[][]
][[]
[EAB EAB B K EAB B A K K EAB V mB mB iA m ++
=
1
]
[]
][[++=
B K B A K K V mB mB iA m
分子分母同乘以[A][B]得
]
][[][]
][[B A A K K K B A V V mB mB iA m ++=
][]][[EAB B EA K mB =
,][]
[][EAB B K EA mB ⋅=
]
[]][[EA A E K iA =
, ][]
[][EA A K E iA ⋅=
, ][]
][[][EAB B A K K E mB iA ⋅=
][EAB k V p =, ][][][][0E A B EA E E ++=
]
[][][]][[0EAB EA E E EAB k V p ++=
]
[][]
[][]
][[]
[EAB EAB B K EAB B A K K EAB V mB mB iA m ++
=
1
]
[]
][[++=
B K B A K K V mB mB iA m
分子分母同乘以[A][B]得
]
][[][]
][[B A A K K K B A V V mB mB iA m ++=
a .当[A]固定,[B]可变时,速度方程可写成: =++=
]
[]
[]
[B K A K K B V V mB mB
iA m ][][1]
[B A K K B V V iA mB m +⎪⎪⎭
⎫ ⎝⎛
+=
,此方程形式与米氏方程相同。
b .当[B]固定,[A]可变时,速度方程可写成:
]
[]
[][]
[]
[A B A K B K K A V V mB mB
iA m ++
=
⎪⎪⎭
⎫ ⎝⎛
++=
][1][]
[]
[B K A B K K A V mB mB
iA m ]
[]
[1][]
[]
[1A B K B K K A B K V mB mB
iA mB m
++
⋅+=
]
[][]
[]
[1A K B K K A B K V V mB
mB iA mB m ++⋅+
=
,此方程形式也与米氏方程相同。
7.2.3 讨论
a .固定两种反应物中的任一种,都可以使速度方程写成米氏方程的形式;两种反应物浓度都变化时,则不为米氏方程的形式。
b .当[A]固定,[B]可变时,[A]影响表观米氏常数,不影响最大反应速度。
c .当[B]固定,[A]可变时,[B]既影响表观米氏常数,又影响最大反应速度。
7.2.4 作图法求动力学参数 7.2.4.1 [A]固定,[B]可变时 a .双倒数作图
m
iA m mB V B A K V K V 1
][1][11+⋅⎪⎪⎭⎫ ⎝⎛+=
, 此直线的横轴截距=⎪
⎪⎭⎫ ⎝
⎛
+-
][11A K K iA mB。
b .斜率对
]
[1A 再作图
斜率=
m
mB m
iA
mB V K A V K K +
⋅
]
[1 此直线的横轴截距=iA
K 1-。
c .横轴截距绝对值的倒数对
]
[1A 再作图
mB iA mB iA mB K A K K A K K +⋅=⎪
⎪⎭
⎫
⎝⎛
+][1
][1
此直线的横轴截距=iA
K 1-。
7.2.4.2 [B]固定,[A]可变时 a .双倒数作图
⎪⎪⎭
⎫ ⎝⎛++
⋅=][11][1]
[1B K V A B V K K V mB m m mB iA 在不同的[B]下以V
1对
]
[1A 作出不同的直线,
这些直线交于第三象限的一点,交点坐标为
⎪⎪⎭
⎫
⎝⎛-m iA V K 1,1,横轴截距=iA
mB
K K B ][1+
-。
b .纵轴截距对
]
[1B 再作图
纵轴截距=
⎪⎪⎭⎫ ⎝⎛
+][11B K V mB m m
m mB V B V K 1][1+⋅= 此直线的横轴截距=mB
K 1-。
c .横轴截距的绝对值对[B]再作图
|横轴截距|=
iA
mB
K K B ][1+
iA
mB
iA K B K K 1][1+
⋅=
此直线的横轴截距=mB K -。
7.3 Theorell Chance 机制动力学 7.3.1 反应模式
7.3.2 速度方程推导
用稳态法处理:
1.][]][[32EP k B EA k =, ][]
[][23EP B k k EA =
2.]][[][]][[112A E k EA k B EA k =+-, ][]
][[)][(]
[]
)[][(][21123112EP A B k k k B k k A k EA k B k E --+=
+=
][][][][0EP EA E E ++=…………①, ][3EP k V =…………②,
①式除以②式得
]
[]
[][][][30EP k EP EA E V
E ++=
]
[]
[][]
[][]
][[)
][(32321123EP k EP EP B k k EP A B k k k B k k ++
+=
-
=
V
E 0][3
23
211231
]
[]
][[)
][(k B k k A B k k k B k k ++
+-
1
]
[]
][[)][(][23211230
3++
+=
-B k k A B k k k B k k E k V 1
]
[]
][[]
[23213113++
+
=
-B k k A B k k k k A k k V m
固定[A],改变[B]时:
]
[]
[][]
[]
[2
3213113B k k A k k k k B A k k B V V m +++
=
-⎪⎪⎭
⎫
⎝⎛+++=
-][1][]
[]
[132
32131A k k B k k A k k k k B V m
]
[]
[1][]
[][1132
3213113B A k k k k A k k k k B A k k V V m ++
+
⋅+
=
-,与米氏方程形式相同。
固定[B],改变[A]时也类似。
