Rac1调控线粒体生物功能减轻氧糖剥夺神经元的损伤
Rac1抑制剂上调糖尿病小鼠肾小球nephrin的表达

mi . c hc r gv nt e  ̄ ed s f o ma sl ew r t stecn r1 i ea u n e ce o UA , l m e t c Mi w i wee ie r oeo n r l ai ee e t . n b mi rt n( E)pa ac ai e e h h sn n s a h o o Ur l x i s r —
D p rme t fNe h o g te it ec igHo i l ea t n o p rl y,h xh T ahn s t , o S pa S a g a ioog Unvri , h n h i(0 2 3 h n h i a t ies y S a g J n t a 2 03 )
伤 具 有 保 护作 用 。
[ 关键词] R c 抑制剂 al
糖尿病 肾病 足 细胞Байду номын сангаас
np r ehi n
RalIhbtr( S 3 7 6 Up euae e ee o c n ii o N C 3 6 ) —rg lt t vl f sh L
Gl me u a p i n Di b tc M ie o r l rNe hrn i a e i c W ANG a x a, Xi o i CHEN Yuq a g, ANG an o g, tal in W Ni s n e
[ 摘 要] 目的: 探讨 R c 抑 制剂( C 3 6 ) S al NS 3 7 6 对 TZ诱导 的糖尿病 小鼠肾小球 内 np r ehi n水平的影响。方 法 : 用腹 采 腔单剂注射链脲佐 菌素(t poooi,T 10mg k ) s etztc S Z,5 / g 的方法建立小鼠糖尿病模型 , 测 N C 3 6 r n 检 S 3 7 6对正常和糖尿 病小鼠尿 白蛋 白排 泄率、 血清肌 酐水平的影 响, 采用 P S染 色观察 肾脏组织学的 改变 , A 透射 电镜观察 超微 结构的改 变; 用免 疫组化 采 观察 N C 3 6 肾组织 内足 细胞 骨架蛋 白 np r S 3 7 6对 ehi n表达的影 响。结果 : C 3 6 NS 3 76降低糖尿病 小鼠尿 白蛋 白排泄 率; 少肾 减 组织 内系膜 区细胞 外基质 的积聚和基底膜的厚度 , 改善 肾小球 滤过膜足 突融合 , 上调 np r ehi 达, n表 未发现 NS 3 7 6具有降 C36 低 血糖的作 用。结论 : al抑制 剂 NS 3 76可能通过上调 肾小球 内 npr Rc C 36 ehi n水平 , 改善足 细胞骨架 的方式 , 对糖尿病 肾脏损
利拉鲁肽通过调节SIRT1FOXO1通路促进自噬保护高糖诱导心肌细胞氧化应激损伤的机制研究演示稿件

VS
利拉鲁肽对SIRT1FOXO1通路的调节 作用能够促进自噬过程,清除受损的 细胞器及有害蛋白,保护心肌细胞免 受高糖诱导的氧化应激损伤。
03
自噬在高糖诱导心肌细胞氧 化应激损伤中的作用
自噬的生理作用
维持细胞内环境稳
定
自噬通过清除受损的细胞器、聚 集的蛋白质和多余的脂质,维持 细胞内环境的稳定。
利拉鲁肽通过调节 SIRT1FOXO1通路促进自噬 保护高糖诱导心肌细胞氧化
应激损伤的机制研究
汇报人:XXX
2024-01-07
目录
• 研究背景与目的 • 利拉鲁肽对SIRT1FOXO1通路的
影响 • 自噬在高糖诱导心肌细胞氧化应
激损伤中的作用 • 利拉鲁肽通过SIRT1FOXO1通路
促进自噬的机制研究 • 实验结果与讨论
它通过刺激胰岛素分泌、抑制胰高血糖素释放等机制降低血糖水平,同时 具有心血管保护作用。
利拉鲁肽能够减轻心肌细胞的氧化应激损伤,但其具体作用机制尚不清楚 。
SIRT1FOXO1通路与自噬的关系
01
SIRT1是一种烟酰胺脱氢酶/脱氢酶超家族成员,可通过去乙酰化作用 调节蛋白质活性。
02
FOXO1是一种转录因子,参与细胞凋亡、自噬等过程。
02
利拉鲁肽对SIRT1FOXO1通 路的影响
SIRT1的调节作用
SIRT1是一种去乙酰化酶,能够通过去乙酰化作用调节多种蛋白质的活性。在高糖条件下,SIRT1的 表达水平可能会降低,导致心肌细胞氧化应激损伤。
利拉鲁肽能够激活SIRT1,通过去乙酰化作用调节下游靶蛋白的活性,从而发挥对心肌细胞的保护作 用。
03
在高糖条件下,SIRT1的活性 降低,导致FOXO1的去乙酰化 作用减弱,进而影响自噬过程 。
抑制线粒体活性氧自由基可减轻高糖诱导的心肌细胞焦亡和铁死亡

抑制线粒体活性氧自由基可减轻高糖诱导的心肌细胞焦亡和铁死亡一、本文概述本文旨在探讨抑制线粒体活性氧自由基(Reactive Oxygen Species, ROS)对减轻高糖诱导的心肌细胞焦亡(Pyroptosis)和铁死亡(Ferroptosis)的影响。
我们将从线粒体ROS的产生及其在心肌细胞死亡中的角色开始讨论,然后详细阐述高糖环境下心肌细胞焦亡和铁死亡的发生机制,以及如何通过抑制线粒体ROS活性来减轻这两种死亡过程。
我们还将探讨可能的分子机制,为未来的心血管疾病治疗提供新的视角和潜在的治疗策略。
二、材料与方法本实验采用成熟的心肌细胞系(如H9c2细胞或原代心肌细胞)作为实验对象。
高糖培养基(如D-葡萄糖)、线粒体活性氧自由基抑制剂(如MitoTEMPO)、细胞焦亡检测试剂盒、铁死亡检测试剂盒、抗氧化剂(如N-乙酰半胱氨酸,NAC)、Western Blot所需抗体及试剂等。
细胞培养箱、超净工作台、倒置显微镜、流式细胞仪、Western Blot电泳及转膜设备、酶标仪等。
将心肌细胞以适当密度接种于培养瓶中,待细胞贴壁生长至适宜密度后,更换为含高糖的培养基进行诱导处理。
同时,设立对照组、抑制剂处理组(加入MitoTEMPO)及抗氧化剂处理组(加入NAC)。
根据细胞焦亡检测试剂盒和铁死亡检测试剂盒的说明书,分别进行细胞焦亡和铁死亡的检测。
通过流式细胞仪分析各组细胞焦亡和铁死亡的比例。
收集处理后的细胞,提取总蛋白并进行Western Blot分析。
检测与细胞焦亡和铁死亡相关的关键蛋白表达水平,如NLRPCaspase-Gasdermin D等。
实验数据以均数±标准差(Mean±SD)表示,采用SPSS软件进行统计分析。
多组间的比较采用单因素方差分析(ANOVA),以P<05为差异有统计学意义。
通过以上实验设计与方法,我们旨在探究抑制线粒体活性氧自由基对高糖诱导的心肌细胞焦亡和铁死亡的影响,为防治高糖环境下心肌细胞损伤提供新的思路与策略。
靶向位于线粒体的circRNA SCAR通过减少mROS输出缓解NASH
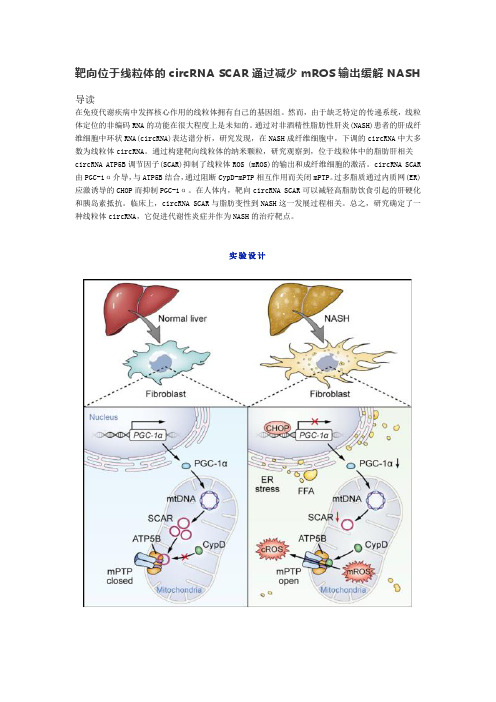
靶向位于线粒体的circRNA SCAR通过减少mROS输出缓解NASH导读在免疫代谢疾病中发挥核心作用的线粒体拥有自己的基因组。
然而,由于缺乏特定的传递系统,线粒体定位的非编码RNA的功能在很大程度上是未知的。
通过对非酒精性脂肪性肝炎(NASH)患者的肝成纤维细胞中环状RNA(circRNA)表达谱分析,研究发现,在NASH成纤维细胞中,下调的circRNA中大多数为线粒体circRNA。
通过构建靶向线粒体的纳米颗粒,研究观察到,位于线粒体中的脂肪肝相关circRNA ATP5B调节因子(SCAR)抑制了线粒体ROS (mROS)的输出和成纤维细胞的激活。
circRNA SCAR 由PGC-1α介导,与ATP5B结合,通过阻断CypD-mPTP相互作用而关闭mPTP。
过多脂质通过内质网(ER)应激诱导的CHOP而抑制PGC-1α。
在人体内,靶向circRNA SCAR可以减轻高脂肪饮食引起的肝硬化和胰岛素抵抗。
临床上,circRNA SCAR与脂肪变性到NASH这一发展过程相关。
总之,研究确定了一种线粒体circRNA,它促进代谢性炎症并作为NASH的治疗靶点。
实验设计结果1 脂质暴露的成纤维细胞的促炎性表型需要mROS成纤维细胞介导多种疾病的纤维化。
其中,NAFLD影响了全球25%的人口。
为了研究NAFLD 患者成纤维细胞的线粒体代谢,本研究从NASH肝硬化和非NAFLD患者的肝组织中分离出成纤维细胞。
利用海马细胞外通量分析仪,研究观察到与正常成纤维细胞相比,NASH成纤维细胞中细胞外酸化速率(ECAR)和耗氧率(OCR)增加(图1A)。
然而,NASH成纤维细胞中ECAR/OCR比值显著升高(图1B)。
同样,棕榈酸盐处理的正常成纤维细胞的ECAR/OCR比值也明显增加(图1C),这概述了体外脂质暴露。
另外,棕榈酸盐处理略微增加了成纤维细胞的凋亡(图S1A)。
总之,这些数据表明,在脂质负担下,成纤维细胞中ATP的产生从线粒体氧化磷酸化转变为糖酵解。
DJ-1调控线粒体功能研究进展

网络出版时间:2023-07-2510:15:27 网络出版地址:https://link.cnki.net/urlid/34.1086.R.20230724.1340.004DJ 1调控线粒体功能研究进展倪晓晨1,2,于世龙1,刘延庆1,金 凤3(1.扬州大学医学院,国家中医药管理局胃癌毒邪论治重点研究室,2.扬州市中医院,3.扬州大学附属医院,江苏扬州 225009)收稿日期:2023-03-10,修回日期:2023-06-25基金项目:国家自然科学基金青年基金项目(No81903850),江苏省中医药科技发展计划项目(NoYB201992)作者简介:倪晓晨(1997-),男,硕士生,研究方向:中医内科学,Email:nxc19970103@163.com;金 凤(1989-),女,博士,硕士生导师,研究方向:中药抗肿瘤药理学,通信作者,E mail:jinfeng0522@126.comdoi:10.12360/CPB202203060文献标志码:A文章编号:1001-1978(2023)08-1406-06中国图书分类号:R329 24;R349 1;R394 2;R742 5;R977 6摘要:DJ 1是PARK7基因编码的蛋白,属于肽酶C56蛋白质家族,PARK7基因的缺陷会导致常染色体隐性遗传早发性帕金森症。
DJ 1蛋白是一个多功能蛋白,它可以作为一个积极的雄激素受体介导的转录调节子,也可以用作氧化还原敏感的分子伴侣,氧化应激传感器,还可以保护神经元免于氧化应激和细胞死亡。
此外,DJ 1还与线粒体自噬、能量代谢、线粒体稳态、内质网-线粒体结构偶联等生命过程有关。
然而目前,DJ 1蛋白的精确功能尚不是很清楚。
该文对DJ 1蛋白调控线粒体功能的作用、机制、分子基础展开综述,并结合临床疾病探讨其潜在价值,具有较好的时效性、必要性、创新性和科学性,也有助于为临床药物开发提供新的靶点和思路。
酪氨酸激酶介导RAC1信号通路在神经胶质瘤中的作用机制

酪氨酸激酶介导RAC1信号通路在神经胶质瘤中的作用机制匡梦;黄艳姣;郑兰荣【摘要】神经胶质瘤是人类中枢神经系统最常见的肿瘤,其侵袭、迁移和增殖等特性是其不良预后的主要原因.证据表明酪氨酸激酶是信号传递过程中的重要因子,其家族成员的异常参与肿瘤发生的多个病理过程.异常激活的酪氨酸激酶,激活一系列下游信号通路,尤其是Ras相关的C3肉毒素底物1 (RAC1),引起级联反应,细胞增殖调节紊乱,最终导致肿瘤的形成.因此酪氨酸激酶/RAC1信号通路被认为是调控肿瘤细胞侵袭迁移的关键,通过针对酪氨酸激酶/RAC1的靶向药物能成为破坏肿瘤的有效途径.【期刊名称】《实用医学杂志》【年(卷),期】2018(034)006【总页数】3页(P1033-1035)【关键词】神经胶质瘤;酪氨酸激酶;RAC1;信号通路【作者】匡梦;黄艳姣;郑兰荣【作者单位】皖南医学院病理学教研室安徽芜湖421002;皖南医学院病理学教研室安徽芜湖421002;皖南医学院病理学教研室安徽芜湖421002【正文语种】中文神经胶质瘤发生于神经外胚层,根据胶质瘤细胞的分化情况分为:星形细胞瘤、少突胶质瘤、室管膜瘤、髓母细胞瘤、多形性胶质母细胞瘤等。
越来越多的证据[1-2]表明神经胶质瘤与Ras相关的C3肉毒素底物1(RAC1)的异常有关。
RAC1是小鸟苷酸三磷酸酶的成员,可以通过细胞前端的肌动蛋白聚合来促进迁移,并诱导膜皱褶和鳞片状伪足的形成[3]。
通过调节细胞骨架重排,RAC1在肿瘤细胞黏附、迁移和侵袭起到了重要作用[4-5]。
RAC1及其下游效应物的异常与乳腺、肺、卵巢癌和神经胶质瘤等肿瘤细胞迁移,侵袭和转移相关[6-9]。
1 酪氨酸激酶家族酪氨酸激酶按其结构可以分为两大类:受体酪氨酸激酶和非受体酪氨酸激酶。
受体型的酪氨酸激酶通常具有胞外配体结合结构域、一个跨膜区以及胞内激酶域。
胞外结构域与配体结合并引起构象变化,激活具有自磷酸化位点的胞内段的酪氨酸激酶。
PGC-1α对线粒体生物合成功能的调控
PGC-1α对线粒体生物合成功能的调控牟彩莹;王松【摘要】线粒体是真核生物细胞的重要细胞器.由于线粒体电子传递链的氧化磷酸化反应为有机体生成约90%的ATP,线粒体通常被誉为真核细胞的"动力站".最近备受关注的辅激活因子--过氧化物酶体增殖物激活受体γ辅激活因子1α(PGC-1α),与机体的线粒体生物合成等生理活动密切相关.近年来对PGC-1α调控线粒体是研究热点,本文综述了PGC-1α调控线粒体的最新研究进展.【期刊名称】《四川解剖学杂志》【年(卷),期】2011(019)001【总页数】4页(P36-38,44)【关键词】过氧化物酶体增殖物受体γ共激活因子1α;骨骼肌;运动;线粒体生物合成【作者】牟彩莹;王松【作者单位】武汉体育学院,健康科学学院,武汉,430079;武汉体育学院,研究生部,武汉,430079;武汉体育学院,健康科学学院,武汉,430079【正文语种】中文【中图分类】Q3431 线粒体生物合成的定义和功能1.1 线粒体的研究历史与结构线粒体是真核生物细胞中特别重要的细胞器,至今已有一个多世纪的研究历史。
在生命进化渊源上,它来源于“内共生”的好氧古细菌,它将自己的遗传基因(m tDNA)编码线粒体氧化磷酸化酶复合体的关键亚基来控制 A TP合成。
同时,它还产生活性氧(ROS)作为细胞氧化还原电势和Redox信号的原发因子。
线粒体内有1000~2000种蛋白质,其中绝大部分由核DNA编码,经胞质核糖体合成后转运进入线粒体。
线粒体蛋白质跨线粒体内、外膜转运是维持线粒体功能的重要环节。
关于如何描述线粒体结构,主要有以下两种模型[1]:一种是Palade的模型,线粒体由内外两层脂质双分子膜围成的细胞器。
内膜再连续向内腔延伸而形成所谓“隔舱板”式结构即脊膜。
线粒体有四个空间:外膜、内膜与外膜之间的空隙和脊膜腔、以及内膜包围的基质。
另一种是三维重构模型,Terrence论述的三维重构模型包括以下特征[1]: (1)线粒体外膜与内质网或细胞骨架等其它细胞组分有结构和功能的连接,形成线粒体网络结构;(2)线粒体内外膜之间有随机分布的接着点结构;(3)内膜不是直接向内延伸成脊膜的,而是通过其表面的部分,即内膜界面膜与脊膜的脊膜连接部分相接;(4)脊膜是管状或者扁平的囊状结构,它们之间可以相互连接或者融合。
Rac1介导的氧化应激在糖尿病视网膜病变中的作用
欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁氉氉氉氉引文格式:张梦圆,魏婷婷,谢田华,姚勇.Rac1介导的氧化应激在糖尿病视网膜病变中的作用[J].眼科新进展,2020,40(12):1185 1187.doi:10.13389/j.cnki.rao.2020.0263【文献综述】Rac1介导的氧化应激在糖尿病视网膜病变中的作用△张梦圆 魏婷婷 谢田华 姚勇欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁欁氉氉氉氉作者简介:张梦圆(ORCID:0000 0003 3943 1353),女,1997年1月出生,江苏宿迁人,在读硕士研究生。
Email:myzhang111@126.com通信作者:姚勇(ORCID:00000002 5506 7101),男,1965年11月出生,安徽合肥人,博士,主任医师,博士研究生导师。
研究方向:玻璃体视网膜疾病的临床与基础研究。
E mail:pard1@126.com收稿日期:2019 12 18修回日期:2020 01 06本文编辑:王燕△基金项目:国家自然科学基金面上项目(编号:81770941);江苏省科教强卫重点学科项目(编号:ZDXKC2016008)作者单位:214023 江苏省无锡市,南京医科大学附属无锡人民医院眼科【摘要】 糖尿病视网膜病变(diabeticretinopathy,DR)是高龄人群主要致盲原因之一。
进一步探寻DR预防、治疗方向具有重要意义。
Rac1/Nox2通路参与细胞黏附、凋亡及细胞骨架重组调控,在细胞信号转导中发挥重要作用。
越来越多的研究表明,激活Rac1/Nox2通路可显著促进DR发生发展,提示调控Rac1/Nox2通路是DR潜在治疗方向。
本文主要阐述了Rac1在DR中的作用,旨在为DR相关研究提供可靠方向。
植物RACK1功能研究
植物RACK1功能研究作者:任啸天 HASHIMI SAID MASOUD来源:《理论与创新》2020年第13期【摘 ;要】在第一個关于烟草BY2细胞中活化C激酶1受体(RACK1)的植物同源物报道之后的二十年后,在阐明其细胞和分子作用方面已经取得了重大进展。
目前的研究发现该蛋白质与许多生物学功能有关,包括蛋白质翻译,多种激素反应发育过程,病原体引起的免疫反应,以及环境应激反应,这样的多种功能作用与它的支架结构相一致,尽管RACK1保持保守的蛋白激酶C结合位点,但缺乏真正的结合活化蛋白激酶C的能力会增加在植物中与RACK1相互作用配体的性质的复杂性和谜团。
【关键词】RACK1;植物激素;植物先天免疫反应;胁迫反应RACK1全称为活化C激酶受体1是一种由WD-40重复序列组成的支架蛋白,分子量约为36KDa,并且含有七个WD-40重复序列的蛋白质可以组装成七叶的β螺旋桨状结构,并且WD-40重复序列在迄今已表征的所有RACK1同源物中均高度保守,表明它们均具有相同的结构。
最开始在小鼠中发现,由于其可以结合活化蛋白激酶C而被命名。
之后在烟草BY2细胞中也鉴定分离出植物的第一个RACK1蛋白,截至目前,已经报道植物中有100多种蛋白质与之相互作用,表明其参与了多种生理功能。
植物的第一个RACK1 同源序列在烟草BY2细胞中发现,其表达受植物内源的调节,该研究表明在烟草中RACK1的表达仅受到生长素的调控,不受细胞分裂素,脱落酸以及乙烯的影响。
其他研究也表明RACK1在激素信号通路中起作用,在水稻中,生长素,茉莉酸以及脱落酸可以诱导RACK1的表达。
在玉米中,将生长中的幼苗进行脱落酸处理,同时也将茉莉酸喷洒到生长中植物的叶片上。
都诱导了RAC1表达,并且两种激素处理之间存在差异。
这些结果都表明了在不同的物种之间,RACK1都参与了内源激素信号通路。
RACK1参与植物先天免疫反应,在水稻中RACK1通过形成免疫复合物的形式参与植物先天免疫,RACK1与Rac1,RAR1,SGT1和Rboh结合形成免疫复合物参与水稻免疫反应,并且可以诱导活性氧的产生抵御病原菌。
crif1基因 -回复
crif1基因-回复基因是生物体内部的基本遗传单位,控制着生物的生长发育以及功能表达。
在这篇文章中,我们将着重介绍一个特定基因——crif1基因,包括其功能、作用机制以及与疾病的关系。
1. CRIF1基因概述CRIF1基因是人类基因组中的一个基因,它位于染色体19号染色体上。
CRIF1 (CR6-interacting factor 1) 又称为TRAM1 (Translocation associated membrane protein 1),是编码一种蛋白质的基因。
CRIF1基因产生的CRIF1蛋白质在细胞核和线粒体中都有表达。
2. CRIF1基因的功能CRIF1蛋白质在细胞中的主要功能是调节线粒体的生物合成和清除。
线粒体是细胞内的“动力站”,负责生成细胞所需的能量。
CRIF1蛋白质通过调控线粒体内核糖体的活性和组装来影响线粒体的生物合成。
此外,CRIF1还参与线粒体的质量控制,促进受损线粒体的自噬和分解。
3. CRIF1基因的作用机制CRIF1蛋白质通过与线粒体RNA结合形成复合物,调节线粒体RNA 表达。
在这一过程中,CRIF1通过与线粒体核糖体RNA结合,促进线粒体核糖体的形成和活性。
此外,CRIF1还通过与线粒体RNA结合,调控线粒体内蛋白质的合成和折叠,维持线粒体的正常功能。
4. CRIF1基因与疾病的关系最近的研究发现,CRIF1基因与多种疾病的发生发展密切相关。
例如,CRIF1基因突变可以导致线粒体合成功能的损害,从而引起代谢性疾病,如肥胖、2型糖尿病等。
此外,CRIF1基因的异常表达也与癌症的发生有关,其过度表达与肿瘤细胞的生长、侵袭和耐药性有关。
一些研究还发现,CRIF1基因与神经退行性疾病如阿尔茨海默病和帕金森病等的发生也存在关联。
CRIF1蛋白质在神经细胞中的异常表达与神经元死亡和突触功能损失有关。
5. 研究和治疗的进展对于CRIF1基因的研究正在不断深入,以便更好地理解其在细胞生物学和疾病发生中的作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Rac1调控线粒体生物功能减轻氧糖剥夺神经元的损伤
来自中南大学湘雅医院叶治团队的最新研究阐明了miRNA-142-3p调控缺血性脑损伤后线粒体生物学以及线粒体功能以及Rac1与miRNA-142-3p相互作用的分子机制,其为临床缺血性脑损伤的治疗提供新的靶点和理论依据。
脑卒中已成为中国首要的死亡原因,也是中国成年人残疾的首要原因。
国内每年新发脑卒中患者约195万,且每年约150万人因脑卒中而死亡。
脑卒中包括缺血性和出血性卒中,其中缺血性卒中的发病率高于出血性卒中,占脑卒中总数的60%-70%。
脑卒中正严重威胁着人们的生命以及生存质量,而如何有效预防、减轻和治疗脑卒中成为目前医学研究的重点和难点之一。
活性氧所致的氧化应激反应是引起脑损伤的一个重要原因。
Rac1是Rho家族G蛋白的成员之一,在缺血缺氧损伤可促进细胞浆内Rac1向胞膜移动,并结合NADPH氧化酶的组件p47 PHOX,使Rac1活化及NADPH氧化酶活性增强,产生大量活性氧。
由于Rac1含有与GTP或GDP结合的高亲和力位点,能在有活性GTP结合形式和无活性GDP结合形式之间循环,从而其可作为“分子开关”特异性调控NADPH氧化酶,刺激内源性活性氧产生,参与细胞毒性改变。
因而Rac l蛋白被认为是NADPH 氧化酶的生物调控开关,是脑缺血再灌注损伤过程中关键因子。
微小RNA (miRNA)是一类长19-24个核苷酸的非编码RNA,并不能编码蛋白。
微小RNA可与靶点mRNA结合,抑制蛋白的翻译。
叶治等的既往研究已证实,稳定存在于哺乳动物血清和血浆中的微小RNA是由组织和细胞主动分泌的,可作为疾病的新型生物标记物,并可起到细胞内分子信号传递的作用。
而miRNA-142-3p可通过负调控Rac1的活性,参与肿瘤的发生发展以及心肌缺血性损伤,但其是否也参与脑缺血再灌注损伤,目前尚无报道。
叶治等利用原代皮质神经元氧糖剥夺模型体外模拟脑缺血再灌注损伤,发现氧糖剥夺损伤可以下调miRNA-142-3p的表达。
激活miRNA-142-3p不仅能提高神经元对氧糖剥夺损伤的抵抗力,而且能够有效的促进线粒体生物功能相关蛋白,如线粒体转录因子A、过氧化物酶体增殖物激活受体γ辅激活子1α和核呼吸因子1的表达。
此外,激活miRNA-142-3p还能通过减少神经元凋亡及线粒体活性氧的生成,稳定线粒体膜电位,增加线粒体DNA的含量,保留线粒体呼吸链复合物以及抑制NOX2的激活等方式显著改善线粒体功能。
最后,使用生物信息学技术确认了Rac1是miRNA-142-3p的作用靶点,miRNA-142-3p可通过负调控Rac1的表达,发挥有效的神经保护作用。
这项成果撰写的文章发表在《中国神经再生研究(英文版)》杂志2020年10期。
文章摘要:最近的研究表明,微小RNA可能在脑缺血再灌注损伤中作为神经保护因子。
既往研究发现miRNA-142-3p可通过负调控Rac1的活性,参与肿瘤的发生发展以及心肌缺血性损伤,但其是否
也参与脑缺血再灌注损伤,目前尚无报道。
因此,实验建立原代皮质神经元氧糖剥夺模型体外模拟脑缺血再灌注损伤,转染mimir-142-3p agomir或miR-142-3p antagomir。
发现氧糖剥夺后,(1)神经元中miR-142-3p表达下调。
而mimir-142-3p agomir可使miR-142-3p过表达,并促进氧糖剥夺细胞死亡和凋亡,并促进线粒体生物功能相关蛋白线粒体转录因子A、过氧化物酶体增殖物激活受体γ辅激活子1α和核呼吸因子1的表达,而miR-142-3p antagomir则会产生相反的作用;(2)通过荧光素酶报告基因实验可证实,Rac1是miR-142-3p的潜在靶向基因。
过表达的miR-142-3p可抑制NOX2活性,并抑制Rac1和Rac1-GTPase的表达;(3)拮抗miR-142-3p可增强上述作用;(4)结果说明,miR-142-3p下调Rac1表达和激活,调控线粒体生物发生和功能,抑制氧糖剥夺损伤,从而发挥了神经保护作用。
实验于2017年3月7日经中南大学动物伦理委员会批准(No. 201703346)。
文章关键词:脑缺血再灌注损伤;氧糖剥夺;miR-142-3p;Rac1;线粒体;生物发生;神经保护;微小RNA;NOX2
文章来源:Xia PP, Zhang F, Chen C, Wang ZH, Wang N, Li LY, Guo QL, Ye Z (2020) Rac1 relieves neuronal injury induced by oxygen-glucose deprivation and re-oxygenation via regulation of mitochondrial biogenesis and function. Neural Regen Res 15(10):1937-1946.
doi:10.4103/1673-5374.280325。
