食品中的氨基酸、多肽及蛋白类物质的理化性质及应用
氨基酸和多肽在生活中的应用

氨基酸和多肽在生活中的应用一·食品氨基酸:氨基酸含量比较丰富的食物有鱼类,豆类及豆制品。
氨基酸可以用作食品添加剂来提高食物的营养价值;如红牛饮料中含有赖氨酸添加剂;可用于调味,谷氨酸具有鲜味,其钠盐就是味精。
多肽:在普通的面包制作基础上添加一定数量的功能肽,可提高其营养价值并有防止面包老化(功能肽具有保湿性);可作为乳蛋白的替代品,制成特殊的婴幼儿食品,能有效地减轻或消除儿童对乳蛋白的过敏反应,来促进宝宝的生长发育;还可作为调味剂,如阿巴斯甜,是一种低热量的食用调味剂。
二·保健品氨基酸:如脑白金,瑞年氨基酸等中老年保健品,其中一些氨基酸,如精氨酸、色氨酸、苯丙氨酸等具有缓解压力,避免沮丧及焦虑等状态的作用,有提高精力的作用。
多肽:白蛋白多肽(AP)从卵清蛋白中分离提取的一组低聚肽。
它具有调整人体免疫功能、提高血清蛋白含量、改善微循环,进而增强体质、提高防病能力的作用;大豆多肽是从大豆蛋白中分离出来的活性多肽,它具有降低胆固醇在体内重吸收,减少甘油三酯在体内合成,促进脂肪代谢等功能;由于食用多肽具有易被吸收利用的特点,所以,当体内因消耗过多的营养物质,致使体内出现内环境失调,各系统功能处于低效状态,感到疲劳,服用多肽就能迅速地使体内所缺乏的活性物质和营养得到补充,从而达到消除疲劳的目的。
三·药品氨基酸:精氨酸注射液可用于肝昏迷的急救药,可由明胶水解并精制而成;甘氨酸与重氮化合物作用制成的一系列抗癌药物对胃癌等有显著功效;谷氨酸、天门冬氨酸、胱氨酸、L-多巴等氨基酸单独作用治疗一些疾病,主要用于治疗消化道疾病、脑病、心血管病、呼吸道疾病以及用于提高肌肉活力、儿科营养和解毒等。
多肽:多肽吸收快速,所以人们把多肽原料中间体作为药品和食品配方的原因,其目的是要加强药效,增强吸收率,可将平常人所食的营养物质,特别是钙等对人体有益的微量元素,吸附、粘贴、装载在本体上;多肽被人体吸收后,可在人体中起信使作用,它作为神经递质传递信息,指挥神经,发挥自身作用,维护人体神经的团队精神和整体效应。
氨基酸多肽蛋白质之间的关系

氨基酸多肽蛋白质之间的关系
氨基酸是生物体内的基本组成单位,而多肽和蛋白质都是由多个氨基酸连接而成的。
因此,多肽和蛋白质是氨基酸的衍生物。
多肽是由少于50个氨基酸连接而成的分子,而蛋白质则是由至少50个氨基酸连接而成的复杂分子。
多肽和蛋白质的结构和功能不同,但它们都是由氨基酸链共价连接而成的。
多肽和蛋白质的结构和功能受到氨基酸序列的影响。
不同的氨基酸序列会导致不同的二级、三级和四级结构,从而产生不同的功能。
因此,氨基酸序列是多肽和蛋白质的关键。
在生物体内,多肽和蛋白质参与许多生物学过程,如代谢、免疫、信号传递、结构支持等。
多肽和蛋白质的功能与它们的结构密切相关,因此氨基酸序列对于多肽和蛋白质的功能具有至关重要的作用。
总之,氨基酸是多肽和蛋白质的基本组成单位,其序列决定多肽和蛋白质的结构和功能。
多肽和蛋白质是生物体中重要的分子,参与许多生物学过程。
高中有机化学教案 氨基酸和蛋白质
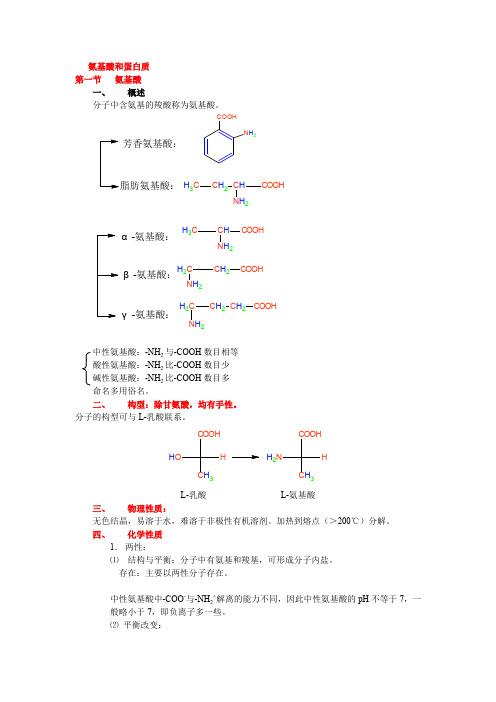
氨基酸和蛋白质第一节 氨基酸一、 概述分子中含氨基的羧酸称为氨基酸。
芳香氨基酸:COOHN H 2C H 3C H 2C HCOOHN H 2α-氨基酸:β-氨基酸:γ-氨基酸:C H 3C H COOHN H 2CH 2C H 2COOH N H 2CH 2C H 2C H 2COOH N H 2中性氨基酸:-NH 2与-COOH 数目相等酸性氨基酸:-NH 2比-COOH 数目少碱性氨基酸:-NH 2比-COOH 数目多命名多用俗名。
二、 构型:除甘氨酸,均有手性。
分子的构型可与L-乳酸联系。
H OH COOHC H 3H N H 2COOH C H 3L-乳酸 L-氨基酸三、 物理性质:无色结晶,易溶于水,难溶于非极性有机溶剂。
加热到熔点(>200℃)分解。
四、化学性质1. 两性:⑴ 结构与平衡:分子中有氨基和羧基,可形成分子内盐。
存在:主要以两性分子存在。
中性氨基酸中-COO -与-NH 2+解离的能力不同,因此中性氨基酸的pH 不等于7,一般略小于7,即负离子多一些。
⑵ 平衡改变:加入酸,平衡左移,正离子增加。
加入碱,平衡右移,负离子增加。
⑶等电点:当正离子数目等于负离子数目时的pH值。
用pI表示。
酸性氨基酸:pI<7,即pH<7,碱性氨基酸:pI>7 ,即pH>7中性氨基酸:pI<7,即pH<7⑷电场下的离子的迁移:①强酸性溶液中,主要以正离子存在,向阴极移动。
②强碱性溶液中,主要以负离子存在,向阳极移动,③等电点时,负离子向阳极移动,正离子向阴极移动。
2.与亚硝酸反应用于定量分析中测定分子中的氨基的含量。
称为范斯莱克(V an Slyke)氨基测定法3.与甲醛作用用于封闭氨基,滴定羧基。
4.络合作用N、O可与金属离子配位5.受热分解:同羟基酸类似①α-氨基酸②β-氨基酸③γ、δ-氨基酸④δ以上氨基酸6.与茚三酮反应:α-氨基酸的性质,现象:加热后,可生成蓝紫色物质。
7.失羧作用:小心加热,可以失去CO2得到胺第二节多肽一、肽:分子间氨基与羧基失水,以酰胺键相连,形成的化合物。
二十二章节氨基酸多肽蛋白质和核酸

4〕与甲醛的反响:
〔2〕羧基的反响 1〕酸性
2〕酯化反响
3〕脱羧反响
〔3〕氨基、羧基共同参与的反响
1〕与水合茚三酮反响〔可用来鉴别α– 氨基酸〕: α-氨基酸可以和水合茚三酮发生呈紫色的反响:
O
OH O
+RCH O C H
OH
O
N2H
水合茚三酮
OO N
O OH
兰紫色
2) 成肽反响
第二十二章 氨基酸、多肽、蛋白质和核酸
(Amino acids、proteins and nucleic acids)
第二十二章
氨基酸、多肽、蛋白质和核酸 (Amino acids、proteins and nucleic acids)
一. 氨基酸的构造和命名 二. 氨基酸的性质 三. α – 氨基酸的合成 四. 多 肽 五. 核 酸
2.α-氨基酸的构型: 组成蛋白质的氨基酸的α-C均为手性碳,因此都具有
旋光性,且以L-型为主。
α-C为决定构型的碳原子:
3. 命名:由来源、性质命名。
氨基酸构型习惯用D、L标记,主要看α– 位手性碳, NH2 在右为D – 型, NH2在左为L – 型。
COOH
H 2N
H
CH3
L – 丙氨酸
自然界存在的氨基酸一般都是α– 氨基酸,而且是L–型。
O
O
RCH O C+ HCl RCH O CH Cl
N3H
N3H
O
O
RCH O C+NaOHRCH O C N+a
N3H
N2H
O R CHC O
NH2
OH H+
O R CHC O
蛋白质、多肽、氨基酸概述及分类重点 PPT

❖ 咪唑环形成质子传递体系
亲核试剂:给出电子
(3)Neutral Amino Acids中性氨基酸
❖ 中性氨基酸侧链不提供也不接受质子
❖ (1) Glysine甘氨酸 最简单、没有光学活性的氨基
酸
❖ (abbreviation:Gly)
❖ 显然与这种氨基酸相关的化学反应比较少,在生物学 上的意义主要是作为结构成份,大量的结构蛋白质如: 胶原和丝素中含有大量的甘氨酸。
CO2H H2N C H
R
R的结构
-H -CH3 -CH(CH3)2 -CH2CH(CH3)2 -CH(CH3)CH2CH3
N H
CO2H
-CH2C6H5
CH2
OH
CH2
N H
-CH2OH -CH(OH)CH3 -CH2CO2H -CH2CH2CO2H -CH2CONH2 -CH2CH2CONH2
-CH2SH -CH2CH2SCH3 -CH2CH2CH2CH2NH2 -CH2CH2CH2NHC(=NH)NH2
❖ 亲水性特别好,但第二个羟基(仲羟基)形成氢键能力弱、
HOOC
NH2
CCHH来自OH CH3❖ (3) Cysteine半胱氨酸 ❖ (abbreviation:Cys)
NH2 HOOC C CH2 SH
H
用 sulfur(硫) 取代丝氨酸的氧,较高pH值下能够给出质子 离 解
硫原子是特别好的亲核试剂
❖ α-,β-,γ-,orδ-氨基酸、
❖ γ-aminobutyric acid γ-氨基丁酸 (GABA):
❖ 神经传递素
❖ 2,5-diiodotyrosine 2, 5-二碘酪氨酸 ❖ 甲状腺激素前体
初中化学知识点归纳氨基酸和蛋白质的性质与应用

初中化学知识点归纳氨基酸和蛋白质的性质与应用氨基酸和蛋白质是化学领域中重要的概念和研究对象。
本文将对初中化学中与氨基酸和蛋白质相关的知识点进行归纳和总结,并探讨其性质与应用。
一、氨基酸的概念与分类氨基酸是构成蛋白质的基本单元,由一种或多种氨基酸残基组成。
根据氨基酸的结构和特性,可以将其分为脂肪族氨基酸和芳香族氨基酸两大类。
脂肪族氨基酸是指在分子结构中含有脂肪族侧链的氨基酸,如甘氨酸、丙氨酸等。
芳香族氨基酸则是指包含芳香族环结构的氨基酸,比如苯丙氨酸、酪氨酸等。
二、氨基酸的性质与应用1. 氨基酸的酸碱性氨基酸是同时具有酸性和碱性的物质,其分子中含有一个或多个氨基(-NH2)和一个羧基(-COOH)。
因此,氨基酸可以通过释放或接受质子而表现出酸性或碱性。
2. 氨基酸的缔合作用氨基酸可以通过缔合反应,将两个或多个氨基酸结合到一起形成肽键。
多个氨基酸通过缔合作用形成的化合物被称为肽,而其中氨基酸数目较多的化合物被称为多肽。
3. 氨基酸的生理功能氨基酸在生物体内具有多种重要的生理功能。
例如,氨基酸是蛋白质的组成单元,参与构建和修复生物体的组织结构;氨基酸还可以作为能量的来源,提供细胞代谢所需的能量。
4. 蛋白质的性质与应用蛋白质是由氨基酸长链缔合而成的生物大分子,在生物体内具有多种重要功能。
根据其复杂的结构和功能,蛋白质可以分为结构蛋白、酶、激素等多种类型。
结构蛋白是生物体内构成组织和细胞的重要组成部分,如肌肉纤维中的肌动蛋白;酶是生物体内催化化学反应的催化剂,如消化道中的胃蛋白酶;激素则是调节生物体生理功能的信号分子,如胰岛素。
除了在生物体内发挥重要作用外,蛋白质还具有广泛的应用价值。
在食品工业中,蛋白质常被用作乳化剂、稳定剂和增稠剂等;在医药领域,蛋白质也被用于制造药物和疫苗。
三、氨基酸和蛋白质的实验室检测方法在实验室中,常用的检测氨基酸和蛋白质的方法包括纸层析法、光谱分析法和生物化学分析法等。
纸层析法是一种简单、快速的方法,可用于检测氨基酸和短肽。
氨基酸的分类特点及理化性质

氨基酸的光吸收
3、氨基酸的两性性质和等电点
(1)、氨基酸是兼性离子 质子受体和质子供体。 所谓兼性离子是指在同一分子上带有 能释放质子的正离子基团和能接受质子的负 离子基团。兼性离子本身既是酸又是碱。因 此它既可以和酸反应,也可以和碱反应。 实验证明:氨基酸在水溶液中或在晶 体状态时,都以兼性离子形式存在。
四、多肽
氨基酸是蛋白质的基本组成材料
蛋白质用强酸、强碱处理后,可以得到 各种各样的氨基酸。在动植物组织中可以 分离得到26~30种不同的氨基酸。第一个氨 基酸早在两个世纪前就已经被发现,而最 后一个氨基酸在1935年才发现。直到1965 年才搞清楚,只有20种氨基酸才是合成蛋 白质的原材料(称为Primary amino acid )。
氨基酸的结构
甘氨酸 Glycine
脂肪族氨基酸
O H2N CH C H OH
氨基酸的结构
甘氨酸
丙氨酸
Glycine
Alanine
脂肪族氨基酸
O H2N CH C CH3 OH
氨基酸的结构
甘氨酸
丙氨酸 缬氨酸
Glycine
Alanine Valine
脂肪族氨基酸
O H2N CH C CH CH3 CH3 OH
芳香族氨基酸
苯丙氨酸 Phenylalanine
O H2 N CH C CH2 OH
酪氨酸
Tyrosine 色氨酸 Trytophan
HN
氨基酸的结构
精氨酸 Arginine
碱性氨基酸
O H2 N CH C CH2 CH2 CH2 NH C NH2 NH OH
氨基酸的结构
精氨酸 Arginine
(3)、电泳及等电点
3蛋白质在食品加工中的应用

•蛋白质定量测定;测定蛋白质水解程度。
乙醛酸反应
乙醛酸反应 在蛋白质溶液中加入HCOCOOH,将浓硫酸沿管壁 缓慢加入,不使相混,在液面交界处,即有紫色 环形成。
豆腐生产工艺
点卤
成品
思考
在豆腐制作 过程中哪些环节 考虑了蛋白质的 性质而选择了相 应的工艺参数?
讨论
浸泡大豆时常选用碱液作为 浸泡液,为什么?
得到多肽片段和AA的混合物
氨基酸是蛋白质的基本结构单元
蛋白质的二级结构
螺旋结构
β-折叠股和β-折叠片
二级结构类型 β-发夹和Ω环 回折
三股螺旋
无规卷曲
α-螺旋和β-折叠结构
蛋白质的三级结构
三级结构是指含有二级结构片断的线性蛋白质链进一 步折叠成紧密的三维形式。 静电相互作用 蛋白质结构稳定 氢键
蛋白质脱去水化层而聚集沉淀蛋白质沉淀可逆沉淀不可逆沉淀可逆沉淀中性盐沉淀等电点沉淀重金属沉淀生物碱试剂沉淀有机溶剂沉淀脱去水化层以及降低介电常数而增加带电质点间的相互作用脱去水化层以及降低介电常数而增加带电质点间的相互作用有机溶剂沉淀等电点沉淀重金属盐沉淀与带负电荷蛋白质结成不溶性盐生物碱试剂和某些酸类沉淀与带正电荷蛋白质生成不溶性盐加热变性沉淀天然结构解体疏水基外露破坏水化层及带电状态天然结构解体疏水基外露破坏水化层及带电状态蛋白质的乳化性质与起泡性质蛋白质是两性分子能在水气界面和油水界面形成高黏弹性薄膜而且比蛋白质是两性分子能在水气界面和油水界面形成高黏弹性薄膜而且比牛奶蛋黄奶油色拉酱牛奶蛋黄奶油色拉酱等乳状液类产低分子表面活性剂所稳定的泡沫和乳状液更稳定
分子形式 两性离子
H2N——P——COO碱性条件下,pH>pI
+H
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
食品中的氨基酸、多肽及蛋白类物质主要内容1概述2蛋白质的理化性质3蛋白质的食品加工学特性4食品中常见的蛋白质1概述1.1氨基酸基本的理化性质一、基本物理学性质包括基本组成和结构、溶解性、酸碱性质、立体化学、熔点、沸点、光学行为、旋光性、疏水性等。
(一)溶解性质根据氨基酸侧链与水相互作用的程度可将氨基酸分作几类。
含有脂肪族和芳香族侧链的氨基酸,如Ala、Ile、Leu、Met、Pro、Val及Phe、Tyr,由于侧链的疏水性,这些氨基酸在水中的溶解度均较小;侧链带有电荷或极性集团的氨基酸,如Arg、Asp、Glu、His、Lys和Ser、Thr、Asn在水中均有比较大的溶解度;但根据电荷及极性分析也有一些例外,如脯氨酸属于带疏水基团的氨基酸,但在水中却有异常高的溶解度。
(二)氨基酸的疏水性氨基酸的疏水性,是影响氨基酸溶解行为的重要因素,也是影响蛋白质和肽的物理化学性质(如结构、溶解度、结合脂肪的能力等)的重要因素。
按照物理化学的原理,疏水性可被定义为:在相同的条件下,一种溶于水中的溶质的自由能与溶于有机溶剂的相同溶质的自由能相比所超过的数值。
估计氨基酸侧链的相对疏水性的最直接、最简单的方法就是实验测定氨基酸溶于水和溶于一种有机溶剂的自由能变化。
一般用水和乙醇之间自由能变化表示氨基酸侧链的疏水性,将此变化值标作△G′。
(三)氨基酸的光学性质氨基酸中的苯丙氨酸、酪氨酸、色氨酸分子中由于有共轭体系,因此可以吸收近紫外光。
它们的最大吸收波长(λmax)分别为260nm、275nm、278nm;在吸收最大波长光线的时候还会发出荧光。
二、基本化学性质关于氨基酸基本的化学性质,在生物化学中已经进行了介绍。
下面再根据Owen R. Fennema, Food Chemistry, 作简要系统介绍;其主要的线索还是氨基酸分子中所带的官能团。
三、重要的分析鉴定反应(一)与茚三酮的反应(略)(二)与邻苯二甲醛的反应:在2-巯基乙醇的存在下,氨基酸与邻苯二甲醛反应生成高荧光的衍生物,在380nm激发时,在450nm 具有最高荧光发射,用来定量分析氨基酸、肽和蛋白质。
(三)与荧光胺的反应含有伯胺基的氨基酸、肽或蛋白质与荧光胺反应生成高荧光的衍生物,在390nm时,在475nm具有最高的荧光发射。
此法可被用于氨基酸、肽或蛋白的定量分析。
1.2肽类物质1.2.1活性肽的种类及功能生物活性肽也称作功能肽,是近年来非常活跃的研究领域,其应用涉及到生物学、医药学、化学等多种学科,在食品科学研究及功能食品开发中也显示出美好的前景。
功能肽按照获得途径的差异可以分作两种类型,一类是由生物体特别是动物体内获得的天然功能肽;另一类是利用动植物蛋白,通过水解或酶解,再经过活性筛选而获得的外源性功能肽。
一、天然活性肽目前,由自然界已经获得了种类多样、功能各异的生物活性肽,下页列举了一些这方面的例证。
昆虫抗菌肽:迄今为止,已有150多种昆虫抗菌肽被分离鉴定,许多抗菌肽的cDNA已被克隆测序并进行了初步的基因定位和表达调控机制研究。
昆虫抗菌肽已成为当前研究的热点,某些抗菌肽正在通过基因工程技术开始工业化生产并用于农业、工业和食品卫生等多个领域。
昆虫抗菌肽是一类碱性多肽,具有分子量小、水溶性好、热稳定性强、无免疫原性,不易被水解等特性;同时还具有强而广谱的抗菌、抗癌、抗病毒的能力,对高等动物机体的正常细胞无损伤。
根据氨基酸组成和结构特征,可把昆虫抗菌肽分为4类:形成两性分子α-螺旋的抗菌肽类;有分子内二硫桥的抗菌肽类;富含甘氨酸的抗菌肽类和富含脯氨酸的抗菌肽类。
关于抗菌肽的作用机理,现在人们比较一致的看法是,不同的抗菌肽在其杀菌方式上可能存在一些差异。
有的通过在细菌膜上形成孔道,造成细胞内物质泄漏进而导致化学势丧失而达到杀菌的效果;有的能够干扰一定类型的外膜蛋白基因的转录,使相应蛋白的合成量减少,从而导致细胞膜的通透性增加,使细菌生长受到抑制。
有些还可能抑制细菌细胞壁的形成,使细菌不能维持正常的细胞形态而生长受阻,等等。
感染性疾病曾一度是人类生存所面临的最大威胁。
随着抗生素的发明和广泛使用,感染性疾病得到了一定程度的控制,但仍然是人类死亡的一个重要原因。
据WHO报告,2000年全球死亡人数5570万,其中1440万由感染性疾病引起,占总死亡人数的15.9%。
过去的几十年里,耐药性微生物的不断产生和生物耐药性问题的日益恶化,开发新的抗感染药物已成为治疗感染疾病的必由之路。
昆虫抗菌肽因其独特的抗菌、杀菌效果和良好的应用前景近来成为抗感染新药开发的热点。
目前国外在抗菌肽临床应用方面进展较快,在流行性脑脊髓炎、人幽门螺旋杆菌感染及抗真菌感染等方面的应用已经进入临床试验阶段。
二、外源性活性肽以天然蛋白作为原料通过水解或酶解的方法,获得大量的肽类,从中筛选活性肽,目前已成为扩大功能肽研究范围、发现新型多肽的有效途径。
当然化学合成也为功能肽的获得提供了有效的途径,但化学合成往往需要一定的活性结构做模型。
目前已有实际应用的外源性功能肽的制备方法有化学水解法、酶水解法、合成法等。
化学水解法是以天然蛋白质为原料,在酸或碱的催化下进行水解而获得多肽。
一般用6~10mol/L盐酸或4mol/L硫酸在100~120℃条件下水解12~24h;也可用6mol/LNaOH或2mol/L的Ba(OH)2水解6h左右;然后经活性炭脱色,再通过701型树脂除去酸和盐便可获得混合多肽。
此法工艺虽然简单但难以控制水解程度,容易将肽链继续水解为氨基酸,并且水解过程中氨基酸的结构容易受到影响而发生构型甚至构造上的变化,影响肽的结构和功能。
此种影响在碱性条件下表现的尤为突出。
利用酶解的方法由天然蛋白制备功能肽是目前常采用的方法。
此方法的一般工艺流程为:原料蛋白→预处理→酶解→灭酶→脱苦味脱色→分离→干燥→成品。
酶种类和水解条件的选择是制备功能肽的关键。
目前可以使用的酶种类较多,如胰蛋白酶、胃蛋白酶、碱性蛋白酶等动物蛋白酶及菠萝蛋白酶、木瓜蛋白酶等植物蛋白酶,而比较便宜易得的还有不同种类的微生物蛋白酶。
到底选择何种,可根据酶的水解特性、原料蛋白的来源及欲得到的功能多肽类型来综合考虑决定。
三、活性肽在食品中的应用营养学研究证明,功能肽类在人体内的消化吸收明显优于蛋白质和单个氨基酸,对人体内蛋白质的合成无任何不良影响,而且具有促进钙吸收、降血压、提高免疫力等生理功能。
此外,功能肽具有良好的水合性,使其溶解度增加,黏度降低、胶凝程度减小,发泡性丧失,具有优良的加工性能。
目前在食品中已经应用或出现了应用苗头的功能肽主要有以下种类。
1.2.2肽的理化性质一、肽的物理性质A、肽的两性:与氨基酸相似,肽类物质也具有两性和等电点。
例如Gly-Asp pI3.63;Gly-Gly-Gly pI5.58;利用多肽的等电点,可以进行肽类物质的分离。
B、黏度与溶解度天然蛋白的水溶液当其浓度超过13%时就会形成凝胶,不利于蛋白溶液的制备;而多肽即使在50%的高浓度下和在较宽的pH范围内仍能保持溶解状态,同时还具有较强的吸湿性和保湿性,这使无法实现的高蛋白饮料和高蛋白果冻的生产成为可能。
C、渗透压和对产品质构的调节作用当一种液体的渗透压比体液高时,易使人体周边组织细胞中的水分向胃肠移动而出现腹泻。
多肽溶液的渗透压比氨基酸溶液要低,因此可以克服因氨基酸溶液渗透压高而导致的问题。
多肽具有抑制蛋白质形成凝胶的性能,可利用此性质来调整食品的质构。
如水产、肉、禽蛋白在加热时因形成凝胶而变硬,适量加入大豆多肽,就会起到软化的作用。
二、化学性质肽类物质基本的化学性质和氨基酸基本的化学性质相同,都是由其特征性官能团决定的。
但肽和蛋白可以发生双缩脲反应而氨基酸则不能。
2蛋白质与食品相关的理化性质2.1与食品相关的物理性质2.1.1蛋白质的变性作用一、蛋白质变性的概念及监测方法A、定义:把蛋白质二级及其以上的高级结构在一定条件(加热、酸、碱、有机溶剂、重金属离子等)下遭到破坏而一级结构并未发生变化的过程叫蛋白质的变性。
B、蛋白质变性所产生的影响:①溶解度降低,原因是二级结构发生变化,疏水基团暴露于分子表面;②与水的结合能力降低;③生物活性(功能)丧失;④容易被水解;⑤黏度变大;⑥难以结晶。
C、根据一系列物理性质、光学性质、生物功能等的改变来监测蛋白质的变性。
如超离心沉降特性、黏度、溶解度、电泳特性、旋光色散、圆二色性、X射线衍射、紫外差示光谱、红外光谱、热力学性质、免疫性质等。
/web/Info_Show.asp?ArticleID=239二、蛋白质变性的热力学和动力学与其它化学反应的活化能相比,蛋白质变性的Ea是比较大的,例如胰蛋白酶、卵清蛋白酶和过氧化物酶热变性的活化能分别为167、552、773 kJ/mol。
由于变性涉及的键能小,而且相差不大,只要在低的温度或小的变性剂浓度就可以发生变性。
上边以两状态转变模型对蛋白变性的热力学、动力学特点进行了讨论。
但实际情况远非这么简单,详细考虑,蛋白质从天然状态向变性状态的转变是一个非常复杂的过程,中间存在着非常多的中间状态。
三、影响蛋白变性的因素(一)物理因素A.加热加热变性的基本过程:当蛋白质溶液被逐渐的加热并超过临界温度时,溶液中的蛋白质将发生从天然状态向变性状态的剧烈转变。
此转变温度被称作熔化温度(Tm)或变性温度(Td),此时蛋白质的天然状态和变性状态的浓度之比为1。
蛋白热变性的一般规律:大多数蛋白质在45~50℃时开始变性,但也有些蛋白的Td可以达到相当高的温度,如大豆球蛋白93℃、燕麦球蛋白108℃等。
当加热温度在临界温度以上时,每提高10℃,变性速度提高600倍。
加热使蛋白变性的本质:提高温度对天然蛋白质最重要的影响是促使它们的高级结构发生变化,这些变化在什么温度出现和变化到怎样的程度是由蛋白质的热稳定性决定的。
一个特定蛋白质的热稳定性又由许多因素所决定,这些因素包括氨基酸的组成、蛋白质-蛋白质接触、金属离子及其它辅基的结合、分子内的相互作用、蛋白浓度、水分活度、pH、离子强度和离子种类等等。
变性作用使疏水基团暴露并使伸展的蛋白质分子发生聚集,伴随出现蛋白质溶解度降低和吸水能力增强。
B.冷冻蛋白质可以发生冻结变性。
其原因一方面是由于蛋白质周围的水与其结合状态发生变化,这种变化破坏了一些维持蛋白原构象的力,同时由于水保护层的破坏,蛋白质的一些基团就可以发生直接的接触和相互作用,导致蛋白质发生聚集或原来的亚基发生重排。
另一方面,由于大量水形成冰后,剩余的水中无机盐浓度大大提高,这种局部的高浓度盐也会使蛋白质发生变性。
C.流体静压压力也可使蛋白变性,但一般在25℃下要求100~1200MPa 的比较高的压力。
压力诱导蛋白质变性的原因主要是蛋白质的柔性和可压缩性。
