酶-3
酶的三个曲线

酶的三个曲线
酶促反应时间进程曲线可以分为三个阶段,分别为:
1. 延滞期:在酶促反应开始时,反应速率较慢,随着反应的进行,酶与底物逐渐结合,反应速率逐渐加快。
这一阶段的主要特点是反应速率与时间呈线性关系。
2. 线性期:在这个阶段,反应速率与时间的关系呈线性增长,酶与底物的结合达到饱和,反应速率不再随时间线性增加。
此时,反应速率取决于酶的活性和底物的浓度。
3. 偏离线性期:随着反应的进行,底物逐渐减少,反应速率也开始下降。
此时,反应速率与时间的关系呈非线性特征,受到酶活性、底物浓度以及产物浓度的影响。
这三个阶段反映了酶促反应在不同时间范围内的特征,有助于我们了解酶反应的动力学和酶的调控机制。
在实际应用中,通过研究酶促反应的时间进程曲线,可以优化反应条件,提高酶的活性和反应效率。
酶工程1-3影响酶催化作用的因素详解

四点假设: ①、②、③ 同“快速平衡法”; ④中间复合体[ES]在一开始浓度增高后,可在相当一段 时间内保持浓度的恒定;在这段时间里,[ES]的生成速度 和[ES]消失(包括分解成 E+S 和 E+P)的速度相等,达 到动态的平衡,即“拟稳态”。
c[ES]不随时间而变化
dc[ES ] dt
k1cE cS
k1c[ES ]
k2c[ES ]
0
c
cE0 cE c[ES ]
vP
dcP dt
k2c[ES ]
cS c[ ES ]
c[ E ]
拟稳态
cp t
vP
k2cE0 cs Km cs
vP ,max cs Km cs
Km
k1 k2 k1
为米氏常数(mol/L)
Km
Ks
k2 k1
当k+2远小于k-1时,Km=Ks
每一种酶的催化反应都有其最适宜的温度范围及最 适温度。
添加酶的作用底物或者某些稳定剂可以适当提高酶 的热稳定性。
4、pH值的影响
在不同的pH值条件下,酶分子和底物分子中的基 团的解离状态发生改变,从而影响酶分子的构象以 及酶与底物的结合能力和催化能力。 在极端的pH值条件下,酶分子的空间结构发生改 变,从而引起酶的变性失活。 每种酶都有其各自的适宜pH值范围和最适pH值。
k1cEcS k1c[ES ]
cE0 cE c[ES ]源自vPdcP dtk2c[ES ]
vP
k2cE0 cs Ks cs
vP ,max cs Ks cs
Ks
k 1 k 1
为解离常数(mol/L)
M-M 方程的修正
1925年,Brigg 和 Haldane 认为:许多酶有很大的催化 能力,当[ES]形成后,即迅速转化成产物P而释放出酶, 即当k+2>k-1时,M-M 方程不成立。
生物化学 第3章 酶

生物化学第3章酶生物化学第3章酶第3章酶自学建议1.掌握酶及所有相关的概念、酶的结构与功能的关系、酶的工作原理、酶促反应动力学特点、意义及应用。
2.熟识酶的分子共同组成与酶的调节。
3.了解酶的分类与命名及酶与医学的关系。
基本知识点酶是对其特异底物起高效催化作用的蛋白质。
单纯酶是仅由氨基酸残基组成的蛋白质,融合酶除所含蛋白质部分外,还所含非蛋白质辅助因子。
辅助因子就是金属离子或小分子有机化合物,后者称作辅酶,其中与酶蛋白共价紧密结合的辅酶又称辅基。
酶分子中一些在一级结构上可能相距很远的必需基团,在空间结构上彼此靠近,组成具有特定空间结构的区域,能与底物特异结合并将底物转化为产物,这一区域称为酶的活性中心。
同工酶就是指催化剂相同化学反应,酶蛋白的分子结构、化学性质乃至免疫学性质相同的一组酶,就是由相同基因编码的多肽链,或同一基因mRNA分解成的相同mrna所译者的相同多肽链共同组成的蛋白质。
酶促反应具有高效率、高度特异性和可调节性。
酶与底物诱导契合形成酶-底物复合物,通过邻近效应、定向排列、表面效应使底物容易转变成过渡态。
酶通过多元催化发挥高效催化作用。
酶促反应动力学研究影响酶促反应速率及其影响因素,后者包括底物浓度、酶浓度、温度、ph、抑制剂和激活剂等。
底物浓度对反应速率的影响可用米氏方程表示。
v?vmax[s]km?[s]其中,km为米氏常数,其值等同于反应速率为最小反应速率一半时的底物浓度,具备关键意义。
vmax和km需用米氏方程的双倒数作图去求得。
酶在拉沙泰格赖厄县ph和拉沙泰格赖厄县温度时催化活性最低,但拉沙泰格赖厄县ph和拉沙泰格赖厄县温度不是酶的特征性常数,受到许多因素的影响。
酶的抑制作用包含不可逆遏制与对称遏制两种。
对称遏制中,竞争抑制作用的表观km值减小,vmax维持不变;非竞争抑制作用的km值维持不变,vmax增大,反竞争抑制作用的km值与vmax均增大。
在机体内酶活性与含量的调节是代谢调节的重要途径。
dna聚合酶3全酶的组成 -回复

dna聚合酶3全酶的组成-回复DNA聚合酶3(DNA polymerase III)是一个复杂的酶系统,是细胞中主要负责DNA复制的酶。
它在细胞中起着至关重要的作用,确保DNA 的准确复制。
DNA聚合酶3由多个亚基组成,每个亚基承担不同的功能和作用,共同协同完成DNA复制的过程。
DNA聚合酶3是在原核生物中发现的,通过研究细菌E.coli的DNA复制过程,对DNA聚合酶3的结构和功能有了深入的认识。
DNA聚合酶3由10个不同的亚基组成,可以分为两个核心复合物:亚单位(core subunits)和周边亚基(accessory subunits)。
DNA聚合酶3的核心复合物由核心亚基α、ε和θ组成。
其中,核心亚基α是DNA聚合酶的主要催化亚单位,负责合成新的DNA链。
核心亚基α具有双链DNA聚合酶活性和3'-5'外切酶活性,可以在合成DNA链时同时去除错误的核苷酸,提高DNA的复制准确性。
核心亚基α是一个非常大的酶,在DNA链合成过程中与其他亚基产生相互作用,形成一个稳定的复合物。
另外两个核心亚基是ε和θ。
ε亚基具有3'-5'外切酶活性,与α亚基共同协调DNA链合成的过程。
θ亚基则参与DNA聚合酶的可动性和稳定性的调节,有助于保持核心复合物的整体结构和功能。
DNA聚合酶3的周边亚基主要是为核心复合物提供支持和调控。
周边亚基包括τ、γ、δ、χ、ζ和ψ。
其中,τ亚基是一个大型亚基,具有招募DNA 聚合酶核心复合物到复制起始点的功能。
γ亚基在DNA复制过程中发挥结构稳定作用,有助于保持DNA聚合酶的整体稳定性。
δ亚基在DNA链合成过程中起调节作用,有助于维持DNA聚合酶3与DNA的结合。
χ、ζ和ψ亚基的具体功能还不太清楚,需要进一步的研究来揭示。
除了这些核心和周边亚基外,DNA聚合酶3还依赖一些辅助因子来完成DNA复制过程。
这些辅助因子包括DNA催化亚基τ/γ、草酰酶A和DNA 单链结合蛋白。
人胱天蛋白酶-3(caspase-3)说明书活性
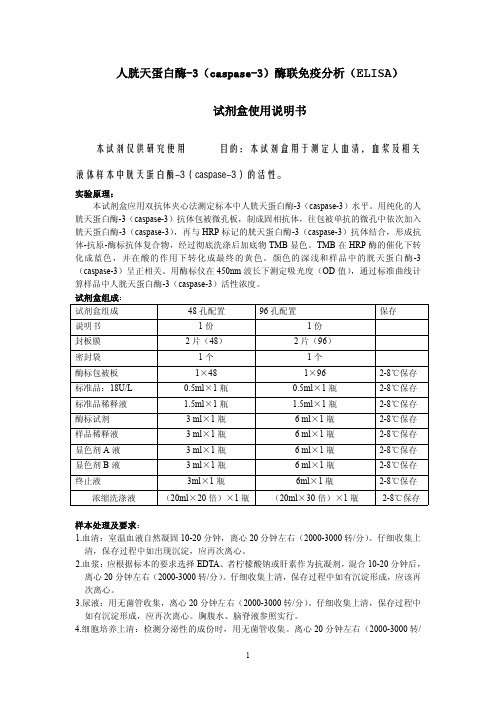
人胱天蛋白酶-3(caspase-3)酶联免疫分析(ELISA)试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测定人血清,血浆及相关液体样本中胱天蛋白酶-3(caspase-3)的活性。
实验原理:本试剂盒应用双抗体夹心法测定标本中人胱天蛋白酶-3(caspase-3)水平。
用纯化的人胱天蛋白酶-3(caspase-3)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入胱天蛋白酶-3(caspase-3),再与HRP标记的胱天蛋白酶-3(caspase-3)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的胱天蛋白酶-3(caspase-3)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中人胱天蛋白酶-3(caspase-3)活性浓度。
试剂盒组成:试剂盒组成48孔配置96孔配置保存说明书1份1份封板膜2片(48)2片(96)密封袋1个1个酶标包被板1×481×962-8℃保存标准品:18U/L0.5ml×1瓶0.5ml×1瓶2-8℃保存标准品稀释液 1.5ml×1瓶 1.5ml×1瓶2-8℃保存酶标试剂3ml×1瓶6ml×1瓶2-8℃保存样品稀释液3ml×1瓶6ml×1瓶2-8℃保存显色剂A液3ml×1瓶6ml×1瓶2-8℃保存显色剂B液3ml×1瓶6ml×1瓶2-8℃保存终止液3ml×1瓶6ml×1瓶2-8℃保存浓缩洗涤液(20ml×20倍)×1瓶(20ml×30倍)×1瓶2-8℃保存样本处理及要求:1.血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
3-酶(1)

母细胞才可以进行发酵。
1897年Būchner兄弟用不含细胞的酵母汁实现了发酵,证明发酵是酶作用
的结果。为此,他们获得了1911年诺贝尔化学奖。
1878年,kūhne将酶命名为“enzyme”,希腊语,意思是“在酵母中”。
1926年,Sumner从刀豆中提取了脲酶,证明脲酶是蛋白质。 上世纪80年代初,Cech和Altman分别发现了具有催化功能的RNA-核酶,
成酶和产物 (product, P) 。
k2 E S ES P E k 1
k1
2015/9/22
17
“张力”、“变形”
E和S的结合,导致S分子中某些化学键的变化,大大降
低了活化能。中间产物学说很好的解释了酶的高效性。
2015/9/22 18
邻近效应和定向效应
概念:一种酶只能作用于一种或一 类结构性质相似的物质。这种酶对
底物的高度选择性叫酶的专一性。
2015/9/22
26
1、绝对专一性:对底物要求严格,只作用一 种底物。如脲酶只作用于尿素而不作用于 其衍生物 。
2015/9/22
27
绝对专一性包括酶的立体异构专一性
旋光异构专一性:旋光异构又称为手性 异构,手性分子不能和它的镜像完全重 叠,能使偏振光的方向发生偏转,即旋 光活性。如L-AA氧化酶只作用于L-AA。 几何异构专一性:几何异构是指在有双 键分子中,由于分子中双键自由旋转受 阻,存在不同的空间排列方式而产生的 立体异构现象,又称顺反异构。如延胡 索酸水化酶只催化反-丁烯二酸及其逆反 应,而不催化顺-丁烯二酸。
契合
可 以很好的解释酶 催化可逆反应。
2015/9/22 33
甘油-3-磷酸氧化酶

甘油-3-磷酸氧化酶
甘油-3-磷酸氧化酶(Glycerol-3-phosphate oxidase)是一种酶,它在生物体的代谢过程中起着重要的作用。
这个酶存在于细胞质中,主要参与脂肪代谢途径中的一部分,被称为甘油磷酸途径。
甘油-3-磷酸氧化酶的主要功能是催化甘油-3-磷酸(一种中间代谢产物)的氧化反应。
在这个反应中,甘油-3-磷酸被转化为二磷酸甘油(一种能量储存分子)。
这个过程涉及到一个电子传递链,其中还涉及到另外两个辅助酶:辅酶Q和辅酶NAD+。
通过这个反应,甘油-3-磷酸氧化酶将电子从甘油-3-磷酸转移到辅酶Q和辅酶NAD+上,同时还释放出一个氧分子。
甘油-3-磷酸氧化酶的这个氧化反应在生物体中扮演着重要的角色。
它参与了三酰甘油合成的过程,这是将脂肪酸和甘油结合形成脂肪分子的关键步骤。
此外,它还参与了脂肪酸的氧化代谢,即将脂肪酸转化为能量的过程。
通过这些代谢途径,甘油-3-磷酸氧化酶帮助维持细胞内的能量平衡,并支持身体正常的能量代谢。
总结一下,甘油-3-磷酸氧化酶是一种参与脂肪代谢的酶,它催化甘油-3-磷酸的氧化反应,将其转化为能量储存分子二磷酸甘油。
这个酶在细胞内的能量代谢过程中起着重要的作用,帮助维持细胞内的能量平
衡。
第四章 酶3 酶的作用机制及活性调节

• b. 修饰剂浓度与酶失活或降低的程度若成正比,则修饰位 于活性中心内
将修饰后的酶水解,肽键打开(但修饰剂与酶结合的共价 键不被打开)→得到带有标签的肽段→用氨基酸测序进行 鉴定
2、研究酶活性部位的方法
2、研究酶活性部位的方法
定点诱变法
• 改变编码蛋白质基因重的DNA顺序→改变氨基酸残基→确 定活性部位 • 如果被代换的氨基酸不影响酶的活性,则该位臵的氨基酸 残基不是必须基团 • 如果被代换的氨基酸使酶活性丧失或降低,则该位臵的原 有氨基酸残基是必须基团
• 1)vmax不变,Km值升高,该位臵氨基酸为结合基团
生
物
化
学
第四章 酶
§4.3 酶的作用机制和酶的调节
• 一、酶的活性部位 • 二、酶催化反应的独特性质 • 三、影响酶催化效率的有关因素
• 四、酶催化反应机制的实例
• 五、酶活性的调节控制
• 六、同工酶
一、酶的活性部位
• 只有少数的氨基酸残基参与底物结合及催化作用
• 酶的活性部位(active site/ active center )——与酶活力直 接相关的区域:分为结合部位(负责与底物的结合→决定酶 的专一性)和催化部位(负责催化底物键的断裂形成新键→ 决定酶的催化能力)
二、酶催化反应的独特性质
• 1、酶反应有两类:其一仅涉及到电子的转移(转换数约 108s-1);其二涉及到电子和质子两者或其他基团的转移 (约103s-1,大部分反应) • 2、酶催化作用是由氨基酸侧链上的功能基团(His、Lys、 Glu、Asp、Ser、Cys)和辅酶为媒介的→比只利用氨基酸 侧链来说,为催化反应提供了更多种类的功能基团 • 3、酶催化反应的最适pH范围通常是狭小的 • 4、与底物分子相比,酶分子很大而活性部位通常只比底物 稍大一些 • 5、存在一个或以上的催化基团及活性部位
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
阳光及紫 外线
维维维D2 维维维D3 维维维D4 维维维D5
人的皮肤含有7—脱氢胆固醇,经过紫 外线激活后转化为维生素D3,称为胆 钙化醇。
的活性形式: ﹡VitD3的活性形式: 1, 25- (OH)2-VitD3
生化作用
促进钙磷吸收,有利于新骨的形成、钙化。 促进钙磷吸收,有利于新骨的形成、钙化。
衍生的辅因子
维生素 B1硫胺 素
焦磷酸硫胺素
TPP
主要参与α 主要参与α酮酸的脱羧
脱羧酶的辅酶
维生素B 维生素 1的功能
主要功能是以辅酶方式参加糖的分解代 谢。硫胺素的衍生物TPP是脱羧酶、丙 酮酸脱氢酶系和α—酮戊二酸脱氢酶系的 辅酶。 缺乏维生素B 1可引起脚气病、神经炎症 等。
维生素B (2)维生素B2与核黄素
维生素 衍生的辅因子 代号 结构 辅因子功能 一碳基团的载体
维生素B 维生素B11 叶酸
四氢叶酸
THF、FH4 、
叶酸: 叶酸:又称为蝶酰谷氨酸
合成酶的辅酶,即传递一碳单位的辅酶,参与一碳单位 如 合成酶的辅酶,即传递一碳单位的辅酶,参与一碳单位(如CH3, -CH2-, -CHO 等)的转移,参与多种生物合成过程 特 的转移 参与多种生物合成过程,特
CH2OH A2
天然的维生素A的 两种形式: A1及 A2 天然的维生素 的 两种形式 及 维生素A只存在于动物性食物中,鱼肝油中含量较多。 维生素 只存在于动物性食物中,鱼肝油中含量较多。 只存在于动物性食物中
生化作用及缺乏症
生化作用
视紫红质的组成成分 *视觉细胞内感受弱光的物质——视紫红质的组成成分 视觉细胞内感受弱光的物质 视紫红质 *参与糖蛋白的合成,维持上皮组织的分化与健全 参与糖蛋白的合成,
CH2NH2
O OH
CH2 O P OH N 磷 磷 磷磷 磷
磷酸吡哆素是转氨酶的辅酶, 磷酸吡哆素是转氨酶的辅酶,
磷酸吡哆醛是氨基酸代谢中的转氨酶及脱羧酶的辅 磷酸吡哆醛是氨基酸代谢中的转氨酶及脱羧酶的辅 是氨基酸代谢中的转氨酶 酶。
生理功能及缺乏症
人类未发现维生素B6缺乏的典型病例。异烟肼能与磷酸 人类未发现维生素B 缺乏的典型病例。 吡哆醛结合 使其失去辅酶的作用,所以在服用异烟肼时, 结合, 吡哆醛结合,使其失去辅酶的作用,所以在服用异烟肼时, 应补充维生素B 应补充维生素B6。
(6)维生素B7 维生素B
维生素 衍生的辅因子 代号 结构 辅因子功能 羧化酶的辅酶ຫໍສະໝຸດ 维生素B 维生素B7 生物素
羧基载体蛋 白的辅基
BCCP的辅基 的辅基
生物素的功能是作为CO2的递体,在生物合成中起 的递体, 生物素的功能是作为 的递体 传递和固定CO2的作用。 的作用。 传递和固定 的作用
维生素B (7).维生素B11
R
(5)维生素B6 维生素B
维生素 衍生的辅因子 代号 结构 辅因子功能
磷酸 吡哆醛 维生素B 维生素B6 吡哆素 磷酸 吡哆胺
PLP
PMP
参与氨基酸的 转氨、 转氨、脱羧和 消旋, 消旋,是氨基 的载体
磷酸吡哆醛和磷酸吡哆胺
CHO HO H3C N 磷磷磷磷 磷
O CH2 O P OH HO OH H3C
(六)
维生素与辅酶
定义
概
述
维生素(vitamin)是机体维持正常功能所必需,但 是机体维持正常功能所必需, 维生素 是机体维持正常功能所必需 在体内不能合成或合成量很少, 在体内不能合成或合成量很少 , 必须由食物供给的一 组低分子量有机物质。 组低分子量有机物质。
分类: 分类:
脂溶性维生素 (lipid-soluble vitamin) 水溶性维生素 (water-soluble vitamin)
缺乏症
儿童——佝偻病 佝偻病 儿童 成人——软骨病 软骨病 成人
(3)维生素 )维生素E
种类:生育酚( ﹡种类:生育酚(tocopherol), 生育三烯酚 ), ﹡易自身氧化,故能保护其他物质。 易自身氧化,故能保护其他物质。 生化作用 体内最重要的抗氧化剂,能避免脂质过氧化物的产生, 体内最重要的抗氧化剂,能避免脂质过氧化物的产生, 保护生物膜的结构与功能。 保护生物膜的结构与功能。 维持生殖机能 促进血红素代谢
维生素的功能
脂溶性维生素在体内可直接参与代谢的 调节作用 水溶性维生素作为酶的辅助因子( 水溶性维生素作为酶的辅助因子(辅 酶),对代谢起调节作用 对代谢起调节作用
1、 水溶性维生素与辅酶
WaterWater-soluble Vitamins
(1)维生素B1 维生素B
维生素
硫胺素
代号 结构 辅因子功能
(4)维生素 (凝血维生素) )维生素K(凝血维生素)
天然形式: 天然形式:K1、K2 人工合成: 人工合成:K3、K4
生化作用及缺乏症
生化作用
维持体内凝血因子Ⅱ 维持体内凝血因子Ⅱ、Ⅶ 、 Ⅸ和Ⅹ的正 常水平, 常水平,参与凝血作用
缺乏表现: 缺乏表现 易出血
重要的脂溶性维生素
1. 维生素A: 视黄醇(retinol)、视黄醛 维生素 : 视黄醇( )、视黄醛 )、 2. 维生素 :麦角钙化(甾)醇(ergocalciferol,即维生素 2) 维生素D:麦角钙化 甾 醇 ,即维生素D 胆钙化(甾)醇(cholecalciferol,即维生素 3) 钙化 甾 醇 ,即维生素D 3. 维生素 :生育粉(tecopherol) 维生素E 生育粉( ) 4. 维生素 :凝血维生素 维生素K:
种类
VitA, VitD, VitE, VitK
维生素A(抗干眼病维生素) (1)维生素 (抗干眼病维生素)
视黄醇) ﹡天然形式:A1(视黄醇) 天然形式:
A2(3-脱氢视黄醇) 脱氢视黄醇) 脱氢视黄醇
视黄醇、 ﹡活性形式 :视黄醇、视黄醛 ﹡维生素A原:β-胡萝卜素 维生素 原 胡萝卜素
CH2OH A1
水溶性维生素与辅酶
维生素B 脱羧酶的辅酶; 维生素 1→TPP, 脱羧酶的辅酶; 维生素B 维生素 2→FMN,FAD ,脱氢酶的辅酶 , 维生素PP→ 维生素 → NAD+, NADP+ ,脱氢酶的辅酶 泛酸(维生素 维生素B3) →辅酶 (CoA-SH),酰化酶的辅酶 辅酶A 泛酸 维生素 , 叶酸→ 叶酸→ THFA,合成酶的辅酶 , 生物素→ 生物素→羧化酶的辅酶 硫辛酸→硫辛酰胺, 硫辛酸→硫辛酰胺, 丙酮酸脱酰氧化过程中的一个传递乙 酰基和氢的辅酶。 酰基和氢的辅酶。 吡哆素→磷酸吡哆素, 吡哆素→磷酸吡哆素, 转氨酶的辅酶 维生素B 维生素B 辅酶, 维生素 12→维生素 12辅酶,变位酶的辅酶
维生素C 维生素C
维生素C氧化为无活性的二酮古洛糖酸 维生素 氧化为无活性的二酮古洛糖酸 氧化为无活性的
维生素C缺乏 维生素 缺乏
维生素C能防治坏血病,称为抗坏血酸。 人体、 人体、猴和豚鼠在肝脏中缺少一个古洛 内酯氧化酶, 内酯氧化酶,因此不能在体内合成抗坏 血酸,必须从食物中获得抗坏血酸,否 血酸,必须从食物中获得抗坏血酸 则出现坏血病,表现为毛细血管脆弱, 皮肤出现小血斑,牙龈发炎出血等病征。
NADP+
抗癞皮病维生素
•MH2 + NAD+ → M + NADH + H+
H
MH2 + NAD+ → M + NADH + H+
以 NAD+ 或 NADP+ 形式作为脱氢酶的辅酶而起到递 氢体的作用。 氢体的作用。
4
1+
CONH2 +2H
H
H CONH2
N
-2H N
+
R •MH2 + NAD+ → M + NADH + H+
(4)维生素B5 维生素B
维生素 衍生的辅因子 代号 结构 辅因子功能
维生素 B5(PP) 烟酸、 烟酸、烟 烟酰胺腺嘌呤 酰胺 磷酸二核苷酸 磷酸二核苷酸 辅酶Ⅱ (辅酶Ⅱ) 亦称: 亦称:尼克酸和尼可酰胺
烟酰胺腺嘌呤 二核苷酸 辅酶Ⅰ (辅酶Ⅰ)
NAD+
多种重要脱氢 酶的辅酶 是电子和氢的 载体
CoA
酰基载体蛋白 的辅基
ACP的辅基 的辅基
参与转酰基反 应,即酰基的 载体
功能: 功能: CoA及ACP是酰基转移酶的辅酶 —酰基载体 及 是酰基转移酶的辅酶
对糖、 对糖、脂和蛋白质代谢过程中的乙酰基转移作用皆有重要作用 CoA-SH转运乙酰基,成为乙酰辅酶 转运乙酰基, 转运乙酰基 成为乙酰辅酶A(acetyl-CoA).
维生素 衍生的辅因子 代号 结构 辅因子功能
黄素单核苷酸 维生素B 维生素B2 核黄素 黄素腺嘌呤二 核苷酸
FMN 参与氧化还原 反应, 反应,是电子 和氢的载体 FAD
黄素蛋白脱氢酶的辅酶
H
H
(3).维生素B3与泛酸 维生素B
维生素 衍生的辅因子 代号 结构 辅因子功能
辅酶A 辅酶A 维生素B3 维生素B3 泛酸
能促进核酸和蛋白质的生物合成。 别是能促进核酸和蛋白质的生物合成 别是能促进核酸和蛋白质的生物合成。
(8)维生素B12(cyanocobalamine) 维生素B
维生素B 维生素B12又称为钴胺 素。 体内活性形式为甲基 体内活性形式为甲基 钴胺素5 钴胺素5 -脱氧腺苷钴 胺素
--维生素B 辅酶。 --维生素B12辅酶。 维生素
缺乏症
夜盲症,干眼病, 夜盲症,干眼病,皮肤干燥等
(2)维生素 (抗佝偻病维生素) )维生素D(抗佝偻病维生素)
维生素D是固醇类化合物,主要有D2,D3, D5。 维生素D是固醇类化合物,主要有D2,D3, D4, D5。 其中D2,D3活性最高。 D2,D3活性最高 其中D2,D3活性最高。
