caspase-3
细胞凋亡实验

细胞凋亡Caspase3检测实验小结一.原理Caspase-3在细胞凋亡中起着不可替代的作用,正常细胞中,Caspase-3以32kD的形式存在于胞浆中,在凋亡的早期,pro-Caspase-3被活化成为具有催化活性的Caspase-3,活化的Caspase-3蛋白,可以激活其他底物蛋白,从而导致凋亡过程。
活化的Caspase-3能够特异性地水解DEVE-X底物。
Ac-DEVE-pNA常用于Caspase-3的检测,细胞凋亡早期产生的Caspase-3可以特异性地水解Ac-DEVE-pNA的肽键,水解后的pNA能够激发发射荧光,根据荧光的强度可以测定Caspase-3,从而反应Caspase-3被活化的程度。
二.试剂配制1.1底物储存液将Ac-DEVE-pNA溶解于DMSO(10mM)1.2底物工作液(2×)50μL底物储存液100μL DTT (1M)400μLEDTA (100mM)10mL Tris Buffer (200mM)调整pH到7.4三.操作方法将经过药物处理的贴壁细胞,用PBS洗两遍,按照6孔板每孔加入100微升裂解液的比例加入Western及IP细胞裂解液裂解液(P0013),若细胞密度较大可加大裂解液用量。
用枪吹打数下,使裂解液和细胞充分接触。
充分裂解后,10000-14000g离心3-5分钟,取20uL 上清用于BCA蛋白定量。
以相同的蛋白上样量,等比例加入Caspase-3底物工作液,室温孵育至少1h,检测混合液405nm波长下的吸光度。
四.STA和CoCl2诱导RGC5细胞凋亡浓度摸索五、流式细胞术检测空白组(不染色) 空白组(单染) 空白组(单染) 空白组(双染) CoCl2+0% FBS CoCl2+2% FBS 凋亡比例:0.65 % 0.29% 3.13 % 16.78% 16.86 % 32.43 %结论:2% FBS+1mM CoCl2处理24h 可以引起RGC5细胞出现较多的凋亡。
Caspase半胱氨酸蛋白酶家族蛋白介绍

抗体动物种属来源缩写:R-兔、M-小鼠、r-大鼠、Sh-山羊、H-人
Caspase-6(CT)半胱氨酸蛋白酶蛋白-6(C端)
抗体动物种属来源缩写:R-兔、M-小鼠、r-大鼠、Sh-山羊、H-人
Caspase-13半胱氨酸蛋白酶蛋白-13
S-0053R
◆兔抗人、大鼠、小鼠Caspase-13多克隆抗体
◆200ul/1000.00 1ml/2900.00 (100ug/200ul 500ug/1ml)亲和纯化抗体
◆WB=1:300-600 Elisa=1:500-1500 IP=1:50-150 IHC=1:300-600
◆WB=1:500-1000 IF=1:100-200 Elisa =1:5000-10000
抗体动物种属来源缩写:R-兔、M-小鼠、r-大鼠、Sh-山羊、H-人
CD10单抗
S-0551M
◆小鼠抗人CD10单克隆抗体
◆100ul/1200.00 200ml/2000.00 (100ug/200ul 500ug/1ml)亲和纯化抗体
◆Caspase-10含有497aa,分子量为55KDa,与其它成员有30%—50%的同源性,Caspase-10分子结构的显著特点是其N端也有两个FADD氨基端样结构域。Caspase-10分布广泛,基因定位于2p12,即因转染昆虫细胞系Sf9中可以引起细胞凋亡,其活性可以被DEVD-CHO所抑制。
抗体动物种属来源缩写:R-兔、M-小鼠、r-大鼠、Sh-山羊、H-人
人半胱氨酸蛋白酶-3(caspase-3)试剂盒使用方法

人半胱氨酸蛋白酶-3(caspase-3)试剂盒使用方法本试剂盒仅供研究使用。
检测范围:96T3 pmol/L -80 pmol/L使用目的:本试剂盒用于测定人血清、血浆及相关液体样本中半胱氨酸蛋白酶-3(caspase-3)含量。
实验原理本试剂盒应用双抗体夹心法测定标本中人半胱氨酸蛋白酶-3(caspase-3)水平。
用纯化的人半胱氨酸蛋白酶-3(caspase-3)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入半胱氨酸蛋白酶-3(caspase-3),再与HRP 标记的半胱氨酸蛋白酶-3(caspase-3)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB 显色。
TMB 在HRP 酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的半胱氨酸蛋白酶-3(caspase-3)呈正相关。
用酶标仪在450nm 波长下测定吸光度(OD 值),通过标准曲线计算样品中人半胱氨酸蛋白酶-3(caspase-3)浓度。
试剂盒组成1 30 倍浓缩洗涤液 20ml×1 瓶 7 终止液 6ml×1 瓶2 酶标试剂 6ml×1 瓶 8 标准品(160 pmol/L) 0.5ml×1 瓶3 酶标包被板 12 孔×8 条 9 标准品稀释液 1.5ml×1 瓶4 样品稀释液 6ml×1 瓶 10 说明书 1 份5 显色剂A 液 6ml×1 瓶 11 封板膜 2 张6 显色剂B 液 6ml×1/瓶 12 密封袋 1 个标本要求1.标本采集后尽早进行提取,提取按相关文献进行,提取后应尽快进行实验。
若不能马上进行试验,可将标本放于-20℃保存,但应避免反复冻融2.不能检测含NaN3 的样品,因NaN3 抑制辣根过氧化物酶的(HRP)活性。
操作步骤1. 标准品的稀释:本试剂盒提供原倍标准品一支,用户可按照下列图表在小试管中进行稀释。
Caspase 3 活性检测试剂盒(比色法)

Caspase 3 活性检测试剂盒(比色法)产品简介:Caspase(Cysteine-requiring Aspartate Protease)家族在介导细胞凋亡过程的起着极其重要的作用,其成员包括Caspase1~11等,均属于蛋白酶家族。
Caspase 3又称CPP32、Yama、apopain、Caspase-3,属于CED-3亚家族,是细胞凋亡过程中的一个关键酶。
Caspase 3 可以剪切procaspase 2、6、7和9,可直接特异性剪切许多Caspase底物(如PARP、ICAD等),并在细胞核凋亡过程中起到重要作用。
Jimei Caspase 3活性检测试剂盒(比色法)(Caspase 3 Colorimetric A ssay Kit)的检测原理是利用Caspase 3催化底物acetyl-Asp-Glu-Val-Asp p-nitroanilide(Ac-DEVD-pNA)产生黄色的游离硝基笨胺pNA (p-nitroaniline),通过测定分光光度比色法测定pNA在400~410nm处吸光值,从而间接获得Caspase 3的活性。
自备材料:1、水浴锅或恒温箱2、96孔板3、酶标仪或分光光度操作步骤(仅供参考):1、制备标准曲线:①按照Caspase Lysis buffer:Assay buffer=1:9的比例配制适量的标准品稀释液。
②用标准品稀释液稀释pNA(10mM),使pNA分别达到200μM、100μM、50μM、25μM、12.5μM、6.25μM,另外设置一般不加pNA仅含标准品稀释液作为零管,把以上系列浓度物质作为标准品。
③取pNA浓度分别为200μM、100μM、50μM、25μM、12.5μM、6.25μM、0的标准品各100μl加入至96孔板或取适量体积加入至容量不超过100μl的比色杯,测定405nm处吸光值即A405。
④用每一个标准品的A405 减去不含pNA的空白对照的A405,计算出实际的吸光值。
Caspase3裂解评估

Caspase3裂解评估
Caspase-3抗体(兔多抗)用人工合成的人Caspase-3本身的切割位点处一段多肽,经适当修饰后免疫兔子,然后用proteinA和抗原多肽亲和柱经过两步纯化得到的高纯度多克隆抗体。
Caspase-3抗体可以识别全长的Caspase-3(35kD),也可以识别Caspase-3被剪切后产生的17kD片段。
未发现和其它Caspase家族蛋白有交叉反应。
Caspase-3是细胞凋亡过程中最关键的执行分子(keyexecutioner)之一,可以剪切细胞凋亡过程中的许多关键蛋白。
Caspase-3的激活需要从没有活性的全长Caspase-3(35kD),在Asp28和Ser29之间及Asp175和Ser176之间进行剪切,产生有活性的17kD肽段。
Caspase-3的激活常被作为细胞凋亡的一个重要指标。
细胞凋亡(apoptosis)是细胞为维持内环境稳定,更好地适应生存环境而主动形成的一种自我死亡过程,它涉及一系列基因的激活、表达及调控等作用。
人胱天蛋白酶-3(caspase-3)说明书活性
人胱天蛋白酶-3(caspase-3)酶联免疫分析(ELISA)试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测定人血清,血浆及相关液体样本中胱天蛋白酶-3(caspase-3)的活性。
实验原理:本试剂盒应用双抗体夹心法测定标本中人胱天蛋白酶-3(caspase-3)水平。
用纯化的人胱天蛋白酶-3(caspase-3)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入胱天蛋白酶-3(caspase-3),再与HRP标记的胱天蛋白酶-3(caspase-3)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的胱天蛋白酶-3(caspase-3)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中人胱天蛋白酶-3(caspase-3)活性浓度。
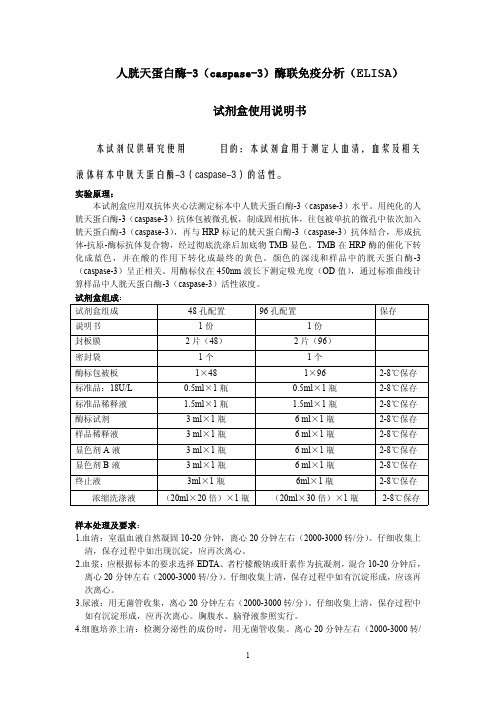
试剂盒组成:试剂盒组成48孔配置96孔配置保存说明书1份1份封板膜2片(48)2片(96)密封袋1个1个酶标包被板1×481×962-8℃保存标准品:18U/L0.5ml×1瓶0.5ml×1瓶2-8℃保存标准品稀释液 1.5ml×1瓶 1.5ml×1瓶2-8℃保存酶标试剂3ml×1瓶6ml×1瓶2-8℃保存样品稀释液3ml×1瓶6ml×1瓶2-8℃保存显色剂A液3ml×1瓶6ml×1瓶2-8℃保存显色剂B液3ml×1瓶6ml×1瓶2-8℃保存终止液3ml×1瓶6ml×1瓶2-8℃保存浓缩洗涤液(20ml×20倍)×1瓶(20ml×30倍)×1瓶2-8℃保存样本处理及要求:1.血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
Caspase-3细胞定位信号的检测与分析的开题报告

Caspase-3细胞定位信号的检测与分析的开题报告一、研究背景与意义Caspase-3是一种重要的半胱氨酸特异性蛋白酶,是凋亡信号通路中的关键酶。
当细胞受到外部压力或内部损伤时,Caspase-3可以被活化,从而引起细胞自身凋亡。
Caspase-3的活化和细胞的凋亡过程密切相关,因此对其进行研究可以进一步理解细胞凋亡的机理和调控,对疾病的治疗也具有重要的参考意义。
Caspase-3的细胞定位信号可以反映其功能状态,常使用免疫荧光染色或免疫组织化学方法来检测。
通过对Caspase-3的定位信号进行检测和分析,可以深入研究其在细胞活动中的作用和调节机制,为研究凋亡相关疾病的发生机制提供重要的实验依据。
二、研究内容和方法本研究旨在检测和分析Caspase-3的细胞定位信号,在细胞层面上探究其功能和调控机制。
具体研究内容和方法如下:1. 选择适宜的细胞系:筛选并选择适宜的细胞系,保证实验的可操作性和准确性。
2. 免疫荧光染色:采用免疫荧光染色技术,制备Caspase-3的免疫标记抗体,并用荧光探针标记,检测Caspase-3在细胞中的分布情况和定位信号。
3. 免疫组织化学:采用免疫组织化学技术,制备Caspase-3的免疫标记抗体,并用酶标法或免疫荧光法检测Caspase-3在组织中的分布情况和定位信号。
4. 图像分析:通过免疫荧光显微镜或显微摄像机拍摄得到Caspase-3的免疫荧光或免疫组织化学图片,进行数字图像分析,计算Caspase-3的荧光强度和定位信号的分布情况。
三、研究预期结果通过本研究,预期可以验证Caspase-3的细胞定位信号,并对其功能和调控机制进行探究,为深入研究细胞凋亡、癌症、心脏病、糖尿病等疾病提供重要的实验基础和参考意义。
同时,本研究可推动细胞凋亡领域的研究进展,为探索更多高效的治疗方法提供重要的理论支持。
Caspase-3在缺血性脑损伤中的作用

Caspase-3在缺血性脑损伤中的作用摘要】脑血管疾病是当今人类三大死亡原因之一,目前仍然缺乏有效的治疗手段,因此需要进一步探讨发病过程中的分子机制,为预防及治疗提供新的理论依据。
近来许多研究发现由半胱氨酸蛋白酶家族介导的细胞凋亡在缺血性脑损伤中起到了重要的作用,而半胱氨酸蛋白酶-3(caspase-3)被认为是细胞凋亡执行阶段的关键蛋白酶,且通过干预caspase-3 表达可减轻脑缺血的损伤程度[1]。
【关键词】缺血性脑损伤凋亡半胱氨酸蛋白酶-3前言:缺血性脑损伤是缺血性脑血管疾病中必经的病理过程,在此过程中细胞凋亡占有重要的比重。
在机体凋亡与抗凋亡过程,Caspase-3属于关键步骤;故在此对细胞凋亡、Caspase-3在缺血性脑损伤中的作用做简要综述。
1、细胞凋亡凋亡是一个基因调控的程序性细胞死亡过程,形态学特征是细胞核和细胞质发生浓缩,染色质发生断裂,不伴有炎症反应。
在这个过程中大量的基因被激活,蛋白质表达增加。
其在体内稳态平衡、神经发育、机体防疫、老化及许多疾病的发生过程中发挥重要作用,如帕金森病、老年性痴呆等神经退行性疾病与神经细胞过度凋亡有关。
依据细胞凋亡机制可将凋亡分为caspase依赖的、非caspase依赖的凋亡,其中以前者为主。
caspase依赖的途径主要有线粒体/细胞色素C通路、死亡受体通路和内质网通路[2]。
1)线粒体/细胞色素C通路:由理化因素导致的DNA损伤、生长因子缺乏、氧化应激、毒物药物等刺激信号激活。
细胞色素C作为一种促凋亡因子从线粒体膜释放入胞浆后,与胞浆中的凋亡激活因子-1(Apaf-1)的C末端及ATP结合,促使caspase-9蛋白酶家族呈“瀑布式”层层激活(caspase-9→caspase-3、6、7),引起细胞形态学上的改变使细胞最终发生凋亡[3];2)死亡受体(Fas-associated death domain,FADD)通路:由配体如TNF、Fas或TRAIL同其受体结合引起,配体受体结合后激活caspase-8,进一步激活caspase-3、caspase-6、capase-7;3)内质网通路:主要由Ca2+介导,胞内钙超载,影响内质网对钙的摄取和释放,造成内质网的应激,内质网应激诱导caspase-12表达,激活的caspase-12可进一步激活caspase-3而引发细胞凋亡。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(一)caspase家族Caspases是近年来发现的一组存在于胞质溶胶中的结构上相关的半胱氨酸蛋白酶,它们的一个重要共同点是特异地断开天冬氨酸残基后的肽键。
Caspase一词是从Cysteine aspartic acid specific protease 的字头缩写衍生而来,就反映了这个特征,而这种高度的特异性,在蛋白酶中是很少见的。
由于这种特异性,使caspase能够高度选择性地切割某些蛋白质,这种切割只发生在少数(通常只有1个)位点上,主要是在结构域间的位点上,切割的结果或是活化某种蛋白,或使某种蛋白失活,但从不完全降解一种蛋白质。
Caspase的研究源于线虫(C. elegans)细胞程序化死亡的研究。
线虫在发育过程中,有131个细胞将进入程序化死亡;研究发现有11个基因与PCD 有关,其中ced3和ced4基因是决定细胞凋亡所必需的,ced9基因抑制PCD。
线虫细胞程序化死亡的研究促进了其他动物特别是哺乳类动物中细胞凋亡的研究。
人们发现哺乳类细胞中存在着Ced3的同源物ICE(interleukin-1b converting enzyme),它催化白介素-1b的活化,即从其前体上将IL-1b 切割下来。
在大鼠成纤维细胞中过量表达ICE和Ced3都会引起细胞凋亡,表明了ICE和Ced3在结构和功能上的相似性;然而敲除ICE基因的小鼠其表现型正常,并未发现细胞凋亡发生明显改变。
进一步的研究发现,另一个ICE成员,后来被称为apopain,CPP32或Yama的半胱氨酸蛋白酶,催化poly(ADP-ribose)Polymerase(PARP),即聚(ADP-核糖)聚合酶的裂解,结果导致细胞的凋亡,因而认为apopain执行着与线虫中的ced3相同的功能。
Apopain被称为是“死亡酶”,而PARP被认为是“死亡底物”。
Apopain/CPP32/Yama是在1995年由两个实验室分别同时报导,时间上只有两周之差。
Ced4的哺乳类同源物则迟迟未能发现,直到1997年,才被证明是Apaf-1(即一种细胞凋亡蛋白酶活化因子apoptosis protease activating factor)。
而Ced 9的哺乳类对应物则较早地被证明是BCL-2,这一问题将在以后的部分述及。
现已确定至少存在11种caspase:这些caspases中,caspase 1和caspase 11,以及可能还有caspase 4被认为不直接参与凋亡信号的转导,它们主要参与白介素前体的活化;而caspase 2,caspase 8,caspase 9和caspase 10参与细胞凋亡的起始;参与细胞凋亡执行的则是caspase 3,caspase 6和caspase 7,其中caspase 3和7具有相近的底物和抑制剂特异性,它们降解PARP,DFF-45(DNA fragmentation factor-45),导致DNA修复的抑制并启动DNA的降解。
而caspase-6的底物是lamin A和keratin 18,它们的降解导致核纤层和细胞骨架的崩解。
(二)caspase-31994年Fernandez-Alnemri等在BenBank表达序列标记(expression sequence tag, EST)数据库中找到一段ICE/CED-3活性中心同源的序列,用它合成探针后,筛选人Jurkat T淋巴细胞cDNA文库,从中克隆到一种新基因,因其编码分子量为32kD的半胱氨酸蛋白酶而称之为CPP32(cysteine protease protein, 32kD)。
随后,其它学者独立地将这一蛋白基因克隆出来,并分别命名为prICE、apopain(凋亡素)和Yama(印度传说中的死亡之神)。
1996年这种蛋白酶被命名为caspase-3。
现在一般认为c aspase-3是细胞凋亡过程中最主要的终末剪切酶,也也是CTL细胞杀伤机制的重要组成部分。
1. caspase-3的结构pro-caspase-3含有277个氨基酸残基,分子量约32kD,与ICE有30%同源性,与CED-3有35%同源,是caspase家族中与CED-3同源性最高的,不论从结构同源性还是从底物特异性来看都与CED-3很相似,所以有人认为它是CED-3在哺乳动物中的同源蛋白。
caspase-3的原结构域明显短于ICE只有28个氨基酸残基,但蛋白酶活性中心和与结合底物有关的保守的氨基酸均与ICE一致。
pro-caspase-3在活化过程中从Asp28~Ser29和Asp175~Ser176两处被剪切,形成P17(29~175)和P10(182~277)两个片段,相当于ICE的P20和P10,两种亚基再组成活性形式的caspase-3。
pro-caspase-3本身并没有催化活性,在活化时首先由颗粒酶B(GrzB)或caspase-10在D175剪切下小片段后它才被部分活化,随后则可进行下一步的自我催化。
在剪切原结构域时可能还有其它caspase如ICE 的参与。
2. caspase-3的活化和参与细胞凋亡caspase-3在细胞凋亡中起着不可替代的作用,caspase-3基因转染昆虫Sf9细胞后引起细胞凋亡,这个过程可以被BCL-2阻断;在发生凋亡的细胞提取液中去除caspase-3后,这些提取液就失去了诱导细胞凋亡的能力;再加入纯化的caspase-3它就又恢复了致凋亡的功能。
caspase-3可以被多种因素活化,在CTL 细胞的杀伤作用中,它既可被Fas/FasL途径活化,也可以通过颗粒酶B途径活化。
颗粒酶B是CTL细胞颗粒中的一种丝氨酸酯酶,是哺乳动物中caspase蛋白酶外唯一的在Asp后剪切的蛋白酶,它可以特异性剪切ICE家族蛋白酶催化亚单位C端的IxxD序列,并活化caspase 2、3、6、7、8、9、10。
ICE也可以被颗粒酶剪切,但剪切后并不被活化。
3. caspase-3引起细胞凋亡的机制caspase-3最主要的底物是多聚(ADP-核糖)聚合酶PARP(poly(ADP-ribose) polymerase),该酶与DNA修复、基因完整性监护有关。
在细胞凋亡启动时,116kD 的PARP在Asp216-Gly217之间被caspase-3剪切成31kD和85kD两个片段,使PARP 中与DNA结合的两个锌指结构与羧基端的催化区域分离,不能发挥正常功能。
结果使受PARP负调控影响的Ca2+/Mg2+依赖性核酸内切酶的活性增高,裂解核小体间的DNA,引起细胞凋亡。
这种裂解过程可被caspase-3的特异性抑制剂Ac-DEVD-CHO所抑制,但不能被CrmA抑制。
caspase 3还可以剪切U1-70K、DNA-PK、PKC和PKC。
PKC和PKC都属于新型PKC(novel PKC, nPKC),当被caspase 3剪切后,可以切除调节区域,而成为活性形式的PKC,另外实验还证明,过量表达PKC和PKC均可以引起细胞凋亡,说明它们都参与了细胞凋亡的诱导是CTL细胞杀伤机制的重要组成部分。
(三)caspase家族蛋白酶在细胞凋亡中的活化顺序表 caspase家族蛋白酶的识别序列及作用底物caspase 8MACH, FLICE, Mch5DEVD pro-caspase3,4,7,9,10 caspase 10Mch4YVADcaspase 11ICH3, FLICE2caspase蛋白酶在死亡受体介导的细胞凋亡中起着中心的作用。
Fas与配体结合而活化后,首先引起YVAD和zVAD敏感的ICE家族蛋白酶活化,然后再活化DEVD敏感的蛋白酶。
其中caspase-8是这一凋亡过程中首先被活化的ICE家族蛋白酶。
Caspase-8活化后,一方面它可以剪切活化caspase-3、caspase-7、caspase-4、caspase-9和caspase-10,通过这些蛋白酶剪切底物使凋亡得以进行;另一方面,它的活性可以被CrmA所抑制,籍此可作为细胞凋亡负调控因素作用的环节。
caspase-8的活化可以是Fas与其配体结合引起的FADD蛋白与caspase-8结合的结果,也可能是颗粒酶B、ICE等作用的结果。
所以其它能够引起细胞凋亡的因素也可以通过激活颗粒酶B或ICE来激活凋亡信号转导途径。
caspase-8活化后引起caspase-3和caspase-7活化,这两种酶都可以剪切PARP,引起DNA的降解。
另外caspase-3还可以活化caspase-6,后者可以降解层蛋白B。
此外,U1核糖体蛋白的70kD亚基(U1-70K)、DNA依赖的蛋白(DNA-PK)的催化亚基、微丝相关蛋白Gas-2、 -actin、PKC、视网膜母细胞瘤蛋白、DNA拓扑异构酶I和II等也都可能作为caspase-3和caspase-6的作用底物。
在哺乳动物细胞的凋亡过程中caspase 3、6、7是与CED-3最相似的蛋白酶,它们完成了大部分剪切底物的作用,发挥了CED-3在美丽线虫中发挥的作用。
目前认为,能够将细胞膜事件与细胞浆事件联系起来的蛋白质除了FADD/caspse-8通路外还有其它形式,新发现的胞浆蛋白CRADD可以将RIP与caspase-2联系起来。
另外,caspase-10和caspase-9都已被证明可以在凋亡信号传导过程中先于其它蛋白酶活化,并通过其酶活性将信号传给其它caspase蛋白酶。
其它ICE家族蛋白酶虽然也在不同程度上参与凋亡过程,但具体细节还不十分清楚,它们可能是在不同细胞和组织起作用,也有可能是作为后备机制辅助上述途径的进行。
1细胞凋亡1.1凋亡的概念与特点细胞凋亡是由基因控制的细胞主动死亡过程,所以又被称为程序性细胞死亡(programmed cell death,PCD),其形态特征为染色质固缩边集、DNA片段化、胞质浓缩、胞膜皱缩并发泡形成凋亡小体,生化上表现为DNA梯形条带[1]。
1.2 凋亡的通路凋亡主要由两条死亡通路介导[2]:一条是死亡受体通路(外部通路);另一条是线粒体通路,即内部通路,包括线粒体和内质网(ER)。
1.2.1 外部通路在外部通路[3]中,死亡配体如Fas-L和受体结合后,与Fas相关的死亡区域蛋白(FADD)相互反应,然后再与促凋亡蛋白酶8(procaspase-8)结合形成死亡诱导病生理学心力衰竭PBL综述细胞凋亡与心力衰竭2信号复合体(DISC),此复合体的procaspase-8 形成二聚体而激活,随后分开并激活procaspase-3而启动凋亡发生。
1.2.2 内部通路内部通路[4]是由大量细胞外和细胞内刺激所转导,包括细胞因子、毒素、辐射、缺氧、氧化应急、缺血再灌注以及DNA损伤等。
