初中化学竞赛辅导6(离子推断题)
离子推断题汇总

离子推断题汇总(一)1.对某酸性溶液(可能含有Br-、SO42—、H2SO3、NH4+ )分别进行如下实验:①加热时放出的气体可以使品红溶液褪色②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝③加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸对于下列物质不能确认其在溶液中是否存在的是A.Br-B.SO42— C.H2SO3 D.NH4+2.(2010·浙江)某钠盐溶液中可能含有 NO2—、SO42—、SO32—、CO32—、Cl—、I—等阴离子。
某同学取5份此溶液样品,分别进行了如下实验:①用pH计测得溶液的pH大于7②加入盐酸,产生有色刺激性气体③加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体④加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色⑤加足量BaCl2溶液,产生白色沉淀,在滤液中加入酸化的(NH4)2Fe(SO4)2溶液,再滴加KSCN 溶液,显红色该同学最终确定在上述六种离子中仅含CO32—、NO2—、Cl—三种阴离子。
请分析,该同学只需要完成上述哪几个实验,即可得出此结论。
A.①②④⑤B.③④ C.③④⑤ D.②③⑤3.某无色溶液中含有K+、Cl—、OH—、SO32—、SO42—,为检验溶液中所含的各阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。
检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。
(1)图中试剂①~⑤溶质的化学式分别是①_____ ___,②_____ ___,③______ __,④____ ____,⑤_____ ___。
(2)图中现象a、b、c表明检验出的离子分别是a._____ 、b.____ _、c.____ _。
(3)白色沉淀A加试剂②反应的离子方程式是。
(4)无色溶液A加试剂③的主要目的是(5)白色沉淀A若加试剂③而不加试剂②,对实验的影响是。
离子推断题

(15分)某强酸性溶液X可能含有Ba2+、A13+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、C1-、NO2-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:根据以上信息,回答下列问题:(1)上述离子中,溶液X中除H+外还肯定含有的离子是▲,不能确定是否含有的离子(M)是▲,若要确定该M(若不止一种,可任选一种)在溶液X中不存在,最可靠的化学方法是▲。
(2)沉淀I的化学式为▲,气体F的电子式为▲。
(3)写出生成A的离子方程式:▲。
(4)通常可以利用KClO在一定条件下氧化G来制备一种新型、高效、多功能水处理剂K2FeO4。
请写出制备过程中的离子方程式▲。
(5)1.0mol/L的E溶液与2.0mol/LF溶液等体积混合完全反反应后,溶液中各离子的浓度大小关系为▲。
(6)假设测定A、F、I均为0.10mol,50mL X溶液中n(H+)=0.40mol,当沉淀C物质的量大于0.70mol时,溶液X中还一定含▲。
(2015秋•衡水校级月考)某强酸性溶液X,可能含有Al3+、Ba2+、NH、Fe2+、Fe3+、CO、SO、SiO、NO中的一种或几种离子,取该溶液进行实验,其现象及转化如图.反应过程中有一种气体是红棕色.请回答下列问题:(1)由强酸性条件即可判断溶液X中一定不存在的离子有______.(2)溶液X中,关于N03-的判断一定正确的是______.a.一定有 b.一定没有 c.可能有(3)产生气体A的离子方程式为______.(4)转化⑥发生反应的现象为______.(5)转化④中产生H的离子方程式为______.(6)若转化③中,D、H20、02三种物质恰好发生化合反应生成E,则反应中D 与02的物质的量之比为______(7)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是______.①NaOH溶液,②KSCN溶液,③石蕊试剂,④pH试纸,⑤KMn04溶液,⑥氯水和KSCN的混合溶液.。
离子推断题的解题方法与技巧

离子推断题的解题方法与技巧
知识梳理 一.离子共存的概念
不发生任何反应
发生反应
知识梳理 二.熟悉常考离子的性质
既能与酸发生反应,又能与碱发生反应, 一般为多元弱酸的酸式酸根离子
知识梳理 三.常见酸、碱性溶液的判断
红色
红色 橙色 蓝色
红色
蓝色 红色
H2 黄色
知识梳理
思考
(1)OH-不能和_H__+_、_N__H_+ 4_、__F_e_2_+_、__F_e_3+_、__C_u_2_+_、__Z_n_2_+_、_ _M__g_2+_、__A__l3_+_、__C_r_3_+_、__H_C__O_3-_、__H__S_-_、__H_S_O__- 3_、__H_2_P_O__- 4 _、 _H__P_O_24_-_大量共存(填具体离子,下同)。 (2)H+不能和____O_H_-_、__C__O_23_-_(H__C_O_- 3_)_、__S_2_-_(H__S_-_)、_____ S_O__23_-_(H__S_O_3-_)_、__P_O_34_-_(_H_2_P_O_- 4_,__H__P_O_24_-_)_、__S_iO__23-_、__A__lO__- 2_、 _C_l_O_-_、__F_-_、__C_H__3C__O_O_-_、__N__O_2-__大量共存。
K+
(√ )
(8)常温下ccOHH+-=1×10-12 的溶液:K+、AlO-2 、CO23-、
离子推断题汇总

离子推断题汇总(一)1.对某酸性溶液(可能含有Br-、SO42—、H2SO3、NH4+ )分别进行如下实验:①加热时放出的气体可以使品红溶液褪色②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝③加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸对于下列物质不能确认其在溶液中是否存在的是A.Br-B.SO42— C.H2SO3 D.NH4+2.(2010·浙江)某钠盐溶液中可能含有 NO2—、SO42—、SO32—、CO32—、Cl—、I—等阴离子。
某同学取5份此溶液样品,分别进行了如下实验:①用pH计测得溶液的pH大于7②加入盐酸,产生有色刺激性气体③加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体④加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色⑤加足量BaCl2溶液,产生白色沉淀,在滤液中加入酸化的(NH4)2Fe(SO4)2溶液,再滴加KSCN 溶液,显红色该同学最终确定在上述六种离子中仅含CO32—、NO2—、Cl—三种阴离子。
请分析,该同学只需要完成上述哪几个实验,即可得出此结论。
A.①②④⑤B.③④ C.③④⑤ D.②③⑤3.某无色溶液中含有K+、Cl—、OH—、SO32—、SO42—,为检验溶液中所含的各阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。
检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。
(1)图中试剂①~⑤溶质的化学式分别是①_____ ___,②_____ ___,③______ __,④____ ____,⑤_____ ___。
(2)图中现象a、b、c表明检验出的离子分别是a._____ 、b.____ _、c.____ _。
(3)白色沉淀A加试剂②反应的离子方程式是。
(4)无色溶液A加试剂③的主要目的是(5)白色沉淀A若加试剂③而不加试剂②,对实验的影响是。
专题练习_离子反应之离子推断

1、一种酸性较强的溶液中,可能存在NO3-、I-、Cl-、Fe3+中的一种或几种。
向该溶液中加入溴水后,溴被还原,由此可推断该溶液中A、含NO3-B、含有NO3-、I-、Cl-C、含I-,但不能确定是否含Cl-D、含有Fe3+2.甲、乙、丙是三种不含相同离子的可溶性强电解质。
它们所含离子如下表所示:甲)>c(乙)>c(丙),则乙物质可能是①MgSO4②NaOH ③(NH4)2SO4④Mg(NO3)2⑤NH4NO3A.①②B.③④C.③⑤D.①⑤3.某溶液中含有SO32-、SiO32-、Br-、CO32-、Na+,向该溶液中通入过量的Cl2,下列判断正确的是①反应前后,溶液中离子浓度基本保持不变的只有Na+②有沉淀生成③有气体产生④溶液颜色发生变化⑤溶液中共发生了3个氧化还原反应A.①③⑤ B.①②③④ C.②④⑤D.①②③④⑤4.有一无色溶液,可能含有K+、Al3+、NH4+、Mg2+、Cl-、SO42-、HCO3-、MnO4-中的一种或几种。
为确定其成分,做如下实验:(1)取部分溶液,加入适量Na2O2固体、产生无色无味的气体并生成白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;(2)另取部分原溶液,加入HNO3酸化的Ba(NO3)2有白色沉淀产生。
下列推断正确的是A.肯定有K+、HCO3-、MnO4- B.肯定有Al3+、Mg2+、HCO3-C.肯定有Al3+、Mg2+、SO42-、Cl- D.肯定有Al3+、Mg2+、SO42-5. 某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO2—、MnO4—、CO32—、SO42—中的若干组成,取一定溶液进行如下实验:(1)取适量溶液,加入过量盐酸,有气体生成,并得到溶液A(2)在所得溶液A中加入过量碳酸氢铵溶液得到溶液B,同时有气体生成,并析出白色沉淀甲(3)在所得溶液B中加入过量Ba(OH)2溶液,也有气体生成,并析出白色沉淀乙。
专题:离子检验与离子推断
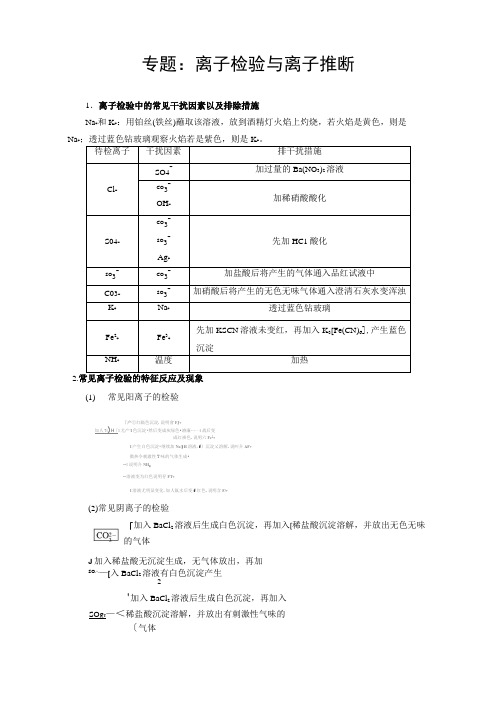
专题:离子检验与离子推断1.离子检验中的常见干扰因素以及排除措施Na+和K+:用铂丝(铁丝)蘸取该溶液,放到酒精灯火焰上灼烧,若火焰是黄色,则是Na+;透过蓝色钻玻璃观察火焰若是紫色,则是K +。
待检离子干扰因素排干扰措施Cl-SO4-加过量的Ba(NO3)2溶液CO3-OH-加稀硝酸酸化S04-CO3-SO3-Ag+先加HC1酸化SO3-CO3-加盐酸后将产生的气体通入品红试液中C03-SO3-加硝酸后将产生的无色无味气体通入澄清石灰水变浑浊K+Na+透过蓝色钻玻璃Fe2+Fe3+先加KSCN溶液未变红,再加入K3[Fe(CN)6],产生蓝色沉淀NH+温度加热2.常见离子检验的特征反应及现象(1)常见阳离子的检验「产①红隔色沉淀.说明會FJ+加人7()H「I尤产'I色沉淀•然后变成灰绿色•濬廉…—I战后变成红褂色.说明六Fe2+I产生白色沉淀•继续加Na()H溶液.f〕沉淀乂溶解.说叫介AF+微热令刺澈性Y味的气体生成•〜I说明介NH:〜溶液变为红色说明存FT+I溶液尤明显变化.加人氟水后变f红色.说明含F/+(2)常见阴离子的检验「加入BaCl2溶液后生成白色沉淀,再加入[稀盐酸沉淀溶解,并放出无色无味的气体J加入稀盐酸无沉淀生成,无气体放出,再加SO^—[入BaCl2溶液有白色沉淀产生2'加入BaCl2溶液后生成白色沉淀,再加入SO g T—<稀盐酸沉淀溶解,并放出有刺激性气味的〔气体叵T一加入AgNO3生成不溶于稀硝酸的白色沉淀[探高考•真题鉴赏]1.(2016・全国高考卷II)某白色粉末由两种物质组成,为鉴别其成分进行如下实验:①取少量样品加入足量水仍有部分固体未溶解;再加入足量稀盐酸,有气泡产生,固体全部溶解;②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。
该白色粉末可能为()A.NaHCO3、A1(OH)3B.AgCl、NaHCO gC.NaSO、BaCOD.NaCO、CuSO233234解析:A项中,NaHCO3、A1(OH)3加入足量水中,NaHCO g溶解,Al(OH)3不溶解;加入稀盐酸,固体全部溶解,且有气泡产生;NaHCO3、A1(OH)3均能与H2SO4反应,最后不会有固体剩余。
离子型推断题

离子型推断题1.在某未知溶液中检验出含有Ba 2+、NO 3-,且溶液的pH =1。
某学生还需检验此溶液中是否大量存在:①Al 3+,②NH 4+,③Fe 2+,④Cl -,⑤AlO 2-,⑥SO 42-,其实这些离子中有一部分不必再检验就能加以否定,你认为不必再检验的离子组是( )A .③⑤⑥B .④⑤⑥C .①②⑤D .①③④2.从下列实验事实得出的相应结论中正确的是( )选项 实验事实结论 A向某溶液加入氯水然后加入KSCN 溶液,溶液变为红色 该溶液中含Fe 3+ BSO 2通入Ba(NO 3)2溶液中出现白色沉淀 BaSO 3不溶于水 C Na 2SiO 3溶液中通入CO 2产生白色沉淀酸性H 2CO 3>H 2SiO 3 D 某溶液中加入稀盐酸产生无色无味、能使澄清石灰水变浑浊的气体该溶液中一定含有CO 32- 3.在含有Na +的中性溶液中,还可能存在NH 4+、Fe 2+、Br -、CO 32-、I -、SO 32-六种离子中的一种或几种,进行如下实验:(1)原溶液滴加足量氯水后,有气泡生成,溶液呈橙黄色;(2)向橙黄色溶液中加BaCl 2溶液无沉淀生成;(3)橙黄色溶液不能使淀粉变蓝。
由此推断原溶液中一定不存在的离子是( )A .NH 4+、Br -、CO 32-B .NH 4+、I -、SO 42-C .Fe 2+、I -、CO 32-D .Fe 2+、I -、SO 32-4.某种溶液可能含有下列阴离子中的一种或几种:SO 2-4、SO 2-3、CO 2-3、Cl -。
(1)当溶液中有大量H +存在时,则不可能有__________存在。
(2)当溶液中有大量Ba 2+存在时,溶液中不可能有____________存在。
(3)当溶液中有____________和____________等阳离子存在时,上述所有阴离子都不可能存在。
5.氧化铜是一种黑色固体,可溶于稀硫酸。
某同学想知道是稀硫酸的哪种粒子(H 2O 、H +、SO 2-4)能使氧化铜溶解。
初中化学竞赛推断题目解题技巧

初中化学竞赛推断题目解题技巧
1. 熟悉化学知识:推断题目需要对化学知识有深入的了解,包括元素周期表、化学反应、化学物质的性质等。
只有熟悉这些知识,才能在解题时迅速找到线索。
2. 仔细阅读题目:推断题目通常不会直接给出答案,而是通过描述一些现象或者条件,让考生根据这些信息推断出答案。
因此,仔细阅读题目,理解题目中的每一个细节,是非常重要的。
3. 利用逻辑推理:推断题目通常需要考生运用逻辑推理的能力,通过已知的信息推断出未知的答案。
例如,通过观察化学反应的结果,推断出反应物或者催化剂;通过分析物质的性质,推断出可能的组成元素等。
4. 利用排除法:当面对多个可能的答案时,可以尝试使用排除法。
首先假设一个答案是正确的,然后看这个答案是否符合题目的所有条件。
如果不符合,就排除这个答案,再试下一个。
5. 反复检查:在确定了答案之后,一定要再次检查一遍,确保自己的答案没有错误。
因为一旦答案出错,就可能会影响整个题目的分数。
6. 多做练习:提高推断题目解题能力的最好方法就是多做练习。
通过不断的练习,可以熟悉各种类型的推断题目,提高自己的解题速度和准确率。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初中化学奥林匹克竞赛集训营学案第六讲离子推断题
例1 某中性溶液中含有k+、Fe3+、Cl—、SO42—四种离子,其中k+、Fe3+、Cl—三种离子的个数比为5∶2∶3。
则溶液中Fe3+与SO42—的个数比()
A 1∶2
B 1∶3
C 2∶3
D 3∶5
例2 经实验测得一中性溶液由Mg2+、Al3+、NO3—、SO42—四种离子组成,其中Mg2+、Al3+、SO42—的个数比为()
A 3∶1∶10
B 3∶5∶1
C 3∶10∶10
D 3∶1∶5
例3 测得某溶液中仅含有Na+、Mg2+、SO42—、Cl—四种离子,其中Na+与Mg2+的个数比为4∶5,则Cl—和SO42—个数比可能为()
A 8∶3
B 3∶2
C 4∶1
D 2∶3
例4在FeCl3和Fe2(SO4)3的混合溶液中,已知Fe3+与Cl—的个数比为4∶3,若溶液中Fe3+为4n个,则硫酸根离子用n表示的个数为
例5 在给定的H+1、S+6、O—2、K+1、Na+1五种元素中,最多可以组成种化合物
例6 已知某无色溶液中可能含有H+、Ag+、Cu2+、Na+、OH—、Cl—、NO3—、CO32—等八种离子中的几种,往该溶液中滴入几滴石蕊试液,石蕊试液变红,则原溶液中大量存在的离子可能为或。
例7 某溶液中可能含有Na+、H+、Cl—、SO42—欲证明两种阴离子确实存在,选用的最佳方案是:先向溶液中滴入足量的溶液至沉淀完全,再取上层清液滴加溶液,又出现白色沉淀,则可得出结论。
例8 在A、B、C、D四种物质的溶液中含有Na+、Fe3+、Ag+、Cu2+、SO42—、Cl—、OH—、NO3—等八种离子,现将这四种物质的稀溶液两两混合,有如下现象产生
⑴A+B →篮色沉淀⑵D+C →白色沉淀(此沉淀不溶于稀硝酸)
⑶B+D →红色沉淀根据上述现象,推断并写出各物质的化学式
A B C D
例9 某工业品盐酸中含有Fe3+、Cl—、H+;该盐酸中所含杂质的化学式,若溶液中H+与Cl—的个数比为60∶63,则Fe3+与Cl—的个数比是。
例10 某无色透明溶液,可能含有下面两离子的几种:阳离子组:Cu2+、Ba2+、Mg2+、H+;阴离子组:Cl—、OH—、NO3—、CO32—;
已知该溶液能和铝粉反应放出氢气,如果确定该溶液中含有Mg2+,试推断溶液中一定含有离子,可能含有离子,不定没有离子。
例11 在A、B 两组溶液中共含有离七种:Na+、Cu2+、Ba2+、Mg2+、NO3—、OH—、SO42—;已知两溶液中含离子各不相同,A溶液中含有四种离子,且能使紫色石蕊试液蓝色,则B溶液中含有的离子是
例12 某工厂的废渣中混有少量锌粉和氧化铜(其它成分不跟酸反应)跟大量的废盐酸接触形成污水,产和生公害。
若向污水中撒入铁粉,且反应完,铁粉有特殊需要剩余,此时污水中一定含有的金属离子是()
例13 在分开盛放的A、B两种溶液中,共含有Na+、H+、Ag+、Ba2+、NO3—、Cl—、CO32—七种离子,已知A溶液中含有三种阳离子和一种阴离子,则B溶液中所含的离子是。
取少量A溶液滴入CuCl2至不再有沉淀生成后,过滤,将此滤液加入B溶液中,则发生化学反应有,。
A Fe2+、Cu2+
B Cu2+ H+
C Fe2+、Zn2+
D Zn2+、H+
答案:1 A 2 B C 3 A B 4 4.5n 5 11 6 Na+、Cl—、NO3—、H+
或Na+、NO3—、Ag+、H+7 Ba(NO3)2稀HNO3AgNO3稀HNO38 CuSO4
NaOH AgNO3FeCl39 1∶63 10 H+、Mg2+;Ba2+、Cl—;Cu2+、CO32—、OH—、NO3—;11 Mg2+、Cu2+、SO42—12 C
练习1 测得某溶液中仅含有Na+、Mg2+、SO42—、Cl—四种离子,其中离子个数比Na+∶Mg2+∶Cl—===4∶5∶8,如果Na+为4n个,则SO42—的离子可能为()
A 2n
B 3n
C 6n
D 8n
练习2 经测得某溶液中有Cu2+、k+、SO42—、Cl—四种离子,其中k+与Cu2+的个数比为4∶3,那么SO42—与C l—的个数比可能为()
A 3∶2
B 1∶3
C 2∶5
D 1∶8
练习3 从给定化合价O—2、Cl—1、Mg0、H+1、Cu+2、C+4六种元素中,选择适当的元素按下列要求组成物质(用化式填写)
⑴单质⑵无氧酸⑶酸性氧化物⑷难溶性碱
⑸碱性氧化物⑹碱式盐⑺可溶性正盐
练习4 某校课外活动小组,将一些可溶性化合物溶于水,配成甲、乙两种溶液中共有H+、Ag+、k+、Ba2+、OH—、Cl—、NO3—、CO32—八种离子,两种溶液中所含离子各不相同,已知向甲溶液里滴入石蕊试液,溶液呈蓝色。
则乙溶液里含有的离子应该是(填离子符号)。
练习5 某溶液中含有Na+、Zn2+、SO42—、NO3—四种离子,已知Na+∶Zn2+∶SO42—===2∶3∶2,则该溶液中Zn2+和NO3—的离子个数比。
练习6 工业品盐酸中因含有Fe3+而带黄色,若某工业品盐酸中H+和Cl—的个数比为91:94,则该盐酸中Fe3+和Cl—的个数比为()
A.1:1 B.1:3 C.91:94 D.1:94
练习7 现有五种离子及其化合价依次是::H+1、S+6、O—2、Na+1、K0;它们相互结合,最多可组成化合物种类是()
A 5
B 6
C 7
D 8
练习8 在分开盛放的A、B 两组溶液共有Na+、Fe3+、Ba2+、Mg2+、Ca2+、NO3—、OH—、SO42—8种离子,两溶液所含离子各不相同,已知,A溶液中共有4种阳离子和2种离子阴离子,则B溶液中所含的离子应该是。
练习9 经测定某溶液中含有大量的Cu2+、SO42—、Cl—、6X(离子)四种离子,其中Cu2+与Cl—的个数为
1:1,则X可能为()(2000年天津竟赛)
A Na+
B OH—
C NO3—
D Zn2+
练习10 某工厂排出的污水中可能含有Ba2+、k+、OH—、SO42—、Cl—、CO32—等离子,为了进一步确定,进行如下实验:取污水仔细观察。
呈无色透明的均一状态。
取污水少许,滴入稀硫酸产生大量白色沉淀,再加入足量稀硝酸,白色沉淀不消失。
经测试,该污水PH>7。
由此推断,污水中肯定含有的离子是,肯定不含的离子是。
答案1 B 2 B D 3 Mg HCl CO2Cu(OH)2CuO Cu2(OH)2CO3CuCl2 4 H+、Ba2+、Ag+、NO3— 5 3∶4 6 D
7 C 8 Ba2+、OH—、9 A C 10
OH—SO42—Ba2+CO32—。
