10级物化竞赛试题答案
表面活性剂(CAI)(10级)

两性离子型表面活性剂,
+
活性部分为
R CH2 CH COONH 3
R-O(CH2CH2O)nH,是非离子型表面活性剂, 亲油基为R-,亲水基为O(CH2CH2O)H。
表面活性剂的物化性质
1.表面活性剂亲水—亲油性平衡值 2. 胶束与胶束量 3.表面活性剂溶解性与温度的关系
表面活性剂
物质在水溶液体相浓度与表面张力的关系:
(1)浓度↑,表面张力↑。如: NaCl、NaOH、KNO3等无机酸、 碱、盐溶液。 (2)浓度↑,表面张力↓。如: 有机酸、醇、醛、酮、醚、酯 等极性物质溶液。 (3)随浓度增大,开始表面张力 急剧下降,但到一定程度便不 再下降。如:肥皂、长链烷基 苯磺酸钠等溶液。这些物质称 为表面活性剂。
表面活性剂
主要内容:
1.表面活性剂的结构特点、分类及物化性质; 2.阴离子表面活性剂; 3.阳离子表面活性剂; 4.两性离子表面活性剂; 5.非离子表面活性剂。
重 点:
1.各类表面活性剂的特点及应用。 2.在精细化学品配方中如何正确选择表面 活性剂。
表面活性剂的发展历程:
90年代 50年代后 支链烷基苯磺酸钠 向无毒、无公 石油化工的发展,促进了醇 40~50年代 德国化学家广泛进行 (TPS)因优良的洗 害、高效、全 系表面活性剂的大力发展, 表面活性剂的研制, 涤性和耐硬水性占据 天然发展,烷 其中醇醚非离子表面活性剂 洗涤剂的主导地位; 开创了近代表面活性 基多苷(APG)成 因其优异的低温洗涤性、低 德国化学家由煤焦油合成了 20世纪30年代 随后由于TPS难以生 为第四代最具 剂时期,并形成合成 泡性、可生物降解性等,加 第一个表面活性剂烷基苯磺 物降解造成河流污染, 潜力的表面活 之脂肪醇和环氧乙烷原料的 表面活性剂与肥皂竟 酸盐,为表面活性剂的开发 在1964年被性能优异 性剂。 充足供应获得迅猛发展,至 争的局面。 奠定了基础。 的直链烷基苯磺酸钠 1917年 今已有超过阴离子表面活性 取代。 剂之势。
XX省百校2022至2023学年高三上学期十月联考化学试题附解析答案完整版

山东省高三十月百校联考化学本试卷满分100分,考试用时90分钟。
注意事项:1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选涂其他答案标号。
回答非选择题时,将答案写在答题卡上。
写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Co 59一、选择题:本题共10小题,每小题2分,共20分。
每小题只有一个选项符合题目要求。
1.中华传统文化源远流长,下列说法与氧化还原反应无关的是()A .《七步诗》:“煮豆燃豆萁,豆在釜中泣”B .《咏煤炭》:“凿开混沌得乌金……不辞辛苦出山林”C .《周礼》:“煤饼烧蛎房(注:牡蛎壳)成灰”D .《抱朴子》:“丹砂(注:)烧之成水银,积变又还成丹砂”HgS 2.氨气是一种重要的工业原料,在工业上可用氨气检验氯气管道是否漏气,其反应原理为。
下列有关叙述错误的是( )23243Cl 8NH N 6NH Cl ++A .的电子式: B .N原子的原子结构示意图:4NH Cl [H N H]Cl H H::+- C .的结构式: D .中子数为18的氯原子:2N N N ≡3517Cl3.化学离不开生活,生活也离不开化学。
下列叙述在科学上没有错误的是()A .施农家肥的蔬菜,无公害,绝对不含任何化学物质B .一种可令所有化学物质黯然失色的漂白粉C .面包、饼干加工时加人的少量小苏打粉是作膨松剂D .一种富含氮、磷、锌等微量元素的口服液4.下列物质的性质与用途具有对应关系的是()A .具有强还原性,可用于冶炼金属钛B .不支持燃烧,干冰可用于人工降雨Na 2COC .具有强碱性,可用作干燥剂D .受热易分解,可用作泡沫灭火剂NaOH 3NaHCO 5.化学是一门以实验为基础的学科。
物理化学竞赛笔试题

全国大学生化学竞赛笔试题第一届1.某溶液由A和B二物质组成,且A和B的折光率有明显差异,如何用折光率的办法测定溶液的组成?配置一系列不同浓度配比的AB混合溶液,测定其折光率并绘制出组成-折光率工作曲线,由曲线查出该溶液的组成。
制成折光率-浓度的标准曲线,将未知组成的混合物的折光率测出,对应标准曲线找出浓度值。
2.使用饱和甘汞电极,你是如何检查它是否饱和的?若不饱和你如何处理使之呈饱和甘汞电极?看电极下端是否有氯化钾固体等,加入少许的氯化钾固体使用甘汞电极时须注意:①因甘汞电极在高温时不稳定,故它一般适用于70℃以下的测量;②甘汞电极不宜用在强酸或强碱性介质中,因此时的液体接界电位较大,且甘汞电极可能被氧化;③若被测溶液中不允许含有氯离子,则应避免直接插入甘汞电极,这时应使用双液接甘汞电极;④保持甘汞电极的清洁,不得使灰尘或局外离子进入该电极内部;⑤当电极内部溶液太少时应及时补充。
饱和甘汞电极在实验中的制备方法:取玻璃电极管,在其底部焊接一铂丝。
取化学纯汞约1 mL,加入洗净并干燥的电极管中,铂丝应全部浸没。
在一个干净的研钵中放一定量的甘汞(Hg2Cl2)、数滴纯净汞与少量饱和KCl溶液,仔细研磨后得到白色的糊状物(在研磨过程中,如果发现汞粒消失,应再加一点汞;如果汞粒不消失,则再加一些甘汞……以保证汞与甘汞相互饱和)。
随后,在此糊状物中加入饱和KCl溶液,搅拌均匀成悬浊液。
将此悬浊液小心地倾入电极容器中,待糊状物沉淀在汞面上后,注入饱和KCl溶液,并静止一昼夜以上,即可使用。
3.当温度不算太高时,常用镍铬—镍硅热电耦用于测温,在所产生的热电势中,哪根丝为正电位?哪根丝为负电位?K型(镍铬一镍硅热电偶):由镍铬与镍硅制成,采用符号EU表示。
是目前用量最大的廉金属热电偶,其用量为其他热电偶的总和。
热电偶丝直径一般为1.2~3.2mm。
正极(KP)的名义化学成分为:Ni:Cr=90:10,负极(KN)的名义化学成分为:Ni:Si=97:3. EU热电偶化学稳定性高,可以在氧化性或中性介质中长时间地测量900℃以下的温度,短期测量可达1200℃。
第10届物理竞赛预赛答案

第十届全国中学生物理竞赛预赛试题一、将正确的答案前面的字母填在横线上方(16分,每小题8分)1.由于大气中CO2含量增多,导致全球气温增高,这被称为温室效应,是环境保护面临的一个重大问题。
CO2对地面附近气温产生影响,主要是因为CO2气。
A.对射来的太阳光中的红外线有强烈的吸收作用,这就足以使全球气温增高。
B.在一昼夜中对射来的太阳光中吸收的热大于它向地球外四周辐射的热,这就使CO2的温度升高,导致全球气温增高。
C.对由地面向外辐射的红外线有强烈的吸收作用,是这些被吸收的热三大气温度升高。
D.强烈吸收由地面向外辐射的红外线,又向各方向辐射红外线,其中约一半向地面辐射,从而地面附近气温增高。
E.对由地面向外辐射的红外线有强烈的反射作用,使这些能量返回地面,从而地面附近气温增高。
2.十九世纪末到二十世纪初,标志近代物理学诞生的两项最重要的科学成就是下列诸项中的和。
A、.晶体管的发明B、麦克斯韦电磁场理论的建立C、.狭义相对论的建立D、.原子的核式结构的确定E、.赫兹实验证实电磁波的存在F、世界上第一台激光器研制成功G、电子的发现H、量子论的提出I、放射性元素的发现J、超导电性的发现二、(16分,每小题8分)1.图10-1中纵坐标为光电效应实验中所加电压(U),横坐标为光子的频率(v0),若某金属的极限频率为v0,普朗克恒量为h,电子电量为e,试在图中画出能产生光电流的区域(用斜线表示)。
图10-12.一光学系统如图10-2所示,A 为物平面,垂直于光轴,L 为会聚透镜,M 为与光轴成45°角的平面镜。
P 为像面,垂直于经平面镜反射后的光轴。
图10-3为同一光学系统的透视图。
设物为A 面上的一个“上”字(如图10-3),试在图10-3中实像面P 上画出像的形状。
三、半径为R 、质量为M 1的均匀圆球与一质量为M 2的重物分别用细绳AD 和ACE 悬挂于同一点A ,并处于平衡,如图10-4所示。
物理化学10

物理化学试卷班级姓名分数一、填空题( 共21题40分)1. 2 分(5311)5311某反应物的转化率分别达到50%,75%,87.5% 所需时间分别为t12,2t12,3t12,则反应对此物质的级数为_______ 。
2. 2 分(6612)6612液态汞的表面张力γ= 0.4636 N·m-1 + 8.32×10-3 N·m-1·K-1·T - 3.13×10-7 N·m-1·K-2·T2在400 K 时,汞的(∂U/∂A)T, V = 。
3. 2 分(4217)4217欲测量下列电池的电动势,与电位差计负极端相连的是该电池的p1端还是p2端?( ) Pt│H2(p1= 0.1p∃)│HCl(aq)│H2(p2= p∃)│Pt4. 2 分(6388)6388反应2[Co(NH3)3Br]2++Hg2++H2O→2[Co(NH3)Br]3++HgBr2,随离子强度的增加反应速率___________,要使反应速率改变25%,则离子强度应为_____________________________。
5. 2 分(5432)543260 Co广泛用于癌症治疗, 其半衰期为5.26 a (年), 则其蜕变速率常数为:_________________, 某医院购得该同位素20 mg, 10 a后剩余______________ mg。
6. 2 分(6636)6636T = 298 K时, 水-空气表面张力γ= 7.17×10-2 N·m-1,(∂γ / ∂T)p, A = - 1.57×10-4 N·m-1·K-1。
在T,p∃时,可逆地增加2 cm2表面,对体系所作的功W =___________, 熵变∆S =_____________。
7. 2 分(4170)4170电极AgNO3(m1)|Ag(s)与ZnCl2(m2)|Zn(s)组成自发电池的书面表示式为:____________________________________________。
第十届Chemy化学奥林匹克竞赛联赛答案
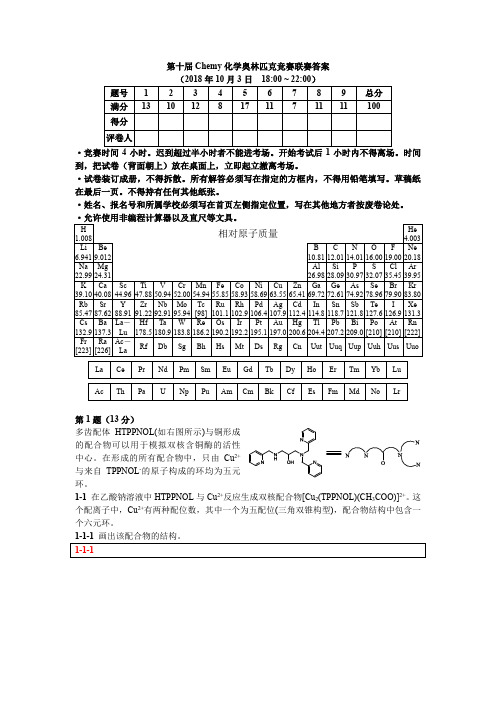
第十届Chemy化学奥林匹克竞赛联赛答案(2018年10月3日18:00 ~ 22:00)·竞赛时间4小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
·试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
·姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
·允许使用非编程计算器以及直尺等文具。
第1题(13分)多齿配体HTPPNOL(如右图所示)与铜形成的配合物可以用于模拟双核含铜酶的活性中心。
在形成的所有配合物中,只由Cu2+与来自TPPNOL-的原子构成的环均为五元环。
1-1 在乙酸钠溶液中HTPPNOL与Cu2+反应生成双核配合物[Cu2(TPPNOL)(CH3COO)]2+。
这个配离子中,Cu2+有两种配位数,其中一个为五配位(三角双锥构型),配合物结构中包含一个六元环。
(3分)1-1-2 将该配离子的盐溶于水,则溶液中仅存在两个Cu配位数一致的双核配合物,且其中两种主要配离子物种的浓度关系随pH关系如下图所示。
画出A和B的结构并指出pK a(A)。
已知C中没有六元环。
画出该配离子的结构。
2位构型相同,且仍保留了Cu2+-HTPPNOL配合物骨架的结构特点。
D中存在三个氧原子的化学环境与配位数均各不相同的碳酸根配体,不存在O-H键,且配离子整体存在对称中心。
(2分)1-4测量配合物的结构最重要的是获得其晶体结构数据,这往往需要选取合适的溶液体系,减小配离子在溶液中的溶解度并得到质量较好的晶体。
若需要测量D的晶体结构,试根据上述信息提出一条策略并作出简要解释。
第2题(10分)为纪念门捷列夫发现元素周期律150周年,国际纯粹和应用化学联合会将2019年设为“国际化学元素周期表年”。
门捷列夫预言了多种当时未知的元素,M即为其中之一。
实验培训题-物化

.,.. 物理化学实验竞赛试题(一)一、单项选择题1. 在差热分析实验中, 当使用WXC-200的双笔记录仪同时记录加热时的升温曲线和差热曲线时, 若已知试样在加热过程中既有吸热效应也有放热效应, 则差热曲线的基线应调在:( )(A) 记录仪量程范围内的任何位置(B) 记录仪的左端位置(C) 记录仪的中间位置(D) 记录仪的右端位置2 在测定水的饱和蒸气压实验中, 用缓冲瓶稳定体系的压力, 则调节体系压力的活塞的正确安装位置是:( )(A) 体系与缓冲瓶之间(B) 体系与U 型压力计之间(C) 缓冲瓶与抽气泵之间(C) 以上三种位置均不对3 H2O2分解反应的动力学实验中, 待反应进行了两分钟以后, 才开始收集生成的氧气并测量其体积,这是为了:( )(A) 赶走反应容器中的空气(B) 使反应溶液溶解氧气达到饱和(C) 使反应液混合均匀(D) 使反应达到平稳地进行4 测定相对粘度应用的计算公式,ηr = ηi/η0 = t i/t0需要的条件是:( )(A) 同一温度测定(B) 使用同一粘度计测定(C) 同一温度且使用同一支粘度计测定(D) 同一温度,使用同一支粘度计,且两个被测的液体密度相近5 在电导实验测定中,需用交流电源而不用直流电源其原因是:( )(A) 防止在电极附近溶液浓度发生变化(B) 能准确测定电流的平衡点(C) 简化测量电阻的线路(D) 保持溶液不致升温6 开启气体钢瓶的操作顺序是:( ) (1) 顺时针旋紧减压器旋杆;(2) 反时针旋松减压旋杆;(3) 观测低压表读数;(4) 观测高压表读数;(5) 开启高压气阀(A) 5─4─3─1 (B) 2─5─4─1─3(C) 1─5─4─2─3 (D) 2─5─17 在双液系气液平衡实验中, 常选择测定物系的折光率来测定物系的组成。
下列哪种选择的根据是不对的?(A) 测定折光率操作简单(B) 对任何双液系都能适用(C) 测定所需的试样量少(D) 测量所需时间少, 速度快8 已知环己烷、醋酸、萘、樟脑的摩尔凝固点降低常数K f 分别为6.5, 16.60, 80.25及173, 今有一未知物能在上述四种溶剂中溶解, 欲测定该化合物之摩尔质量, 最适宜的溶剂是:( )(A) 萘(B) 樟脑(C) 环己烷(D) 醋酸9 饱和标准电池在25℃时电动势为:( )(A) 1.01845 V(B) 1.01800 V(C) 1.01832 V(D) 1.01865 V.,.. 10 用对消法测量可逆电池的电动势时,如发现检流计光标总是朝一侧移动,而调不到指零位置,与此现象无关的因素是: ( )(A) 工作电源电压不足(B) 工作电源电极接反(C) 测量线路接触不良(D) 检流计灵敏度较低11 在差热分析中, 都需选择符合一定条件的参比物, 对参比物的要求中哪一点应该除外?(A) 在整个实验温度范围是热稳定的(B) 其导热系数与比热尽可能与试样接近(C) 其颗粒度与装填时的松紧度尽量与试样一致(D) 使用前不能在实验温度下预灼烧12. 在乙酸乙酯皂化速率常数测定中, 称取 a mg 乙酸乙酯, 而NaOH 的浓度为 c , 则它加入的体积为:( )(A) a2881⨯. ÷ c (ml) (B) a 881.÷c ×10-3(ml) (C) 88.1a÷c (ml)(D) a 2881⨯. ÷c ×10-3 (ml) 13 水等牛顿流体的粘度随剪切力的增大而( )(A)增大 (B)减小 (C)不变14 在做二组份气液平衡相图的实验中,取样管没有干燥,对测定结果的影响( )(A)很大 (B)无影响 (C)有影响,但不大15 在做二组份气液平衡相图的实验中,某一号溶液组成发生不大的变化,对测定结果的影响( )(A)很大 (B)无影响 (C)有影响,但不大16 在水中加入表面活性剂能使水与石蜡的接触角( )(A)减大 (B)增大 (C)不变17 在二组份金属相图的测定实验中,样品熔化后,在样品上面覆盖一层( ),可防止金属被氧化。
物化试卷(有答案)

一、单项选择题,每题3分,共24分。
1.为了测定电极的电极电势, 需将待测电极与标准氢电极组成电池, 这个电池的电动势就是待测电极电势的数值。
按照目前惯用的电池符号书写方式和IUPAC 对电极电势符号的规定, 待测电池符号应是 (A) (+)标准氢电极‖待测电极(-) (B) (-)待测电极‖标准氢电极(+) (C) (-)标准氢电极‖待测电极(+) (D) (+)待测电极‖标准氢电极(-) 2.一定温度和浓度的水溶液中,Li +、Na +、K +、Rb +的摩尔电导率依次增大的原因是: (A) 离子浓度依次减弱 (B) 离子的水化作用依次减弱 (C) 离子的迁移数依次减小 (D) 电场强度的作用依次减弱 3.使用表面活性物质时应当特别注意的问题是 (A) 两性型和非离子型表面活性剂不能混用 (B) 阳离子型和阴离子型表面活性剂不能混用 (C) 阳离子型和非离子型表面活性剂不能混用 (D) 阴离子型表面活性剂不能在酸性环境中使用 4. 表面活性剂在结构上的特征是(A) 一定具有磺酸基或高级脂肪烃基 (B)一定具有亲水基 (C)一定具有亲油基 (D)一定具有亲水基和憎水基5. 用化学方法测定反应速率的主要困难是(A) 很难同时测定各物质浓度 (B) 不能使反应在指定的时刻完全停止 (C) 不易控制温度 (D) 混合物很难分离 6. 与光化学基本定律有关的说法中正确的是 (A) 凡是被物质吸收了的光都能引起光化反应(B) 光化反应所得到的产物数量与被吸收的光能的量成正比 (C) 在光化反应中, 吸收的光子数等于被活化的反应物微粒数 (D) 在其它条件不变时, 吸收系数越大, 透过溶夷光强度也越大 7.溶胶系统最基本的特征是(A)微多相,热力学不稳定 (B)均相,热力学稳定 (C)光散射现象明显,渗透压小 (D)光散射现象弱,扩散极慢8.溶胶一般都有明显的丁达尔效应, 这种现象产生的原因是(A)分散相粒子对光强烈吸收 (B)分散相粒子对光强烈反射 (C)分散相粒子对光产生散射 (D)分散相粒子对光产生折射二、填空题,共21分,无特殊说明的每空2分。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2011~2012学年第一学期《物理化学》竞赛试题答案
出题:蔡洁 使用班级:化工、应化、环境、高分子10级
一、填空题。
在题中“____”处填上答案。
(本大题共10分,每题2分)
1、解: 减小
2、解:nC T V T T ,m d 1
2
⎰或nC V ,m ( T 2-T 1 )
3、解: 范德华常数a ,b 临界参数
4、解: -203.96 kJ ·mol -1
5、解: 315 J 二、是非题。
在题后括号内,正确的打“√”,错误的打“×”。
(本大题分10小题, 每,题2分,共20分)
1、解:是
2、解:不是
3、解:不是
4、解:对
5、解:不是
6、解:不对
7、解:是
8、解:不是
9、解:不是 10、解:不是 三、选择题。
填上正确答案代号。
(本大题分10小题, 每小题2分, 共20分) 1、解:(1) 2、解:(3) 3、解:(2) 4、解:( 3 ) 5、解:(3) 6、解:( 4 ) 7、解:(3) 8、解:(1) 9、解:(1) 10、解:( 4 ) 四、计算题。
( 本 大 题20分 )
解:设计如下途径计算:(3分)
(1)因真空蒸发, p 环=0 W=0 (2分)
Q =∆U = ∆H -∆(pV )
压力变化不大时,压力对凝聚系统的焓、熵影响不大,所以∆H 1=0、∆S 1=0。
又理想气体恒温 ∆H 3=0 ,所以 ∆H =∆H 1+∆H 2+∆H 3 =∆H 2 =n ∆ vap H m
则 Q =n ∆vap H m - p (V g -V l )= n ∆vap H m - pV g ≈n ∆vap H m - nRT
= 1×30770J -1mol ×8.3145 J·K -1·mol -1 ×353K = 27835J (3分)
(2)∆S =∆S 1+∆S 2+∆S 3=∆S 2+∆S 2= (∆H 2/T )+ nR ln(p /p )
真空等温蒸发
∆H 、∆S
∆H 3、∆S 3 (3)
(1) ∆H 1、∆S 1 苯 (l) 1 mol 353K ,θp
苯 ( l ) 1 mol 353 K
p = 101.325 k Pa
苯 ( g ) 1 mol 353 K ,θp
苯 (g ) 1 mol 353 K
p = 101.325 kPa
(2) ∆H 2、∆S 2
= (30770J/353K)+1×8.3145J ·K -1×ln(101.325kPa/100kPa) = 87.28J ·K -1(5分)
∆G =∆H - T ∆S = 30770J - 353K×87.28J·K -1= -39.84J (3分) (3)环境熵变 :
∆S 环= -Q 系/T 环= -27835J/353K =-78.85 J·K -1 (2分)
(4)可用熵判据判断过程的性质,此过程
∆S 隔=∆S 系+∆S 环= 87.28J·K -1+(-78.85J·K -1)= 8.43J·K -1 > 0
故为不可逆过程。
(2分)
五、计算题。
( 本 大 题11分 )
解:( 1 ) W = 0 (3分)
( 2 ) W = -p (外)∆V = -p (外)nRT (
)1121p p - = -0.1 MPa ×10 mol ×8.314 J ·mol -1·K -1×298 K ×(1/0.1 MPa -1/1.0 MPa) = -22.30 kJ (4分) ( 3 ) W = -nRT ln( V 2 / V 1 ) = nRT ln(p 2 / p 1) = -57.05 kJ (4分)
六、计算题。
( 本 大 题14分 ) 解:
22-33
3475.158811ln
101.38.314475.15293.150.152(5)
=0.152+101.3=101.450.152=1.510(4)
1101.3
101.45 1.5120
120/7.5(5)
8.314293
p Kp p Kp p Kp Kp Kp
V V M M W n g mol g g
⨯⎛⎫
=- ⎪
⎝⎭
==
⨯⨯⨯=⨯=
=⨯总油油油油分分分
即每立方米空气最多能带出7.5克的油。
更正说明: 475.15应为473.15,“W 油=…”一式中101.45应为101.3 七、证明题。
( 本 大 题5分 )
解: ∵d d d H T S V p =+ ∴T T
H S T V p P ⎛⎫∂∂⎛⎫
=+
⎪ ⎪∂∂⎝⎭⎝⎭ 椐麦克斯韦关系式 p T S V
p T ⎛⎫∂∂⎛⎫
= ⎪
⎪
∂∂⎝⎭⎝⎭- p T
H V V T p T ⎛⎫∂∂⎛⎫=- ⎪ ⎪∂∂⎝⎭⎝⎭。
