元素周期表综合练习
元素周期表元素周期律章节综合练习题附答案

元素周期表元素周期律章节综合练习题一、单选题1.下列说法中,不符合皿A族元素性质特征的是()A.从上到下原子半径逐渐减小B.易形成-1价离子C.最高价氧化物的水化物显酸性D.从上到下氢化物的稳定性依次减弱2.下列有关碱金属、卤素结构和性质描述正确的是( )①随着核电荷数的增加,碱金属单质、卤素单质的熔、沸点依次升高,密度依次增大②F、Cl、Br、I的最外层电子数都是7,次外层电子数都是8③碱金属单质的金属性很强,均易与氧气发生反应,加热时生成氧化物R2O④砹是原子序数最大的卤族元素,根据卤素性质的递变规律,At与比化合最容易⑤根据HF、HCl、HBr、HI的稳定性逐渐减弱的事实,推出F、Cl、Br、I的非金属性逐渐增强的规律⑥碱金属都应保存在煤油中⑦卤素按F、Cl、Br、I的顺序其非金属性逐渐减弱的原因是随着核电荷数增加,电子层数增多,原子半径增大起主要作用⑧碳酸铯不易发生分解反应生成氧化铯和二氧化碳A.全部正确B.⑦⑧C.①③⑤⑥⑦D.①③⑦⑧3.下列不能说明氯元素的非金属性比硫元素强的事实是( )①HCl比H2S稳定②HC1O氧化性比H2SO4强③HClO4酸性比H2so4强④Cl2能与H2s反应生成S⑤氯原子最外层有7个电子,硫原子最外层有6个电子A.②⑤B.①②C.①②④D.①③⑤4.下列说法正确的是( )A.第I A族元素的金属性比第IIA族元素的金属性强B.第W A族元素的简单气态氢化物中,稳定性最强的其沸点也最高C.同周期非金属元素的氧化物对应的水化物的酸性从左到右依次增强D.第二周期元素随族序数的递增,其最高化合价也递增©)))5.已知某原子的结构示意图为,下列说法正确的是()A.该元素位于第2周期第IIA族B.该元素位于第2周期第皿族C.该元素位于第3周期第IIA族D.该元素位于第3周期0族6.下列关于元素周期表的叙述正确的是( )A.周期表中有8个主族,8个副族B.目前使用的元素周期表中,最长的周期含有32种元素C.短周期元素是指1〜20号元素D.原子的最外层电子数都等于该元素所在的族序数7.下列关于卤族元素在周期表中由上到下性质发生递变的叙述中,正确的是()①单质的氧化性增强②单质的颜色加深③气态氢化物的稳定性增强④单质的沸点升高⑤阴离子的还原性增强A.①②③B.②③④C.②④⑤D.①③⑤8.氟、氯、溴、碘四种元素,它们的下列性质的递变规律不正确的是()A.单质的密度依次增大9.单质的熔点、沸点依次升高C.C12可从KI溶液中置换出I2D.气态氢化物的稳定性逐渐减弱,氯、溴、碘元素的氧化物对应水化物的酸性逐渐增强10如图所示为第I A族金属(又称为碱金属)元素的某些性质与核电荷数的变化关系,则下列各性质中不符合图示关系的是()A.金属性B.与水反应的剧烈程度C.阳离子的氧化性D.原子半径11.下列关于元素周期表的叙述中正确的是()A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数B.除零族外,由长、短周期元素共同组成的元素族称为主族C.主、副族元素的族序数从左到右都是依次由小到大排列(如I B〜皿B)D.元素周期表共七个横行代表七个周期,18个纵行代表18个族11.元素周期表是学习化学的重要工具,如图是元素周期表中的一格,从该图中,我们获取的相关信息中错误的是()2299A.该元素的名称是钠C.该元素在地壳中的含量为22.99%B.该元素的原子序数为11D.该元素的元素符号为NaII12.15号元素在元素周期表中的位置是( )A.第2周期VA族B.第2周期VIA族C.第3周期VIA族D.第3周期VA族13.原子序数为83的元素位于:①第五周期;②第六周期;③W A族;④V A族;⑤IIB族,其中正确的组合是( )A.①④B.②③C.②④D.①⑤14.下列说法正确的是( )A.碱性强弱顺序:LiOH〉NaOH〉KOH〉RbOHB.金属性强弱顺序:Rb〉K〉Na〉LiC.和酸反应时Fe失2个电子,Na失1个电子,所以Fe的金属性强于NaD.Rb不易与水反应放出H215.下图分别为元素周期表的一部分(数字为原子序数),其中X为35的是()L二、填空题16.碱金属与卤素是典型的金属元素和非金属元素。
高考化学元素周期律综合练习题含详细答案

高考化学元素周期律综合练习题含详细答案一、元素周期律练习题(含详细答案解析)1.已知元素X 、Y 均为短周期元素,X 元素的一种核素常用于测文物的年代,Y 元素原子半径是所有原子中最小的,元素X 、Y 可形成两种常见化合物M 和N ,已知M 可以使高锰酸钾酸性溶液褪色,M 分子中所含X 元素的质量是Y 元素质量的6倍,且M 的相对分子质量为56。
N 是一种常用溶剂,它的实验式XY 。
回答下列问题:(1)符合条件的M 的有 ______种。
(2)任意写一种不带支链的M 的结构简式__________。
(3)若在N 与液溴的混合液中加入铁粉可以发生反应(在如图装置a 容器中反应),则:①写出a 容器中发生的所有反应的化学方程式:_____________。
②d 容器中NaOH 溶液的作用是_____________。
(4)在碘水中加入N 振荡静置后的现象是__________。
(5)等质量M 、N 完全燃烧时消耗O 2的物质的量较多的是________(填“M ”或“N ”)。
【答案】3 CH 2=CH -CH 2-CH 3 2Fe +3Br 2=2FeBr 3、+Br 23FeBr −−−→+HBr 吸收HBr 和Br 2,防止污染环境 溶液分层,下层无色,上层紫红色 M【解析】【分析】短周期元素X 元素的一种核素常用于测文物的年代,则X 为碳(C );Y 元素原子半径是所有原子中最小的,则Y 为氢(H )。
元素X 、Y 可形成两种常见化合物M 和N ,已知M 可以使高锰酸钾酸性溶液褪色,M 分子中所含X 元素的质量是Y 元素质量的6倍,且M 的相对分子质量为56,则M 为分子式C 4H 8的烯烃;N 是一种常用溶剂,它的实验式XY ,则N 为苯(C 6H 6)。
【详解】由以上分析可知,M 是分子式为C 4H 8的烯烃,N 是分子式为C 6H 6的苯。
(1)符合条件的M 有CH 2=CHCH 2CH 3、CH 3CH =CHCH 3、(CH 3)2C =CH 2,共3种。
初中化学元素周期表经典综合大题练习卷

初中化学元素周期表经典综合大题练习卷
1. 下面关于元素周期表的说法正确的是什么?
A. 元素周期表是元素按一定规律排列形成的表格
B. 元素周期表纵向的列称为族,横向的行称为周期
C. 元素周期表的第1行是1个元素,第2行是2个元素,以此类推
D. 元素周期表中元素按照原子量从小到大排列
()
2. 元素周期表中,下列元素符号和名称匹配正确的是()
A. C:氢
B. H:氧
C. O:碳
D. Ca:钙
3. 下列属于金属元素的是()
A. 钠
B. 铁
C. 硫
D. 氯
4. 没有稳定同位素的元素是()
A. U
B. C
C. Cl
D. P
5. 根据元素周期表中元素位置及其化学性质,下列元素中,最容易发生化学变化的是()
A. 冠状病毒
B. 氧气
C. 蔗糖
D. 金属铝
6. 铜是一种常见的金属,铜最外层电子的排布情况是()
A. 1个S电子,1个D电子,1个P电子
B. 1个S电子,1个P 电子,2个D电子
C. 1个S电子,2个P电子,1个D电子
D. 1个S电子,2个D电子
7. 下列物质中能导通电的是()
A. 纯净水
B. 纯净酒精
C. 食盐水
D. 纯净石蜡
答案:
1. A
2. C
3. A、B
4. C
5. B
6. B
7. C。
初中化学元素周期表100道练习题

初中化学元素周期表100道练习题一、选择题(每题2分,共60分)1. 元素周期表是根据元素的什么性质排列的?(A)原子质量(B)原子序数(C)元素的单质(D)元素的氧化价答案:B2. 原子的核外电子称为什么?(A)质子(B)中子(C)电子(D)伽玛射线答案:C3. 下列元素中,哪个元素的原子序数最小?(A)氢(B)氧(C)铁(D)铜答案:A4. 具有相同元素符号的原子,它们的原子序数是否相等?(A)相等(B)不相等答案:B5. 元素周期表第一周期有几个元素?(A)2个(B)4个(C)8个(D)18个答案:A...二、填空题(每题3分,共30分)1. 具有相同原子序数的元素称为_____。
答案:同位素2. 原子的质子数等于其原子序数,如果一个元素的原子序数为17,那么它的质子数是_____。
答案:173. 氧的原子序数是_____, 其符号是_____。
答案:8,O4. 元素周期表上第一个周期只有两个元素,它们是氢和_____。
答案:氦5. 钠的原子序数是_____, 其符号是_____。
答案:11,Na...三、简答题(每题10分,共10分)1. 请简要介绍一下元素周期表的发现和组成原理。
答案:元素周期表是由德国化学家门捷列夫于1869年发现的。
它根据元素的原子序数,将元素按照递增的顺序排列,同时根据元素的化学性质划分为不同的周期表们,周期表的行称为周期,列称为族。
元素周期表的设计整齐清晰,方便研究和记忆各个元素的性质和特点。
...四、综合题(每题15分,共15分)1. 下表是某元素周期表的一部分,请填写表格中的缺失信息:| 元素符号 | 原子序数 | 原子质量 |答案:- Be的原子质量:9.012- B的原子序数:5- N的原子序数:7- O的原子序数:8...注意:以上题目仅供参考,具体题目和答案还需根据实际情况进行调整。
九年级化学元素周期表专项练习
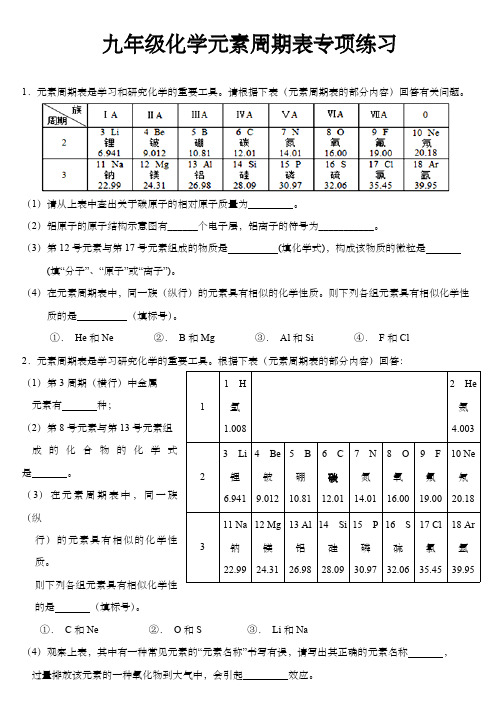
九年级化学元素周期表专项练习1.元素周期表是学习和研究化学的重要工具。
请根据下表(元素周期表的部分内容)回答有关问题。
(1)请从上表中查出关于碳原子的相对原子质量为 。
(2)铝原子的原子结构示意图有______个电子层,铝离子的符号为___________。
(3)第12号元素与第17号元素组成的物质是 (填化学式),构成该物质的微粒是 (填“分子”、“原子”或“离子”)。
(4)在元素周期表中,同一族(纵行)的元素具有相似的化学性质。
则下列各组元素具有相似化学性质的是 (填标号)。
①. He 和Ne②. B 和Mg③. Al 和Si④. F 和Cl2.元素周期表是学习研究化学的重要工具。
根据下表(元素周期表的部分内容)回答:(1)第3周期(横行)中金属元素有 种;(2)第8号元素与第13号元素组成的化合物的化学式是 。
(3)在元素周期表中,同一族(纵行)的元素具有相似的化学性质。
则下列各组元素具有相似化学性的是 (填标号)。
①. C 和Ne②. O 和S③. Li 和Na(4)观察上表,其中有一种常见元素的“元素名称”书写有误,请写出其正确的元素名称 ,过量排放该元素的一种氧化物到大气中,会引起 效应。
11 H 氢1.0082 He 氦4.00323 Li 锂6.941 4 Be 铍9.012 5 B 硼10.81 6 C 碳12.017 N 氮14.018 O 氧16.009 F 氟19.0010 Ne 氖20.18311 Na 钠22.9912 Mg 镁24.3113 Al 铝26.9814 Si 硅28.0915 P 磷30.9716 S 硫32.0617 Cl 氯35.4518 Ar 氩39.95(5)聚合物锂离子电池被誉为“21世纪的电池”,根据上图元素周期表中锂元素的相关信息,回答下列问题:锂元素在化学反应中容易 (填“得到”或“失去”)电子;锂元素与第17号元素组成的化合物的化学式是 。
元素与元素周期表练习题

元素及元素周期表一.选择题:1.地壳中含量最多的金属元素是 ( )A .氧B .硅C .铝D .铁2.决定元素种类的是 ( )A .质子数B .电子数C .中子数D .核外电子数3.下列化学符号中数字表示的意义正确的是 ( )A .CO 2:“2”表示一个二氧化碳分子含有两个氧原子B .2Na :“2”表示两个钠元素C . :“+2”表示镁离子带有两个单位正电荷D .S 2- :“2–”表示硫元素的化合价为负二价4.某粒子的结构示意图如图所示,对该粒子的说法错误的是( )A .核电荷数为12B .核外有3个电子层C .带12个单位正电荷D .在化学反应中,易失去最外层上的2个电子5.根据右图提供的信息,下列说法正确的是( )A .钠原子最外层有11个电子B .钠的相对原子质量是22.99gC .钠属于非金属元素D .钠的原子序数为116.生活中常接触到“加碘食盐”、“高钙牛奶”,其中的“碘”和“”应理解为( ) A.单质 B.分子 C.元素 D.原子7.最近,“镉大米”成为公众关注的热点问题之一。
据了解,含镉的大米对人的肝肾损害比较大。
镉(Cd)的原子序数为48,中子数为64,下列说法错误的是( )A 、镉原子的质子数为48B 、镉原子的相对原子质量为112gMg+2C、镉是金属元素D、镉原子的核外电子数为488.正确读写化学符号是学好化学的基础。
铝元素符号书写正确的是()A.ALB.alC.aLD.Al9.硒被誉为“抗癌大王”。
根据右图提供的硒的有关信息,下列说法中,正确的是()A.硒属于金属元素B.硒的原子序数是34C.硒的原子结构示意图中x=4 D.硒的相对原子质量是78.96 g10.近来中国部分地区出现镉污染的大米,食用后对人体有害。
下列有关镉的说法中错误的..是()A.镉的原子序数是48 B.镉属于非金属元素C.镉的元素符号是Cd D.镉的相对原子质量是112.411.氦是太阳中含量较多的元素,其元素符号为()A.H B. He C. N D.Cl12.我市盛产茶叶,“雪青”“清润茗芽”等绿茶享誉省内外。
元素周期表习题

元素周期表练习1、元素的种类和原子的种类( )A、前者大B、后者大C、相同 D.无法确定2、在元素周期表中,第3周期和第4周期里元素的数目 ( )A、前者大B、后者大C、相等D、不能确定3、元素周期表中,周期的划分依据是()A.元素的核电荷数B.元素的化合价C.元素原子的电子层数D.元素原子的最外层电子数4、下列说法中,错误的是()A.位于同一周期的元素原子具有相同的电子层数B.位于同一主族的元素原子具有相同的最外层电子数C.IA族元素原子的最外电子层都只有1个电子,所以IA族元素均为活泼金属元素D.稀有气体元素所在的族称为0族,其原子的最外电子层不都为8电子结构5、下列说法正确的是()A、非金属元素(稀有气体除外)都是主族元素B、元素种数最多的族是第Ⅷ族C、主族元素都是短周期元素D、短周期元素都是主族元素6、在元素周期表中,第3、4、5、6周期元素的数目分别是()A.8、18、32、32 B.8、18、18、32C.8、18、18、18 D.8、8、18、187、医学研究证明,用放射性53135I治疗肿瘤可收到一定疗效,下列有关53135I的叙述正确的是 ( )A. 53135I位于元素周期表中第4周期ⅦA族B.53135I是一种新发现的元素C.53135I核内的中子数与核外电子数之差为29D. 53153I是碘的一种同素异形体8、下列说法正确的是( )①氘和氚在元素周期表中位置相同②氢元素是指11H ③11H、21H、31H是氢元素的三种核素④21H和31H的化学性质几乎完全相同A.②③B.③④C.①③④D.②③④9、某元素二价阳离子核外有18个电子,质量数为42,该元素原子的原子核中的中子数为( )A. 18B. 20C. 22D. 1610、下列说法中正确的是 ( )A、每一周期的元素都是从碱金属开始,最后以稀有气体结束B、同一周期从左到右,各元素原子核的电子数都是从1个逐渐增加到8个C、同一主族相邻周期元素的原子核外电子数肯定相差8个D、已发现的主族元素中,全部为金属的是第ⅡA族,全部为非金属的是第ⅦA A族。
(完整版)元素周期表练习题(附答案)

元素周期表练习题 一、选择题(每小题只有1个选项符合题意)[ ]1.下列关于元素周期表的说法,错误的是A.元素周期表是元素按原子量大小排列而成的B.从第一周期到第三周期元素,其原子的价电子数和族数是一致的C.主族元素中(氢除外)族序数越小的元素,其最高价氧化物的水化物碱性越强D.元素周期表是元素周期律的具体表现形式[ ]2.下列各图若为元素周期表的一部分(表中数字为原子序数),其中正确的是[ ]3.下列各组中的元素用原子序数表示,其中都属于主族的一组元素是A.2、4、6 B.19、20、21C.1、3、5 D.8、16、18[ ]4.主族元素在周期表中的位置取决于元素原子的A.原子量和核外电子数 B.电子层数和最外层电子数C.原子量和最外层电子数 D.电子层数和次外层电子数二、选择题(每小题有1或2个选项符合题意)[ ]6.下列关于周期表中第三周期元素性质从左到右变化趋势的叙述,错误的是A.最高正价依次升高B.气态氢化物稳定性逐渐增强C.原子半径逐渐增大D.最高价氧化物对应的水化物碱性逐渐减弱,酸性逐渐增强[ ]7.下列气态氢化物中,按稳定性由强到弱的顺序排列的是A.HI、HBr、HCl、HF B.HCl、H2S、PH3、SiH4C.H2O、H2S、HCl、HBr D.HF、H2O、NH3、CH4[ ]8.下列各组元素最高价氧化物对应水化物碱性渐弱,酸性渐强的是A.NaOH、Mg(OH)2、H3PO4、H2SO4B.KOH、NaOH、H2SO4、HClO4C.Be(OH)2、Ca(OH)2、HBrO4、HClO4D.Mg(OH)2、Ba(OH)2、H3PO4、H2SO4[ ]9.同主族3种元素X、Y、Z,已知它们的最高价氧化物对应水化物的酸性HXO4>HYO4>HZO4则下列判断正确的是A.原子半径X>Y>Z B.气态氢化物稳定性HX<HY<HZC.非金属性X>Y>Z D.气态氢化物还原性HX>HY>HZ[ ]10.R元素的原子有3个电子层,M层电子数是K层电子数的3倍,对R元素的判断不正确的是A.R元素处于3周期ⅥA族B.R元素是较活泼的非金属元素C.原子核外共有14个电子D.元素最低化合价为-2价[ ]11.某元素Y的核外电子数等于核内中子数,取2.8 g该元素的单质与氧气充分反应,可得6.0g化合物YO2,则该元素在周期表中位置A.第三周期 B.第二周期C.第ⅣA族 D.第Ⅴ族[ ]12.短周期中的两种元素X和Y,X的原子序数大于Y,X原子的最外层电子数是内层电子总数的一半,Y的二价阴离子和Ne原子的电子层结构相同,关于X和Y形成的化合物Z的说法正确的是A.Z是酸性氧化物B.Z的水化物是碱C.Z的化学式为X2Y D.Z的水化物的酸性强于硫酸[ ]13.A、B、C 3种元素的核外电子数都比氩原子少,若A和C处于同一主族,A和B的核电荷数之差为5,B原子的M电子层比L电子层少2个电子,则A、B、C 3种元素分别为A.Li、Na、S B.Na、S、LiC.Na、K、Br D.K、Br、Na[ ]14.X和Y 2元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素的阳离子半径,Z和Y两元素的原子核外电子层数相同,Z元素的原子半径小于Y元素的原子半径,X、Y、Z3种元素原子序数的关系是A.X>Y>Z B.Y>X>Z C.Z>X>Y D.Z>Y>X[ ]15.短周期元素X和Y能形成XY4化合物,若X的原子序数为m,Y的原子序数为n,则m和n 不可能的关系是A.m-13=n B.n+5=m C.m+8=n D.n-11=m[ ]16.某元素原子最外电子层上只有两个电子,该元素A.一定是金属元素B.一定是ⅡA族元素C.一定是过渡元素D.可能是金属元素,也可能不是金属元素三、填空题1.在短周期元素中:①金属性最强的元素是________,与水反应最剧烈的非金属是________;②地壳中含量最丰富的元素位于第________周期第________族,地壳中含量最多的金属元素位于周期表的第________周期第________族.在11~18号的元素中;③原子半径最小的元素是________,阳离子半径最小的是________,阴离子半径最小的是________;④最高价氧化物中既能与盐酸,又能与烧碱反应的有________.2.在短周期元素中:原子核外电子总数是其最外层电子数2倍的元素是________,原子电子层数和核外最外层电子数相等的元素是________,最外层电子数为电子层2倍的元素是________.3.已知X、Y是前20号元素,X、Y的最外层有n和m-5个电子,次外层有n+2和m个电子,则X、Y为________和________(写出元素符号).4.某元素的原子具有3个电子层,最外电子层上有5个电子,它在周期表中的位置是________,它的最高价氧化物的化学式是________,最高价氧化物对应的水化物的化学式是________.写出它与足量烧碱溶液反应的离子方程式________.5.原子序数为34的元素在周期表中的位置________.其最高价氧化物的化学式________,最高价氧化物对应水化物的化学式________,气态氢化物的化学式________.6.A、B、C 3种短周期元素,A、B为同一周期,B的原子序数比A的原子序数大1,B和C的原子最外层电子数相同,B原子比C原子多8个电子,3种元素的原子序数之和为33,3种元素原子最外层电子数之和为11,则3种元素的名称分别是A________、B________、C________,其中原子半径最大的元素(写元素符号)________,写出3种元素最高价氧化物对应水化物的化学式(按酸性逐渐增强的顺序排列)________.7.取钠、镁、铝的单质各1g,分别与足量盐酸反应,产生氢气最快的是________,产生氢气最多的是________,反应中失电子数目最多的是________,还原性最强的是________,生成氢气的物质的量之比是________. 一、1.A,2.D,3.A,4.B,二、6.C,7.B、D,8.A、B,9.C,10.C,11.A、C,12.A,13.B,14.D,15.C,16.D三、1.①Na,F2;②2、ⅥA,3、ⅢA;③Cl,Al3+,Cl-;④Al2O32.Be,H、Be、Al,He、C、S.3.S、Al5.4周期ⅥA族;SeO3,H2SeO4,H2Se6.铝、硅、碳、Al,Al(OH)3<H4SiO4<H2CO37.钠,铝,铝,钠,36∶69∶92四、A、B、C、D4种元素分别为H、N、S、K,(略). 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
元素周期表综合练习
⒈下列说法中正确的是( )
(A )非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
(B )非金属元素呈现的最低化合价的绝对值等于该元素原子的最外层电子数
(C )最外层有2个电子的原子都是金属原子
(D )最外层有5个电子的原子都是非金属原子
⒉第七周期为不完全周期,若把这一周期元素全部排满,下列有关推论错误的是( )
(A )第七周期排满时有32种元素 (双选)
(B )第七周期排满时最后一种单质不与任何物质发生化学反应
(C )第七周期第ⅦA 族元素原子序数为117,是一种金属元素
(D )第七周期第ⅢA 族元素的氢氧化物与Al(OH)3具有相似的化学性质
⒊已知X 、Y 、Z 三种主族元素在周期表中的相对位置如图所示,且X 的
原子序数为a ,下列说法不正确的是( )
(A )Y 、Z 的原子序数之和可能为2a (B )Y 的原子序数可能是a-17
(C )Z 的原子序数可能是a+31 (D )X 、Y 、Z 一定都是短周期元素
⒋若短周期中的两种元素可以形成原子个数比为2∶3的化合物,则这两种元素的原子序数之差不可能是( )
(A )1 (B )3 (C )5 (D )6
⒌a X n-和b Y m+是由短周期元素形成的简单离子,已知a X n-比b Y m+多两个电子层,下列说法不正确的是( )
(A )X 可能是第三周期元素 (B )Y 不可能是第二周期元素
(C )b小于或等于4 (D )a-b+m+n 等于10或16
⒍下表为元素周期表的一部分,请回答有关问题:
(1)⑤和⑧的元素符号是 和 ;
(2)表中最活泼的金属是 ,非金属最强的元素是 ;(填写元素符号)
(3)表中能形成两性氢氧化物的元素是 ,分别写出该元素的氢氧化物与⑥、⑨
最高价氧化物的水化物反应的化学方程式: , ;
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:
⒎X、Y、Z和W代表原子序数依数增大的四种短周期元素,它们满足以下条件:①元素周期表中,Z与Y相邻,Z与W也相邻;②Y、Z和W三种元素的原子最外层电子数之和为17。
(1)Y、Z和W三种元素是否位于同一周期(填“是”或“否”),理由是。
(2)Y是,Z是,W是。
(3)X、Y、Z和W可组成一化合物,其原子个数之比为8∶2∶4∶1,写出该化合物的名称及化学式。
⒏已知X、Y、Z都是短周期的元素,它们的原子序数依次递增,X原子的电子层数与它
的核外电子总数相同,而Z原子的最外层电子数是次外层的三倍,Y和Z可以形成两种以上气态化合物,则:
(1)X是,Y是,Z是;(2)由Y和Z组成,有Y和Z的质量比为7∶20的化合物的化学式(分子式)是。
(3)由X、Y、Z中的两种元素组成,且与X2Z分子间具有相同电子数的两种离子是和。
(4)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子的个数比为4∶2∶3,该盐的化学式(分子式)是。
⒐X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层电子数与次外层电子数相等,X与W、Y与Z这两对原子的最外层电子数之和均为9。
单质Y和W都可与浓NaOH溶液反应。
请回答下列问题:
(1)Y、Z、W的原子半径由小到大的顺序是。
(2)工业生产单质Y的原理是(用化学方程式表示)。
(3)X与Y化学性质类似,则X与浓的NaOH溶液反应的化学方程式是。
(4)0.1 mol 的单质W与50 mL 1.5 mol/L的FeBr2溶液反应,则被氧化的Fe2+和Brˉ的物质的量之比是。
⒑设X、Y、Z代表3种元素。
已知:①X+和Yˉ离子具有相同的电子层结构;②Z元素原子核内质子数比Y原子核内质子数少9个;③Y和Z两种元素可以形成4核42个电子的负一价离子。
据此,请填空:
⑪写出X、Y、Z三种元素的名称:X ;Y ;Z
⑫写出X、Y两种元素的最高价氧化物对应水化物相互反应的离子方程式
⒒通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子。
B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀,请回答:
⑪用化学符号表示下列4种微粒:A ;B ;C ;D
⑫写出A、B、E三种微粒反应的离子方程式
⒓短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5。
X元素原子最外层上的电子数是Y和Z两元素原子最外层上的电子数的总和;Y元素原子的最外层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物。
⑪X元素的名称是,Y元素的名称是,Z元素的名称是
⑫XZ3化合物的分子式是
⑬分别写出X、Y的含氧酸的分子式、
⒔X、Y、Z、M、N为短周期的五种主族元素,其中X、Z同主族,Y、Z同周期,M与X、Y既不同族,也不同周期。
X原子最外层电子数是核外电子层数的3倍,Y的最高化合价与其最低化合价的代数和等于6。
N是短周期主族元素中原子半径最大的非金属元素。
⑪写出下列元素的元素符号:X ;Y ;M
⑫写出N单质与NaOH溶液反应的离子方程式
⑬Y与Z相比,非金属性较强的元素是,可以证明该结论的实验是(用离子方程式表示)
⒕A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。
其中B的单质为双原子分子,它与A的单质可形成分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期中简单离子半径最小的元素;E元素的原子最外层比次外层少两个电子;C、F两种元素的原子最外层共有13个电子。
⑪B的原子结构示意图
⑫B、C、E分别与A形成的化合物中最稳定的是(写化学式)
⑬C与D形成的化合物的化学式是,它的性质决定了它在物质的分类中应属于;请写出该化合物的水化物的电离方程式
⑭F的单质在反应中常作剂,该单质的水溶液与E的低价氧化物反应的离子方程式为
⒖A、B、C、D、E、F为原子序数依次增大的主族元素,已知A、C、F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应生成盐和水,D元素原子的最外层电子数比次外层电子数少4,E元素原子次外层电子数比最外层电子数多3。
⑪写出下列元素的符号:A ;D ;E
⑫A、C两种元素最高价氧化物的水化物反应的离子方程式为
⑬工业上制取单质D的反应方程式为
⒗有A、B、C、D、E五种短周期元素,它们的核电荷数按C、A、B、D、E的顺序增大。
C、D都能分别与A按原子个数比1∶1或2∶1形成化合物。
CB可与EA2反应生成C2A与气态物质EB4。
⑪写出五种元素名称:A ,B ,C ,D ,E
⑫画出E的原子结构示意图
⑬比较EA2与EB4的熔点高低> (用化学式表示)
⑭含D元素的化合物在高温灼烧时火焰呈色。
参考答案:
⒈A ⒉BD ⒊D ⒋D ⒌B
⒍(1)S、Ar;(2)K,F;(3)Al,2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O、
Al(OH)3+KOH=KAlO2+2H2O;(4)向试管中的溴化钠溶液中滴入新制的氯水,溶液呈橙黄色,然后加入2mL四氯化碳,振荡,静置,若四氯化碳层呈橙红色,说明氯的非金属性比溴强。
⒎(1)否若三者处于同一周期,则最外层电子数之和不可能为17
(2)N O S
(3)硫酸铵(NH4)2SO4
⒏(1)氢氮氧;(2)N2O5;(3)NH4+OH-或H3O+;(4)NH4NO3。
⒐(1)Cl<S<Al (2)2Al2O34Al+3O2↑
(3)Be+2NaOH+2H2O=Na2Be(OH)4+H2↑或Be+2NaOH=Na2BeO2+H2↑(4)3:5 ⒑⑪钾氯氧⑫H++OH-=H2O
⒒⑪H2O NH3NH4+OH-
⑫Al3++3NH3+3H2O=Al(OH)3↓+3NH4+或Mg2++2NH3+2H2O=Mg(OH)2↓+2NH4+
⒓⑪氮碳氢⑫NH3⑬HNO3或HNO2H2CO3或H2C2O4等有机酸
⒔⑪O Cl H ⑫Si+2OH-+H2O=SiO32-+2H2↑⑬Cl Cl2+S2-=2Cl-+S↓
⒕⑪氮的原子结构示意图(略)⑫H2O ⑬Al2O3两性氧化物电离方程式略
⑭氧化SO2+Cl2+2H2O=4H++SO42-+2Cl-
⒖⑪Na Si P ⑫Al(OH)3+OH-=[Al(OH)4]-⑬SiO2+2C Si+2CO↑
⒗⑪氧氟氢钠硅⑫硅的原子结构示意图略⑬SiO2SiF4⑭黄。
