6氧化铝晶型及相变温度
晶型转变的影响因素
影响晶型转变的因素众所周知,结构决定性质,而对于晶体来说,当外界条件变化时,晶体结构形式发生改变,碳、硅、金属的单质、硫化锌、氧化铁、二氧化硅以及其他很多物质都具有这一现象,所以本文通过查阅文献举例说明影响晶型的一些因素,主要有温度、压力、粒度和组成。
一、温度温度对晶型影响比较复杂,当温度升高时,晶体中的分子或某些离子团自由旋转,取得较高的对称性,而改变晶体的结构。
下面举例说明:(1) BaO·Al2O3·SiO2(BAS)系微晶玻璃的主晶相为钡长石。
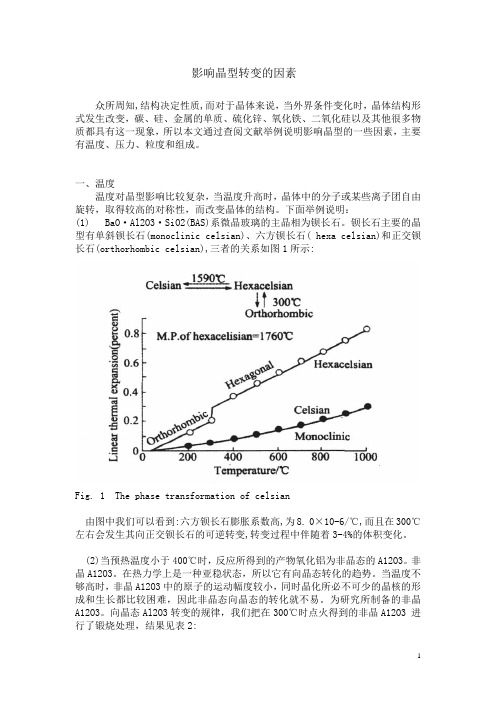
钡长石主要的晶型有单斜钡长石(monoclinic celsian)、六方钡长石( hexa celsian)和正交钡长石(orthorhombic celsian),三者的关系如图1所示:Fig. 1 The phase transformation of celsian由图中我们可以看到:六方钡长石膨胀系数高,为8. 0×10-6/℃,而且在300℃左右会发生其向正交钡长石的可逆转变,转变过程中伴随着3-4%的体积变化。
(2)当预热温度小于400℃时,反应所得到的产物氧化铝为非晶态的A12O3。
非晶A12O3。
在热力学上是一种亚稳状态,所以它有向晶态转化的趋势。
当温度不够高时,非晶A12O3中的原子的运动幅度较小,同时晶化所必不可少的晶核的形成和生长都比较困难,因此非晶态向晶态的转化就不易。
为研究所制备的非晶A12O3。
向晶态Al2O3转变的规律,我们把在300℃时点火得到的非晶A12O3 进行了锻烧处理,结果见表2:Fig.1 XRD Patterns of Produets kept for 1.5h at 700一900℃Fig.2 XRD Pattems of produets kept for o.5h at l000一l200℃Fig.3 XRD Pattems of produets kept for o.5h at l000℃ and l200℃Fig.4 XRD Pattems of produets kept for different time at l000℃Fig.5 XRD Pattems of produets kept for different time at 1100℃从图1中可以看到,非晶态的氧化铝经700、800、900℃锻烧1.5h后,氧化铝从非晶态转变为r-A12O3,并且随着温度的升高r- A12O3。
氧化铝晶型

γ-Al2O3、η-Al2O3、κ-Al2O3、χ-Al2O3、θ-Al2O3、α-Al2O3
、ρ-Al2O3和无定形相,共8种晶相。
ρ-Al2O3是结晶度最差,常温有胶结性能,500度后转变为γ-Al2O3,1000度后全变为α-Al2O3。
α-Al2O3在常温与高温都是稳定相。
即平时的刚玉材料的主晶相。
α-Al2O3也叫煅烧氧化铝,具有熔点高、硬度大、绝缘性能强、耐磨性好、化学性质稳定等特点。
广泛用于耐火材料、绝缘器材、集成电路基板、磨料磨具、陶瓷材料等许多领域。
α型氧化铝不溶于水和酸,工业上也称铝氧,是制金属铝的基本原料;也用于制各种耐火砖、耐火坩埚、耐火管、耐高温实验仪器;还可作研磨剂、阻燃剂、填充料等;。
氧化铝晶型及相变温度

AI2O3晶型转变AI2O3 晶型转变(trans for mation of AI2O3)AI2O3各晶型之间发生的转变。
AI2O3的晶型有:a、丫、n、3、B、k、x等。
外界条件改变时,晶型会发生转变。
在AI2O3这些变体中,只有a -AI2O3(刚玉)是稳定的,其它晶型都是不稳定的,加热时都将转变成 a -AI2O3o因为a -AI2O3中的氧已是最紧密堆集。
a -AI2O3密度为 3.99g/cm3。
除刚玉外,常见的AI2O3晶型为丫-AI2O3。
丫-AI2O3具有尖晶石型结构。
但在其结构中,某些四面体的空隙没有被充填,因而丫-AI2O3的密度较刚玉小。
丫-AI2O3的密度为3.65g/cm3。
各种AI(OH)3加热脱水时,约在450 C形成丫-AI2O3o 丫-AI2O3加热到较高温度转变为刚玉。
但这种转变要在1000 C以上时,转化速度才比较大。
氧化铝的其它一些不稳定晶型也都是AI(OH)3加热脱水时,在不同条件下形成的。
P -AI2O3应为无定形态,但也有人认为它是介于无定形与晶态之间的过渡态。
由于p -AI2O3是AI2O3各种形态中唯一在常温下能自发水化的形态,可以作为耐火材料浇注料的胶结剂,因此近年来受到了重视。
3 -AI2O3(密度3.31g/ cm3)不是纯AI2O3,不属于AI2O3 一元系,其化学式为Na2O?11AI2O3。
由于3 -AI2O3开始发现时忽视了Na2O的存在,而被误认为是AI2O3的一种变体,采用了3 -AI2O3这一名称,并沿用至今。
当刚玉处于高温、碱金属气氛下,即可转变成 3 -AI2O3。
3 -AI2O3在高温下也会逸出碱金属氧化物而转化为刚玉。
氧化铝含有元素铝和氧。
若将铝矶土原料经过化学处理,除去硅、铁、钛等的氧化物而制得的产物是纯度很高的氧化铝原料,AI?O?含量一般在99%以上。
矿相是由40%〜76%的Y Al ?O?和24%〜60%的a- AI?O?组成。
氧化铝熔点

氧化铝熔点氧化铝(Al2O3)是一种常见的无机化合物,也是铝的最常见的氧化物。
它具有多种应用领域,如陶瓷制品、催化剂、绝缘体等。
了解氧化铝的物理性质是理解其应用和性能的关键。
其中一个重要的物理性质是其熔点。
本文将详细介绍氧化铝的熔点、其影响因素以及相关的应用。
氧化铝的熔点是指氧化铝从固态转变为液态的温度。
熔点是物质的固态和液态之间的平衡点。
对于氧化铝来说,其熔点是非常高的,约2050摄氏度(3722华氏度)。
这意味着在常温下,氧化铝呈固态存在。
高熔点是氧化铝的一个重要特性,使其可在高温环境下应用。
氧化铝的高熔点是由其晶体结构决定的。
氧化铝具有六方密堆积晶体结构,其中铝离子和氧离子呈了十二面体的配位关系。
这种结构使得氧化铝具有较高的结晶能,从而导致了高熔点。
此外,氧化铝的高熔点还归因于其强烈的离子键。
在高温下,离子键需要克服巨大的能量才能断裂,从而使氧化铝能够保持其固态结构。
氧化铝熔点的高温特性使其非常适合在高温环境中使用。
它具有优异的耐高温性能,可承受高温下的腐蚀和氧化。
这使得氧化铝成为许多高温应用领域的理想选择,如耐火材料、高温陶瓷和涂料等。
其高熔点还使氧化铝成为制备其他高熔点化合物和合金的重要原料。
除了高温应用,氧化铝还具有许多其他应用领域。
作为陶瓷的主要成分,氧化铝在陶瓷制品中发挥着重要的作用。
由于其高熔点和优异的耐磨性,氧化铝被广泛应用于陶瓷制品,如瓷砖和瓷器。
此外,氧化铝还用作催化剂的载体。
其高表面积和化学稳定性使氧化铝成为催化剂的理想基础材料。
尽管氧化铝的熔点很高,但通过添加某些添加剂,可以降低其熔点。
例如,在制备氧化铝陶瓷时,常用的添加剂如氧化铁或氧化镁可以降低氧化铝的熔点。
这样可以降低烧结温度,提高制备效率。
此外,氧化铝纳米颗粒的熔点也可能不同于大块氧化铝的熔点。
纳米颗粒的尺寸效应可能会导致熔点的变化。
总结一下,氧化铝具有较高的熔点(约2050摄氏度/3722华氏度),这使得它在高温应用中表现出色。
氧化铝晶体空间结构

氧化铝晶体空间结构
氧化铝有多种变体,其中最为人们所熟悉的是α型氧化铝和γ型氧化铝,二者均为白色无定形粉末。
自然界存在的刚玉为α型氧化铝,该晶体属于六方紧密堆积构型,氧原子按六方紧密堆积方式排列,6个氧原子围成一个八面体,在整个晶体中有三分之二的八面体孔穴为铝原子所占据。
由于这种紧密堆积结构,再加上晶体中铝离子与氧离子之间的吸引力强,晶格能大,所以α型氧化铝的熔点(2288K)和硬度(8.8)都很高。
γ型氧化铝只在低温条件下存在,强热至1273K可转化为α型氧化铝,γ氧化铝晶体属于立方面心紧密堆积构型,铝原子不规则地排列在由氧原子围成的八面体和四面体孔穴中。
还有一种为β型氧化铝,有离子传导能力(允许钠离子通过),金属铝表面的氧化铝薄膜为氧化铝的另外一种变体。
严格地说,氧化铝属于过渡型化合物,其主要为离子型而含部分共价型。
浅析氢氧化铝在高温焙烧过程中结构与性能的变化

浅析氢氧化铝在高温焙烧过程中结构与性能的变化摘要:氢氧化铝煅烧是生产氧化铝的关键性工序,对产品质量、生产产量、能耗等方面有着直接的影响,所以深入研究分析氢氧化铝高温焙烧的结构与物相变化情况,有利于调整焙烧工艺。
本文主要探索氢氧化铝焙烧中结构与性能变化,为生产效率提升起到积极作用。
关键词:高温焙烧;氢氧化铝;结构与性能;变化分析引言氢氧化铝煅烧是氧化铝生产的最后一道工序,其能耗占总生产环节能耗的10%左右。
氢氧化铝煅烧工序对氧化铝产量、质量、能耗方面影响巨大,所以深入研究分析氢氧化铝煅烧理论、工艺与设备是极为关键的。
氢氧化铝在焙烧炉内脱水与相变来说,会产生较大的复杂性变化,是物理与化学变化的过程。
在该过程中,影响因素比较多,这些因素包含原始氢氧化铝制备方法、粒度、杂质等方面,并且杂质不同种类、含量、焙烧条件等会给氢氧化铝结构与性能产生影响[1]。
具体来说,主要包含下述几点:(1)脱除附着水,该环节温度处于100~110℃之间。
(2)脱除结晶水,该环节温度处于130~190℃之间。
(3)晶型转变,这个温度大概是1200℃,此时,氢氧化铝全部转变为α-Al2O3。
氧化铝技术人员非常重视相关理论基础的研究,以便进一步完善工艺条件。
氢氧化铝煅烧工艺包含传统回转窑工艺,改进回转窑工艺和流态化焙烧工艺三个阶段。
无论是传统的回转窑焙烧工艺还是改进的回转窑焙烧工艺,传热效果都不太理想。
而流态化焙烧工艺具有明显优势,如热效率高,热耗低;产品质量好;设备简单,寿命长、维修费用低;对环境污染低等。
1氢氧化铝焙烧工艺化铝焙烧炉系统有喂料、干燥器、预热系统、加热炉、焙烧炉、冷却器、除尘、反灰等多个部分。
喂料系统内,设备为螺旋喂料器,经过过滤机后的氢氧化铝原料,利用皮带直接传输到料仓内,并通过喂料机直接传输到干燥器上。
这部分物料的附着水含量约为5%,温度约30 ℃,物料在干燥器中被250~300 ℃的烟气加热,附着水蒸发,然后将物料送入旋风分离器[2]。
氧化铝质量标准

--内控质量标准氧化铝内控质量标准2014─XX─XX批准2014─XX─XX实施1.目的:为规定氧化铝的质量标准控制范围,特制定本标准。
2.范围:适用于氧化铝的质量评价。
3.责任人:实验室主任、检验员、质量监督员。
4.内容4.1物料的基本信息4.2定性和定量限度要求4.3标准正文【性状】本品为白色晶体,不应有杂物和团块。
【检查】(1)水分将坩埚置于300±10℃的马弗炉中,干燥1h,取出置于干燥器中,冷却30min,称量,精确至0.1mg。
称取试样约5g,精确至0.1mg,置于马弗炉中,控制温度300±10℃,干燥2h,取出,置于干燥器中,冷却30min,称量,精确至0.1mg。
其限度为0.3~7.0% 。
(2)灼烧失重将坩埚和盖置于马弗炉中,控制温度1100±20℃灼烧30分钟。
)。
向坩埚中加入取出稍冷,置于干燥器中,冷却40分钟,称量,精确至0.1mg(质量m1约5g试样,盖上坩埚盖,称量,精确至0.1mg。
将坩埚盖部分打开,置于烘箱中,控制温度300±10℃,干燥1.5小时,取出,置于干燥器中,冷却30分钟,盖好坩埚盖,称量,精确至0.1mg(质量m)。
将坩埚盖部分打开,置于高温炉中,控制温度1100±20℃,2灼烧2小时,取出稍冷,置于干燥器中,冷却40分钟,将盖盖严,称量,精确至0.1mg (质量m)。
其限度为0.15~7.00% 。
按下式计算300~1100℃灼烧失重的百分含量3m2– m3灼烧失重(%)= ×100m0式中:m2---于300℃干燥后盛有试样的坩埚及盖的质量, gm3---1100℃灼烧后盛有试样的坩埚及盖的质量,gm0---300℃干燥后的试样量(即m2- m1), g4.4贮存条件和注意事项:置于清洁干燥处。
4.5包装形式:4.6有效期和复验期4.6.1有效期:4.6.2复验期:4.6.3复验标准:氧化铝内控质量标准。
氧化铝材料的物理化学性质

氧化铝材料的物理化学性质氧化铝是一种广泛应用的材料,被用于制造陶瓷、玻璃、电子器件和建筑材料等领域。
它具有优良的物理化学性质,例如高温稳定性、低介电常数、高硬度和耐腐蚀性等。
在本文中,我们将探讨氧化铝材料的一些重要物理化学性质及其在不同领域中的应用。
一、晶体结构和晶格常数氧化铝的晶体结构多样,其中最常见的是以α-Al2O3为代表的三方晶系。
α-Al2O3具有六方紧密堆积结构,空位率极低,其原子结构的排列非常规则。
晶体结构中氧原子属于八面体配位,而铝原子则属于四面体配位。
在正常压力下,α-Al2O3具有较高的稳定性,能够抵抗高温、高压和复杂环境的影响。
氧化铝晶体的晶格常数与晶体结构密切相关。
α-Al2O3的晶格常数为a=4.758Å,c=12.991Å,其晶胞体积为219.52Å^3。
晶格常数与氧化铝材料的物理化学性质密切相关,并且影响着其在不同领域中的应用。
例如,在制造催化剂时,晶格常数能够影响催化活性和选择性。
二、介电性质氧化铝在常温下是绝缘体,其电阻率高达10^14Ω·cm以上。
这是因为氧化铝晶体结构中的氧原子与铝原子呈电中性分布,致使氧化铝晶体中几乎不带有自由电子。
然而,当氧化铝材料被加热至高温时,电子会被激发形成了空穴电子对。
这些电子能够在晶格中移动,导致氧化铝变成半导体。
在高场强下,氧化铝材料的电阻率降低,可以发生电击穿。
氧化铝的介电性质随温度、频率和晶体结构的变化而变化。
例如,在频率较低的情况下氧化铝材料的介电常数相对较大,通常在单晶氧化铝的范围内为9.5~12左右。
在高温下,材料的介电常数逐渐减小,这是由于加热过程中氧化铝材料的带隙变窄,导致电介质损耗增加。
三、化学性质氧化铝具有良好的耐腐蚀性,可在不同的环境下使用。
其化学惰性高,能够长期稳定的存在于强酸和弱碱性环境中。
氧化铝晶体结构中的化学键倾向于共价键,因此氧化铝材料的电子亲和能和极化能相对较小。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Al2O3晶型转变
Al2O3晶型转变(trans for mation of Al2O3)
Al2O3各晶型之间发生的转变。
Al2O3的晶型有:α、γ、η、δ、θ、k、x等。
外界条件改变时,晶型会发生转变。
在Al2O3这些变体中,只有α-Al2O3(刚玉)是稳定的,其它晶型都是不稳定的,加热时都将转变成α-Al2O3。
因为α-Al2O3中的氧已是最紧密堆集。
α-Al2O3密度为3.99g/cm3。
除刚玉外,常见的Al2O3晶型为γ-Al2O3。
γ-Al2O3具有尖晶石型结构。
但在其结构中,某些四面体的空隙没有被充填,因而γ-Al2O3的密度较刚玉小。
γ-Al2O3的密度为3.65g/cm3。
各种Al(OH)3加热脱水时,约在450℃形成γ-Al2O3。
γ-Al2O3加热到较高温度转变为刚玉。
但这种转变要在1000℃以上时,转化速度才比较大。
氧化铝的其它一些不稳定晶型也都是Al(OH)3加热脱水时,在不同条件下形成的。
ρ-Al2O3应为无定形态,但也有人认为它是介于无定形与晶态之间的过渡态。
由于ρ-Al2O3是Al2O3各种形态中唯一在常温下能自发水化的形态,可以作为耐火材料浇注料的胶结剂,因此近年来受到了重视。
β-Al2O3(密度3.31g/cm3)不是纯Al2O3,不属于Al2O3一元系,其化学式为Na2O•11Al2O3。
由于β-Al2O3开始发现时忽视了Na2O的存在,而被误认为是Al2O3的一种变体,采用了β-Al2O3这一名称,并沿用至今。
当刚玉处于高温、碱金属气氛下,即可转变成β-Al2O3。
β-Al2O3在高温下也会逸出碱金属氧化物而转化为刚玉。
氧化铝含有元素铝和氧。
若将铝矾土原料经过化学处理,除去硅、铁、钛等的氧化物而制得的产物是纯度很高的氧化铝原料,Al₂O₃含量一般在99%以上。
矿相是由40%~76%的γ-Al₂O₃和24%~60%的α-Al₂O₃组成。
γ-Al₂O₃于950~1200℃可转变为α-Al₂O₃(刚玉),同时发生显著的体积收缩。
资料:刚玉粉硬度大可用作磨料,抛光粉,高温烧结的氧化铝,称人造刚玉或人造宝石,可制机械轴承或钟表中的钻石。
氧化铝也用作高温
耐火材料,制耐火砖、坩埚、瓷器、人造宝石等,氧化铝也是炼铝的原料。
煅烧氢氧化铝可制得γ-Al₂O₃。
γ-Al₂O₃具有强吸附力和催化活性,可做吸附剂和催化剂。
刚玉主要成分α-Al₂O₃。
桶状或锥状的三方晶体。
有玻璃光泽或金刚光泽。
密度为3.9~4.1g/cm3,硬度9,熔点2000±15℃。
不溶于
水,也不溶于酸和碱。
耐高温。
无色透明者称白玉,含微量三价铬的显红色称红宝石;含二价铁、三价铁或四价钛的显蓝色称蓝宝石;含少量四氧化三铁的显暗灰色、暗黑色称刚玉粉。
可用做精密仪器的轴承,钟表的钻石、砂轮、抛光剂、耐火材料和电的绝缘体。
色彩艳丽的可做装饰用宝石。
人造红宝石单晶可制激光器的材料。
除天然矿产外,可用氢氧焰熔化氢氧化铝制取。
氧化铝化学式Al₂O₃,分子量101.96。
矾土的主要成分。
白色粉末。
具有不同晶型,常见的是α-Al₂O₃和γ-Al₂O₃。
自然界中的刚玉为α-Al₂O₃,六方紧密堆积晶体,α-Al₂O₃的熔点2015±15℃,密度3.965g/cm3,硬度8.8,不溶于水、酸或碱。
γ-Al₂O₃属立方紧密堆积晶体,不溶于水,但能溶
于酸和碱。
α型氧化铝
在α型氧化铝的晶格中,氧离子为六方紧密堆积,Al3+对称地分布在氧离子围成的八面体配位中心,晶格能很大,故熔点、沸点很高.α型氧化铝不溶于水和酸,工业上也称铝氧,是制金属铝的基本原料;也用于制各种耐火砖、耐火坩埚、耐火管、耐高温实验仪器;还可作研磨剂、阻燃剂、填充料等;高纯的α型氧化铝还是生产人造刚玉、人造红宝石和蓝宝石的原料;还用于生产现代大规模集成电路的板基.γ型氧化铝
γ型氧化铝是氢氧化铝在140-150℃的低温环境下脱水制得,工业上也叫活性氧化铝、铝胶。
其结构中氧离子近似为立方面心紧密堆积,Al3+不规则地分布在由氧离子围成的八面体和四面体空隙之中。
γ型氧化铝不溶于水,能溶于强酸或强碱溶液,将它加热至1200℃就全部转化为α型氧化铝.γ型氧化铝是一种多孔性物质,每克的内表面积高达数百平方米,活性高吸附能力强。
工业品常为无色或微带粉红的圆柱型颗粒,耐压性好.在石油炼制和石油化工中是常用的吸附剂、催化剂和催化剂载体;在工业上是变压器油、透平油的脱酸剂,还用于色层分析;在实验室是中性强干燥剂,其干燥能力不亚于五氧化二磷,使用后在175℃以下加热6-8h还能再生重复使用。
世界上用拜耳法生产的氧化铝要占到总产量的90%以上,氧化铝大部分用于制金属铝,用作其它用途的不到10%。
