《化学键》优质课-PPT教学用
合集下载
人教版高中化学必修二第一章第三节《化学键》课件(共38张PPT)
活泼的金属元素和酸根离子形成的盐 把NH4+看作是活泼的金属阳离子
金属氧化物:Na2O,Al2O3等
强碱:NaOH Ba(OH)2等
如何表示氯化钠的形成过程--电子式
•资料卡片
电子式 为方便起见,我们在 元素符号周围用“ · ”或 “×”来表示原子的最外 层电子(价电子)。这种 式子叫做电子式。例如:
归纳:分子间作用力与化学键的比较
作用微粒 作用力大小
意义
化学键 相邻原子间 作用力大 范德华力 分子之间 作用力小
影响化学性质和 物理性质
影响物理性质 (熔沸点等)
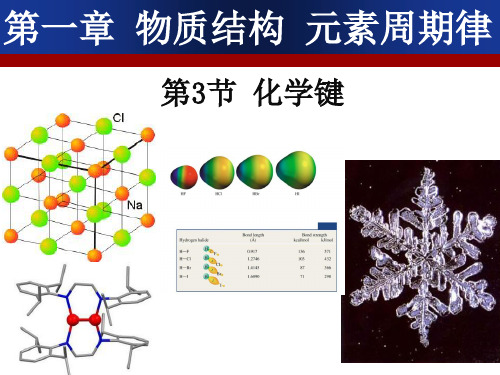
一些氢化物的沸点
讨论: 为什么HF、H2O和NH3的沸点会反
常呢?
2.氢键
1)形成条件:原子半径较小,非金属性很强的 原子(N、O、F)与H原子形成强极性共价键 ,与另一个分子中的半径较小,非金属性很强 的原子Y (N、O、F),在分子间H与Y产生
1.原子、离子都要标出最外层电子,离子须标明 电荷;
2.阴离子要用方括号括起来;
3.相同的原子可以合并写,相同的离子要单个写 ;
4.不能把“→”写成“====”;
⑴ 用电子式表示氧化镁的形成过程 ⑵ 用电子式表示硫化钾的形成过程
氢气在氯气中燃烧
写出该过程的化学方程式和实验现象 思考:活泼的金属元素和活泼非金属元素化 合时形成离子键。请思考,非金属元素之间 化合时,能形成离子键吗?为什么?
较强的静电吸引,形成氢键
2)表示方法:X—H…Y—H(X.Y可相同或不 同,一般为N、O、F)。
3)氢键能级:比化学键弱很多,但比分子间作 用力稍强
特征:具有方向性。
氢键作用:使物质有较高的熔沸点(H2O、HF 、 NH3) 使物质易溶于水
金属氧化物:Na2O,Al2O3等
强碱:NaOH Ba(OH)2等
如何表示氯化钠的形成过程--电子式
•资料卡片
电子式 为方便起见,我们在 元素符号周围用“ · ”或 “×”来表示原子的最外 层电子(价电子)。这种 式子叫做电子式。例如:
归纳:分子间作用力与化学键的比较
作用微粒 作用力大小
意义
化学键 相邻原子间 作用力大 范德华力 分子之间 作用力小
影响化学性质和 物理性质
影响物理性质 (熔沸点等)
一些氢化物的沸点
讨论: 为什么HF、H2O和NH3的沸点会反
常呢?
2.氢键
1)形成条件:原子半径较小,非金属性很强的 原子(N、O、F)与H原子形成强极性共价键 ,与另一个分子中的半径较小,非金属性很强 的原子Y (N、O、F),在分子间H与Y产生
1.原子、离子都要标出最外层电子,离子须标明 电荷;
2.阴离子要用方括号括起来;
3.相同的原子可以合并写,相同的离子要单个写 ;
4.不能把“→”写成“====”;
⑴ 用电子式表示氧化镁的形成过程 ⑵ 用电子式表示硫化钾的形成过程
氢气在氯气中燃烧
写出该过程的化学方程式和实验现象 思考:活泼的金属元素和活泼非金属元素化 合时形成离子键。请思考,非金属元素之间 化合时,能形成离子键吗?为什么?
较强的静电吸引,形成氢键
2)表示方法:X—H…Y—H(X.Y可相同或不 同,一般为N、O、F)。
3)氢键能级:比化学键弱很多,但比分子间作 用力稍强
特征:具有方向性。
氢键作用:使物质有较高的熔沸点(H2O、HF 、 NH3) 使物质易溶于水
《第三节_化学键》PPT课件

5、共价键的表示方法
(1) 电子式
H2
HF
H· H ·
Cl2
H2O
NH3
· · · H · F · · · · · · · H· O· H · · ·
H N H H
· · · · · · · Cl Cl · · · · ·· ·
CH4
N2
· · · · · · N· N ·
· ·
H · · · H· C H · · · · H
研究证实:化学反应中物质变化的实质是 旧化学键的断裂和新化学键的形成。
共价键与离子键的比较:
成键元素
活泼金属 元素与活 泼非金属 元素(通 常) 同种或不 同非金属 元素(通 常)
随堂练习
1、下列物质中,含有共价键的化合物是( AC ) A、NaOH B、CaCl2 C 、 H 2O D、 H2
Na+和Cl-之间存在着 相互作用—离子键
思考
除了氯化钠之外,还有哪些物质是通过离子键
形成的?离子键形成的条件是什么? 阴阳离子 原子易得失电子
活泼金属ⅠA、ⅡA 活泼非金属ⅥA、ⅦA
现学现用
下列哪些物质中存在离子键?
Na2O Na2O2 MgCl2 NaOH SO2 KNO3 HCl NH4Cl
现学现用
下列哪些物质中存在离子键?
Na2O
Na2O2
MgCl2
NaOH
SO2
KNO3
HCl
NH4Cl
2、离子化合物 许多阴、阳离子通过静电作用便形成 了离子化合物。
常见的离子化合物
酸
强碱 盐 活泼金属氧化物
活泼金属与活泼非金属形成的化合物
观察以下示例,归纳电子式 的书写规则
09912_演示文稿《化学键》课件

2024/1/27
7
02
离子键的形成与性质
2024/1/27
8
离子键的形成过程
01
原子间电子转移
金属原子失去电子,非金属原 子获得电子,形成正、负离子
。
2024/1/27
02
静电引力作用
正、负离子间存在静电引力, 相互靠近形成离子键。
03
离子键的特点
无方向性、无饱和性,键能较 大,键长较长。
9
离子键的强度与影响因素
选择反应
选择具有代表性的化学反应,如酸碱中和反应、氧化还 原反应等。
进行反应
按照实验要求进行操作,观察并记录反应过程中的现象。
2024/1/27
实验原理
化学反应的本质是旧化学键的断裂和新化学键的形成, 通过观察这些变化可以深入理解化学反应的机理。
准备试剂和仪器
根据反应需要准备相应的试剂和仪器,如酸碱指示剂、 电极等。
一种特殊的共价键,其中一个原子提供空轨道,另一个原 子提供孤对电子。配位键的形成使得分子或离子更加稳定 。
15
分子间作用力和氢键
分子间作用力
存在于分子之间的相互作用力,包括范德华力和氢键等。这些作用力较弱,但对物质的物理性质(如熔点、沸点 、溶解度等)有重要影响。
氢键
一种特殊的分子间作用力,存在于含有氢原子的分子之间。氢键的形成需要氢原子与电负性较大的原子(如F、O 、N等)相连,且氢原子与另一个电负性较大的原子之间存在相互作用。氢键对物质的性质有重要影响,如水的 熔沸点异常高就是由于氢键的存在。
2024/1/27
12
03
共价键的形成与性质
2024/1/27
13
共价键的形成过程
化学课件《化学键》优秀ppt34 人教课标版

2、离子的电子式:
··
·· Cl · ··
阳离子 H+ Na+ Mg2+ Ca2+
阴离子
电子式
(1)原子的电子式:常把其最外层电子数用 小黑点“.”或小叉“×”来表示。
(2)阳离子的电子式:不要求画出离子最外 层电子数,只要在元素、符号右上角标出 “n+”电荷字样。
(3)阴离子的电子式:不但要画出最外层电子 数,而且还应用于括号“[ ]”括起来,并在 右上角标出“n·-”电荷字样。
H
Li
Be
元素周期表
N
O
F
Na
Mg
P
S
Cl
K
Ca
……
Rb
Sr
As
Se
Br
Sb
Te
I
Cs
Ba
Bi
Po
At
Fr
Rb
课堂练习
D 1、下列说法正确的是( )
A.含有金属元素的化合物一定是离子化合物
B.第IA族和第VIIA族原子化合时,一定生成离子键
C.由非金属元素形成的化合物一定不是离子化合物
D.活泼金属与非金属化合时,能形成离子键
B
(1)CaO Cl Ba
(C2)l Li2O [ Cl ](3[)CBa D K Cl
F
Mg 2 [ F ]2
K Cl
4、用 电子式 表示 离子化合物 的 形成过程 用电子式表示氯化钠的形成过程
Na ·+
··
·· C··l · →
Na+ [:C·l·:]··
用电子式表示溴化钙的形成过程
节化学键
知识技能:掌握化学键、离子键、共价键的概念;
化学化学键ppt课件

键长与分子结构
键长定义
实例
化学键长是指两个成键原子的核间平 均距离,它通常用于描述共价键的大 小。
例如,碳氢键的键长比氮氢键的短, 这是因为碳的原子半径比氮小,所以 碳氢键的电子密度更高。
键长与电子密度关系
一般来说,电子密度越高,化学键越 短。这是因为电子密度高,原子之间 的相互吸引更强,因此距离更近。
化学键的结构和强度决定了材料的相变温度和稳定性,对于材料的加工、使用和回收再利 用具有重要意义。
在药物设计中的应用
药物活性与化学键
药物分子中的化学键直接决定了 药物的活性。通过改变药物分子 中的化学键,可以调整药物的生 物活性,提高其治疗效果或降低
副作用。
药物设计与合成
在药物设计与合成过程中,化学 键理论为药物分子结构的优化提 供了理论指导,有助于发现和开
化学键理论的发展与完善
总结词
随着实验数据的积累和新技术的应用,化学键理论得到不断的发展和完善。
详细描述
量子化学计算方法的进步使得我们能够更精确地描述化学键的形成和断裂过程,从而更好地理解物质 的性质和反应机理。同时,新的理论模型和计算方法的提出,也为化学键理论的进一步发展提供了有 力支持。
化学键在新能源和绿色化学中的应用
。
离子键和共价键
形成方式、特点和性质上有所不同。
详细描述
离子键是由电子转移形成的化学键,通常存在于金属和非金属元素之间,其特点是形成正负离子间的相互作用。 共价键是通过电子共享形成的化学键,通常存在于非金属元素之间,其特点是形成共用电子对的相互作用。两种 化学键类型在性质和结构上有所不同,但它们在自然界和人工合成的物质中都广泛存在。
04
化学键的应用
在材料科学中的应用
第三节《化学键》课时2课件

原子形成HCl过程中,能否形成离子键?
不能,因非金属元素的原子均有获得电子的偏 向。
❖HCl分子不是通过离子键来形成,是通过什么方式结合 的呢?
我只有一个电 子,太少了
我也少一 个电子
e
H 原子
eeeee ee
Cl 原子
二位好!我有一个好办法.你们
每人拿出一个电子共用,就象共
好 呵 谢 谢
同分享快乐一样共同拥有,行吗? 好 呵 谢 谢
注意:稀有气体是单原子分子,
所以稀有气体中不存在化学
2. 分类
键。
离子键
共价键
3. 从化学键角度理解化学反应:
反应物化学键断裂(分子变成原子),生成物化学键形成 (原子结合成分子)过程。
①若只有化学键的断裂或只有化学键的形成一定是 化学反应吗?
②所以必须_既__有__旧__键__断__裂_,__又__有__新__键__形_成___才是化学反应。
D.单质分子中不存在化学键
C 2.下列分子的电子式书写正确的是( )
A.氨 B.四氯化碳 C.氮 气 D.二氧化碳
3.下表物质所含化学键类型、所属化合物类型完全正确的
A 一组是(
)
4.按要求写出下列化学式。
NH Cl (1)由非金属元素组成的离子化合物_______4____ AlCl (2)含金属元素的共价化合物___________3______
e
ee e eeee
愿意
H原子, 你愿意 拿出一 个电子 共用吗?
愿意
e ee
e e
e ee
Cl原子, 你愿意 拿出一 个电子 共用吗?
HCl的形成
不稳定
稳定
共用1对e—
共价键
化学键ppt课件

离子键强度影响因素
离子半径
离子半径越小,离子间的静电吸 引力越强,离子键强度越高。
离子电荷
离子电荷越高,离子间的静电吸 引力越强,离子键强度越高。
电子构型
离子的电子构型对离子键强度也 有影响,例如8电子构型的离子
通常具有较高的稳定性。
离子化合物性质总结
物理性质
离子化合物通常具有较高的熔点和沸点,硬度较大 ,且多为脆性。它们在水中溶解度较大,且溶解时 伴随热量的变化。
静电吸引
正负离子之间通过静电吸 引力相互靠近,形成离子 键。
离子晶体结构特点
晶体结构
离子晶体由正负离子按照 一定的规律排列而成,形 成空间点阵结构。
配位数
每个离子周围所邻接的异 号离子的数目称为该离子 的配位数。
晶格能
离子晶体中离子间的相互 作用力称为晶格能,晶格 能的大小决定了离子晶体 的稳定性和物理性质。
01
02
高分子材料
利用共价键的特性,设计合成具 有特定功能的高分子材料。
03 04
纳米材料
通过控制化学键的合成和组装, 制备具有特殊性质的纳米材料。
晶体材料
通过调控化学键的类型和参数, 制备具有优异性能的晶体材料。
06
实验方法与技术手段
Chapter
X射线衍射技术
01
X射线衍射原理
利用X射线与物质相互作用产生衍射现象,通过分析衍射图谱获得物质
其他先进实验方法介绍
核磁共振波谱法
利用核磁共振现象研究 物质结构和化学键性质 的方法,具有高分辨率 和信息量大的优点。
质谱法
通过测量离子质荷比研 究物质结构和化学键性 质的方法,可用于确定 分子式、分析复杂混合 物等。
化学键(ppt课件)

第三节 化学健
第一章 物质结构 元素周期表
你有想过吗?
2.物质中原子为什么总是按一定数目相结合?
1.为什么一百多种元素可形成千千万万种物 质?元素的原子间通过什么作用形成如此丰富 多彩的物质呢?
实验1—2:钠在氯气中燃烧
现象
化学方程式
Na在Cl2中剧烈燃烧,产生黄色火焰,集气瓶中充满白烟
··
··
:
··
··
I
··
:
I
··
:
:
01
The end
氢氧化钠晶体中,钠离子与氢氧根离子以 离子键结合;在氢氧根离子中,氢与氧以共价 键结合。请用电子式表示氢氧化钠。
[ ]
+
-
·
H
·
D
练习2、下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合成稳定化合物的是: A.10与12 B.8与17 C. 11与17 D.6与14
C
01
活泼的金属元素和活泼非金属元素化合
新化学键的生成
生成物分子生成
旧化学键被破坏
一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。
4
ቤተ መጻሕፍቲ ባይዱ
3
5
化学反应的实质
离子键和共价键的比较
[小结]
离子键
共价键
成键微粒
阴、阳离子
原子
相互作用
静电作用
共用电子对
成键元素
活泼的金属元素(IA,IIA族) 和活泼的非金属元素(VIA,IIA族)
同种或不同种 非金属元素
Na
﹕
﹕
·
·
O
过氧化钠晶体中,过氧根离子 (O2 ) 2-与钠 离子以离子键结合;在过氧根离子中,两个氧 原子以共价键结合。请用电子式表示过氧化钠。
