药物合成反应重要人名反应整理
(完整word版)人名反应药物合成反应中主要的人名反应
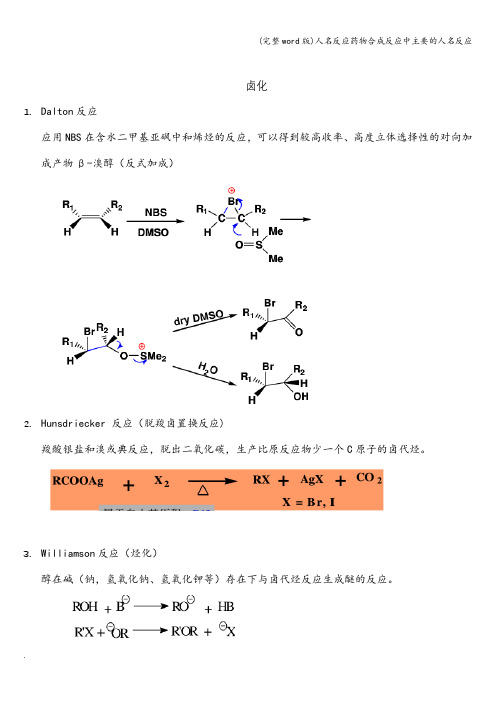
卤化1.Dalton反应应用NBS在含水二甲基亚砜中和烯烃的反应,可以得到较高收率、高度立体选择性的对向加成产物β-溴醇(反式加成)2.Hunsdriecker 反应(脱羧卤置换反应)羧酸银盐和溴或典反应,脱出二氧化碳,生产比原反应物少一个C原子的卤代烃。
3.Williamson反应(烃化)醇在碱(钠,氢氧化钠、氢氧化钾等)存在下与卤代烃反应生成醚的反应。
烃化4. F-C 碳酰化羧酸及羧酸衍生物在质子酸或Lewis 酸的催化下,对芳烃进行亲电取代生成芳酮的反应。
酰化1. Gattermann 反应羟基或烷氧基取代的芳烃在ZnCl 2,AlCl 3等Lewis 酸的催化下与氰化氢和氯化氢反应,生成亚胺盐酸盐,在经水解生成相应的芳醛的反应。
2. Vilsmeier —Haack 反应3.Reimer—tiemann反应4.Claisen和Dieckmann反应缩合1.Claisen-Schmidt反应2.Prins反应3.安息香缩合4.Blanc反应(氯甲基化)5.Mannich反应(氨甲基化)反应机理6.β-羟烷基化反应7. Michael反应8.Wittg反应9.羧基α活性亚甲基反应10.α,β-环氧化烷基化反应(Darens反应)11.D—A反应重排12.13.Pinacol重排14.B—B—Z重排15.Favorskii重排16.Beckmann重排17.Hofmann重排18.Stevens重排19.Sommelet—hauser重排20.Claisen重排还原21.Clemansen还原22.黄明龙反应23.氨基保护剂还有Boc单纯的课本内容,并不能满足学生的需要,通过补充,达到内容的完善教育之通病是教用脑的人不用手,不教用手的人用脑,所以一无所能。
教育革命的对策是手脑联盟,结果是手与脑的力量都可以大到不可思议。
药物合成反应-人名反应
20
Delépine amine synthesis.
Delepine胺合成
用卤代烃和环六亚甲基四胺(乌洛托品)反应得季铵盐,然后水解可得伯胺。
P057
21
Dieckmann condensation
若两个酯在同一分子之内,在上述条件下可发生分子内缩合,得环状β-酮酸酯,此反应称为Dieckmann反应。
1
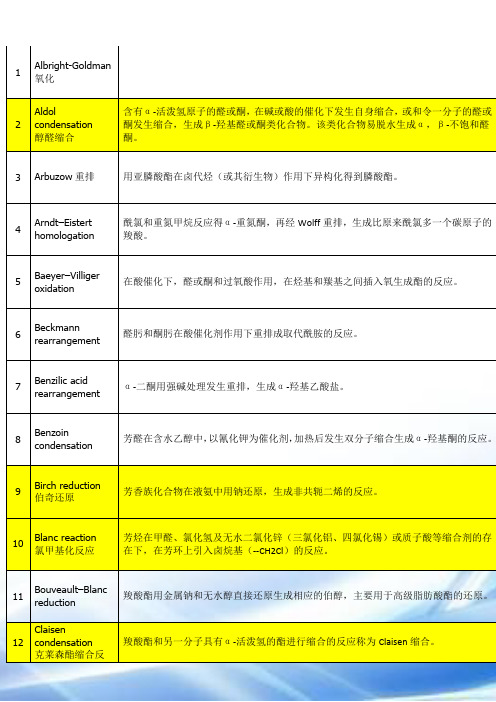
Albright-Goldman氧化
P222
2
Aldol condensation
醇醛缩合
含有α-活泼氢原子的醛或酮,在碱或酸的催化下发生自身缩合,或和令一分子的醛或酮发生缩合,生成β-羟基醛或酮类化合物。该类化合物易脱水生成α,β-不饱和醛酮。
P130
3
Arbuzow重排
用亚膦酸酯在卤代烃(或其衍生物)作用下异构化得到膦酸酯。
P202
17
Curtius rearrangement
酰基叠氮化合物加热分解生成异腈酸酯的反应。
P188
18
Dakin oxidation
在芳香醛中,当醛基的邻、对位有羟基等供电子基团时,和有机过氧酸反应,醛基经甲酸酯阶段,最后转换成羟基。
P226
19
Darzens condensation
醛或酮和α-卤代酸酯在碱催化下缩合生成α,β-环氧羧酸酯的反应。
用甲酸及其铵盐可以对醛酮进行还原烃化,得各类胺。
P271
37
Lossen rearrangement
异羟肟酸的O-酰基衍生物用碱处理,有时只需加热,先生成异氰酸酯,然后水解得到伯胺的反应。
P187
38
Mannich reaction
具有活性氢的化合物和甲醛(或其他醛)、胺进行缩合,生成胺甲基衍生物的反应。
人名反应药物合成反应中主要的人名反应
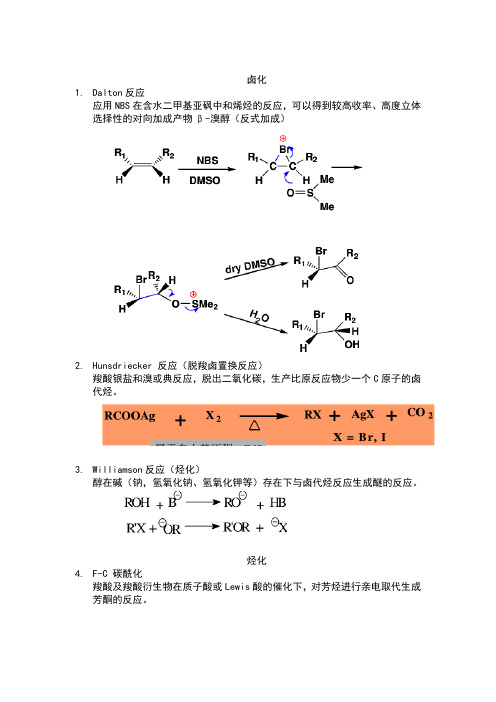
卤化1.Dalton反应应用NBS在含水二甲基亚砜中和烯烃的反应,可以得到较高收率、高度立体选择性的对向加成产物β-溴醇(反式加成)2.Hunsdriecker 反应(脱羧卤置换反应)羧酸银盐和溴或典反应,脱出二氧化碳,生产比原反应物少一个C原子的卤代烃。
3.Williamson反应(烃化)醇在碱(钠,氢氧化钠、氢氧化钾等)存在下与卤代烃反应生成醚的反应。
烃化4.F-C 碳酰化羧酸及羧酸衍生物在质子酸或Lewis酸的催化下,对芳烃进行亲电取代生成芳酮的反应。
酰化1.Gattermann反应羟基或烷氧基取代的芳烃在ZnCl2,AlCl3等Lewis酸的催化下与氰化氢和氯化氢反应,生成亚胺盐酸盐,在经水解生成相应的芳醛的反应。
2.Vilsmeier-Haack反应3.Reimer-tiemann反应4.Claisen和Dieckmann反应缩合1.Claisen-Schmidt反应2.Prins反应3.安息香缩合4.Blanc反应(氯甲基化)5.Mannich反应(氨甲基化)反应机理6.β-羟烷基化反应7. Michael反应8.Wittg反应9.羧基α活性亚甲基反应10.α,β-环氧化烷基化反应(Darens反应)11.D-A反应重排12.13.Pinacol重排14.B-B-Z重排15.Favorskii重排16.Beckmann重排17.Hofmann重排18.Stevens重排19.Sommelet-hauser重排20.Claisen重排还原21.Clemansen还原22.黄明龙反应23.氨基保护剂还有Boc。
【2017年整理】药物合成的人名反应

1.Hunsdriecke反应:羧酸银盐和溴或碘反应,脱去二氧化碳,生成比原反应物少一个碳原子的卤代烃。
2.Sandmeyer反应:用氯化亚铜或溴化亚铜在相应的氢卤酸存在下,将芳香重氮盐转化成卤代芳烃。
3.Gattermann反应:将上面改为铜粉和氢卤酸。
4.Shiemann反应:将芳香重氮盐转化成不溶性的重氮氟硼酸盐或氟磷酸盐,或芳胺直接用亚硝酸纳和氟硼酸进行重氮化,此重氮盐再经热分解(有时在氟化钠或铜盐存在下加热),就可以制得较好收率的氟代芳烃。
5.Williamson合成:醇在碱(钠,氢氧化钠,氢氧化钾)存在下与卤代烃反应生成醚。
6.Gabriel合成:将氨先制备成邻苯二甲酰亚胺,利用氮上氢的酸性,先与氢氧化钾生成钾盐,然后与卤代烃作用,得N-烃基邻苯二甲酰亚胺,肼解或酸水解即可得纯伯胺。
7.Delepine反应:用卤代烃与环六亚甲基四胺(乌洛托品)反应得季铵盐,然后水解可得伯胺。
8.Leuckart反应:用甲酸及其铵盐可以对醛酮进行还原烃化,得各类胺。
9.Ullmann反应:卤代芳烃与芳香伯胺在铜或碘化铜及碳酸钾存在并加热的条件下可得二苯胺及其同系物。
10.Friedel-Crafts反应:在三氯化铝催化下,卤代烃及酰卤与芳香族化合物反应,再环上引入烃基及酰基。
11.Meerwein芳基化反应:芳基自由基可与烯反应,引致烯键的碳原子上。
12.Gomberg-Bachmann反应:芳香自由基与过量存在的另一芳香族化合物发生取代反应,得到联苯。
方向自由基的来源主要有三种:最常用重氮离子的分解;其次为N-亚硝基乙酰苯胺类及芳酰过氧化物的分解13.Hoesch反应:腈类化合物与氯化氢在Lewis酸催化剂ZnCl2的存在下与具有烃基或烷氧基的芳烃进行反应可生成相应的酮亚胺,在经水解则得具有羟基或烷氧基的芳香酮。
14.Gattermann反应:将具有羟基或烷氧基的芳烃在三氯化铝或氯化锌催化下与氰化氢及氯化氢作用生成相应芳香醛的反应。
药物合成人名反应整理

1.Baeyer-Villiger:酮与过氧酸,重排成酯;如环酮,转化成内酯或羟基酸2.Birch:芳香族化合物在液氮中用钠还原,生成非共轭二烯3.Claisen重排:烯丙基芳基醚加热重排为邻烯丙基酚类4.Claisen反应和Dieckmann:C为羧酸酯与另一分子具有α-活泼氢的酯缩合得到β-酮酸酯;D 发生在同一分子内5.Clemmensen:酸性条件,用锌汞齐或锌粉还原醛基、酮基为甲基和亚甲基6.Friedel-Crafts:羧酸及衍生物在质子酸或Lewis酸催化下对芳烃亲电取代生成芳酮7.Gattermann:羟基或烷氧基取代的芳烃在ZnCl2、AlCl3等Lewis酸的催化下与氰化氢和氯化氢反应生成亚胺盐酸盐,再水解生成芳醛8.Grignard:有机卤素与金属镁在无水醚存在下生成格氏试剂,后者再与羟基反应得醇类9.Hoesch:腈类与氯化氢在Lewis酸催化剂ZnCl2的存在下与羟基或烷氧基取代的芳烃反应生成酮亚胺,再经水解得芳酮10.Michael:活性亚甲基化合物和α,β-不饱和羰基化合物在碱性催化剂存在下发生加成缩合生成β-羰烷基类化合物11.Pinacol:连乙二醇类用酸处理时重排成醛或酮12.Pictet-Spenglerβ-芳乙胺与羟基化合物在酸性溶液中缩合生成1,2,3,4-四氢异喹啉13.Prins:烯烃与甲醛在酸催化下加成得1,3-二醇或其环状缩醛1,3-二氧六环及α-烯醇14.Reimer-Tiemann:苯酚和氯仿在强碱水溶液中加热,生成芳醛15.Schmidt:在酸催化下,叠氮酸与羧酸、酮或醛反应分别生成伯胺、酰胺或腈16.Ullmann:由于卤代芳烃活性较低,又有位阻,不易与芳香伯胺反应。
如加入酮或碘化酮以及碳酸钾并加热,可得二苯胺及其同系物。
17.Vilsmeier-Haack:以N-取代甲酰胺为甲酰化试剂在氧氯化磷的催化下在芳环上引入甲酰基18.Wagner-Meerwein:正溴丙烷与AlBr3反应,形成碳正离子,重排得2-溴丙烷19.Witting:醛或酮与磷叶立德反应合成烯烃20.安息香:芳醛在含水乙醇中,以氰化钠为催化剂,加热后发生双分子缩合生成α-羟基酮1.Aldol缩合:含α-活性氢的的醛或酮,在碱或酸的催化下发生自身缩合,或与另一分子的醛或酮发生缩合,生成β-羟基醛或酮类化合物的反应,称为α-羟烷基化反应。
药物合成反应重要人名反应

反应:羧酸银盐和溴或碘反应,脱去二氧化碳,生成比原反应物少一个碳原子的卤代烃。
反应:用氯化亚铜或溴化亚铜在相应的氢卤酸存在下,将芳香重氮盐转化成卤代芳烃。
反应:将上面改为铜粉和氢卤酸。
反应:将芳香重氮盐转化成不溶性的重氮氟硼酸盐或氟磷酸盐,或芳胺直接用亚硝酸纳和氟硼酸进行重氮化,此重氮盐再经热分解(有时在氟化钠或铜盐存在下加热),就可以制得较好收率的氟代芳烃。
合成:醇在碱(钠,氢氧化钠,氢氧化钾)存在下与卤代烃反应生成醚。
合成:将氨先制备成邻苯二甲酰亚胺,利用氮上氢的酸性,先与氢氧化钾生成钾盐,然后与卤代烃作用,得N-烃基邻苯二甲酰亚胺,肼解或酸水解即可得纯伯胺。
反应:用卤代烃与环六亚甲基四胺(乌洛托品)反应得季铵盐,然后水解可得伯胺。
反应:用甲酸及其铵盐可以对醛酮进行还原烃化,得各类胺。
反应:卤代芳烃与芳香伯胺在铜或碘化铜及碳酸钾存在并加热的条件下可得二苯胺及其同系物。
反应:在三氯化铝催化下,卤代烃及酰卤与芳香族化合物反应,再环上引入烃基及酰基。
芳基化反应:芳基自由基可与烯反应,引致烯键的碳原子上。
反应:芳香自由基与过量存在的另一芳香族化合物发生取代反应,得到联苯。
方向自由基的来源主要有三种:最常用重氮离子的分解;其次为N-亚硝基乙酰苯胺类及芳酰过氧化物的分解反应:腈类化合物与氯化氢在Lewis酸催化剂ZnCl2的存在下与具有烃基或烷氧基的芳烃进行反应可生成相应的酮亚胺,在经水解则得具有羟基或烷氧基的芳香酮。
反应:将具有羟基或烷氧基的芳烃在三氯化铝或氯化锌催化下与氰化氢及氯化氢作用生成相应芳香醛的反应。
反应:以N-取代的甲酰胺化试剂在氧氯化磷作用下,在芳核或杂环上引入甲酰基。
反应:将酚及某些杂环化合物与碱金属的氢氧化物溶液和过量的氯仿一起加热形成芳醛的反应。
反应和Dieckmann反应:羧酸酯与另一分子具有α-活泼氢的酯进行缩合的反映称为Claisen缩合。
若两个酯在同一分子之内,在上述条件下可发生分子内缩合,得环状β-酮酸酯,此反应称为Dieckmann反应。
药物合成反应重要人名反应整理

药物合成反应重要人名反应整理Happy First, written on the morning of August 16, 20221.Hunsdriecke反应:羧酸银盐和溴或碘反应;脱去二氧化碳;生成比原反应物少一个碳原子的卤代烃..2.Sandmeyer反应:用氯化亚铜或溴化亚铜在相应的氢卤酸存在下;将芳香重氮盐转化成卤代芳烃..3.Gattermann反应:将上面改为铜粉和氢卤酸..4.Shiemann反应:将芳香重氮盐转化成不溶性的重氮氟硼酸盐或氟磷酸盐;或芳胺直接用亚硝酸纳和氟硼酸进行重氮化;此重氮盐再经热分解有时在氟化钠或铜盐存在下加热;就可以制得较好收率的氟代芳烃..5.Williamson合成:醇在碱钠;氢氧化钠;氢氧化钾存在下与卤代烃反应生成醚..6.Gabriel合成:将氨先制备成邻苯二甲酰亚胺;利用氮上氢的酸性;先与氢氧化钾生成钾盐;然后与卤代烃作用;得N-烃基邻苯二甲酰亚胺;肼解或酸水解即可得纯伯胺..7.Delepine反应:用卤代烃与环六亚甲基四胺乌洛托品反应得季铵盐;然后水解可得伯胺..8.Leuckart反应:用甲酸及其铵盐可以对醛酮进行还原烃化;得各类胺..9.Ullmann反应:卤代芳烃与芳香伯胺在铜或碘化铜及碳酸钾存在并加热的条件下可得二苯胺及其同系物..10.Friedel-Crafts反应:在三氯化铝催化下;卤代烃及酰卤与芳香族化合物反应;再环上引入烃基及酰基..11.Meerwein芳基化反应:芳基自由基可与烯反应;引致烯键的碳原子上..12.Gomberg-Bachmann反应:芳香自由基与过量存在的另一芳香族化合物发生取代反应;得到联苯..方向自由基的来源主要有三种:最常用重氮离子的分解;其次为N-亚硝基乙酰苯胺类及芳酰过氧化物的分解13.Hoesch反应:腈类化合物与氯化氢在Lewis酸催化剂ZnCl2的存在下与具有烃基或烷氧基的芳烃进行反应可生成相应的酮亚胺;在经水解则得具有羟基或烷氧基的芳香酮..14.Gattermann反应:将具有羟基或烷氧基的芳烃在三氯化铝或氯化锌催化下与氰化氢及氯化氢作用生成相应芳香醛的反应..15.Vilsmeier-Haack反应:以N-取代的甲酰胺化试剂在氧氯化磷作用下;在芳核或杂环上引入甲酰基..16.Rimer-Tiemann反应:将酚及某些杂环化合物与碱金属的氢氧化物溶液和过量的氯仿一起加热形成芳醛的反应..17.Claisen反应和Dieckmann反应:羧酸酯与另一分子具有α-活泼氢的酯进行缩合的反映称为Claisen缩合..若两个酯在同一分子之内;在上述条件下可发生分子内缩合;得环状β-酮酸酯;此反应称为Dieckmann反应..18.Aldol缩合:含有α-活泼氢原子的醛或酮;在碱或酸的催化下发生自身缩合;或与令一分子的醛或酮发生缩合;生成β-羟基醛或酮类化合物..该类化合物易脱水生成α;β-不饱和醛酮..19.Claisen-Schimidt反应:芳醛与含有α-活泼氢的醛、酮之间的缩合..芳醛和脂肪醛、酮在碱催化下缩合生成β-不饱和醛酮的就反应..20.Tollens缩合:甲醛在碱的催化下;可与含有α-活性氢的醛、酮进行醛醇缩合;在醛、酮的α-碳原子上引入羟甲基;产物是β-羟基醛或其脱水物——α;β-不饱和醛酮..21.Cannizzaro反应:22.Robinson环和:酯环酮与α;β-不饱和酮的共轭加成产物所发生的分子内缩合反应;可以再原来环结构基础上在引入一个环..23.Prins反应:烯烃与甲醛或其他醛在酸催化下加成而得1;3-丙二醇或其环状缩醛1;3-二氧六环及α-烯醇的反应..安息香缩合:芳醛在含水乙醇中;以氰化钾为催化剂;加热后发生双分子缩合生成α-羟基酮的反应..24.Reformatsky反应:醛或酮与α-卤代酸酯在金属锌粉存在下缩合而得β-羟基酸酯或脱水得α;β-不饱和酸酯的反应..25.Grignard反应:由有机卤素化合物卤代烃、活性卤代芳烃等与金属镁在无水乙醚存在下生成格式试剂;后者在与羰基化合物醛、酮等反应而得相应的醇类的反应..26.Blanc反应:芳烃在甲醛、氯化氢及无水二氯化锌三氯化铝、四氯化锡或质子酸等缩合剂的存在下;在芳环上引入卤烷基--CH2Cl的反应..27.Mannich反应:具有活性氢的化合物与甲醛或其他醛、胺进行缩合;生成胺甲基衍生物的反应..28.Pictet-Spengler反应:β-芳乙胺与羰基化合物在酸性溶液中缩合生成1;2;3;4-四氢异喹啉的反应..29.Strecker反应:脂肪族或芳香族醛、酮类与氰化氢和过量氨或胺类作用生成α-氨基腈;再经酸或碱水解得到dl-α-氨基酸类的反应..30.Michael反应:活性亚甲基化合物和α;β-不饱和羰基化合物在碱性催化剂存在下发生加成缩合;生成β-羰烷基类化合物..31.Wittig反应:醛或酮与含磷试剂——烃代亚甲基三苯膦反应;醛、酮分子中的羰基的氧原子被亚甲基或取代亚甲基所取代;生成相应的稀类化合物及氧化三苯膦;此类反应称为羰基稀化反应..32.Horner反应:利用膦酸酯与醛、酮类化合物在碱存在下作用生成烯烃的反应..33.Knoevenagel反应:凡具有活性亚甲基的化合物在氨、胺或其羧酸盐的催化下;与醛、酮发生醛醇型缩合;脱水得α;β-不饱和化合物的反应..34.Stobbe反应:丁二酸酯或α-烃基取代的丁二酸酯在碱性试剂存在下;与羰基化合物进行缩合而得α-烷烃或芳烃亚甲基丁二酸单酯的反应..常用碱性试剂有醇钠;叔丁醇钾;氰化钠和三苯甲烷钠等35.Perkin反应:芳香醛和脂肪酸酐在相应的脂肪酸碱金属盐的催化下缩合;生成β-芳基丙烯酸类化合物的反应..36.Darzens缩合:醛或酮与α-卤代酸酯在碱催化下缩合生成α;β-环氧羧酸酯的反应..37.Diels-Alder反应:共轭二烯烃与烯烃、炔烃进行环加成;生成环己烯衍生物的反应..38.Wagner-Meerwein重排:在质子酸或lewis酸催化下生成的碳正离子中;烷基、芳基、或氢从一个碳原子通过过渡态;迁移至相邻带正电荷碳原子的反应..39.Pinacol重排:在酸催化下;邻二叔醇失去一分子水;重排成醛或酮的反应..40.二苯基乙二酮-二苯基乙醇酸型重排:α-二酮用强碱处理发生重排;生成α-羟基乙酸盐..41.Fovorski重排:α-卤代酮在碱氢氧化钠;醇钠;HNRR’催化下脱去卤原子;重排为羧酸或其衍生物的反应..42.Wolff重排:α-重氮酮经加热、光解或在某些金属等催化剂作用下脱去一分子氮气后重排成烯酮的反应..烯酮经进一步反应;生成羧酸、酯、酰胺或酮..43.Arndt-Eistert反应:酰氯与重氮甲烷反应得α-重氮酮;再经Wolff 重排;生成比原来酰氯多一个碳原子的羧酸..44.Beckmann重排:醛肟与酮肟在酸催化剂作用下重排成取代酰胺的反应..45.Hofmann重排:氮上无取代基的酰胺用卤素溴或氯及碱处理;脱羧生成伯胺的反应..由于产物比反应物少一个碳原子;所以又称为Hofmann降解..46.Curtius重排:酰基叠氮化合物加热分解生成异腈酸酯的反应..47.Schmidt反应:在酸催化下;酸和酮或醛与氨或叠氮化钠反应生成伯胺、酰胺或腈的反应..48.Baeyer-Villiger氧化:在酸催化下;醛或酮与过氧酸作用;在烃基与羰基之间插入氧生成酯的反应..49.Stevens重排:α-位上具有吸电子基Z的季铵盐在强碱作用下;脱去一个α活泼氢生成叶立德;然后季氮上的烃基进行分子内1;2-迁移;生成叔胺的反应..50.Sommelet-Hauser重排:苄基季铵盐在强碱催化下;重排成邻位烃基取代的苄基叔胺的反应..51.Wittig重排:醚类化合物经强碱处理;分子中一个烃基发生迁移;生成醇的反应..52.Claisen重排:烯醇或酚的烯丙基醚加热;通过3;3-σ迁移使烯丙基自氧原子迁移到碳原子上的反应..53.Cope重排:1;5-二稀连二烯丙基经过3;3-σ迁移;异构化成另一双烯丙基衍生物的反应..54.Fischer吲哚合成:醛或酮的芳腙在适当催化剂存在下;脱氨基生成吲哚类化合物的反应..55.Oppenauer氧化:仲醇与丙酮在烷氧基铝存在下一起回流;将仲醇氧化成酮..56.Dakin反应:在芳香醛中;当醛基的邻、对位有羟基等供电子基团时;与有机过氧酸反应;醛基经甲酸酯阶段;最后转换成羟基..57.Sharpless环氧化反应:58.Wacker反应:在氯化钯、氯化铜存在下;利用空气中的氧气使烯烃转化成醛或酮的过程..59.Birch还原:芳香族化合物在液氨中用钠还原;生成非共轭二烯的反应..60.Clemmensen反应:在酸性条件下;用锌汞齐或锌粉还原醛基、酮基为甲基和亚甲基的反应..61.Wolff-кижер-黄鸣龙还原反应:醛酮在强碱条件下;与水合肼缩合成腙;进而放氮分解转化成甲基和亚甲基的反应..62.Meerwein-Ponndorf-Verley反应:将醛、酮等羰基化合物和异丙醇铝在异丙醇中共热;可还原得到相应的醇;同时将异丙醇氧化成丙酮..63.Leuckart反应:在甲酸及其衍生物存在下;羰基化合物与氨、胺的还原胺化反应..64.Rosenmund反应:酰卤在适当的反应条件下;用催化氢化或金属氢化物选择性的还原为醛的反应..65.Bouveault-Blanc反应:将羧酸酯用金属钠和无水醇直接还原生成相应的伯醇;主要用于高级脂肪酸酯的还原..66.偶姻缩合:羧酸酯在惰性溶剂如醚、甲苯、二甲苯中与金属钠发生还原偶联反应;生成α羟基酮..67.脱苄反应:苄基或取代苄基与氧、氮或硫连接生成的醇、醚、酯、苄胺、硫醚等;均可以通过氢解反应脱去苄基生成相应的烃、醇、酸、胺等类化合物..68.Heck反应:卤代烃、苯甲酰氯或芳基重氮盐等与乙烯基化合物的C-C 偶联反应..69.Suzuki交叉偶联反应:钯催化的有机硼化合物与卤代烃生成不对称联芳烃..。
人名反应-药物合成反应中主要的人名反应
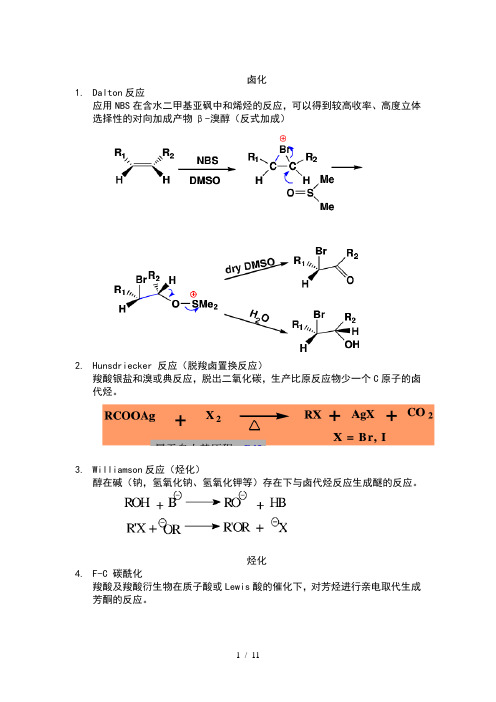
卤化1.Dalton反应应用NBS在含水二甲基亚砜中和烯烃的反应,可以得到较高收率、高度立体选择性的对向加成产物β-溴醇(反式加成)2.Hunsdriecker 反应(脱羧卤置换反应)羧酸银盐和溴或典反应,脱出二氧化碳,生产比原反应物少一个C原子的卤代烃。
3.Williamson反应(烃化)醇在碱(钠,氢氧化钠、氢氧化钾等)存在下与卤代烃反应生成醚的反应。
烃化4.F-C 碳酰化羧酸及羧酸衍生物在质子酸或Lewis酸的催化下,对芳烃进行亲电取代生成芳酮的反应。
酰化1.Gattermann反应羟基或烷氧基取代的芳烃在ZnCl2,AlCl3等Lewis酸的催化下与氰化氢和氯化氢反应,生成亚胺盐酸盐,在经水解生成相应的芳醛的反应。
2.Vilsmeier-Haack反应3.Reimer-tiemann反应4.Claisen和Dieckmann反应缩合1.Claisen-Schmidt反应2.Prins反应3.安息香缩合4.Blanc反应(氯甲基化)5.Mannich反应(氨甲基化)反应机理6.β-羟烷基化反应7. Michael反应8.Wittg反应9.羧基α活性亚甲基反应10.α,β-环氧化烷基化反应(Darens反应)11.D-A反应重排12.13.Pinacol重排14.B-B-Z重排15.Favorskii重排16.Beckmann重排17.Hofmann重排18.Stevens重排19.Sommelet-hauser重排20.Claisen重排还原21.Clemansen还原11 /1122. 黄明龙反应23. 氨基保护剂还有Boc。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.Hunsdriecke反应:羧酸银盐和溴或碘反应,脱去二氧化碳,生成比原反应物少一个碳原子的卤代烃。
2.Sandmeyer反应:用氯化亚铜或溴化亚铜在相应的氢卤酸存在下,将芳香重氮盐转化成卤代芳烃。
3.Gattermann反应:将上面改为铜粉和氢卤酸。
4.Shiemann反应:将芳香重氮盐转化成不溶性的重氮氟硼酸盐或氟磷酸盐,或芳胺直接用亚硝酸纳和氟硼酸进行重氮化,此重氮盐再经热分解(有时在氟化钠或铜盐存在下加热),就可以制得较好收率的氟代芳烃。
5.Williamson合成:醇在碱(钠,氢氧化钠,氢氧化钾)存在下与卤代烃反应生成醚。
6.Gabriel合成:将氨先制备成邻苯二甲酰亚胺,利用氮上氢的酸性,先与氢氧化钾生成钾盐,然后与卤代烃作用,得N-烃基邻苯二甲酰亚胺,肼解或酸水解即可得纯伯胺。
7.Delepine反应:用卤代烃与环六亚甲基四胺(乌洛托品)反应得季铵盐,然后水解可得伯胺。
8.Leuckart反应:用甲酸及其铵盐可以对醛酮进行还原烃化,得各类胺。
9.Ullmann反应:卤代芳烃与芳香伯胺在铜或碘化铜及碳酸钾存在并加热的条件下可得二苯胺及其同系物。
10.Friedel-Crafts反应:在三氯化铝催化下,卤代烃及酰卤与芳香族化合物反应,再环上引入烃基及酰基。
11.Meerwein芳基化反应:芳基自由基可与烯反应,引致烯键的碳原子上。
12.Gomberg-Bachmann反应:芳香自由基与过量存在的另一芳香族化合物发生取代反应,得到联苯。
方向自由基的来源主要有三种:最常用重氮离子的分解;其次为N-亚硝基乙酰苯胺类及芳酰过氧化物的分解13.Hoesch反应:腈类化合物与氯化氢在Lewis酸催化剂ZnCl2的存在下与具有烃基或烷氧基的芳烃进行反应可生成相应的酮亚胺,在经水解则得具有羟基或烷氧基的芳香酮。
14.Gattermann反应:将具有羟基或烷氧基的芳烃在三氯化铝或氯化锌催化下与氰化氢及氯化氢作用生成相应芳香醛的反应。
15.Vilsmeier-Haack反应:以N-取代的甲酰胺化试剂在氧氯化磷作用下,在芳核或杂环上引入甲酰基。
16.Rimer-Tiemann反应:将酚及某些杂环化合物与碱金属的氢氧化物溶液和过量的氯仿一起加热形成芳醛的反应。
17.Claisen反应和Dieckmann反应:羧酸酯与另一分子具有α-活泼氢的酯进行缩合的反映称为Claisen缩合。
若两个酯在同一分子之内,在上述条件下可发生分子内缩合,得环状β-酮酸酯,此反应称为Dieckmann反应。
18.Aldol缩合:含有α-活泼氢原子的醛或酮,在碱或酸的催化下发生自身缩合,或与令一分子的醛或酮发生缩合,生成β-羟基醛或酮类化合物。
该类化合物易脱水生成α,β-不饱和醛酮。
19.Claisen-Schimidt反应:芳醛与含有α-活泼氢的醛、酮之间的缩合。
芳醛和脂肪醛、酮在碱催化下缩合生成β-不饱和醛酮的就反应。
20.Tollens缩合:甲醛在碱的催化下,可与含有α-活性氢的醛、酮进行醛醇缩合,在醛、酮的α-碳原子上引入羟甲基,产物是β-羟基醛或其脱水物——α,β-不饱和醛酮。
21.Cannizzaro反应:22.Robinson环和:酯环酮与α,β-不饱和酮的共轭加成产物所发生的分子内缩合反应,可以再原来环结构基础上在引入一个环。
23.Prins反应:烯烃与甲醛(或其他醛)在酸催化下加成而得1,3-丙二醇或其环状缩醛1,3-二氧六环及α-烯醇的反应。
安息香缩合:芳醛在含水乙醇中,以氰化钾为催化剂,加热后发生双分子缩合生成α-羟基酮的反应。
24.Reformatsky反应:醛或酮与α-卤代酸酯在金属锌粉存在下缩合而得β-羟基酸酯或脱水得α,β-不饱和酸酯的反应。
25.Grignard反应:由有机卤素化合物(卤代烃、活性卤代芳烃等)与金属镁在无水乙醚存在下生成格式试剂,后者在与羰基化合物(醛、酮等)反应而得相应的醇类的反应。
26.Blanc反应:芳烃在甲醛、氯化氢及无水二氯化锌(三氯化铝、四氯化锡)或质子酸等缩合剂的存在下,在芳环上引入卤烷基(--CH2Cl)的反应。
27.Mannich反应:具有活性氢的化合物与甲醛(或其他醛)、胺进行缩合,生成胺甲基衍生物的反应。
28.Pictet-Spengler反应:β-芳乙胺与羰基化合物在酸性溶液中缩合生成1,2,3,4-四氢异喹啉的反应。
29.Strecker反应:脂肪族或芳香族醛、酮类与氰化氢和过量氨(或胺类)作用生成α-氨基腈,再经酸或碱水解得到(dl)-α-氨基酸类的反应。
30.Michael反应:活性亚甲基化合物和α,β-不饱和羰基化合物在碱性催化剂存在下发生加成缩合,生成β-羰烷基类化合物。
31.Wittig反应:醛或酮与含磷试剂——烃代亚甲基三苯膦反应,醛、酮分子中的羰基的氧原子被亚甲基或取代亚甲基所取代,生成相应的稀类化合物及氧化三苯膦,此类反应称为羰基稀化反应。
32.Horner反应:利用膦酸酯与醛、酮类化合物在碱存在下作用生成烯烃的反应。
33.Knoevenagel反应:凡具有活性亚甲基的化合物在氨、胺或其羧酸盐的催化下,与醛、酮发生醛醇型缩合,脱水得α,β-不饱和化合物的反应。
34.Stobbe反应:丁二酸酯或α-烃基取代的丁二酸酯在碱性试剂存在下,与羰基化合物进行缩合而得α-烷烃或芳烃亚甲基丁二酸单酯的反应。
(常用碱性试剂有醇钠,叔丁醇钾,氰化钠和三苯甲烷钠等)35.Perkin反应:芳香醛和脂肪酸酐在相应的脂肪酸碱金属盐的催化下缩合,生成β-芳基丙烯酸类化合物的反应。
36.Darzens缩合:醛或酮与α-卤代酸酯在碱催化下缩合生成α,β-环氧羧酸酯的反应。
37.Diels-Alder反应:共轭二烯烃与烯烃、炔烃进行环加成,生成环己烯衍生物的反应。
38.Wagner-Meerwein重排:在质子酸或lewis酸催化下生成的碳正离子中,烷基、芳基、或氢从一个碳原子通过过渡态,迁移至相邻带正电荷碳原子的反应。
39.Pinacol重排:在酸催化下,邻二叔醇失去一分子水,重排成醛或酮的反应。
40.二苯基乙二酮-二苯基乙醇酸型重排:α-二酮用强碱处理发生重排,生成α-羟基乙酸盐。
41.Fovorski重排:α-卤代酮在碱(氢氧化钠,醇钠,HNRR’)催化下脱去卤原子,重排为羧酸或其衍生物的反应。
42.Wolff重排:α-重氮酮经加热、光解或在某些金属等催化剂作用下脱去一分子氮气后重排成烯酮的反应。
烯酮经进一步反应,生成羧酸、酯、酰胺或酮。
43.Arndt-Eistert反应:酰氯与重氮甲烷反应得α-重氮酮,再经Wolff重排,生成比原来酰氯多一个碳原子的羧酸。
44.Beckmann重排:醛肟与酮肟在酸催化剂作用下重排成取代酰胺的反应。
45.Hofmann重排:氮上无取代基的酰胺用卤素(溴或氯)及碱处理,脱羧生成伯胺的反应。
由于产物比反应物少一个碳原子,所以又称为Hofmann降解。
46.Curtius重排:酰基叠氮化合物加热分解生成异腈酸酯的反应。
47.Schmidt反应:在酸催化下,酸和酮(或醛)与氨或叠氮化钠反应生成伯胺、酰胺(或腈)的反应。
48.Baeyer-Villiger氧化:在酸催化下,醛或酮与过氧酸作用,在烃基与羰基之间插入氧生成酯的反应。
49.Stevens重排:α-位上具有吸电子基Z的季铵盐在强碱作用下,脱去一个α活泼氢生成叶立德,然后季氮上的烃基进行分子内1,2-迁移,生成叔胺的反应。
50.Sommelet-Hauser重排:苄基季铵盐在强碱催化下,重排成邻位烃基取代的苄基叔胺的反应。
51.Wittig重排:醚类化合物经强碱处理,分子中一个烃基发生迁移,生成醇的反应。
52.Claisen重排:烯醇或酚的烯丙基醚加热,通过[3,3]-σ迁移使烯丙基自氧原子迁移到碳原子上的反应。
53.Cope重排:1,5-二稀(连二烯丙基)经过[3,3]-σ迁移,异构化成另一双烯丙基衍生物的反应。
54.Fischer吲哚合成:醛或酮的芳腙在适当催化剂存在下,脱氨基生成吲哚类化合物的反应。
55.Oppenauer氧化:仲醇与丙酮在烷氧基铝存在下一起回流,将仲醇氧化成酮。
56.Dakin反应:在芳香醛中,当醛基的邻、对位有羟基等供电子基团时,与有机过氧酸反应,醛基经甲酸酯阶段,最后转换成羟基。
57.Sharpless环氧化反应:58.Wacker反应:在氯化钯、氯化铜存在下,利用空气中的氧气使烯烃转化成醛或酮的过程。
59.Birch还原:芳香族化合物在液氨中用钠还原,生成非共轭二烯的反应。
60.Clemmensen反应:在酸性条件下,用锌汞齐或锌粉还原醛基、酮基为甲基和亚甲基的反应。
61.Wolff-кижер-黄鸣龙还原反应:醛酮在强碱条件下,与水合肼缩合成腙,进而放氮分解转化成甲基和亚甲基的反应。
62.Meerwein-Ponndorf-Verley反应:将醛、酮等羰基化合物和异丙醇铝在异丙醇中共热,可还原得到相应的醇,同时将异丙醇氧化成丙酮。
63.Leuckart反应:在甲酸及其衍生物存在下,羰基化合物与氨、胺的还原胺化反应。
64.Rosenmund反应:酰卤在适当的反应条件下,用催化氢化或金属氢化物选择性的还原为醛的反应。
65.Bouveault-Blanc反应:将羧酸酯用金属钠和无水醇直接还原生成相应的伯醇,主要用于高级脂肪酸酯的还原。
66.偶姻缩合:羧酸酯在惰性溶剂如醚、甲苯、二甲苯中与金属钠发生还原偶联反应,生成α羟基酮。
67.脱苄反应:苄基或取代苄基与氧、氮或硫连接生成的醇、醚、酯、苄胺、硫醚等,均可以通过氢解反应脱去苄基生成相应的烃、醇、酸、胺等类化合物。
68.Heck反应:卤代烃、苯甲酰氯或芳基重氮盐等与乙烯基化合物的C-C偶联反应。
69.Suzuki交叉偶联反应:钯催化的有机硼化合物与卤代烃生成不对称联芳烃。
